成纤维细胞生长因子21在肝脏脂质沉积中的作用研究
2024-10-02裴培范宜佳陆国琴滕懿群祝峰


[摘要]目的探讨成纤维细胞生长因子(fibroblastgrowthfactor,FGF)21在肝脏脂质沉积中的作用机制。方法将HepG2细胞分为对照组和诱导组,诱导组采用油酸和棕榈酸构建脂肪肝细胞模型,通过油红O染色观察两组细胞镜下的脂质沉积,检测两组细胞中FGF21和谷胱甘肽过氧化物酶4(glutathioneperoxidase4,GPX4)的蛋白表达情况;以FGF21慢病毒感染脂肪肝细胞作为干扰组,以scramble慢病毒感染脂肪肝细胞作为非干扰组,比较两组细胞的FGF21mRNA表达水平、脂质沉积及GPX4蛋白表达水平。结果与对照组相比,诱导组细胞的脂质沉积明显,FGF21蛋白表达水平显著升高,而GPX4蛋白表达水平显著降低(P<0.05)。FGF21慢病毒干扰后,干扰组细胞的FGF21mRNA表达水平显著下降,脂滴减少,脂质沉积明显改善,GPX4蛋白表达水平显著升高(P<0.05)。结论FGF21可能通过抑制脂质过氧化促进肝脏脂质形成。
[关键词]成纤维细胞生长因子21;脂质沉积;谷胱甘肽过氧化物酶4
[中图分类号]R575.5[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.25.005
Studyontheroleoffibroblastgrowthfactor21inliverlipiddeposition
PEIPei1,FANYijia1,LUGuoqin2,TENGYiqun1,ZHUFeng1
1.Children’sMedicalCenter,theSecondAffiliatedHospitalofJiaxingUniversity,Jiaxing314000,Zhejiang,China;2.DepartmentofNeonatology,JiaxingMaternityandChildHealthHospital,Jiaxing314009,Zhejiang,China
[Abstract]ObjectiveToinvestigatethemechanismoffibroblastgrowthfactor(FGF)21inliverlipiddeposition.MethodsHepG2cellsweredividedintocontrolgroupandinductiongroup.Fattylivercellmodelwasconstructedusingoleicacidandpalmiticacidininductiongroup.LipiddepositionunderthemicroscopewasobservedbetweentwogroupsbyoilredOstaining,andtheproteinexpression ofFGF21andglutathioneperoxidase4(GPX4)intwogroupsweredetected.FGF21lentivirus-infectedfattylivercellswereusedasinterferencegroup,andscramblelentivirus-infectedfattylivercellswereusedasnon-interferencegroup.TheexpressionlevelofFGF21mRNA,lipiddepositionandexpressionlevelofGPX4proteinwerecomparedbetweentwogroups.ResultsComparedwithcontrolgroup,inductiongrouphadsignificantlipiddeposition,significantlyincreasedexpressionlevelofFGF21protein,andsignificantlydecreasedexpressionlevelofGPX4protein(P<0.05).AftertheinterferenceofFGF21lentivirus,expressionlevelofFGF21mRNAwassignificantlydecreased,lipiddropletsweredecreased,lipiddepositionwassignificantlyimproved,andGPX4proteinexpressionlevelwassignificantlyincreasedininterferencegroup(P<0.05).ConclusionFGF21maypromoteliverlipidformationbyinhibitinglipidperoxidation.
[Keywords]Fibroblastgrowthfactor21;Lipiddeposition;Glutathioneperoxidase4
随着生活水平的改善,肥胖已成为中国重大的公共卫生问题,肥胖所伴随的代谢疾病如糖尿病、高血压和非酒精性脂肪性肝病(nonalcoholicfattyliverdisease,NAFLD)等日益突出。其中以脂质异常沉积为主要特征的NAFLD正演变为全球最常见的慢性肝病之一,其在亚洲人群的发病率达30%[1-2]。NAFLD不仅可诱发肝炎、肝硬化、肝癌等疾患,还会导致心血管疾病、糖尿病等肝外疾病[3]。成纤维细胞生长因子(fibroblastgrowthfactor,FGF)家族共有23个成员,其中FGF21在维持能量稳态中至关重要。FGF21是一种肽激素,可在组织间自由扩散和循环,并直接改善细胞内的脂质[4]。研究发现多种疾病如糖尿病、心脏疾病、代谢异常等均与FGF21的异常表达相关[5-7]。临床研究发现NAFLD患者的血清FGF21表达水平显著升高,并猜测FGF21可作为预测肝脂肪变性的生物标记物,但现有证据未能直接验证肝脏脂质沉积与FGF21基因关联[8-9]。近年来,大量研究指出铁死亡可能在肝脏疾病的病理进展中发挥关键作用。硫醚能抑制谷胱甘肽过氧化物酶4(glutathioneperoxidase4,GPX4)活化介导的氧化应激,从而改善高脂小鼠胰岛素抵抗,减轻小鼠肝脏代谢异常[10]。研究表明FGF21参与NAFLD形成,GPX4途径可在改善小鼠肝脏代谢中发挥重要作用,但FGF21是否可通过调控GPX4影响肝脏疾病的发生尚不清楚。本研究检测FGF21和GPX4在脂肪肝细胞模型中的表达水平,观察慢病毒干扰FGF21表达后是否对脂肪肝细胞的脂质沉积及GPX4表达水平产生影响,旨在探究FGF21在肝脏脂质沉积中的作用机制,为防治肝脏代谢异常提供新思路。
1材料与方法
1.1细胞培养
HepG2细胞来自嘉兴大学生化实验室。HepG2细胞在含10%胎牛血清和1%青霉素-链霉素的DMEM高糖培养基中,于37℃5%CO2培养箱中培养。
1.2试剂和仪器
FGF21慢病毒购自上海和元生物科技有限公司,FGF21蛋白抗体、GPX4蛋白抗体均购自中国ABclonal公司;微管蛋白购自天津SungeneBiotech公司;多功能酶标仪购自瑞士TECAN公司;Bio-Rad凝胶成像仪购自美国Bio-Rad公司。
1.3细胞分组与脂肪肝细胞模型的建立
复苏HepG2细胞,隔天更换一次新鲜的培养基,观察细胞生长状态,确保细胞状态良好。待细胞密度达80%~90%时,用0.25%的胰蛋白酶消化细胞,将细胞均匀接种于6孔板中,每孔细胞密度均保持30%左右,最后向各孔中补充DMEM培养基1ml,待细胞密度达80%时进行诱导。诱导组添加245μmol/L油酸和122.5μmol/L棕榈酸诱导建立脂肪肝细胞模型,对照组添加等体积的磷酸盐缓冲液,24h后收集细胞及上清液。
1.4FGF21慢病毒干扰细胞模型的建立
按照上述细胞传代方法将脂肪肝细胞接种于6孔板,待细胞密度达80%左右时,非干扰组按照说明书要求,结合细胞密度加入scramble慢病毒,待细胞稳定24h后,添加油酸和棕榈酸进行诱导;干扰组按照说明书要求,根据细胞密度加入相应FGF21慢病毒,待细胞稳定24h后,再加入油酸和棕榈酸进行诱导,诱导48h后,收集细胞及上清液。
1.5油红O染色
每组细胞各取3个孔,收集培养液,用磷酸盐缓冲液清洗3遍,4%多聚甲醛固定10min,采用油红O染色法进行染色:首先稀释油红储存液,染色10min,75%酒精脱色,苏木素复染,显微镜下观察细胞脂质沉积情况。最后用100%异丙醇提取溶解在脂滴中的油红O,并通过测量510nm处的吸光度测定其相对浓度。
1.6FGF21mRNA表达水平检测
采用Trizol法从细胞中提取总RNA,根据反转录试剂盒说明书操作,并在普通聚合酶链反应仪上反转录获得互补DNA。在ThermoFisher-QS3实时定量聚合酶链反应仪上检测FGF21mRNA表达水平。以GAPDH为内参。实验运行方案为:变性程序(95℃10min),扩增定量程序重复40次(95℃15s,60℃10s,72℃15s,单次荧光测量),熔解曲线程序(60~95℃,升温速率0.1℃/s,连续荧光测量)。使用2-△△Ct计算目的mRNA的相对表达量并进行比较。本研究所用引物序列见表1。
1.7FGF21和GPX4蛋白浓度测定
提取各组细胞总蛋白,使用BCA蛋白质测定试剂盒检测总蛋白浓度。将各样本的蛋白浓度调整一致,再与1/4体积的蛋白上样缓冲液混合后煮沸,变性;通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离总蛋白,转膜;室温下5%脱脂奶粉封闭2h,按照1∶1000稀释FGF21抗体原液,根据分子量大小分别以微管蛋白作为内参,4℃过夜孵育;第2天洗膜,5%脱脂奶粉稀释辣根过氧化物酶标记的二抗(1∶1000)于摇床上孵育90min,洗膜,加发光液,Bio-Rad成像系统曝光,采用ImageJ软件测定灰度值,目标蛋白分别与内参灰度值相比为各自相对表达水平。
1.8统计学方法
采用SPSS22.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差(![]() )表示,组间比较采取t检验。P<0.05为差异有统计学意义。
)表示,组间比较采取t检验。P<0.05为差异有统计学意义。
2结果
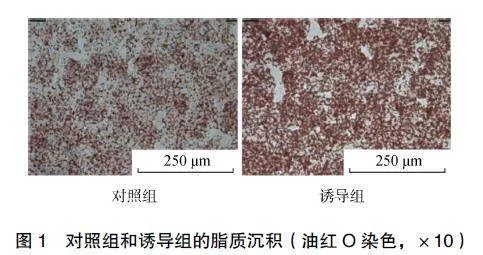
2.1脂肪肝细胞模型
与对照组相比,油酸和棕榈酸诱导后,细胞内脂滴形成积累更为明显,脂质沉积更为显著,说明脂肪肝细胞模型构建成功,见图1。
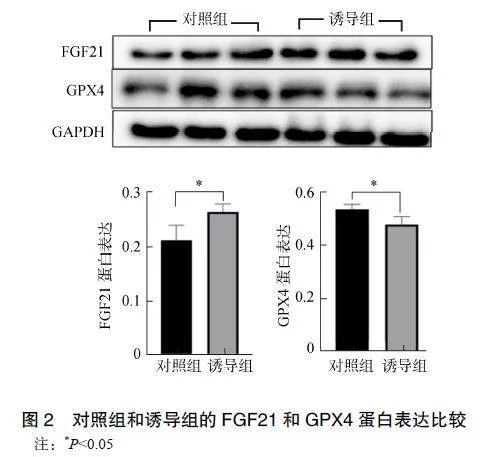
2.2FGF21和GPX4蛋白表达水平
诱导组的FGF21蛋白表达显著高于对照组(P<0.05),GPX4蛋白表达显著低于对照组(P<0.05),见图2。
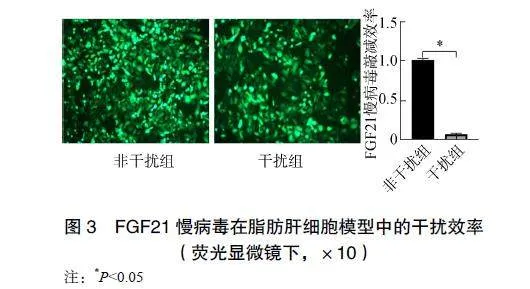
2.3FGF21慢病毒干扰情况
荧光显微镜下观察脂肪肝细胞的慢病毒感染情况,发现脂肪肝细胞内慢病毒感染情况良好,同时实时定量聚合酶链反应检测FGF21mRNA表达水平,发现FGF21mRNA表达水平显著降低,表明FGF21敲减效率显著,见图3。
2.4敲减FGF21后脂肪肝细胞内脂质变化
敲减FGF21后,与非干扰组相比,干扰组脂质沉积明显减少;干扰组吸光度值显著低于非干扰组(P<0.05),见图4。
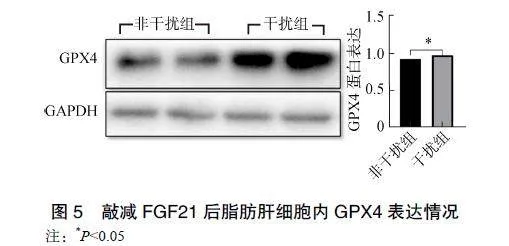
2.5敲减FGF21后脂肪肝细胞内GPX4表达情况
干扰组的GPX4蛋白水平显著高于非干扰组(P<0.05),见图5。
3讨论
生活方式和饮食习惯的改变使得肥胖人群迅速
增加。研究发现NAFLD已成为最常见的慢性肝病之一[11]。由于临床上大多数NAFLD患者并无明显症状,因此早期难以发现肝脏脂质代谢异常。对怀疑NAFLD的患者多采用肝脏超声检查,但超声检查缺乏足够的敏感度和特异性,易耽误该病的早期诊断和干预。肝脏穿刺虽然是诊断NAFLD的金标准,但因其有创性在临床上难以广泛实施[12]。因此,寻找敏感且准确性高的生物标志物来辨别肝脏脂质累积显得尤为重要。
本研究采用油酸和棕榈酸诱导的方式构建脂肪肝细胞模型。研究人员采用油红O染色,镜下发现油酸和棕榈酸诱导的肝脏细胞脂质沉积明显,可见大片红色脂滴沉积。肝脏是FGF21的主要合成器官,同时FGF21也可直接改善肝脏细胞内脂质的积累。本研究发现,与对照组相比,诱导组的FGF21蛋白表达显著增加,为进一步验证二者的关系,构建FGF21慢病毒干扰模型,发现干扰组镜下脂质沉积较前减少,与既往采用三酰甘油、总胆固醇、高密度脂蛋白胆固醇等指标观察脂质含量不同[13-14]。本研究采用吸光度作为观察脂滴含量定量指标,结果显示干扰组的吸光度值显著低于非干扰组,提示FGF21慢病毒干扰后脂肪肝细胞脂质沉积减少,说明二者间存在密切关联。脂质过氧化可能是FGF21与脂质异常累积的作用机制之一。研究发现NAFLD患者肝脏中丙二醛和4-羟基壬烯醛显著增高[15]。Li等[16]发现花生四烯酸可促进蛋氨酸胆碱缺乏诱导的小鼠肝脏发生铁死亡、脂质活性氧(reactiveoxygenspecies,ROS)积累,ROS通过促进脂滴形成产生肝脏脂质变性。GPX4是一种利用自身的催化活性、削弱脂质过氧化物毒性、维持膜脂质双分子层稳态的重要物质,基于此,GPX4也被认为是清除膜脂过氧化氢产物的核心。研究表明抑制GPX4表达将增加细胞中的脂滴和脂质过氧化作用,激活GPX4表达将抑制细胞内脂滴形成[17]。本研究发现FGF21表达增高的同时,GPX4表达明显降低,表明GPX4对细胞膜脂质过氧化的作用在减弱,进而诱导脂质形成,最终导致肝脏脂质病变;而敲减FGF21后,GPX4表达增高,细胞内脂质沉积呈现降低趋势。
综上,FGF21参与肝脏脂质沉积的形成,且脂质过氧化在肝脏代谢异常中发挥重要作用,FGF21可能通过改变GPX4途径而影响脂质变化。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] 刘晓琳,范建高.非酒精性脂肪性肝病的研究进展与展望[J].现代医药卫生,2017,33(5):641–644,650.
[2] ZHANGH,ZHANGE,HUH.Roleofferroptosisinnon-alcoholicfattyliverdiseaseanditsimplicationsfortherapeuticstrategies[J].Biomedicines,2021,9(11):1660.
[3] 中华医学会肝病学分会脂肪肝和酒精性肝病学组,中国医师协会脂肪性肝病专家委员会.非酒精性脂肪性肝病防治指南(2018年更新版)[J].实用肝脏病杂志,2018,21(2):177–186.
[4] YANJ,NIEY,CAOJ,etal.TherolesandpharmacologicaleffectsofFGF21inpreventingaging-associatedmetabolicdiseases[J].FrontCardiovascMed,2021,8:655575.
[5] CHENY,LIQ,ZHAOS,etal.Berberineprotectsmiceagainsttype2diabetesbypromotingPPARγ-FGF21-GLUT2-regulatedinsulinsensitivityandglucose/lipidhomeostasis[J].BiochemPharmacol,2023,218:115928.
[6] TUCKERW,TUCKERB,RYEKA,etal.Fibroblastgrowthfactor21inheartfailure[J].HeartFailRev,2023,28(1):261–272.
[7] ROMERO-HERRERAI,NOGALESF,DIAZ-CASTROJ,etal.Bingedrinkingleadstoanoxidativeandmetabolicimbalanceinskeletalmuscleduringadolescenceinrats:Endocrinerepercussion[J].JPhysiolBiochem,2023,79(4):799–810.
[8] HUAMC,HUANGJL,HUCC,etal.Includingfibroblastgrowthfactor-21incombinedbiomarkerpanelsimprovespredictionsofliversteatosisseverityinchildren[J].FrontPediatr,2019,7:420.
[9] XIAOF,SHIX,HUANGP,etal.Dose-responserelationshipbetweenserumfibroblastgrowthfactor21andliverfatcontentinnon-alcoholicfattyliverdisease[J].DiabetesMetab,2021,47(6):101221.
[10] ZHANGY,WUQ,LIUJ,etal.Sulforaphanealleviateshighfatdiet-inducedinsulinresistanceviaAMPK/Nrf2/GPx4axis[J].BiomedPharmacother,2022,152:113273.
[11] DAYCP.Non-alcoholicfattyliverdisease:Amassiveproblem[J].ClinMed(Lond),2011,11(2):176–178.
[12] 马蓉霞,吴葆华.儿童非酒精性脂肪肝研究进展[J].西北国防医学杂志,2019,40(3):195–198,封3.
[13] 于帅,王斌,杜娜,等.非酒精性脂肪肝患者并发2型糖尿病的风险分析[J].山东医药,2015,55(3):50–52.
[14] 林仿,任跃忠,褚建平,等.甘油三酯与高密度脂蛋白胆固醇比值和谷氨酰转移酶对非酒精性脂肪肝的预测价值[J].中华全科医学,2017,15(7):1175–1177,1191.
[15] LOGUERCIOC,DEGIROLAMOV,DESIOI,etal.Non-alcoholicfattyliverdiseaseinanareaofsouthernItaly:Mainclinical,histological,andpathophysiologicalaspects[J].JHepatol,2001,35(5):568–574.
[16] LIX,WANGTX,HUANGX,etal.Targetingferroptosisalleviatesmethionine-cholinedeficient(MCD)-dietinducedNASHbysuppressingliverlipotoxicity[J].LiverInt,2020,40(6):1378–1394.
[17] QIJ,KIMJW,ZHOUZ,etal.Ferroptosisaffectstheprogressionofnonalcoholicsteatohepatitisviathemodulationoflipidperoxidation-mediatedcelldeathinmice[J].AmJPathol,2020,190(1):68–81.
(收稿日期:2024–06–10)
(修回日期:2024–07–29)
