齐墩果酸对衰老睾丸间质细胞(Leydig细胞)的作用以及EGF/EGFR表达的影响
2024-09-23段豫磊牛嗣云梁思刘子铭朱娟王红杰



摘要:目的 观察齐墩果酸对衰老睾丸间质细胞(Leydig细胞)的影响以及对表皮生长因子(epidermal growth factor, EGF)和表皮生长因子受体(epidermal growth factor receptor, EGFR)的调控作用。方法 原代培养大鼠Leydig细胞,将其分为正常组、模型组和齐墩果酸组。模型组和齐墩果酸组采用H2O2(300 μmol/L)和FeSO4(100 μmol/L)每日处理2 h,持续4 d,造细胞衰老模型。之后正常组和模型组在DMEM/F12 培养液培养3 d,齐墩果酸组在齐墩果酸终浓度为20 μmol/L的DMEM/F12 培养液中培养3 d。ELISA法检测细胞睾酮分泌情况;BrdU免疫荧光染色检测细胞增殖率;DAPI荧光染色检测细胞凋亡率;qRT-PCR检测细胞EGF和EGFR mRNA表达。结果 模型组睾酮分泌水平、细胞增殖率、EGF和EGFR mRNA表达水平均低于正常组(Plt;0.05),凋亡率均高于正常组(Plt;0.05)。齐墩果酸可抑制Leydig细胞凋亡(Plt;0.05),并提高细胞睾酮分泌水平、细胞增殖水平、EGF和EGFR mRNA表达水平(Plt;0.05)。结论 齐墩果酸可促进衰老Leydig细胞睾酮分泌及细胞增殖、抑制细胞凋亡,其机制与调控EGF和EGFR mRNA表达有关。
关键词:Leydig细胞;齐墩果酸;衰老;表皮生长因子;表皮生长因子受体
DOI:10.3969/j.issn.1674490X.2024.04.001
中图分类号:Q291""""" 文献标志码:A""""" 文章编号:1674490X(2024)04000107
The effect of oleanolic acid on senescent Leydig cells and the expression of EGF/EGFR
DUAN Yulei1, NIU Siyun1, LIANG Si2, LIU Ziming2, ZHU Juan3, WANG Hongjie1,2
(1. School of Basic Medical Sciences, Hebei University, Baoding 071000, China; 2. Department of Anesthesiology, Affiliated Hospital of Hebei University, Baoding 071000, China; 3. Department of Pharmacy, Zhengzhou First Peoples Hospital, Zhengzhou 450004, China)
Abstract: Objective To observe the effect of oleanolic acid on senescent Leydig cells and the regulation of EGF and EGFR. Methods Primary cultured rat Leydig cells were divided into normal group, model group and oleanolic acid group. The model group and the neat fruit acid group were treated with H2O2 (300 μmol/L) and FeSO4 (100 μmol/L) daily for 2 h for 4 d. Thereafter, the normal and model groups were cultured in DMEM/F12
收稿日期:20240625
基金项目:
国家自然科学基金资助项目(82374180);河北省中医药管理局项目(2020234);河北大学医学学科培育项目(2023B10)
第一作者:段豫磊(1994—),男,河南焦作人,实验师,硕士,主要从事男性生殖衰老研究。E-mail: 497305795@qq.com
通信作者:王红杰(1968—),女,河北保定人,主任医师,教授,博士,博士生导师,主要从事麻醉与复苏的临床及基础研究。E-mail: hongjiew68@163.com
medium for 3 d, and the oleanolic acid group was cultured in DMEM/F12 medium with a final concentration of 20 μmol/L. Testosterone secretion was measured by ELISA, proliferation by immunofluorescence staining by BrdU, apoptosis by DAPI staining, and EGF and EGFR mRNA expression by qRT-PCR. Results Compared with the normal group, the testosterone secretion level, cell proliferation rate, EGF and EGFR mRNA expression level were significantly decreased (Plt;0.05), and the apoptosis rate was significantly increased (Plt;0.05). Oleanolic acid significantly inhibited apoptosis in the model group (Plt;0.05) and significantly increased testosterone secretion, cell proliferation levels, and EGF and EGFR mRNA expression levels (Plt;0.05). Conclusion Oleanolic acid can promote testosterone secretion and cell proliferation and inhibit cell apoptosis, and its mechanism may be related to the regulation of EGF and EGFR mRNA expression.
Key words: Leydig cells; oleanolic acid; senescence; epidermal growth factor; epidermal growth factor receptor
随着中国经济的快速发展以及生活环境的剧烈变化,人口老龄化已成为严重的社会问题,提高老年人口的生活质量刻不容缓[1-2]。睾丸作为男性生殖系统的重要靶腺,其功能减退是机体衰老的早期信号之一,决定衰老进程[3-4]。Leydig细胞是睾丸中生产雄激素以及维持生精功能的重要细胞,Leydig细胞衰老导致性腺功能衰退并诱导老年疾病发生,对男性的生活质量带来严重的负面影响[5]。目前,在延缓衰老以及提高男性性腺功能方面,西医药尚缺乏有效应对措施,而中医药却有独到之处,但作用机制不明。女贞子可补肾强腰、明目乌发,中医临床用于治疗阴虚内热、眩晕耳鸣、腰膝酸软、须发早白等老年性疾病。已有报道女贞子具有延缓衰老的作用,可改善衰老大鼠肾上腺及睾丸组织退行性变[6],但其发挥药理作用的活性组分尚不明确。齐墩果酸是一种五环三萜类化合物,是中药材女贞子的主要活性成分[7],具有恢复睾丸功能的作用[8],但其对衰老Leydig细胞的影响及可能的分子机制尚无研究。表皮生长因子(epidermal growth factor, EGF)和表皮生长因子受体(epidermal growth factor receptor, EGFR)广泛参与调控细胞分化、增殖与凋亡过程[9],维持睾丸稳态[10],高度表达于Leydig细胞[11]。基于此,本研究采用氧化应激损伤的方法建立Leydig细胞衰老模型,观察齐墩果酸对衰老Leydig细胞功能的影响以及对EGF和EGFR的调控作用,分析其可能机制,为其临床应用提供实验依据。
1" 材料与方法
1.1" 实验动物
SPF级2月龄Wistar大鼠20只(体质量220~260 g),雌雄各半,用于合笼繁殖新生鼠。由河北医科大学实验动物中心提供,动物许可证号:1510063。河北大学医学部动物实验中心培养,许可证号:SYXK(冀)2017-002。
1.2" 药物及试剂
胎牛血清(以色列Biological Industries公司);DMEM/F12培养基(美国Gibco公司);胶原酶Ⅰ(美国Sigma公司);BrdU一抗(美国Abcam公司);即用型DAPI 溶液(中国索莱宝公司);Caymans Testosterone ELISA Kit(美国Cayman公司);TRIzol Reagent(美国Ambion公司);PrimeScriptTM RT reagent Kit(日本Takara公司);TB GreenTM Premix Ex TaqTM Ⅱ(日本Takara公司)。
1.3" 方法
1.3.1 "Leydig细胞培养
取11~19日龄新生Wistar大鼠,颈椎脱臼处死,无菌状态下取双侧睾丸组织,于无菌PBS溶液中剥离白膜并置于胶原酶Ⅰ中消化,游离生精小管周围间质中的细胞,采用差异贴壁法分离纯化Leydig细胞[12]。将获得的Leydig细胞以每皿1×107个细胞接种于培养皿中,在含10%胎牛血清的DMEM/F12培养基中培养,待融合度达80%时以1∶2进行传代,第3代的细胞以每孔1×106个细胞接种于6孔板内,培养2 d后备用。
1.3.2" 细胞分组和处理
将“1.3.1”中培养的Leydig细胞分为正常组、模型组和齐墩果酸组。其中模型组和齐墩果酸组采用自由基氧化损伤法造Leydig细胞衰老模型:培养液中加入300 μmol/L H2O2和100 μmol/L FeSO4作用2 h,之后更换新鲜的培养液,每日1次,持续4 d(各组细胞加入终浓度为20 μmol/mL的BrdU溶液用于免疫荧光实验)。模型组继续在含10%胎牛血清的DMEM/F12培养液中培养3 d;齐墩果酸组在终浓度20 μmol/L齐墩果酸的DMEM/F12 培养液中培养3 d。
1.3.3" DAPI荧光染色
各组细胞去除培养液,PBS清洗3遍,每遍5 min。4% 多聚甲醛固定细胞10 min,PBS清洗3遍,每遍5 min。DAPI染色试剂染色,甘油与水1∶1混合液封片,置于荧光显微镜(日本 Nikon 公司)下观察拍照,细胞核亮蓝白色为阳性细胞,计数每个视野内阳性细胞。各组观察10个视野,计算平均阳性率。重复3次独立实验。
1.3.4" BrdU免疫荧光染色
各组细胞去除培养液,PBS清洗2遍。之后4%多聚甲醛固定细胞10 min,2 mol/L盐酸变性30 min,0.1 mol/L硼酸钠中和15 min,BrdU一抗稀释液(1∶100)室温孵育过夜,羊抗兔二抗稀释液(1∶500)37 ℃避光孵育2 h,DAPI复染细胞核,甘油与水1∶1混合液封片,置于荧光显微镜下观察拍照,计数每个视野内阳性细胞。每组细胞计10个视野,重复3次独立实验,计算平均阳性细胞率。
1.3.5" ELISA法检测细胞睾酮分泌
采用Caymans Testosterone ELISA Kit进行各组Leydig细胞培养液中睾酮含量的测定,每组重复3次独立实验。首先按照说明书进行排版设计:包括 2个空白孔(Blk)、2个本底孔(NSB)、2个最大结合孔(B0)和8孔标准曲线。每个培养液样本3个复孔。使用ELISA Buffer稀释各组培养液,每孔50 μL配置好的培养液,各孔添加50 μL Testosterone AChE Tracer(除Blk外),后各孔加入50 μL Testosterone ELISA Antiserum(除NSB和Blk外)。塑料薄膜覆盖全板,室温振荡孵育2 h,各孔采用Wash Buffer清洗5次。每孔加入200 μL Ellman Reagent,23 ℃下避光孵育90 min。酶标仪405~420 nm波长读板,并计算样本浓度。
1.3.6" 荧光定量PCR(qRT-PCR)
TRIzol法提取各组细胞总RNA,按照PrimeScript RT reagent Kit说明,逆转录RNA为cDNA。使用TB GreenTM Premix Ex TaqTM Ⅱ试剂盒对各组cDNA于qRT-PCR仪中进行扩增,以β-actin为内参基因,利用2-△△ct 方法统计各组EGF和EGFR基因转录水平。重复3次独立实验。各基因引物序列见表1。
1.3.7" 统计分析
采用SPSS 22.0软件进行数据分析。各实验数据经正态性检验,满足正态分布后采用单因素方差分析(One-Way ANOVA)。若满足方差齐性,两两比较选用最小显著差法(least significant difference,LSD),若方差不齐则用 Dunnetts T3 法,Plt;0.05 为差异有统计学意义。
2" 结果
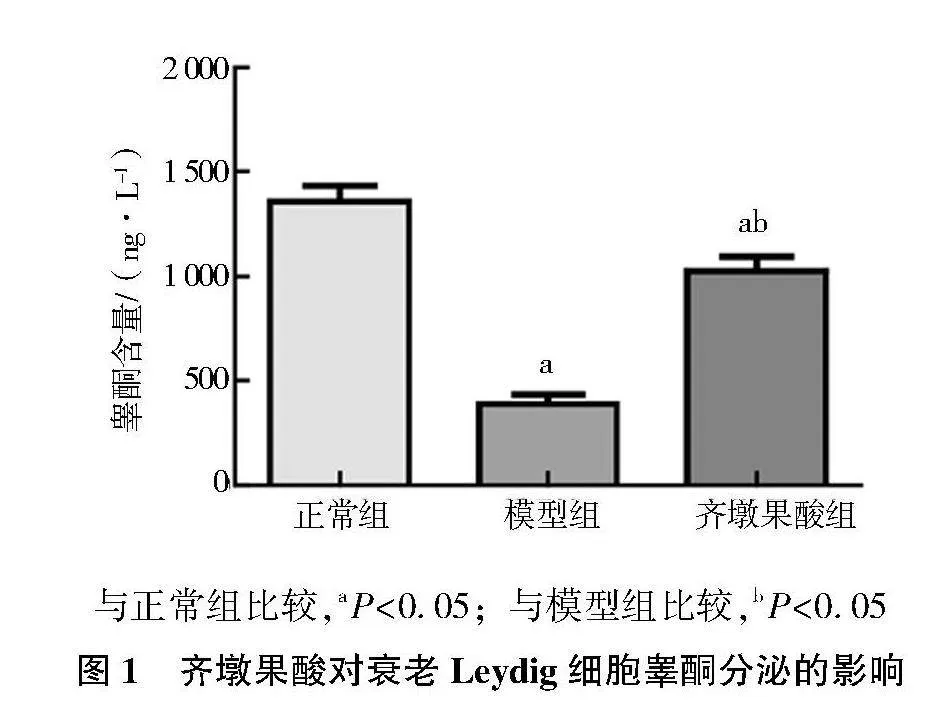
2.1" Leydig细胞分泌睾酮的含量
首先使用睾酮ELISA试剂盒检测各组细胞培养液的睾酮含量,结果显示,模型组细胞培养液的睾酮含量低于正常组(Plt;0.05),经齐墩果酸干预后,睾酮含量升高(Plt;0.05),但不如正常组(Plt;0.05)(图1)。
与正常组比较,aPlt;0.05;与模型组比较,bPlt;0.05
2.2" Leydig细胞BrdU免疫荧光染色
BrdU在S期可替代胸腺嘧啶核苷选择性结合细胞DNA,是细胞增殖的常见标记物。免疫荧光染色显示,BrdU阳性产物呈红色,定位于细胞核(图2A)。统计结果表明,模型组BrdU阳性细胞率低于正常组(Plt;0.05),经齐墩果酸干预后,阳性细胞率升高(Plt;0.05)(图2B)。
A 各组Leydig细胞BrdU免疫荧光染色(×200);B 各组Leydig细胞BrdU阳性率统计;与正常组比较,aPlt;0.05;与模型组比较,bPlt;0.05
2.3" DAPI染色检测Leydig细胞凋亡率
对各组Leydig细胞进行DAPI染色,DAPI染色呈蓝色荧光,凋亡细胞细胞核浓缩变小,染色加深,显示出强亮蓝白色荧光,如图中红色箭头指示(图3),为凋亡细胞。计算各组细胞中凋亡细胞百分率,结果显示,模型组细胞凋亡率高于正常组(Plt;0.05),经齐墩果酸干预后,细胞凋亡率降低(Plt;0.05)。
与正常组比较,aPlt;0.05;与模型组比较,bPlt;0.05
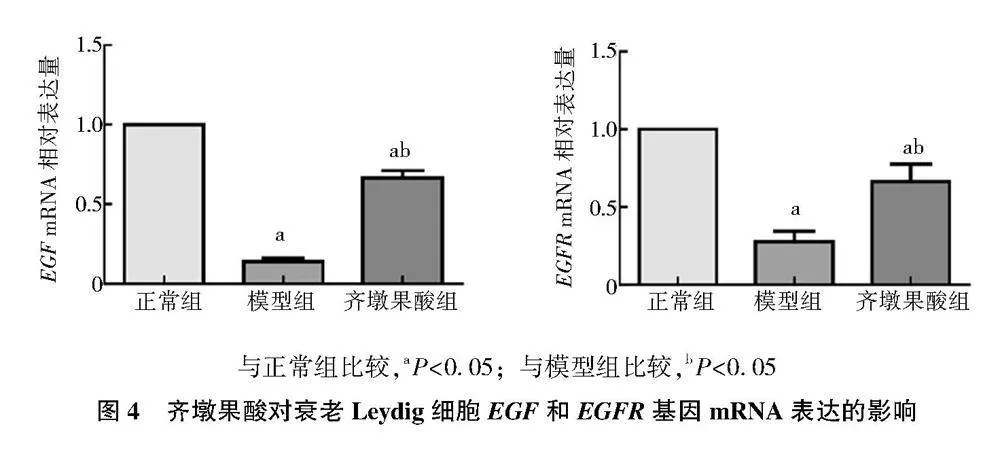
2.4" qRT-PCR检测Leydig细胞EGF和EGFR基因mRNA表达
为探讨齐墩果酸延缓Leydig细胞衰老的可能机制,采用qRT-PCR检测各组Leydig细胞EGF和EGFR基因mRNA表达(图4),结果显示,模型组细胞中EGF和EGFR基因mRNA表达均低于正常组(Plt;0.05),经齐墩果酸干预后,EGF和EGFR基因mRNA表达均升高(Plt;0.05)。
与正常组比较,aPlt;0.05;与模型组比较,bPlt;0.05
3" 讨论
衰老是一种自然的、多因素的现象,其特征是退化过程的积累。衰老不仅伴有更年期症状,也是导致大多数慢性疾病和组织功能障碍的主要原因,机体通过性激素对其直接或间接地发挥调控作用[13]。Leydig细胞是雄激素(睾酮)产生的重要细胞,睾酮的产生随着年龄的增长而减少[14],不仅影响男性生殖功能,而且与心血管病、前列腺增生、代谢综合征、骨质疏松症、阿尔茨海默病等老年病密切相关[15]。Leydig 细胞衰老导致增殖能力减弱,其数量因凋亡率升高而下降,且细胞的睾酮合成能力降低,从而导致血清睾酮水平随年龄增长而下降[16]。基于此,靶向延缓 Leydig 细胞衰老进程成为可能的治疗策略。
目前,临床治疗男性性腺衰老仍以睾酮替代疗法为主,但其有明显的毒副作用,且对男性生育能力有不良影响[17]。传统中药在延缓衰老及防治相关疾病方面效果显著。《本草再新》记载,女贞子“养阴益肾,补气舒肝。治腰腿疼,通经和血”“主补中,安五脏,养精神,除百疾”。但因女贞子有效作用成分和药理机制尚不明确,影响其临床使用。齐墩果酸是女贞子的成分,已有报道其具有抗氧化、抗感染[18]、神经保护[19]以及胃肠道保护[20]作用,并可延长秀丽隐杆线虫寿命[21],提示其潜在的抗衰老功效,但其对Leydig细胞的作用尚不清楚。本研究显示,齐墩果酸可显著提高自由基氧化损伤诱导的衰老Leydig细胞增殖、抑制细胞凋亡,并提高Leydig细胞睾酮分泌,表明齐墩果酸对衰老Leydig细胞具有积极作用。
EGFR是表皮生长因子受体家族成员之一,具有酪氨酸激酶活性,是一种重要的跨膜受体。EGF是EGFR高亲和力配体,与之结合并激活EGFR,进而激活MAPK、PI3K、c-Src等多条信号通路[22]。EGF与EGFR在包括上皮和间充质谱系在内的许多细胞类型中得到广泛表达,调节包括发育、组织稳态、增殖、存活和分化等多种细胞生物学关键过程[23]。有研究表明,激活EGF信号传导可延缓秀丽隐杆线虫的衰老[24],EGF和EGFR mRNA和蛋白水平下调还与细胞衰老[25]以及多种老年病的发生密切相关[26]。在本研究中,齐墩果酸可显著上调衰老Leydig细胞中EGF和EGFR mRNA水平,初步证明齐墩果酸对Leydig细胞EGF/EGFR信号传导的调控作用。而齐墩果酸对Leydig细胞EGF/EGFR下游通路的调控作用以及EGF/EGFR与Leydig细胞衰老的关系,将是进一步研究的工作。
综上所述,齐墩果酸可促进衰老Leydig细胞睾酮分泌,促进其增殖并抑制凋亡,其机制可能与调控EGF和EGFR mRNA表达有关,为齐墩果酸的临床应用提供了理论依据和科学支撑。
参考文献:
[1]MA Y M, HE X, QI K Y, et al. Effects of environmental contaminants on fertility and reproductive health[J]. J Environ Sci, 2019, 77: 210-217. DOI: 10.1016/j.jes.2018.07.015.
[2]刘丹.中国人口老龄化发展现状、成因与对策[J].中国老年学杂志, 2022, 42(16): 4123-4126. DOI: 10.3969/j.issn.1005-9202.2022.16.071.
[3]SANTIAGO J, SILVA J V, ALVES M G, et al. Testicular aging: an overview of ultrastructural, cellular, and molecular alterations[J]. J Gerontol A Biol Sci Med Sci, 2019, 74(6): 860-871. DOI: 10.1093/gerona/gly082.
[4]PERHEENTUPA A, HUHTANIEMI I. Aging of the human ovary and testis[J]. Mol Cell Endocrinol, 2009, 299(1): 2-13. DOI: 10.1016/j.mce.2008.11.004.
[5]BEATTIE M C, ADEKOLA L, PAPADOPOULOS V, et al. Leydig cell aging and hypogonadism[J]. Exp Gerontol, 2015, 68: 87-91. DOI: 10.1016/j.exger.2015.02.014.
[6]马紫童,王雪帆,唐秀凤,等.基于神经网络模型评价淫羊藿、女贞子配伍对自然衰老大鼠肾脏、睾丸及肾上腺的影响[J].山东中医杂志, 2020, 39(8): 852-860. DOI: 10.16295/j.cnki.0257-358x.2020.08.017.
[7]万晓莉.齐墩果酸药理作用的研究进展[J].黔南民族医专学报, 2023, 36(1): 73-75.
[8]ZHAO H X, LIU J, SONG L X, et al. Oleanolic acid rejuvenates testicular function through attenuating germ cell DNA damage and apoptosis via deactivation of NF-κB, p53 and p38 signalling pathways[J]. J Pharm Pharmacol, 2017, 69(3): 295-304. DOI: 10.1111/jphp.12668.
[9]SABBAH D A, HAJJO R, SWEIDAN K. Review on epidermal growth factor receptor (EGFR) structure, signaling pathways, interactions, and recent updates of EGFR inhibitors[J]. Curr Top Med Chem, 2020, 20(10): 815-834. DOI: 10.2174/1568026620666200303123102.
[10]SNOS DEMARCO R, JONES D L. EGFR signaling promotes basal autophagy for lipid homeostasis and somatic stem cell maintenance in the Drosophila testis[J]. Autophagy, 2020, 16(6): 1145-1147. DOI: 10.1080/15548627.2020.1739450.
[11]宋卫儒,梁季鸿.表皮生长因子及其受体在睾丸中的表达及对生殖功能的调控[J].医学文选, 2005(3): 414-416. DOI: 10.3969/j.issn.1673-6575.2005.03.095.
[12]孙静.何首乌饮及其单体化合物对大鼠Leydig细胞衰老关键基因甲基化调控机制研究[D].保定:河北大学, 2018:15-16.
[13]XING Y T, XUAN F, WANG K X, et al. Aging under endocrine hormone regulation[J]. Front Endocrinol, 2023, 14: 1223529. DOI: 10.3389/fendo.2023.1223529.
[14]YEAP B B, FLICKER L. Testosterone, cognitive decline and dementia in ageing men[J]. Rev Endocr Metab Disord, 2022, 23(6): 1243-1257. DOI: 10.1007/s11154-022-09728-7.
[15]KETCHEM J M, BOWMAN E J, ISALES C M. Male sex hormones, aging, and inflammation[J]. Biogerontology, 2023, 24(1): 1-25. DOI: 10.1007/s10522-022-10002-1.
[16]HAN S, LUO J Q, XU S, et al. Low-intensity pulsed ultrasound alleviates human testicular leydig cell senescence in vitro[J]. Int J Mol Sci, 2022, 24(1): 418. DOI: 10.3390/ijms24010418.
[17]PATAKY M W, YOUNG W F, NAIR K S. Hormonal and metabolic changes of aging and the influence of lifestyle modifications[J]. Mayo Clin Proc, 2021, 96(3): 788-814. DOI: 10.1016/j.mayocp.2020.07.033.
[18]POLLIER J, GOOSSENS A. Oleanolic acid[J]. Phytochemistry, 2012, 77: 10-15. DOI: 10.1016/j.phytochem.2011.12.022.
[19]GUDOITYTE E, ARANDARCIKAITE O, MAZEIKIENE I, et al. Ursolic and oleanolic acids: plant metabolites with neuroprotective potential[J]. Int J Mol Sci, 2021, 22(9): 4599. DOI: 10.3390/ijms22094599.
[20]SHI Y J, LENG Y F, LIU D S, et al. Research advances in protective effects of ursolic acid and oleanolic acid against gastrointestinal diseases[J]. Am J Chin Med, 2021, 49(2): 413-435. DOI: 10.1142/S0192415X21500191.
[21]ZHANG J L, LU L L, ZHOU L J. Oleanolic acid activates daf-16 to increase lifespan in Caenorhabditis elegans[J]. Biochem Biophys Res Commun, 2015, 468(4): 843-849. DOI: 10.1016/j.bbrc.2015.11.042.
[22]BURGESS A W. Regulation of signaling from the epidermal growth factor family[J]. J Phys Chem B, 2022, 126(39): 7475-7485. DOI: 10.1021/acs.jpcb.2c04156.
[23]SCHNEIDER M R, WOLF E. The epidermal growth factor receptor ligands at a glance[J]. J Cell Physiol, 2009, 218(3): 460-466. DOI: 10.1002/jcp.21635.
[24]YU S, DRISCOLL M. EGF signaling comes of age: promotion of healthy aging in C. elegans[J]. Exp Gerontol, 2011, 46(2/3): 129-134. DOI: 10.1016/j.exger.2010.10.010.
[25]LI N N, CUI J Y, WEN C Y, et al. Different cellular properties and loss of nuclear signalling of porcine epidermal growth factor receptor with aging[J]. Gen Comp Endocrinol, 2020, 290: 113415. DOI: 10.1016/j.ygcen.2020.113415.
[26]SIDDIQUI S, FANG M, NI B, et al. Central role of the EGF receptor in neurometabolic aging[J]. Int J Endocrinol, 2012, 2012: 739428. DOI: 10.1155/2012/739428.
(责任编辑:刘俊华)
