酰胺基官能化氮杂环卡宾锌配合物的合成、表征及催化性能探究
2024-09-20阚启明刘苏韩悦张嘉敏罗志雄丁茯




摘 要: 通过溶剂热法,使双齿酰胺基官能化氮杂环卡宾(NHC)配体与ZnCl2反应,合成了一种全新的酰胺基官能化N-杂环卡宾锌配合物L1-Zn。通过单晶X射线衍射(SC-XRD)、红外光谱(FTIR)和能谱(EDX)对其结构和化学组成进行了表征。锌配合物的晶体结构测定揭示了其为零维结构。该配合物可催化丙交酯开环聚合反应,在无溶剂条件下,当反应温度120℃、反应时间3h、单体与催化剂物质的量比100∶1时,丙交酯的转化率为21%。
关 键 词:氮杂环卡宾;锌配合物;丙交酯聚合
中图分类号:O641.4文献标志码: A 文章编号:1004-0935(2024)08-1211-04
近年来,氮杂环卡宾(NHC)因具有强σ-供体和弱π-受体[1-2]特性与周期表中的绝大部分金属元素进行配位,其本身具有共轭结构,稳定性良好,并因为配体空间结构和电子效应的可调整,使得结构多元化、易于修饰,而受到广泛关注[3]。使用氮杂环卡宾配体的催化剂已经广泛地应用于各种催化反应[4-5],并显示出优异的催化性能,然而很多经过NHC修饰的过渡金属(如Pd、Rh、Ru、Ir)因其较高的价格或者生物毒性问题而影响其使用范围[6]。因此,目前的氮杂环卡宾配合物研究热点之一是使用更便宜、低毒的金属替代已报道的贵金属。锌是一种廉价、环境友好且易于获得的金属,其配合物在催化领域的应用越来越受到关注。近年来,大量NHC-Zn作为催化剂被报道用于烯丙基烷基化、炔烃/烯烃/CO2氢化硅烷化等反应[7],此外NHC-Zn配合物在聚合反应方面也显示出良好的应用前景。
从绿色经济的角度来看,来自可再生资源的可生物降解聚酯是石油基聚合物的有前途的替代品[8-9]。在众多可生物降解的合成聚酯中,聚乳酸(PLA)因其优异的生物相容性而备受关注。PLA是通过丙交酯(LA)开环聚合制备得到的生物可降解聚合物[10],而LA则可以通过玉米和大豆的发酵获得。目前,PLA用于食品包装[11]以及许多生物医学领域[12],具有日益增长的工业价值[13]。已报道的合成聚乳酸的主要方法是,通过金属催化剂(如辛酸锡(II)或异丙氧基铝)催化丙交酯开环聚合,可以得到较高分子量的聚乳酸。然而,锡的潜在毒性使研究者们将注意力集中在生物相容性的金属如K、Mg、Ca、Ti、Fe、Zn和Al[14]。据此,开发了一种合成方法简单、易于制备的LA开环聚合催化剂L1-Zn。
使用酰胺基团对苯并咪唑类化合物进行修饰,合成出新型双齿酰胺基官能化氮杂环卡宾配体,进而通过溶剂热法将该配体与金属锌配位合成出了一种新型氮杂环卡宾锌配合物L1-Zn,并将其应用于丙交酯本体聚合反应中。结果表明,该锌配合物在丙交酯开环聚合反应中具有催化活性。
1 实验部分
1.1 仪器和试剂
苯胺(C6H5NH2)、氯乙酰氯(CH2ClCOCl)、二氯甲烷(CH2Cl2)、三乙胺(N(CH2CH3)3)、苯并咪唑(C7H6N2)、四氢呋喃((CH2)4O)、氢化钠(NaH)、二溴甲烷(CH2Br2)、乙腈(CH3CN)、氯化锌(ZnCl2)、N,N-二甲基甲酰胺(HCON(CH3)2),分析纯,国药集团化学试剂有限公司。
采用BRUKER-500核磁共振仪(美国布鲁克公司)测试化合物的C谱和H谱。采用NicoletiS50 FTIR红外分析仪(美国赛默飞世尔公司)在波数 400~4000cm-1内测试。在293K下采用XtaLAB mini型X射线衍射仪进行测试,石墨单色器单色化Mo Kα射线(λ=0.071073nm)作入射光,以ψ-ω扫描方式收集衍射点。
1.2 实验方法
L1-Zn的合成路线如图1所示。
1.2.1化合物(1)的合成
反应瓶中加入苯胺0.9312g(0.01mol)和20mL二氯甲烷,待其溶解后滴加3~5滴三乙胺。将1.36g(0.012mol)氯乙酰氯与15mL二氯甲烷混合溶液1h内滴加至反应瓶内,室温反应3h。反应结束后,旋蒸去除溶剂,再用去离子水洗涤并抽滤,干燥3h,所得白色固体为化合物(1),质量1.4780g,产率为95%。化合物(1)的核磁共振氢谱与碳谱结果:1HNMR(500 MHz, DMSO-d6)δ4.12–4.30(s,2H),6.97–7.17(t,J=7.3 Hz,1H),7.23–7.44(t,J=8.0 Hz,2H),7.44–7.74(d,J=8.0Hz,2H), 9.95–10.49(s,1H)。13CNMRδ(125MHz,DMSO-d6):164.58,138.45,128.81,123.81,119.36,43.55。
1.2.2 化合物(2)的合成
反应瓶中加入11.8140g(0.1mol)苯并咪唑和40 mL四氢呋喃,溶解后少量多次加入氢化钠4.0000 g(0.1mol),将8.6920 g(0.05mol)二溴甲烷与30mL乙腈混合溶液1h内滴加至反应瓶内。80℃回流反应24 h。反应结束后抽滤,将滤液静置冷却至结晶,干燥3 h,所得白色产物为化合物(2),质量10.6789克,产率为86.02%。化合物(2)的核磁共振氢谱与碳谱结果:1H NMR(500 MHz,DMSO-d6)δ8.78(s,2H),7.88(d,J=8.1 Hz,2H),7.61(d,J=7.9 Hz,2H),7.25(t,J=7.6 Hz,2H),7.19(t,J=7.6 Hz,2H),6.90(s,4H)。13C NMR(126 MHz,DMSO-d6)δ144.86,143.93,133.16,123.57,122.81,120.21,111.20,52.93。
1.2.3 酰胺基官能化氮杂环卡宾配体L1的合成
反应瓶中加化合物(2)1.240g(0.0050 mol)和30mL乙腈溶剂,待其全部溶解。将化合物(1)1.7113g(0.0110mol)溶解于10mL乙腈中,缓慢滴加到反应瓶中,100℃回流48h,生成白色浑浊溶液。过滤后干燥3h得白色固体为化合物L1,质量2.2035g,产率为75%。化合物L1的核磁共振氢谱与碳谱结果:1HNMR(500 MHz,DMSO-d6)δ5.62~5.82(s,4H),7.03~7.14(t,J=7.5Hz,2H),7.30~7.37 (t,J=7.9Hz,4H),7.61~7.72(m,6H),7.71~7.82(dt,J=7.4, 19.3 Hz,4H), 8.09~8.22(d,J=8.1Hz,2H), 8.36~8.52(d,J=8.1 Hz,2H), 10.50~10.70(s, 2H),11.09~11.30(m,2H)。13CNMR(126MHz,DMSO-d6)δ=49.62,54.61,111.22,113.78,119.21,123.63,123.87,127.24,128.82,129.70,131.81,138.31,144.38,163.28。
1.2.4 酰胺基氮杂环卡宾锌配合物L1-Zn的合成
将酰胺基官能化氮杂环卡宾L1(0.0580g, 0.1mmol)、ZnCl2(0.0136g,0.1mmol)加入水热反应釜中,加入3mL水和1mL DMF作为溶剂,室温下搅拌至完全溶解。程序控温烘箱5℃·min-1温度梯度升温至90℃,反应72 h后48h内均匀降温至30℃,得透明长条状晶体为配合物L1-Zn。
1.3 催化丙交酯开环聚合反应的方法
向10mL Schlenk管中加入单体L-丙交酯,真空干燥2h,再加入催化剂L1-Zn。油浴,聚合温度130~170℃,反应时间1~3h。反应结束后取出Schlenk管,浸入液氮中止聚合。向Schlenk管中加入二氯甲烷使反应物全部溶解,然后将部分二氯甲烷溶液转移到核磁管中,抽真空去除二氯甲烷得到待测反应物,再用适量氘代氯仿溶解,通过1HNMR测定丙交酯的转化率。以L-丙交酯次甲基上的氢(Hm)作为单体的特征峰(δ= 5.05)和聚乳酸次甲基上的氢(Hp)作为聚合物的特征峰(δ=5.16),归一化计算积分比值Hp/(Hm+Hp)得到聚合反应转化率。L1-Zn催化的丙交酯聚合反应如图2所示。
2 结果与讨论
2.1 单晶X射线衍射
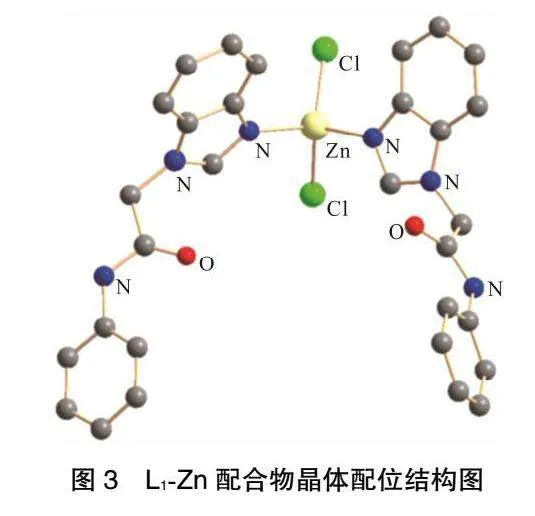
酰胺基氮杂环卡宾锌金属配合物L1-Zn晶体结构如图3所示。空间群为P21/C1,属于单斜晶系,零维结构。L1-Zn的结构单元为L1配体中相连的N—C—N键在反应过程中发生断裂,而Zn2+重新连接了N—N键并与2个Cl-相连。Cl—Zn—Cl键角为116.06°,N—Zn—Cl键角为106.35°~112.6°,N—Zn—N键角为108.0°。Zn—Cl键长为0.2286~0.2382nm,Zn—N键长为0.2028~0.2044nm。配合物的3个结晶轴a、b、c长短不一,夹角α=90°,γ=90°,但y轴与z轴夹角β>90°。晶体参数如表1所示。
2.2 红外光谱(FTIR)分析
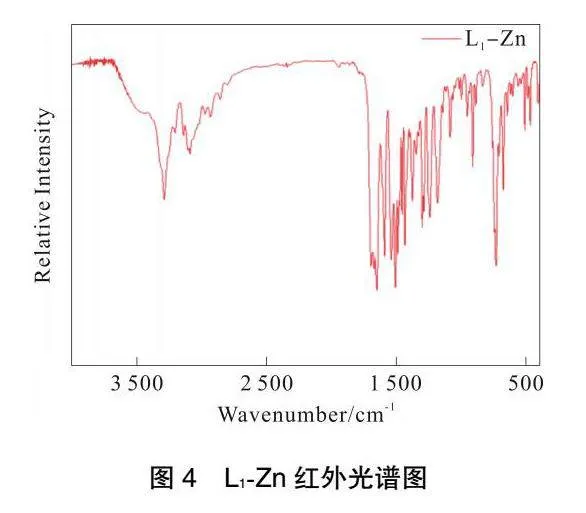
L1-Zn红外光谱图如图4所示。3285.94cm-1处的峰是酰胺基团的N—H伸缩振动峰;3088.38cm-1为苯环的C—H、C=C的伸缩振动吸收峰;2932.15cm-1为取代基链接的亚甲基C—H伸缩振动峰;1681.60cm-1为咪唑环C=N的伸缩振动峰;1518.27cm-1为苯环骨架的伸缩振动吸收峰;1099.85cm-1处的峰归属于锌金属配合物H3L1-ZnC—C单键伸缩振动峰;761.72cm-1为苯环C—H的伸缩振动峰。
2.3 能谱(EDX)分析
通过能量色散X射线光谱(EDX)分析进一步表征了L1-Zn配合物的化学组成,结果如图5所示。该配合物中含有Zn、C、N、O、Cl元素,进而证明L1配体与Zn金属成功配位。
2.4 催化效果评价
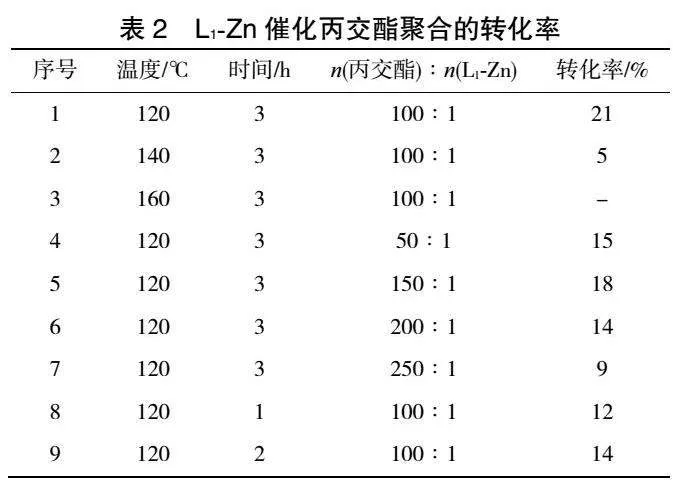
对L1-Zn配合物在丙交酯本体聚合反应中的催化活性进行探究,单体与催化剂物质的量比分别为50∶1、100∶1、150∶1、200∶1、250∶1,聚合温度为130~170℃,反应时间为1~3h,结果见表2。
在无溶剂条件下,当反应温度为120℃、反应时间为3h、丙交酯与催化剂物质的量比为100∶1时,催化效果为最佳,转化率达到21%。当固定反应条件为120℃和反应时间3h时,反应转化率随着丙交酯与催化剂物质的量比的增大而降低(序号7、8、9)。在反应温度和催化剂用量相同的条件下,反应转化率随着反应时间的增加而增大(序号1、4、5)。将反应温度从120℃提高到160℃,反应转化率没有提高(序号1、2、3)。分析原因可能是L1-Zn配合物在超过120℃的高温条件下,结构发生了变化,使其催化活性降低,因此温度升高,转化率反而降低。目前氮杂环卡宾锌配合物催化丙交酯开环聚合的应用还未见报道,合成的锌配合物催化剂在聚合领域显示了潜在的应用价值。
3 结论
通过苯基氨基甲酰氯和双(1H-苯并咪唑-1-基)甲烷的烷基化反应,合成了一种新型酰胺基官能化氮杂环卡宾配体(L1)。通过溶剂热法将配体L1与ZnCl2配位合成了锌配合物(L1-Zn)。单晶X射线衍射测试表明L1-Zn为零维结构。在无溶剂条件下,L1-Zn可有效催化了丙交酯的开环聚合,展示出了一定的催化活性。
参考文献:
[1] HUYNH H V. Electronic properties of N-heterocyclic carbenes and their experimental determination[J].Chem Rev, 2018, 118(19): 9457-9492.
[2] 杨亮茹,郭梦丽,袁金伟,等. 钳形氮杂环卡宾金属络合物的研究进展[J]. 有机化学,2023,43(6):2002-2025.
[3] 郭杰,张帆,谢世玉,等. 氮杂环卡宾-钯功能化的配位聚合物(NHC-Pd@Zn-L)合成、表征及催化Suzuki-Miyaura交叉偶联反应[J]. 化工学报,2022,73(8):3608-3614.
[4] 张建明,高健,冯捷,等. 氮杂环卡宾/过渡金属联合催化研究进展[J]. 有机化学,2021,41(10):3792-3807.
[5] 韩英锋,甘明明,李楚玉. 氮杂环卡宾化合物的研究进展[J]. 西北大学学报(自然科学版),2019,49(6):825-847.
[6] SHAIKH N S, JUNGE K, BELLER M. A convenient and general iron-catalyzed hydrosilylation of aldehydes[J].Org Lett, 2007, 9(26): 5429-5432.
[7] SPECKLIN D, FLIEDEL C, DAGORNE S. Recent representative advances on the synthesis and reactivity ofN-heterocyclic-carbene-supported zinc complexes[J].The Chemical Record, 2021, 21(5): 1130-1143.
[8] CUI Y, JIANG J, PAN X, et al. Highly isoselective ring-opening polymerization of rac-O-carboxyanhydrides using a zinc alkoxide initiator[J].Chem Commun(Camb), 2019, 55(86): 12948-12951.
[9] 谢彬,白茸茸,孙华山,等. 聚乳酸塑料合成、生物降解及其废弃物处置的研究进展[J]. 生物工程学报,2023,39(5): 1912-1929.
[10] DRUMRIGHT R E, GRUBER P R, HENTON D E. Polylactic acid technology[J].Advanced Materials, 2000, 12(23): 1841-1846.
[11] 李寅萱. 聚乳酸在食品包装中的研究进展与应用[J]. 绿色包装,2023(2):15-19.
[12] 陈品鸿,苏灿坤,林若玫,等. 静电纺丝载药聚乳酸(PLA)纳米纤维膜的综合实验设计[J]. 实验技术与管理,2020,37(7): 74-79.
[13] 杨菊香,曾莎,贾园,等. 聚乳酸改性及其应用进展[J]. 塑料,2020,49(5):102-107.
[14]KREMER A B, MEHRKHODAVANDI P. Dinuclear catalysts for the ring opening polymerization of lactide[J].Coordination Chemistry Reviews, 2019, 380: 35-57.
