负载型三维电极处理甲基橙废水的动力学和降解机理研究
2024-09-20徐孟晓胡俊生











摘 要:采用化学共沉淀法制备负载型Fe3O4-MnO2/GAC粒子电极,通过三维电极系统处理甲基橙废水,探讨甲基橙和COD降解的反应动力学,并运用紫外-可见光光谱分析甲基橙的降解机理。结果表明:降解甲基橙和COD反应均为一级反应,粒子投加量为50g·L-1,溶液pH为7,溶液温度为45℃时反应速率常数最大,降解甲基橙和COD的反应活化能分别为3.4442×104J·mol-1和1.5299×104J·mol-1。此外,根据紫外-可见光光谱推测甲基橙降解机理为偶氮式降解,强氧化物与甲基橙接触首先破坏发色基团,并且破坏偶氮键分解为多种芳香类物质;接着·OH进一步攻击苯环大π键,生成苯酚、对苯二酚等中间产物,最终被矿化为CO2和H2O。
关 键 词:三维电极;甲基橙;COD;动力学
中图分类号:X791;TQ613.1 文献标志码: A 文章编号: 1004-0935(2024)08-1173-08
印染废水具有水量大、色度高、组分复杂、水质变化大等特征,在排放前必须进行工程预处理[1]。此外,印染废水具有色泽深的特征,对受纳水体外观也造成了不良的影响[2]。甲基橙是一种广泛应用于印染纺织的偶氮活性染料,传统的物理法、化学法、生物法均难以对偶氮废水进行有效处理。三维电极作为一种电催化氧化技术具有氧化性能好、操作灵活、占地面积小等优点,被认为是一种具有良好应用前景的处理高浓度有机废水的方法。该技术是将粒子电极利用电场作用成为复极性粒子,粒子与粒子之间形成许多的微电解池,通过在粒子电极表面直接氧化分解以及利用生成的强氧化剂间接将有机污染物分解矿化[3]。然而,传统的粒子电极在重复使用效果不理想、能耗高以及选择性小[4],成为阻碍三维电极应用的关键问题。徐斌[5]等制备了Fe3O4负载的氧化石墨烯粒子电极降解甲基橙。研究发现,在初始pH=5,粒子电极投加量3g·L-1,反应时间90min,电流密度30mA·cm-2,外加电压 7V 的反应条件下,SGF 粒子电极体系的甲基橙色度和 COD 去除率分别是98.8%和87.5%。张添淇[6]采用浸渍焙烧法制备负载SnO2的氧化铝粒子电极,对甲基橙废水处理,实验结果表明在电解时间60min,电解电压6V,pH=7.2,电解质投加量为1g·L-1,粒子电极投加量120g,曝气量200mL·min-1的条件下,甲基橙和COD去除率分别可以达到最高值,甲基橙去除率为82.27%,COD去除率为61.77%。莫再勇[7]等人制备铬、铁二元修饰的活性炭粒子电极处理甲基橙废水,研究表明在工作电压15V、空气流量0.2 L·min-1、pH为5、处理时间为30min时,脱色率可达到94.31%。
前言目前对于三维电极处理甲基橙废水的动力学和降解机理研究较少,本研究采用化学共沉淀法制备Fe3O4-MnO2/GAC粒子电极,应用于三维电极体系处理甲基橙废水,分析甲基橙和COD降解的动力学规律,推测降解机理与历程,为三维电极的实际应用提供初步理论依据。
1 实验部分
1.1 材料、试剂与仪器
活性炭由河南平顶山绿之原活性炭有限公司生产。
实验药剂:甲基橙、邻苯二甲酸氢钾、钼酸铵、无水Na2SO4、AgSO4、HgSO4、Fecl3·6H2O、Fecl2·4H2O、KMnO4、NaOH均为分析纯;H2SO4、K2Cr2O7均为优级纯;H2O2质量分数为25%。
实验仪器:UV-1810紫外可见分光光度计:上海佑科仪器仪表有限公司;FA1204B电子天平:上海佑科仪器仪表有限公司;101-1鼓风干燥箱:绍兴市上虞区诚尚仪器有限公司;JJ-1型电动搅拌器:常州市江南实验仪表厂;LZB-3WB转子流量计:常州科德精密机械制造有限公司;ACO-001电磁式空气泵:深圳市兴日生实业有限公司;PHS-2FpH计:上海仪电科学仪器股份有限公司。
1.2 实验装置
实验装置由阴极、阳极、稳压直流电源、曝气头、转子流量计、实验气泵等组成,如图1所示。
装置采用立方体反应器155mm×125mm×155mm(长×宽×高),有效容积1000mL,材质为有机玻璃,水样以及药剂可以从上部投加,阴极采用石墨板,阳极采用Ti,规格均为150mm×120mm×
3mm。反应器底部有曝气装置,利用转子流量计控制曝气量,用以调节反应内部的曝气,并起到充分搅拌的作用,从而使甲基橙废水得到充分处理。
1.3 粒子电极制备
正文粒子电极制备运用化学共沉淀法将Fe3O4-MnO2负载于颗粒状活性炭。
首先将3mm柱状活性炭颗粒用去离子水清洗数次后依次用稀酸、稀碱溶液浸泡30min,过滤后用去离子水洗至中性,然后将活性炭置于超声水浴锅中处理30min,于105℃下干燥12h备用。
称取89.55gFeCl2·4H2O溶解于100mL蒸馏水中完全溶解,后加入0.18L浓度为5mol·L-1的氢氧化钠(NaOH),放入50℃水浴锅中,持续机械搅拌,使生成的蓝色絮状物分布均匀,然后缓慢加入0.3L浓度为0.5mol·L-1的KMnO4持续机械搅拌,加入9.375mL浓度为8mol·L-1的H2O2,当烧杯中的液体物质全部转化成黑色混合液时,加入15.95g预处理的活性炭颗粒,持续机械搅拌2h,静置沉淀后除去上清液,将剩下的混合液放入鼓风干燥箱中烘干,温度调节为105℃,烘干12h,取出烘干后的材料反复洗涤,最终达到上清液为中性为止,除去上清液,继续烘干后放入瓶内密封保存即可。
1.4分析方法
1.4.1 甲基橙测定方法
采用紫外-可见分光光度法[8]在甲基橙pH为1的状态下可见光最大吸收波长为460nm,计算得到其不同时间的浓度。
1.4.2COD测定方法
COD的测定采用快速密闭催化消解法。当COD大于50mg·L-1,将波长为600nm的吸光度值代入标准曲线可计算得到COD质量浓度。当COD大于50mg·L-1,将波长为440nm的吸光度值代入标准曲线可计算得到COD质量浓度。
2 结果与分析
2.1 动力学方程拟合
在甲基橙溶液浓度100mg·L-1,极板间距为6cm,外加电压为10.12V、曝气量为313mL·min-1、电解质投加量为3.195g·L-1,初始pH为7,粒子电极投加量50g·L-1,溶液温度为25℃,进行实验。一次实验连续进行2h,每20min取一次样。
2.1.1 降解甲基橙动力学拟合
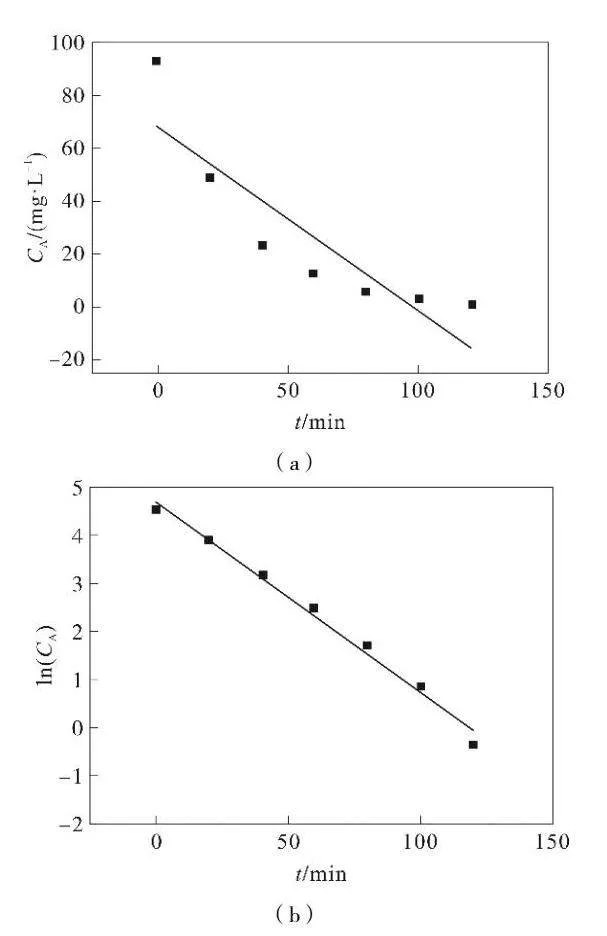
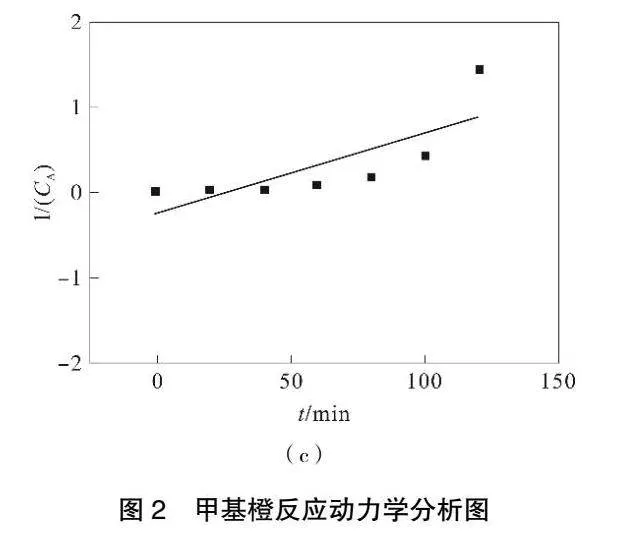
根据化学反应动力学理论。假定Fe3O4-MnO2/GAC对甲基橙的降解反应属于零级反应,则CA-t呈直线关系(图2(a)),回归方程为y=-0.6997x+68.797,R2=0.7876。
假定Fe3O4-MnO2/GAC对甲基橙的降解反应属于一级反应,则ln(CA)-t呈直线关系(图2(b)),回归方程为y=-0.0398x+4.7159,R2=0.9887。
假定Fe3O4-MnO2/GAC对甲基橙的降解反应属于二级反应,则1/(CA)-t呈直线关系(图2(c)),回归方程为y=0.009 4x-0.247 6,R2=0.611 3。
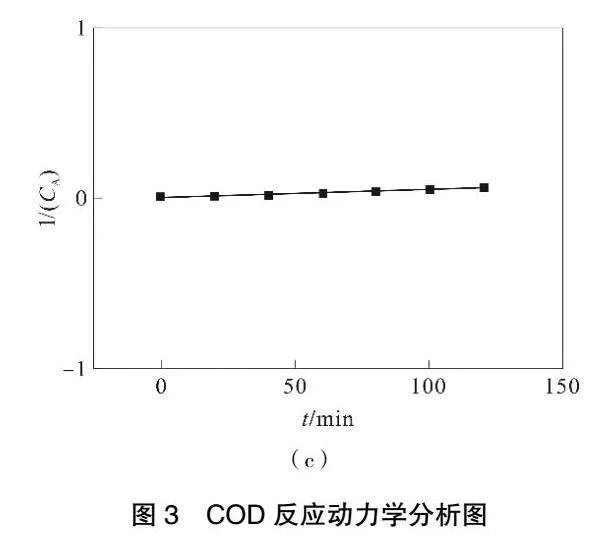
2.1.2 降解COD动力学拟合
根据化学反应动力学理论。假定Fe3O4-MnO2/GAC对COD的降解反应属于零级反应,则CA-t呈直线关系(图3(a)),回归方程为y=-0.681x+85.73,R2=0.8691。
假定Fe3O4-MnO2/GAC对COD的降解反应属于一级反应,则ln(CA)-t呈直线关系(图3(b)),回归方程为y=-0.0156x+4.5384,R2=0.9875。
假定Fe3O4-MnO2/GAC对甲基橙的降解反应属于二级反应,则1/(CA)-t呈直线关系(图3(c)),回归方程为y=0.000 4x+0.005 7,R2=0.976。
甲基橙降解零级反应相关系数为0.7876,一级反应相关系数为0.9887,二级反应相关系数为0.6113;COD降解零级反应相关系数为0.8691,一级反应相关系数为0.9875,二级反应相关系数为0.976。以及反应相关系数最大。
在三维电极降解甲基橙过程中,主要是利用电芬顿反应生成强氧化物质·OH。因此在动力学研究方面,可忽略直接氧化[9]。甲基橙(R)被强氧化物质·OH氧化,获得氧化产物(P):
R+·OH→P
反应速率方程为:
式中:c(R)—甲基橙的浓度;
c(·OH)—·OH的浓度;
c(P)—氧化产物的浓度;
k—反应的速率常数;
t—反应时间。
在一定的电化学体系里如果认为·OH达到了稳定浓度,则认为·OH浓度为一常数[10]。
在整个反应过程中反应条件保持不变,即排除其他条件对反应速率的影响,Fe3O4-MnO2/GAC粒子电极对甲基橙和COD的降解反应为一级反应。
2.2 粒子电极投加量
在甲基橙溶液质量浓度100mg·L-1,极板间距为6cm,外加电压为10.12V、曝气量为313mL·min-1、电解质投加量为3.195g·L-1,初始pH为7,溶液温度为25℃,改变粒子电极投加量,进行实验。一次实验连续进行2h,每20min取一次样。
2.2.1 甲基橙降解反应速率
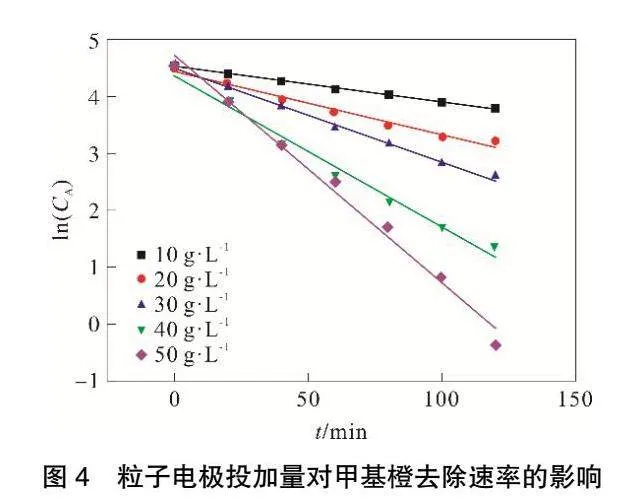
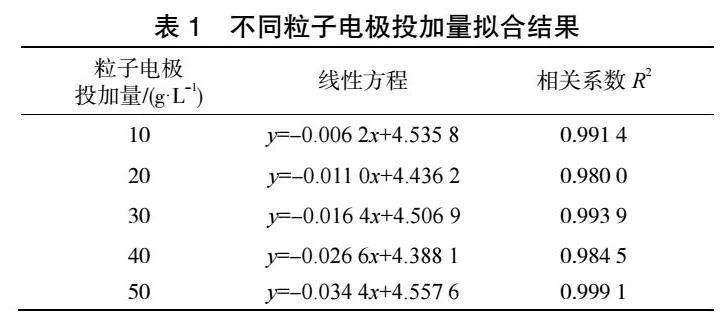
由图4和表1可见,ln(CA)与t存在良好线性关系,相关系数R2可以达到0.98以上。随着粒子电极投加量的增加,甲基橙降解反应速率常数k不断增大,当粒子电极投加量达到50g·L-1,反应速率常数k最大可达到0.0344。
2.2.2 COD降解反应速率
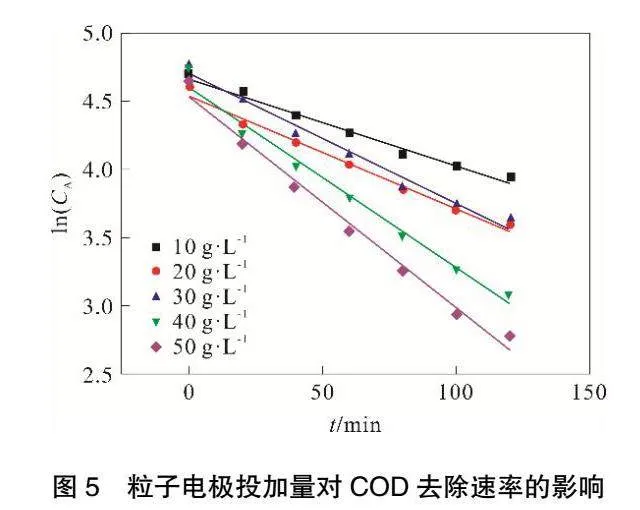
由图5和表2可见,ln(CA)与t存在良好线性关系,相关系数R2可以达到0.97以上。
随着粒子电极投加量的增加,COD降解反应速率常数k不断增大,当粒子电极投加量达到50 g·L-1,反应速率常数k最大可达到0.015 6。
粒子电极作为三维电极中最重要的部分,合适的粒子电极投加量可以增加污染物质与电极的接触面积[11],从而提高反应效率。随着粒子电极投加量增大,反应过程中处置距离减小,从而使得传质效率升高[12]。并且随着粒子电极投加量增大铁、锰金属氧化物增多,从而促进电芬顿反应进行,使得甲基橙和COD降解反应速率增大。
2.3 溶液pH对反应速率的影响
在甲基橙溶液浓度100mg·L-1,极板间距为6cm,外加电压为10.12V、曝气量为313mL·min-1、电解质投加量为3.195g·L-1,溶液温度为25℃,粒子电极投加量为50g·L-1,改变甲基橙溶液pH,进行实验。一次实验连续进行2h,每20min取一次样。
2.3.1 甲基橙降解反应速率
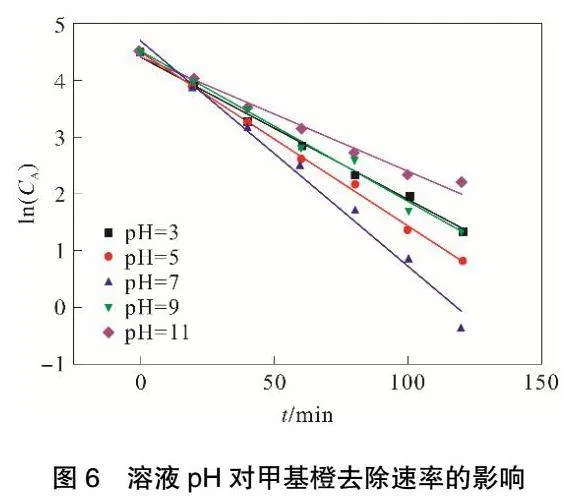
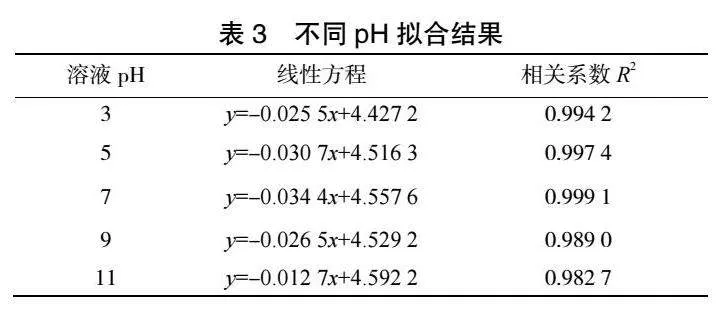
由图6和表3可见,ln(CA)与t存在良好线性关系,相关系数R2可以达到0.98以上。随着溶液pH的增加,甲基橙降解反应速率常数k呈现出先增大后减小的趋势,当甲基橙溶液pH达到7,反应速率常数k最大可达到0.0344。
2.3.2 COD降解反应速率
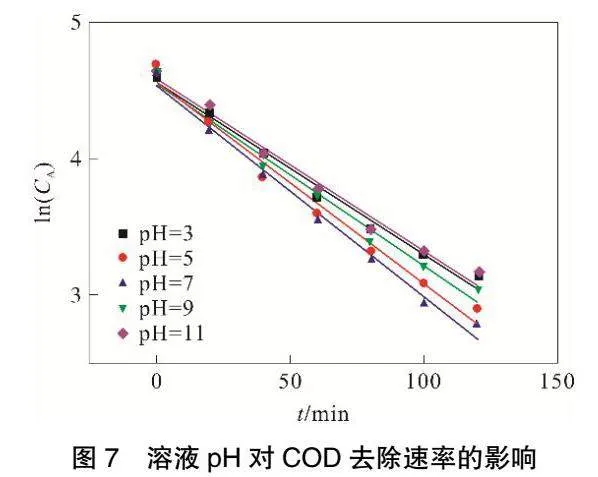
由图7和表4可见,ln(CA)与t存在良好线性关系,相关系数R2可以达到0.98以上。随着溶液pH的增加,COD解反应速率常数k呈现出先增大后减小的趋势,当甲基橙溶液pH达到7,反应速率常数k最大可达到0.0156。
在所有的电化学体系中,污染物在酸性条件下带正电荷,在碱性条件下污染物带负电荷[13],并且pH也影响颗粒电极物质的吸附能力[14]。大部分研究表明,三维电极系统处于弱酸性环境,有机污染物有较好的去除效果[7,15-17],这是因为O2+2H++2e-=H2O2,H+在溶液中含量高有利于H2O2的生成。由于本实验的粒子电极中有MnO2存在,根据Wang[18]等人的研究,由于MnO2的存在,在极化粒子电极的阳极侧发生H2O和OH-的放电反应,产生吸附的羟基自由基:MnO2+H2O→MnO2(·OH )+H++e-。这样,即使在中性环境中,溶液依然能够产生大量H+,从而生成H2O2和·OH,有效去除甲基橙和COD。
当溶液pH过低时,其中含有大量H+,这会导致电解槽中发生析氢副反应:2H++2e-=H2。该反应的发生会降低H2O2生成的活性,抑制了H2O2的生成,从而导致甲基橙和COD降解速率较低。当溶液pH大于7时,随着pH增大,溶液中存在大量OH-,OH-与Fe2+或者Fe3+反应会产生絮凝沉淀,覆盖在离子电极表面,影响粒子电极的复极性,从而无法生成·OH,进而导致甲基橙和COD降解速率下降。因此,将甲基橙溶液初始pH控制在中性环境中最有利于甲基橙与COD的去除。
2.4 溶液温度对反应速率的影响
在极板间距为6cm,外加电压为10.12V、曝气量为313mL·min-1、电解质投加量为3.195g·L-1,初始pH为7,甲基橙浓度为100mg·L-1,粒子电极投加量为50g·L-1,改变溶液温度,进行实验。一次实验连续进行2h,每20min取一次样。
2.4.1 甲基橙降解反应速率
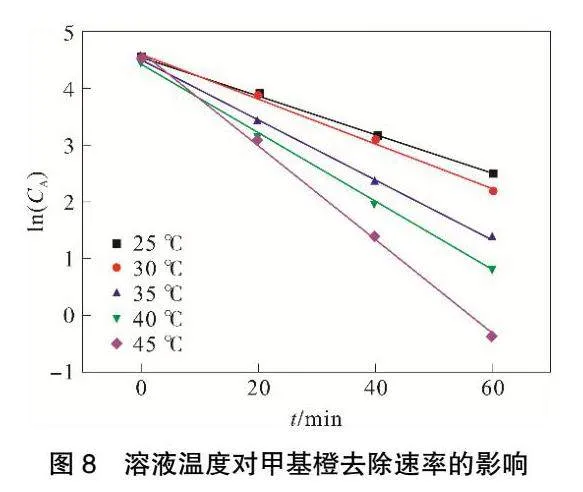
随着温度升高甲基橙降解速率变快,为保证统一,选取第1h的实验样本。
由图8和表5可见,ln(CA)与t存在良好线性关系,相关系数R2可以达到0.99以上。随着体系反应温度升高,底物活度增加,使其参与反应的机会增多,进而促进反应速率明显提高。当溶液温度达到45℃,反应速率常数k最大可达到0.0827。
由图9可知,lnk与1/T拟合的相关系数R2为0.9787,lnk与1/T有良好的线性关系,说明反应速率常数与绝对温度的关系符合阿伦乌尼斯方程[19]:
式中:k—反应速率常数,min-1;
k0—频率因子常数,min-1;
Ea—反应活化能,J·mol-1;
R—气体常数,8.314 J·mol-1·K-1;
T—绝对温度,K。
对(1)式取对数得:![]()
将实验数据带入(2)式,解得反应活化能Ea=3.4442×104J·mol-1,k0=3.5667×104min-1,进而得到温度与甲基橙降解反应速率方程为:
2.4.2 COD降解反应速率
由图10和表6可见,ln(CA)与t存在良好线性关系,相关系数R2可以达到0.98以上。
随着体系反应温度升高,底物活度增加,使其参与反应的机会增多,进而促进反应速率明显提高。当溶液温度达到45℃,反应速率常数k最大可达到0.023。
由图11可知,lnk与1/T拟合的相关系数R2为0.9832,lnk与1/T有良好的线性关系,说明反应速率常数与绝对温度的关系符合阿伦乌尼斯方程,同理将实验数据带入(2)式,解得反应活化能Ea=1.5299×104J·mol-1,k0=7.62min-1,进而得到温度与COD降解反应速率方程为:
3 降解机理初探
在极板间距为6cm,外加电压为10.12V、曝气量为313mL·min-1、电解质投加量为3.195g·L-1,初始pH为7,甲基橙质量浓度为100mg·L-1,粒子电极投加量为50g·L-1,溶液温度为45℃,进行实验。一次实验连续进行2 h,每30min取一次样。借助紫外-可见分光光度计在190~600nm 范围内进行扫描。
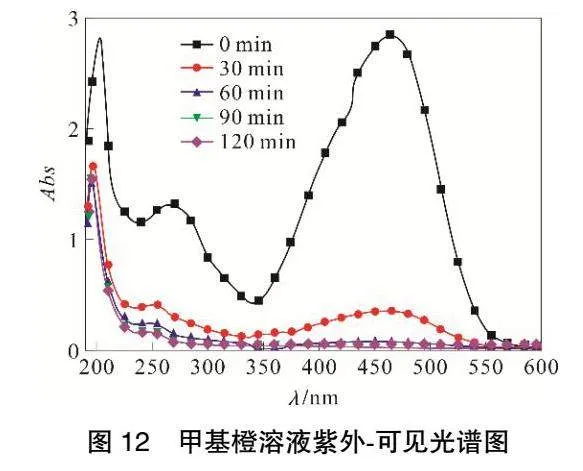
由图12可知,在0min时,463nm处出现强吸收峰,这是甲基橙分子中偶氮结构的n-π*跃迁引起的,属于甲基橙的偶氮键特征吸收峰[20];275nm处的吸收峰是由苯环共轭体系的π-π*跃迁引起的,属于甲基橙分子中苯环的特征吸收峰;203nm处吸收峰由π-π*跃迁和苯环共振重叠引起的E2吸收带。随着降解反应进行,463nm处吸收峰迅速降低,最后波峰消失,此时甲基橙溶液颜色从橙色,变为黄色,最终变为无色,表明甲基橙分子结构中的偶氮键被氧化破坏,甲基橙分子中-SO3Na 和-N(CH3)2发色基团也脱落,使n-π*的跃迁逐渐消失[21]。30min时,463nm处吸收峰很小,说明甲基橙剩余较少;275nm的吸收峰向前推移至250nm处,说明苯系物苯环上的支链在逐渐断裂。30min之后,463nm处吸收峰几乎消失,203nm处吸收峰降低幅度很小,60min后基本保持不变,这是由于前期氧化形成中间产物苯环结构较多且稳定,很难被氧化降解[22-23]。
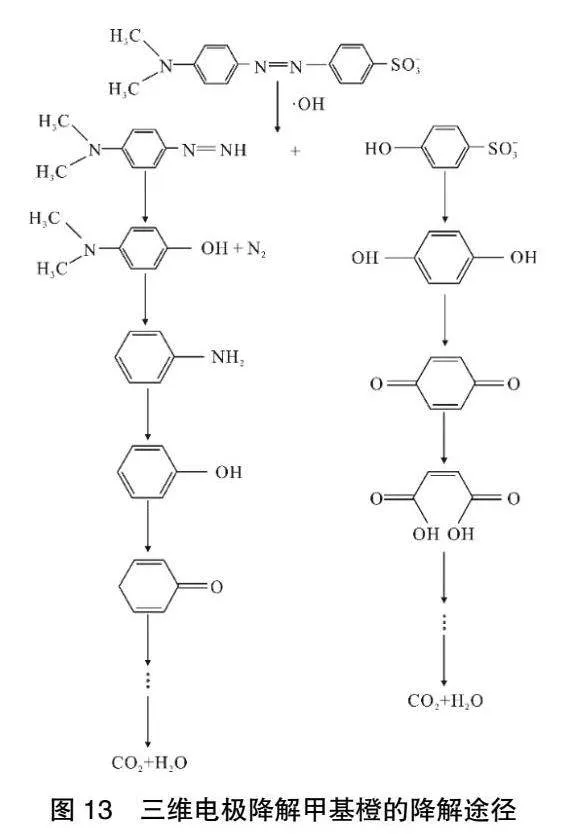
初步推测甲基橙降解途径如图13所示。
该三维电极系统为中性,则甲基橙为偶氮式结构。由Fenton反应产生的强氧化性物质·OH,强氧化物与甲基橙接触首先破环发色基团,生成偶氮苯和硫酸基苯,并且通过攻击甲基橙分子中的偶氮键。强氧化物攻击偶氮键导致偶氮苯分子从中间断开,分解为多种芳香类物质;接着·OH进一步攻击苯环大π键,生成苯酚、对苯二酚、邻苯二酚;然后对苯二酚继续反应生成苯醌[24]。苯醌会在强氧化物质攻击下,环被打开降解为乙二酸、丁二酸等物质,最终被矿化为CO2和H2O。
4 结 论
1)对负载型三维电极降解甲基橙和COD进行动力学分析。结果表明,甲基橙和COD降解符合一级反应动力学。粒子投加量为50g·L-1,溶液pH为7,溶液温度为45℃时反应速率常数最大。温度与甲基橙降解反应速率方程为:k=3.5667×104exp(-3.4442×104/(RT));温度与甲基橙降解反应速率方程为:k=7.62exp(-1.5299×104/(RT))。
2)通过紫外-可见光谱图可以看出:463nm处吸收峰迅速降低,最后波峰消失,表明甲基橙分子结构中的偶氮键被氧化破坏;275nm的吸收峰向前推移至250nm处,说明苯系物苯环上的支链在逐渐断裂;203nm处吸收峰下降幅度很小,60min后基本保持不变,这是由于前期氧化形成中间产物苯环结构较多且稳定。
3)初步推测反应机理:甲基橙降解为偶氮式降解,强氧化物与甲基橙接触首先破环发色基团,并且通过攻击甲基橙分子中的偶氮键导致偶氮苯分子从中间断开,分解为多种芳香类物质;接着·OH进一步攻击苯环大π键,生成苯酚、对苯二酚、邻苯二酚、苯醌等中间产物,最终被矿化为CO2和H2O。
参考文献:
[1]许青枝,王翔,郑莹莹. 印染废水水质特征及处理技术探讨[J]. 能源与节能, 2022, 2: 90-91.
[2]王开花. 印染废水处理技术现状及发展趋势[J]. 资源节约与环保, 2020, 12: 79-80.
[3]MA J, GAO M, SHI H, et al. Progress in research and development of particle electrodes for three-dimensional electrochemical treatment of wastewater: a review[J].EnvironSciPollutRes Int. 2021,28(35):47800-47824.
[4]时晓宁, 王培京, 王茂, 等.粒子电极在废水处理中的应用研究进展[J].四川环境, 2020, 39(5):179-185.
[5]徐斌, 张书陵, 高月香, 等. 石墨烯三维电极-电Fenton 系统降解甲基橙[J]. 中国环境科学, 2020, 40(10):4385-4394.
[6]张添淇. 三维电极电催化降解甲基橙模拟废水的研究[D]. 沈阳:沈阳建筑大学,2022.
[7]莫再勇, 李香源, 曾玉凤. 铬、铁二元修饰的高效碳基催化剂及其三维电极催化降解甲基橙模拟废水[J]. 玉林师范学院学报(自然科学), 2019, 40(5):71-76.
[8]李雪, 冯岩, 于衍真. 三维电极体系在废水处理中的应用[J]. 中国资源综合利用,2016,34(4):29-33.
[9]WANG CT, HU JL, CHOU WL, et al.Removal of color from real dyeing wastewater by Electro-Fenton technology using a three-dimensional graphite cathode[J].Journal of Hazardous Materials, 2008, 152(2):601-606.
[10]宋卫锋,林美强,倪亚明. DSA 类电极催化降解硝基苯动力学及机理的研究[J]. 环境科学研究,2002(5):10-13+21.
[11]苏博. 三维电极降解偶氮废水的研究[D]. 沈阳:沈阳建筑大学,2020.
[12]白忠腾. 三维电-Fenton粒子电极制备及其处理焦化废水研究[D]. 鞍山:辽宁科技大学,2021.
[13] TANGWZ, HUANGC. Effect of chlorine content of chlorinated phenols on their oxidationkinetics by Fenton’s reagent[J].Chemosphere,1996,33(8):1621-1635
[14] ZHOU M, LEIL. Electrochemical regeneration of activated carbon loaded with p-nitrophenolin a fluidized electrochemical reactor[J].ElectrochimActa, 2006,51(21):4489-4496
[15]李沅知. 活性炭粒子电极改性及其三维电极反应器处理废水的研究[D]. 长沙:中南大学, 2014.
[16]张程蕾,滕厚开,韩恩山, 等. Fe3O4-MnO2/Gh的制备及其对氯乙酸的降解研究[J]. 工业水处理, 2021, 41(1):43-48.
[17]张显峰. SnO2/Fe3O4粒子电极的制备及三维电极体系电催化性能研究[D]. 中国石油大学, 2017.
[18]WANGZY, LIJF, HEXL, et al. Organic Pollutants Removal Performance and Enhanced Mechanism Investigation of Surface-Modified Steel Slag Particle Electrode [J].En8c9fe22a9e8b87fbfbf4674744cdd06f7fd6cec1c85529d4a56e77f4aeaec885vironmental Progress & Sustainable Energy, 2018, 58(1): 1-7.
[19] SUN S P, ZENG X, LEMLEYA T. kinetics and mechanism of carbamazepine degradation by a modified Fenton-like reaction with ferric-nitrilotriacetatecomplexes[J].Journal of Hazardous Materials, 2013,(252/253):155-165.
[20] ZHAO WT, HUANG X, LEEDJ. Enhanced treatment of coke plant wastewater using an anaerobic anoxic oxicmembrane bioreactor system[J].Separation & Purification Technology,2009,66(2):279-286.
[21]吴正雷,彭文博,董凯,等. Ni 基催化剂处理甲基橙废水动力学及机理研究[J]. 当代化工,2020,49(5):850-853.
[22]孙宏, 张泽, 潘珊珊. 负载型纳米Mn-Fe 双金属配合物的制备及催化性能[J]. 化学工程, 2016, 44(9): 6-10.
[23]孙宏, 张泽, 于祥辉. ZnFe2O4/ZnO复合材料光催化氧化水中甲基橙[J]. 印染助剂, 2018, 35(9): 44-47.
[24]汤茜,王艳华,迟赫. 电Fenton法降解甲基橙的机理研究[J]. 安全与环境工程, 2011,18(5):37-41.
