水热条件对氢氧化镁粉末改性效果的影响
2024-09-20夏亮张丽张莹李雅侠冯颖
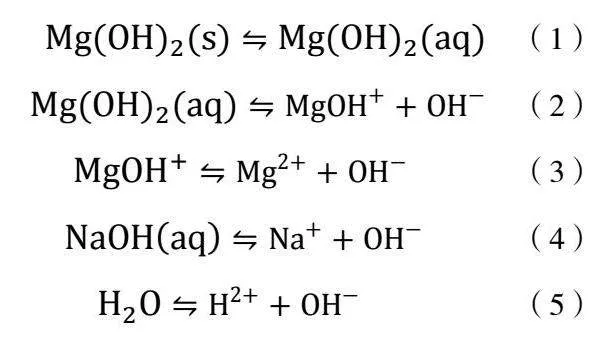
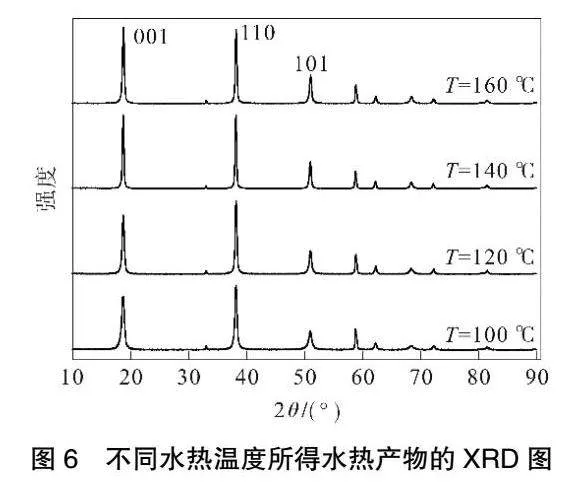



摘 要: 本文研究了水热条件对氢氧化镁粉末改性效果的影响,采用扫描电镜(SEM)、X射线衍射(XRD)、激光粒度分析仪和比表面仪等表征方法对所得产品进行了分析。结果表明:矿化剂浓度、温度和时间对产品粒径及形貌影响显著。以硫酸镁制得的氢氧化镁粉末为前驱体,在矿化剂浓度为0.6 mol·L-1、水热温度为140 ℃、水热时间为6 h条件下,可得到D50为10.58 μm、I001/I101为1.22、比表面积为22.41 m2·g-1的六方片形产品。
关 键 词:阻燃剂;氢氧化镁;水热反应
中图分类号:TQ050.4+21文献标识志码: A 文章编号: 1004-0935(20202024)0×8-1152-05
1 引言
随着高分子材料工业的迅速发展,塑料、橡胶、纤维等合成材料广泛地应用于建筑、化工和军事领域。然而,这些聚合物材料大多存在易燃问题,导致的重大火灾数量不断增加,因此阻燃技术在这些领域的应用备受关注[1]。如今,国内外阻燃剂的生产取得了长足的进步,包括各种有机、无机阻燃剂。然而,一些阻燃剂也存在问题,可能会产生负面影响,例如阻燃剂本身的毒性或用作阻燃剂时释放有害物质。因此,无污染、绿色环保的阻燃剂是未来的发展方向。
氢氧化镁作为一种高效、低毒、无烟、无污染的环保型阻燃剂,在高分子材料阻燃领域具有较好的应用前景[2-4]。氢氧化镁的阻燃抑烟机理主要通过以下几个方面实现:氢氧化镁水解得到氧化镁和水,此过程吸收大量热量(44.8 kJ·mol-1),从340 ℃的初始温度分解到完全分解时的490 ℃,有利于抑制聚合物的温度上升,防止燃烧;分解产物对应形成稳定的氧化物保护膜,具有良好的耐火性,覆盖燃烧材料的表面,使其不能与氧气接触,不能传热;产生的大量水蒸气,可降低气相区可燃物的浓度。氢氧化镁分解时不会形成有害物质,同时还可以中和酸性气体,达到阻燃目的的同时还不会污染环境。综合分析,氢氧化镁阻燃剂是一种近乎完美的环保型阻燃剂。然而大多数常规氢氧化镁为比表面积大于20 m2·g-1的无定形薄片,由于比表面积大,会导致颗粒之间发生强烈团聚,形成粒径为10~100 μm的颗粒。这些大颗粒氢氧化镁在聚合物材料的界面处产生较大的间隙,导致界面处存在严重缺陷,使聚合物材料活性降低,进而达到阻燃效果。为了获得优异的阻燃性能,应优先选用颗粒尺寸小、比表面积小、分散性好的六方片形氢氧化镁。
制备氢氧化镁的方法有很多,包括沉淀法[5]、水热法[6]和溶剂热反应法[7]。常用于制备氢氧化镁的原料包括海卤(MgCl2)、水氯镁石(MgCl2)、菱镁矿(MgCO3)和白云石(MgCO3、CaCO3)。菱镁矿(MgCO3)储量丰富,其可以煅烧成一种廉价的MgO产品,称为轻质煅烧氧化镁(也称为轻烧粉,MgO质量分数为80%~93%)。与从海水和盐水中获得的常用MgCl2相比,轻烧粉特别适合采用直接水合法(![]()
![]()
![]()
![]() )制备氢氧化镁[8]。但是,这种方法无法去除轻烧氧化镁中的杂质(SiO2),因此只能生产低端氢氧化镁产品。另一种可用的方法是首先用酸将轻烧粉中的MgO转化为可溶性镁盐,例如分别用HCl或H2SO4转化为MgCl2或MgSO4,然后用碱如NaOH、Ca(OH)2或氨沉淀Mg2+。然而,由于酸的使用,成本明显增加,还引入了新的杂质,如HCl中的Cl−和H2SO4中的SO42−2-。并且这些方法制备的氢氧化镁都是凝胶状的,晶体表面带有电荷,具有很强的极性,非常容易团聚在一起,在非极性的高分子材料中应用时容易分散不均匀,影响材料性能[9]。
)制备氢氧化镁[8]。但是,这种方法无法去除轻烧氧化镁中的杂质(SiO2),因此只能生产低端氢氧化镁产品。另一种可用的方法是首先用酸将轻烧粉中的MgO转化为可溶性镁盐,例如分别用HCl或H2SO4转化为MgCl2或MgSO4,然后用碱如NaOH、Ca(OH)2或氨沉淀Mg2+。然而,由于酸的使用,成本明显增加,还引入了新的杂质,如HCl中的Cl−和H2SO4中的SO42−2-。并且这些方法制备的氢氧化镁都是凝胶状的,晶体表面带有电荷,具有很强的极性,非常容易团聚在一起,在非极性的高分子材料中应用时容易分散不均匀,影响材料性能[9]。
水热改性法可以降低氢氧化镁的表面极性,提高颗粒的分散性[10]。以NaOH溶液[11]为矿化剂对以硫酸镁为原料所制得的氢氧化镁产品进行水热改性,此过程属于“溶解-结晶”过程,在Mg(OH)2-NaOH-H2O体系中存在如式(1)至式(5)的反应过程。
在Mg(OH)2-NaOH-H2O体系中,MgOH+和OH-的浓度会影响氢氧化镁的重结晶过程,此外水热时间和水热温度也对氢氧化镁重结晶过程有着直接影响,进而影响水热产品的分散性。
1实验部分
1.1 实验方法
采用120 mL内衬聚四氟乙烯的高压釜,以硫酸镁制取的平均粒径(D50)为12.40 mm、峰强度比(I001/I101)为0.65、比表面积为46.65 m2·g-1的氢氧化镁固体粉末为原料,加入一定量的NaOH溶液,在一定温度下,水热反应一定时间后自然冷却至室温,抽滤并用蒸馏水和无水乙醇洗涤至中性后干燥、研磨得到水热反应后的氢氧化镁产物。
1.2 表征方法
采用BT-9300H激光粒度分析仪对Mg(OH)2产品进行了粒径测试,可获得其颗粒直径、数量和粒度分布等信息。利用扫描电镜技术,可以直接观察晶体缺陷及其形貌。产品晶体的结构通过X射线衍射仪进行测试,扫描范围为10°~90°,扫描速度为 6(°)·min-1。采用Micromeritics仪器公司的比表面积分析仪测定产品比表面积。
2结果与讨论
2.1 矿化剂浓度对产品的影响
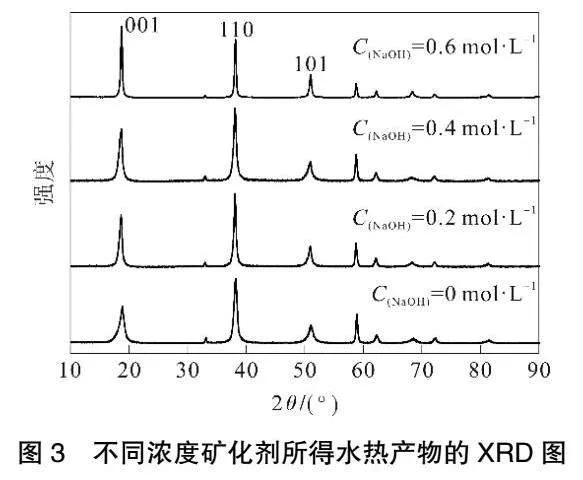
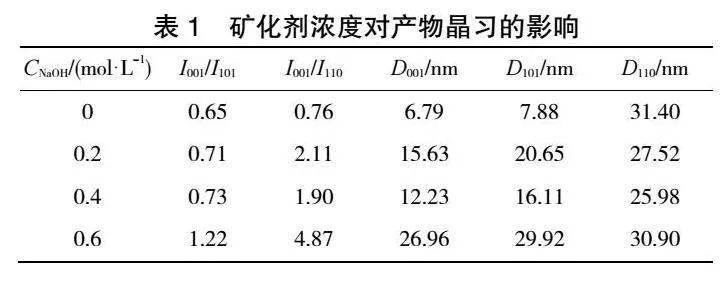
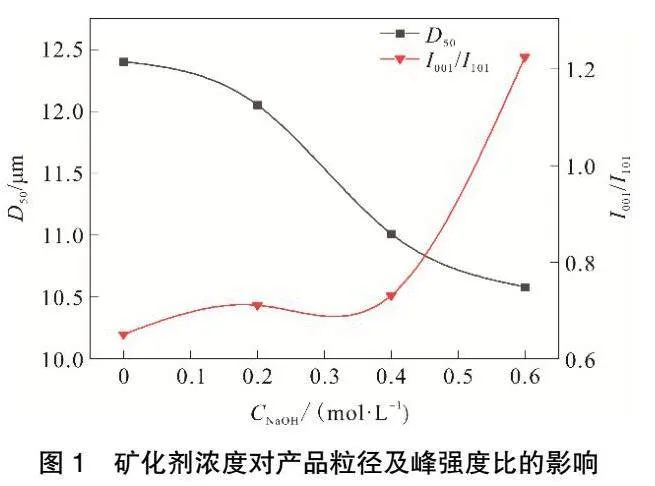
在水热温度为140 ℃、水热时间为6 h时,矿化剂浓度对产品粒径及峰强度的影响见图1,对产品晶习的影响见表1,所得水热产品的SEM结果见图2,XRD结果见图3。由图1可知,随着矿化剂浓度的增加,产品的平均粒径逐渐减小,I001/I101逐渐增大。当矿化剂浓度为0.6 mol·L-1时,I001/I101可达1.22,经比表面积仪测定,比表面积为22.41m2·g-1。这表明产品的分散性被显著提高。由图2可以看出,未加入矿化剂(CNaOH=0 mol·L-1)时,产品形貌无明显规则且存在团聚现象,当增大矿化剂浓度后,产品的晶体棱角看起来更加清晰,并有六方片状的产物生成。由表1和图3可知,随着矿化剂浓度增加,各主要峰面强度增加,晶粒尺寸增大,产品分散性变好。上述结果表明,OH-对晶体的成核及生长有影响,会改变氢氧化镁晶体的生长习性而得到不同形貌的氢氧化镁,OH-除了对形貌有影响外,对氢氧化镁晶体的尺寸也有影响。控制水热条件,可以改变晶体的生长方向,使非极性001晶面增加,极性大的101晶面减小。
2.2 水热温度对产品的影响
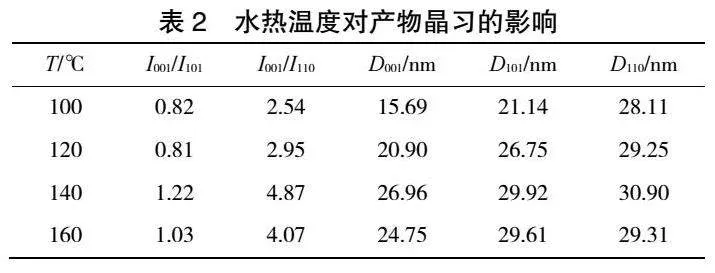
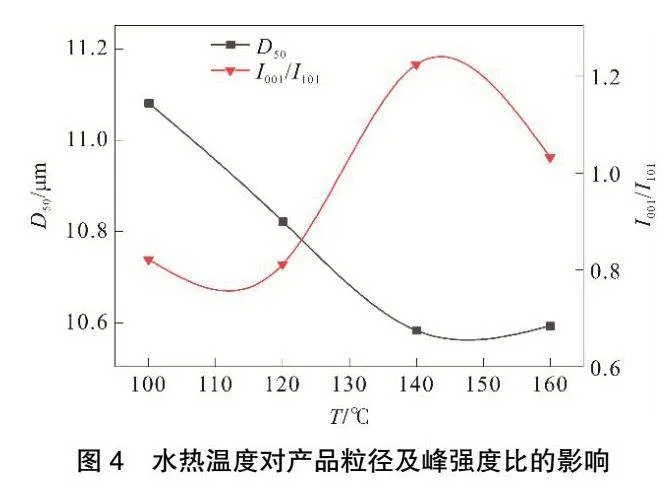
在矿化剂浓度为0.6 mol·L-1、水热时间为6 h时,水热温度对产品粒径及峰强度比的影响见图4,所得水热产物的SEM图见图5,对产品晶习的影响见表2,XRD结果见图6。由图4可知,随着水热温度的升高产品平均粒径逐渐减小,当温度达160 ℃后,产品粒径开始增大,温度为140 ℃时I001/I101比值最大。由图5可以看出,随着水热温度升高产品相貌逐渐趋于六方片状,改性效果明显。由表2和图6可知,随着温度升高,各峰面强度和晶粒尺寸逐渐增大,说明高温可以促进Mg(OH)2溶解,释放出大量Mg2+,有利于重结晶过程晶体的生长,但是温度过高产品晶体边缘部分发生团聚,这说明水热温度过高并不利于晶体的生长,并且高温条件也会增加生产成本。故最适宜水热温度选择140 ℃。
2.3 水热时间对产品的影响
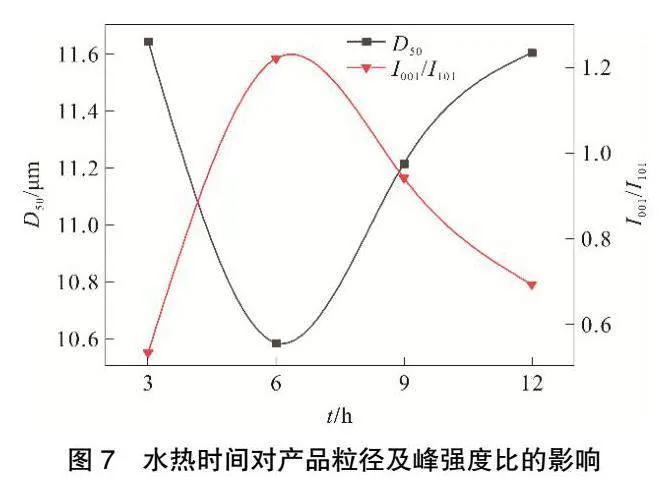
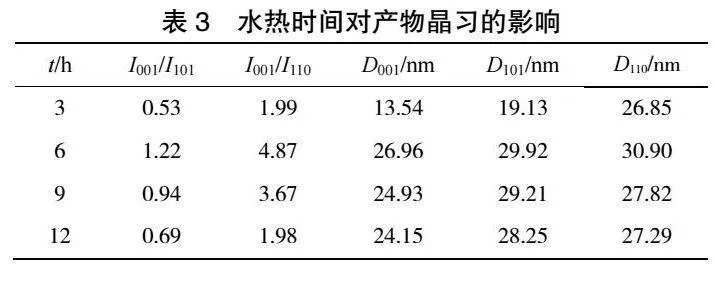
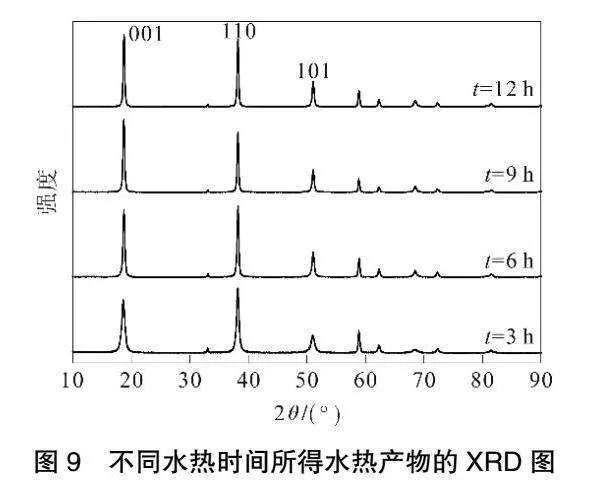
在矿化剂浓度0.6 mol·L-1、水热温度140 ℃时,水热时间对产品粒径及峰强度比的影响见图7,所得水热产物的SEM图见图8,对产品晶习的影响见表3,XRD结果见图9。由图7可知,水热时间为6 h时,氢氧化镁水热产品的平均粒径最小,I001/I101最大。由图8可以看出,随着反应时间的延长,有较大无规则的产物生成,继续延长反应时间,会使部分生长基元在大颗粒上非定向生长,呈现出不完整形貌。对比比表面积为45.65 m2·g-1的氢氧化镁原料,水热6 h样品的比表面积下降至22.41 m2·g-1。由表3和图9可知,随着反应时间的延长,I001/I101由0.53增至1.22,I001/I110由1.99增至4.87,001晶面尺寸D001由13.54 nm增至26.96 nm,101晶面尺寸D101由19.13 nm增至29.92 nm,110晶面尺寸D110由26.85 nm增至30.90 nm,表明随着时间的延长,氢氧化镁晶体的上述晶面变厚,这有利于生成六方片状的形貌,这与比表面积的结果一致。上述结果表明,水热时间的长短对氢氧化镁晶体的形貌和分散性影响比较明显,水热6 h时有大量的完整六方片状晶体,水热9 h后晶体形貌发生改变,六方形的棱角变得模糊。实验结果表明水热6 h的氢氧化镁样品生长得最好。考虑到实际生产效率问题,最适宜水热时间选择6 h。
3结论(结束语)
以NaOH溶液作为矿化剂,对以硫酸镁为原料制得的平均粒径(D50)为12.40 mm、峰强度比(I001/I101)为0.65、比表面积为46.65 m2·g-1的氢氧化镁粉末进行水热改性,考察了矿化剂浓度、水热温度和水热时间对改性后产品的影响。
结果表明,在矿化剂浓度为0.6 mol·L-1、水热温度为140 ℃、水热时间为6 h条件下,改性得到的氢氧化镁产品平均粒径(D50)最小为10.58 mm,I001/I101最大值可达1.22,比表面积为22.41 m2·g-1,此时氢氧化镁晶体棱角分明,呈现六方片状。
参考文献:
[1] ZHANG H Y, WANG H Q, WANG H Q. Flame retardant mechanism and surface modification of magnesium hydroxide flame retardant[J].IOP Conference Series:Earth and Environmental Science, 2018, 170: 032028.
[2] 谢超飞.氢氧化镁基阻燃剂的研究进展[J].上海有色金属,2018,39(6):44-47.
[3] 肖铭. 氢氧化镁阻燃剂应用研究进展[J]. 精细与专用化学品, 2022, 30(2): 31-33.
[4] 王禹博,马亚丽,徐少伟,等. 氢氧化镁及氧化镁制备和应用的研究进展[J]. 辽宁化工,2021,50(3):378-382.
[5] 宋肖飞,蔡以兵,孙晓璐,等. 原位沉淀法制备氢氧化镁阻燃棉织物及其性能[J]. 材料科学与工程学报,2019,37(6):953-959.
[6] 吴易梅,孙玉柱,路贵民,等. 结晶-水热法制备六角片状氢氧化镁[J]. 高校化学工程学报,2019,33(2):425-434.
[7] 吴健松,李财花,李海民. 有机溶剂-水热法制备阻燃球形氢氧化镁[J]. 无机盐工业,2006,38(3):40-42.
[8] 孙晓君,丁珂,仇龙,等. 以轻烧粉制备六方片状氢氧化镁[J]. 硅酸盐学报,2019,47(4):538-544.
[9] 林琴,陈丹妮,屠强,等. 氢氧化镁制备中影响晶粒分散性的因素研究[J]. 山东化工,2021,50(22):17-18.
[10] 张建忠,徐永杰,王金晶. 水热法制备氢氧化镁阻燃剂研究[J]. 盐科学与化工,2018,47(6):10-13.
[11] 彭程. 氢氧化钠溶液中氢氧化镁的水热改性[J]. 化工管理,2020(9):188-189.
