桦褐孔菌口服佐剂对禽类疫苗的体液免疫增强作用研究
2024-09-20杨硕费智国郭梦帅郭玲陈智张琳丁志勇关红艳赵晓明黄悦妍刘娜刘建钗

摘要 为了明确桦褐孔菌发酵产物(Inonotus obliquus fermentation product, IOFP)作为禽类疫苗佐剂的适用性,选择商品化禽流感灭活疫苗和鸭坦布苏病毒弱毒活疫苗分别免疫SPF鸡和SPF鸭,并饲喂含0.8% IOFP的饲粮,同时设置饲喂商品化饲粮的对照组。在免疫后不同时间点采集鸡和鸭的外周血,分离血清后分别测定禽流感病毒(avian influenza virus,AIV)特异性血凝抑制(hemagglutinin inhibition,HI)抗体、鸭坦布苏病毒(duck Tembusu virus,DTMUV)特异性抗体及二者中和抗体效价。使用统计学方法评价IOFP对机体体液免疫反应的影响。鸭免疫后28 d使用DTMUV强毒株攻毒,持续检测泄殖腔排毒量,以确定IOFP对DTMUV排毒量的影响。结果显示,IOFP作为口服佐剂能够显著提升AIV、DTMUV疫苗抗体和中和抗体水平,特别是对免疫早期抗体的改善效果尤为显著。此外,添加IOFP还能够减少DTMUV的排毒量,缩短排毒时间。由此可见,IOFP是一种禽类病毒性疫苗普遍适用的口服佐剂,对于缩短免疫“空窗期”、提升疫苗保护效果具有较好的改善作用。
关键词 桦褐孔菌发酵产物;禽流感病毒灭活疫苗;鸭坦布苏病毒弱毒活疫苗;抗体;中和抗体
中图分类号 S852.5 文献标识码 A 文章编号 0517-6611(2024)17-0094-04
doi:10.3969/j.issn.0517-6611.2024.17.020
Study on the Enhancement Effect of Oral Adjuvant of Inonotus obliquus on the Humoral Immunity of Avian Vaccines
YANG Shuo1, FEI Zhi-guo1,2,3, GUO Meng-shuai2,3,4 et al
(1.College of Life Science and Food Engineering, Hebei Engineering University, Handan, Hebei 056038;2.Institute of Animal Husbandry and Veterinary Medicine, Shandong Academy of Agricultural Sciences/Shandong Provincial Key Laboratory of Livestock and Poultry Disease Prevention and Breeding, Jinan, Shandong 250100;3. Key Laboratory of Livestock and Poultry Bioomics, Ministry of Agriculture and Rural Affairs,Jinan,Shandong 250100;4.College of Animal Science and Veterinary Medicine, Shandong Agricultural University, Tai’an, Shandong 271018)
Abstract In order to clarify the applicability of Inonotus obliquus fermentation product (IOFP) as the adjuvants of avain vaccines, commercial avian influenza inactivated vaccine and duck Tembusu virus attenuated live vaccine were selected to immunize SPF chicken and ducks, respectively. SPF chicken in the experimental group were fed with the commercial diet containing 0.8% IOFP, SPF chicken in the control group were fed with the the commercial diet. The peripheral blood from the chicken and ducks was collected at different time points after immunization and the serum was separated to determine the specific hemagglutinin inhibition (HI) antibodies of avian influenza virus (AIV), specific antibodies of duck Tembusu virus (DTMUV), and their neutralizing antibody titer. The effects of IOFP on the humoral immune response were evaluated by using the statistical methods.After 28 days post immunization, the ducks were challenged with virulent DTMUV, and the cloacal detoxification volume was detected, so as to confirm the effects of IOFP on the detoxification volume of DTMUV. The results showed that IOFP as oral adjuvant could significantly improve the titers of specific and neutralizing antibodies against AIV and DTMUV, and especially the improvement effect on the antibodies at the early stage. In addition, adding IOFP could reduce the detoxification volume of DTMUV, and shorten the shedding time. Therefore, IOFP was a common oral adjuvant for avian viral vaccines, which had a great improvement effect on shortening the immune “gap period” and improving the protective effect of vaccines.
Key words Inonotus obliquus fermentation product;Avian influenza inactivated vaccine;Duck Tembusu virus attenuated vaccine;Antibody;Neutralizing antibody
基金项目 山东省重点研发计划项目“乡村振兴科技创新提振行动计划”(2022TZXD0041);秦皇岛市珍稀药用真菌应用创新平台项目(202201B051);山东省重点研发计划项目(竞争性创新平台)(2022CXPT005-02,2022CXPT010);山东省农业科学院农业科技创新工程项目(CXGC2023A21)。
作者简介 杨硕(1992—),男,湖北潜江人,硕士研究生,研究方向:禽类疫病防控技术。
通信作者,教授,从事动物疫病防控技术研究。
收稿日期 2023-09-25
禽流感病毒(avian influenza virus,AIV)是严重危害我国禽类养殖业的病毒之一,每年造成大量禽类死亡,经济损失巨大。由于病毒的变异和重组,禽流感病毒从禽类溢出而具备感染人类能力的事件偶有发生,对公共安全造成了极大危害[1-2]。鉴于此,我国起初采用疫苗免疫和物理扑杀相结合的措施来应对高致病性禽流感的传播。随着病毒学和疫苗制备技术的进步,防疫工作又逐渐转变为新型疫苗免疫模式[3-4],该模式在实际应用中取得成功且获得了国际社会的认可。鸭坦布苏病毒病是自2010年以来严重威胁养鸭业的病毒性传染病,主要引起蛋鸭产蛋率骤降、肉鸭和育成鸭死亡,近年来它已成为水禽养殖业常见且频繁流行的疫病之一[5-7]。随着疫苗的成功研制和大规模应用,鸭坦布苏病毒的传播逐渐由大规模暴发转变为地方性间歇流行,加上流行病学监测,其造成的经济损失逐年减少。因此,在禽流感和鸭坦布苏病毒病的防控措施中,疫苗免疫起到了至关重要的作用。在实际生产中,经常会出现免疫失败的现象,其原因之一是免疫“空窗期”(免疫后至疫苗起效的时间段)的存在。“空窗期”越长,感染的可能性就越高,加上免疫本身会对禽类产生一定程度的应激,所以“空窗期”是病毒感染的高峰期。因此,促进疫苗特异性抗体的提前分泌、缩短起效的窗口期十分必要。
佐剂是提高疫苗免疫效果的有效工具,而绿色口服佐剂是集安全、高效、经济于一身的一种佐剂。研究表明,药用真菌桦褐孔菌制剂具有抗肿瘤、抗氧化、调节免疫力、降血糖、抗病毒、抗细菌、抗寄生虫等多种功效[8-10],将其应用于禽类养殖能够显著提升机体的生产性能和免疫性能,它是一种效果优良的饲料添加剂和免疫增强剂[11-12]。当其以口服佐剂的形式配合新城疫(newcastle disease,ND)灭活疫苗使用时,可以显著提升新城疫病毒特异性抗体、中和抗体的水平,有效改善机体的攻毒保护率,是一种经济、方便的佐剂[13]。迄今为止,桦褐孔菌作为口服佐剂改善疫苗免疫效果的研究仅此一项,尚不确定它是不是家禽/水禽常用疫苗普遍适用的佐剂。笔者选择商品化的禽流感灭活疫苗和鸭坦布苏病毒弱毒活疫苗,分别免疫SPF鸡和SPF鸭,以口服形式饲喂桦褐孔菌制剂,对免疫后鸡和鸭的抗体水平进行检测,旨在明确IOFP对2种疫苗免疫效果的改善作用,为禽类广泛适用的佐剂产品开发提供候选材料。
1 材料与方法
1.1 材料
1.1.1 试验动物、细胞、病毒。
9日龄SPF鸡胚和鸭胚、7日龄SPF鸡和鸭均购自山东昊泰实验动物繁育有限公司;非洲绿猴肾(Vero)细胞由笔者所在实验室保存;鸭坦布苏病毒DTMUV(TCID50为10-5.79/mL)由山东省畜禽疫病防治与繁育重点实验室保存。
1.1.2 主要试剂。
禽流感灭活疫苗(150252152)、鸭坦布苏病毒弱毒活疫苗(2006012-2)为齐鲁动物保健品有限公司产品;桦褐孔菌制剂由秦皇岛高通生物科技有限公司制备,制备方法参照文献[13];鸭坦布苏病毒ELISA抗体检测试剂盒为中国农业科学院上海兽医研究所研制产品 。
1.2 动物试验
1.2.1 试验1。
1.2.1.1 试验分组。
SPF鸡20只,随机分为2组(试验组与对照组),每组10只,分别饲养在隔离器中。7日龄,免疫禽流感灭活疫苗,剂量与免疫途径参照疫苗说明书。对照组饲喂商品化日粮,试验组则在商品化日粮的基础上添加0.8%的IOFP(m/m),试验期自由采食和饮水。
1.2.1.2 试验方法。
分别于免疫后0、4、7、14、21、28、35和42 d采集外周血,进行抗体及中和和抗体的检测。采集的外周血3 000 r/min离心10 min后分离血清,进行AIV特异性血凝抑制(HI)抗体滴度和中和抗体滴度的检测,操作方法参考文献[14]。
1.2.2 试验2。
1.2.2.1 试验分组。
SPF鸭20只,随机分为2组(试验组与对照组),每组10只,分别饲养在隔离器中。14日龄,进行鸭坦布苏病毒弱毒活疫苗的免疫,14 d后加强免疫1次,剂量与免疫途径参照疫苗说明书。对照组饲喂商品化日粮,试验组则在商品化日粮的基础上添加0.8%的IOFP,试验期自由采食和饮水。
1.2.2.2 试验方法。
分别于首免后0、4、7、14、21和28 d采集外周血,分离血清后进行抗体滴度及中和抗体滴度的检测。抗体滴度的测定按照ELISA抗体检测试剂盒说明书进行,中和抗体滴度的测定采用固定病毒稀释血清的方法。将病毒稀释为200 TCID50,与系列倍比稀释的血清混匀,置于5% CO2培养箱(37 ℃)中孵育2 h;取等量的混合液接种于单层Vero细胞上,每个稀释度4个重复;在37 ℃、5% CO2的条件下作用2 h后,吸弃混合液并加入维持液;在相同条件下继续培养5 d,每天观察细胞病变数,按照Reed-Muench法计算血清中和抗体的效价。2组鸭子在加强免疫后14 d,使用DTMUV强毒株攻毒,攻毒方式为滴鼻点眼,攻毒剂量为10-5.79/mL;攻毒后每隔1 d采集2组鸭子的肛拭子,使用荧光定量方法进行排毒量的检测,检测方法与李海燕等[15]的方法相一致。
1.3 数据统计与分析
试验数据采用 GraphPad Prism 8.0 软件中 student’s t-test 进行分析,并进行差异显著性检验(P<0.05 表示差异显著,P<0.01表示差异极显著)。
2 结果与分析
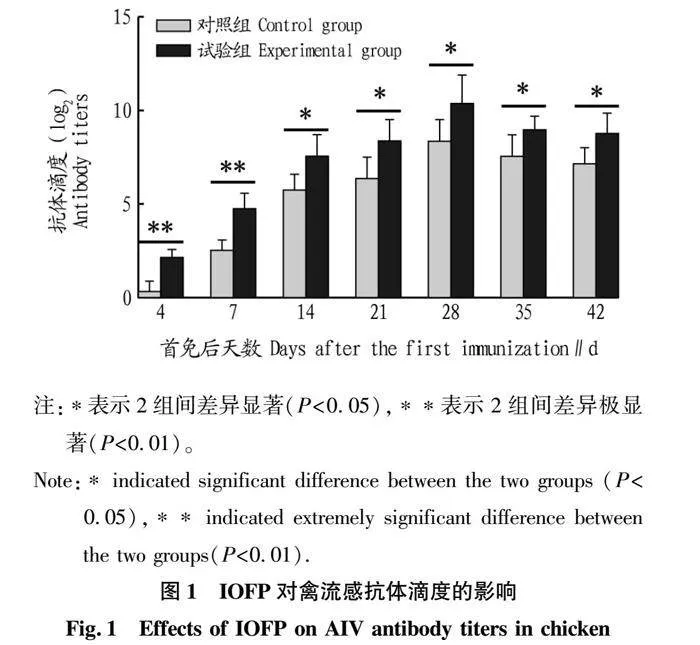
2.1 IOFP对AIV抗体滴度的影响
对不同时间点的AIV HI特异性抗体滴度进行测定,结果如图1所示。从图1可以看出,试验组和对照组鸡的HI抗体滴度变化趋势基本一致,均表现为4 d检测到抗体的产生,28 d达到峰值,此后缓慢下降。试验组每个时间点的抗体滴度与对照组相比均提高1~2个滴度左右且差异显著(P<0.05),免疫早期(4和7 d)2组间差异极显著(P<0.01)。
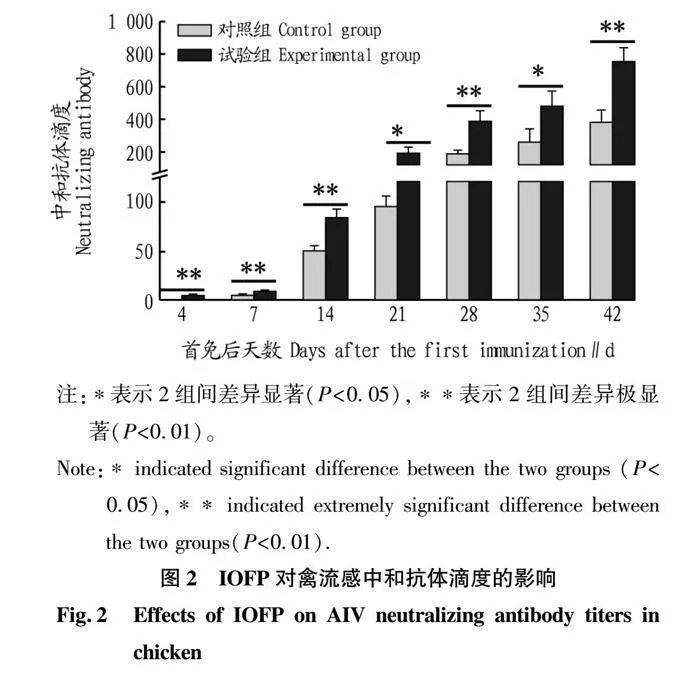
2.2 IOFP对AIV中和抗体滴度的影响
对不同时间点AIV的中和抗体滴度进行测定,结果见图2。从图2可以看出,IOFP对中和抗体效价的提升比HI抗体更为明显。除了21、35 d中和抗体滴度显著高于对照组外(P<0.05),其余时间点2组间差异均极显著(P<0.01);从中和抗体出现时间来看,试验组4 d即可检测到抗体效价,而对照组7 d才能检测到。
2.3 IOFP对DTMUV抗体滴度的影响
对不同时间点DTMUV特异性抗体滴度进行测定,结果如图3所示。从图3可以看出,在2次免疫的情况下,2组鸭坦布苏病毒抗体滴度随着时间的变化而逐渐升高,28 d时达到峰值。与对照组相比,试验组在口服IOFP后每个时间点均有1~2个抗体滴度的提升(P<0.05),同时试验组抗体出现时间上也比对照组提前3 d左右。
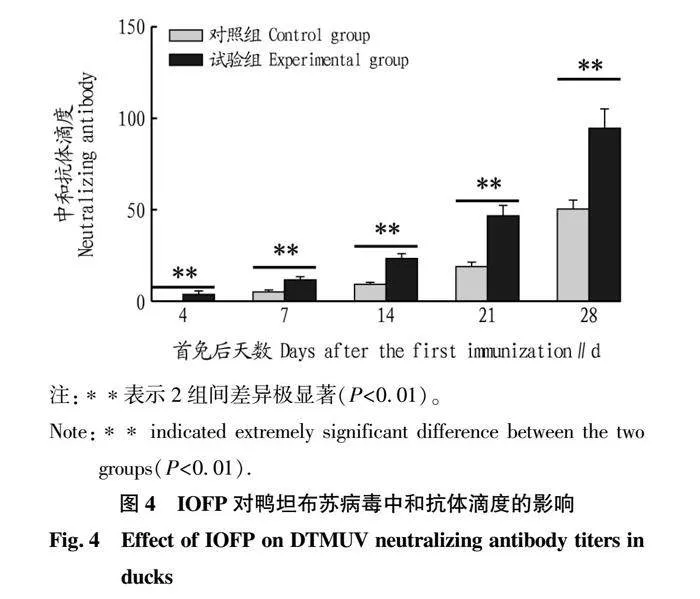
2.4 IOFP对DTMUV中和抗体滴度的影响
对不同时间点鸭DTMUV的中和抗体滴度进行了检测,结果见图4。从图4可以看出,IOFP佐剂不仅能够提升中和抗体的滴度,而且能够促进中和抗体的提前分泌。在每个时间点,试验组的中和抗体滴度均高于对照组,且差异极显著(P<0.01);对照组在7 d左右检测到中和抗体的存在,而试验组4 d即可检测到,且其中和抗体滴度与对照组7 d时的中和抗体滴度相近。
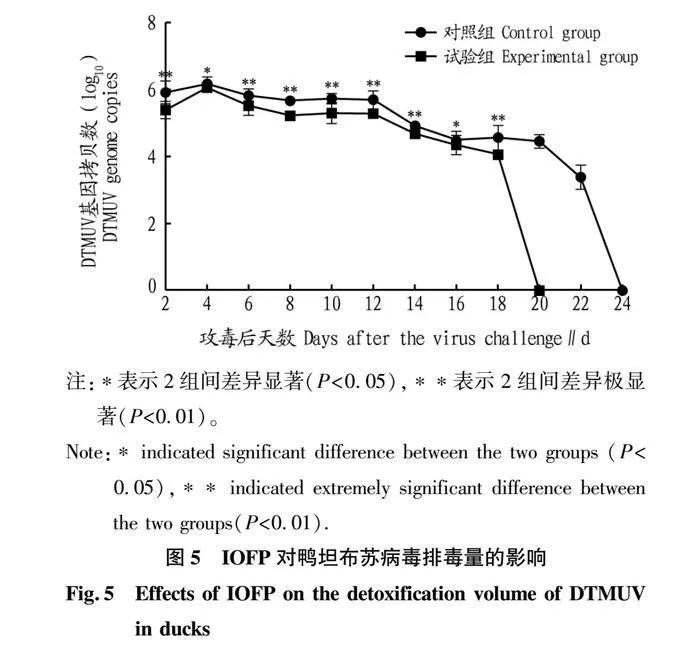
2.5 IOFP对DTMUV排毒量的影响
如图5所示,2组鸭在攻毒后2 d即可在泄殖腔中检测到病毒的存在,4 d时排毒量达到峰值,此后缓慢下降。对照组在攻毒后的持续排毒期为22 d,而试验组为18 d;在排毒量方面,对照组在每个时间点的排毒量均高于试验组。
3 讨论与结论
桦褐孔菌具有较强的免疫增强和免疫调节作用,自16世纪以来就被人类用于多种疾病的治疗[16-17]。随着研究的不断深入,桦褐孔菌的增强免疫作用在多种动物中得到体现。桦褐孔菌多糖通过促进小鼠胸腺的发育而提升T淋巴细胞的含量[18]。桦褐孔菌胞内多糖能够强烈刺激BDF1小鼠脾脏B淋巴细胞的增殖和分化,促进IgM的产生,二者均能够增强小鼠的免疫力[16]。桦褐孔菌发酵产物以口服形式用于禽类生产,可以显著促进脾脏、胸腺和法氏囊的发育,提升T淋巴细胞的含量和相关细胞因子的表达,提升特异性抗体水平,从而改善机体的攻毒保护率[19];以口服形式将桦褐孔菌发酵产物饲喂肉兔,胸腺器官指数、T淋巴细胞的含量、相关细胞因子的表达和特异性抗体水平均得到不同程度的改善[20]。以上结果表明,桦褐孔菌是动物普遍适用的一种免疫增强剂。在笔者所在课题组的前期研究中,IOFP配合新城疫病毒(NDV)疫苗使用可以显著提升疫苗的特异性HI抗体和中和抗体水平,并促进了中和抗体的提前产生,但IOFP配合其他(形式)的疫苗是否能达到同样的效果还需要进一步验证。
抗体效价是临床上判断疫苗能否保护野毒感染的直观指标,也是评价疫苗免疫效果的主要标准[21]。该研究从体液免疫入手,以鸡和鸭为研究对象,分析了口服IOFP对禽流感灭活疫苗和鸭坦布苏病毒弱毒活疫苗体液免疫的增强效果。结果表明,IOFP能够显著提升SPF鸡和鸭的抗体水平、缩短中和抗体的产生时间、提高病毒的清除速率。IOFP配合禽流感疫苗使用时,试验组所有时间点的HI抗体和中和抗体滴度均显著或极显著高于对照组,特别是免疫后4~7 d时的HI抗体和4~14 d的中和抗体滴度,2组间差异极显著(P<0.01)。早期抗体滴度的快速提升能够有效缩短免疫后的空窗期,尽早对动物提供有效保护对于禽类养殖业的高效生产具有重要意义。这不仅体现在鸡免疫的禽流感灭活疫苗中,而且在鸭免疫的鸭坦布苏病毒弱毒活疫苗中也得到了体现。在免疫后4 d的抗体效价测定中,对照组尚未产生抗体,而试验组已经检测到抗体,在此时间点同样也检测到中和抗体的产生,试验组中和抗体滴度与对照组7 d时的中和抗体滴度相当。该研究2个试验结果与IOFP增强NDV灭活疫苗免疫效果的研究结果相一致。此外,该研究使用鸭坦布苏病毒弱毒活疫苗。相较于灭活疫苗,活疫苗不仅能够激发机体的体液免疫,而且能够诱导细胞免疫的产生,所以进行了鸭坦布苏病毒攻毒后的排毒量检测,以确定疫苗对病毒的杀灭作用。以上结果证实,无论是病毒含量还是排毒时间,IOFP均起到了积极的作用,这也是增强机体细胞免疫反应强度的体现。
综上所述,无论是鸡还是鸭,亦或灭活苗还是弱毒苗,IOFP均能够起到增强免疫效果、缩短免疫空窗期的作用,是禽类及不同形式疫苗普遍适用的口服佐剂。该研究仅选择实践中广泛应用的疫苗为代表进行了验证,并未使用所有形式的疫苗,后续研究将进行逐一验证。
参考文献
[1] SUN H L,LI H,TONG Q,et al.Airborne transmission of human-isolated avian H3N8 influenza virus between ferrets[J].Cell,2023,186(19):4074-4084.
[2] 秦立得,孙荣钊,马冬,等.H5亚型禽流感病毒的危害与疫苗研究进展[J].中国动物检疫,2023,40(5):55-60.
[3] 冯亚亚,郭晶,李玉保,等.禽流感 DNA 疫苗研究进展[J].中国畜牧兽医,2020,47(11):3667-3675.
[4] 宋依红.H5亚型禽流感病毒HA蛋白纳米颗粒疫苗研制及免疫效果评价[D].杨凌:西北农林科技大学,2022.
[5] SU J L,LI S,HU X D,et al.Duck egg-drop syndrome caused by BYD virus,a new Tembusu-related flavivirus[J].PLoS One,2011,6(3):1-10.
[6] 赵瑞宏,张丹俊,潘孝成,等.1例雏鸭坦布苏病毒病的诊断[J].安徽农业科学,2013,41(27):11052,11063.
[7] ZHANG L,LI Z L,TANG Z C,et al.Efficient identification of Tembusu virus CTL epitopes in inbred HBW/B4 ducks using a novel MHC class I-restricted epitope screening scheme[J].The journal of immunology,2022,209(1):145-156.
[8] 贺紫薇,刘旭,李东辉,等.桦褐孔菌研究进展[J].中医药信息,2020,37(2):119-123.
[9] 李婉珍,胡丰林,万水霞,等.桦褐孔菌发酵及其提取物清除自由基活性的研究[J].生物学杂志,2006,23(4):22-25.
[10] 杨晨芝,郝静,丁霄,等.桦褐孔菌多糖对乳酸菌发酵及酸奶品质的影响[J].中国乳品工业,2020,48(11):22-25.
[11] 李海燕,林冬梅,丁志勇,等.桦褐孔菌发酵产物对鸡生长性能和部分免疫指标的影响[J].华北农学报,2017,32(S1):59-63.
[12] 任帅萌.桦褐孔菌发酵产物对 SPF 鸭生长性能和免疫性能的影响[D].邯郸:河北工程大学,2020.
[13] ZHANG L,LIN D M,LI H Y,et al.Immunopotentiating effect of Inonotus obliquus fermentation products administered at vaccination in chickens[J].Molecular cellular probes,2018,41:43-51.
[14] 白俊平,吴家强,于森,等.桦褐孔菌发酵产物对鸡新城疫疫苗免疫效果的影响[J].动物医学进展,2019,40(12):24-29.
[15] 李海燕,于森,刘伟杰,等.鸭特异性CpG ODN体外抑制鸭坦布苏病毒复制的研究[J].中国家禽,2017,39(16):17-21.
[16] KIM Y O,HAN S B,LEE H W,et al.Immuno-stimulating effect of the endo-polysaccharide produced by submerged culture of Inonotus obliquus[J].Life sciences,2005,77(19):2438-2456.
[17] 黄年来.俄罗斯神秘的民间药用真菌——桦褐孔菌[J].中国食用菌,2002,21(4):7-8.
[18] 张慧丽,杨松,宋雅娜,等.桦褐孔菌不同提取成分对小鼠免疫功能比较研究[J].微生物学杂志,2007,27(6):20-23.
[19] 李海燕,张琳,于森,等.3 种食药用真菌发酵物对 SPF 鸡生产和免疫性能的影响[J].黑龙江畜牧兽医,2018(3):185-188.
[20] 费智国.桦褐孔菌发酵产物对 伊拉兔生长性能和免疫性能的影响[D].邯郸:河北工程大学,2023.
[21] LV J F,YANG L X,QU S H,et al.Detection of neutralizing antibodies to Tembusu virus:Implications for infection and immunity[J].Frontiers in veterinary science,2019,6:1-10.
