木里矿区河流浮游生物组成及其环境影响因子
2024-09-20岳哿丞刘艳芳罗晓


摘要 [目的]了解木里矿区河流中浮游生物群落结构特征及其关键环境影响因子,为矿区水资源管理与保护提供数据支撑与参考依据。[方法]对环绕木里露天矿区的典型河流多索河、莫日河进行水体环境和浮游生物采样分析。[结果]多索河与莫日河分别采集到浮游植物6门21种与6门19种,浮游动物2门15种与2门9种。其中硅藻门、绿藻门、原生动物均为2条河流中优势种类,2条河流的浮游生物密度和生物量在空间上均呈现上游多、下游少的特点。多索河中浮游植物和浮游动物Shannon-Wiener指数、Margalef指数、Pielou指数分别为1.64和0.58、0.86和0.33、0.69和0.42;莫日河中浮游植物和浮游动物Shannon-Wiener指数、Margalef指数、Pielou指数分别为1.86和0.21、0.87和0.24、0.79和0.36。冗余分析(RDA)和相关分析结果表明,水温、pH、氮营养物质是影响多索河和莫日河浮游生物群落结构的关键环境因子。[结论]木里矿区水生态保护应着重关注营养盐污染,加强治理过度放牧所导致的面源污染。
关键词 水域生态;浮游生物;群落结构;环境因子;冗余分析
中图分类号 S932.8 文献标识码 A 文章编号 0517-6611(2024)17-0066-06
doi:10.3969/j.issn.0517-6611.2024.17.014
Structure of Plankton Communities in Muli Mining Area and Their Environmental Impact Factors
YUE Ge-cheng, LIU Yan-fang, LUO Xiao
(School of Civil Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050037)
Abstract [Objective]To understand the structural characteristics of the plankton community and its key environmental impact factors in the rivers of Muli mining area, and to provide data support and reference basis for the management and protection of water resources in the mining area. [Method]Collection and analysis of water and plankton in the rivers (Duosuo and Mori) that surround the opencast mine in the town of Muli.[Result]6 Phylum (21 species) of phytoplankton and 2 Phylum (15 species) of zooplankton were collected in the Dosuo River and 6 Phylum (19 species) of phytoplankton and 2 Phylum (9 species) of zooplankton were collected in the Mori River.In both rivers diatoms, green algae and protozoa were the dominant species, and the density and biomass of plankton were quantitatively higher upstream and lower downstream.The Shannon-Wiener, Margalef and Pielou indices for phytoplankton and zooplankton in Duosuo River are 1.64 and 0.58, 0.86 and 0.33, 0.69 and 0.42, respectively;the Shannon-Wiener, Margalef and Pielou indices for phytoplankton and zooplankton in Mori River are 1.86 and 0.21, 0.87 and 0.24, 0.79 and 0.36. Water temperature, pH, and nitrogen nutrients were identified as the main environmental factors affecting the structure of the planktonic communities in the Dosso and Mojito Rivers by redundancy analysis (RDA) and correlation analysis. [Conclusion]The ecological protection of water in the Muli mining area should focus on nutrient pollution and strengthen the control of non-point source pollution caused by overgrazing.
Key words Aquatic Ecology;Plankton;Community structure;Environmental factors;Redundancy analysis
作者简介 岳哿丞(1998—),男,天津人,硕士研究生,研究方向:水污染控制。
通信作者,副教授,博士,从事水污染控制研究。
收稿日期 2023-08-31;修回日期 2023-10-15
浮游生物是一类个体微小、能够在水系统中自由漂浮的生物,主要包括浮游植物和浮游动物两个大类[1]。作为水生态系统中初级生产者的浮游植物,其群落组成与分布对水体环境的变化具有一定的响应[2];浮游动物作为中间营养级,既是浮游植物的摄食者[3],又是水体中高等生物的饵料[4],对水体中各因子的变化反应敏感[5]。有研究表明浮游生物群落结构的变化往往与其所处环境的变化相对应,其群落结构与所处环境之间具有很强的相关性。通过综合多种水生物指标可以衡量浮游生物群落结构是否稳定,一定程度上可以反映流域的生态状况和水体的营养状况[6-7],表征水体质量与生物多样性的有效生态学信号[8-9]。因此,研究浮游生物群落结构与水体中各环境因子之间的相互关系,对了解水体生态结构具有一定的指导意义。
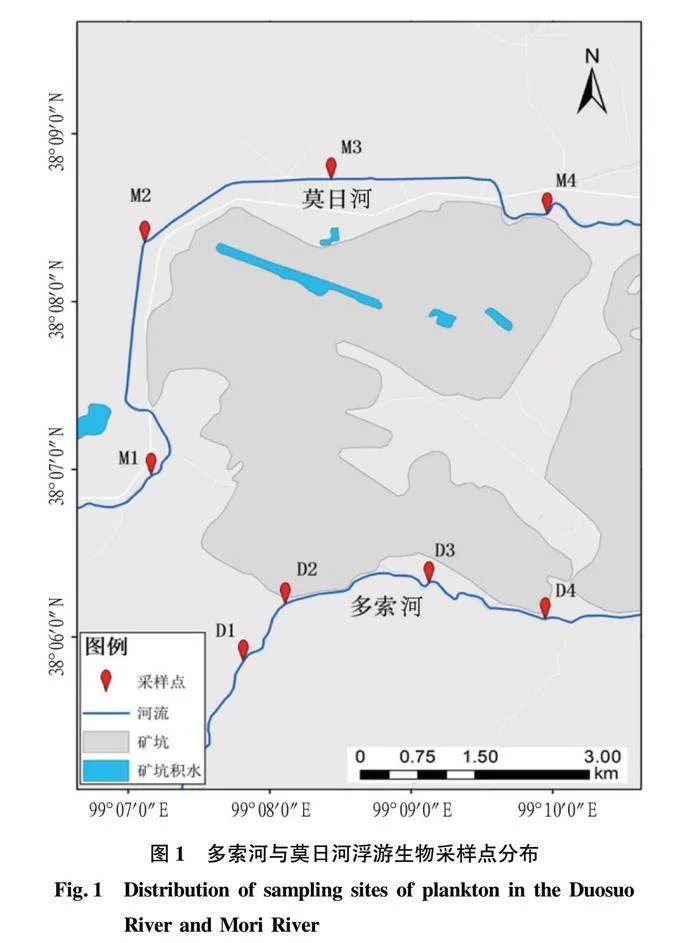
木里矿区位于青海省海西蒙古藏族自治州天峻县,青藏高原东北部,平均海拔3 800~4 200 m。气候为典型的高原大陆性气候,多年平均气温-3.5 ℃,矿区地处黄河一级支流大通河源头湿地生态区[10],是生态安全保障的重要组成部分[11],由于常年过度开采导致当地生态环境受到严重破坏,为恢复当地生态环境,国家大力推进矿区生态修复治理,目前当地生态环境已明显好转。选取木里矿区大通河2条典型支流多索河和莫日河进行水生态调查。由于2条河流环绕矿坑且为典型的高寒高海拔河流,水体自净能力差,水生生物多样性小,生态环境脆弱敏感,其水生态状况对矿区生态环境的变化具有一定的响应。通过分析环境因子指标,浮游生物密度、生物量、生物多样性指标,对2条河流进行深入的水生态学研究,识别影响河流水生态健康的主要因素,为木里矿区水体环境保护提供参考。
通过分析2条河流水质、浮游生物的群落结构特征及空间上的变化,并通过Pearson相关分析与冗余分析(RDA)探究环境因子和浮游生物之间的内在关系,确定影响浮游生物群落结构的主要环境因子[12],为矿区水资源管理与保护提供数据支撑与理论依据。
1 材料与方法
1.1 样点设置
根据《水环境监测规范》[13]、《全国淡水生物物种资源调查技术规定(试行)》[14]中关于地表河流浮游生物定量采样相关样点布置标准以及莫日河、多索河的地形、水文等特点,在2条河流中各设置4个采样点,共设置8个采样点(图1),于2022年7、8、9月分别进行了3次浮游生物样品采集。
1.2 样品采集与处理
浮游生物样品采集分为定性样品采集和定量样品采集。浮游植物定性样品用25号浮游生物网在距水面0.5 m处按“∞”字缓慢拖曳3~5 min[15]。采集后的样品置于采样瓶中加入5%甲醛进行现场固定。定量样品于河流表层采集,采集后的1 L水样用鲁格溶液进行固定后带回实验室静置48 h,使用虹吸管缓慢吸取上层清液浓缩定容至30 mL,在光学显微镜下进行物种鉴定与计数。浮游植物鉴定参考《中国淡水藻类:系统、分类及生态》[16]和《中国淡水藻志》[17]。浮游动物定性样品采用13号浮游生物网距水面0.5 m处按“∞”字缓慢拖曳3~5 min,采集后样品置于采样瓶中加入5%甲醛进行现场固定。定量样品于距水面0.5 m处采集,经25浮游生物网过滤浓缩后加入5%甲醛溶液进行现场固定,静置24 h后吸取上清液浓缩定容至30 mL,在光学显微镜下进行物种鉴定与计数。浮游动物鉴定参考《中国淡水轮虫志》[18]、浮游动物计数以及密度和生物量的计算方法参照《淡水浮游生物研究方法》[19]。
采集浮游生物的同时,进行部分水质理化指标的现场测定。水温(WT)、溶解氧(DO)、pH使用多参数水质分析仪(Sanxin,SX751)测定。总氮(TN)、总磷(TP)、氨氮(NH3-N)、硝酸盐氮(NO3-N)、亚硝酸盐氮(NO2-N)、高锰酸盐指数(CODMn)、叶绿素a(Chl-a),采集水样带回实验室检测。
1.3 数据处理与分析
应用以下公式计算与评价河流浮游生物优势度(Y)[20]与生物多样性指数[21](Shannon-Wiener 多样性指数(H′)、Pielou 均匀度指数(J)、Margalef 丰富度指数(d)。
Y=niNfi(1)
H′=-Si=1Pilog2Pi(2)
J=H′lnS(3)
d=(S-1)/lnN(4)
式中:ni为第i种在各采样点的总个体数;N 为各采样点中浮游动物的总个体数;fi为第i种在各采样点出现的频率;
Pi为第i种的个体数与总个体数的比值,即Pi=ni/N;S为样品中浮游生物种类数。
1.4 统计分析
采样地图由Arc GIS10.5软件绘制;浮游生物群落结构与环境因子间的冗余关系(RDA)采用Canoco 5软件[21-22];其他图表使用Excel 2019、Origin pro2021绘制。
2 结果与讨论
2.1 水质理化指标
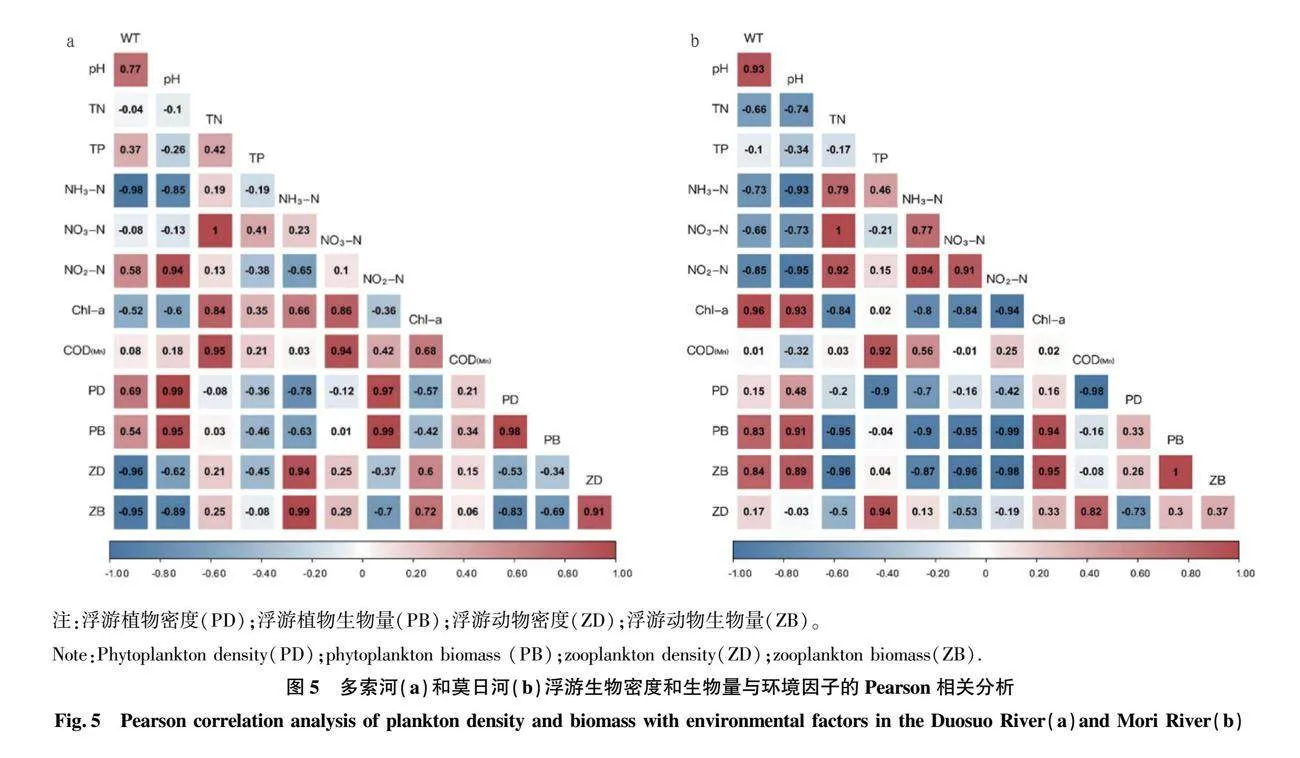
多索河与莫日河水温变化范围分别为5.3~7.1 ℃与4.3~9.7 ℃,2条河流具有典型高原大陆性气候,气温较低;DO浓度变化范围分别为8.30~8.48 mg/L与8.41~8.47 mg/L,pH变化范围分别为8.5~8.6与8.5~8.7,水体整体呈弱碱性;总氮浓度变化范围分别为0.58~3.72 mg/L与0.87~8.49 mg/L,硝酸盐氮浓度变化范围分别为0.35~3.43 mg/L与0.86~8.20 mg/L,亚硝酸盐氮浓度变化范围分别为0.002~0.004 mg/L与0.005~0.038 mg/L;氨氮浓度变化范围分别为0.08~0.30 mg/L与0.13~0.41 mg/L,2条河流均表现出沿流向方向,即D1→D4、M1→M2方向氮营养物质浓度不同程度增加且硝酸盐氮占总氮含量的90%以上,其主要原因一方面为2条河流流经牧区“散养式”放牧产生的粪污,通过地表径流汇入河道导致高硝酸盐浓度[23];另一方面,由于2条河流水温低,河流中硝酸盐氮的降解主要依赖于反硝化细菌将硝酸盐氮转化为氮气,而反硝化细菌作为厌氧菌对水温与氧含量有着极为严格的要求,低水温导致反硝化细菌几乎无法存活并且少量氧就能导致反硝化速率大幅度下降从而表现出高硝酸盐氮浓度,这与Liu等[24]调查发现高原河流状态表现一致。总磷浓度变化范围分别为0.009~0.078 mg/L与0.010~0.063 mg/L;高锰酸盐指数浓度变化范围分别为2.50~3.60 mg/L与1.70~3.90 mg/L;叶绿素a浓度2条河流变化范围均为0~0.90 μg/L。
2.2 浮游生物种类组成
2.2.1 浮游植物群落组成。
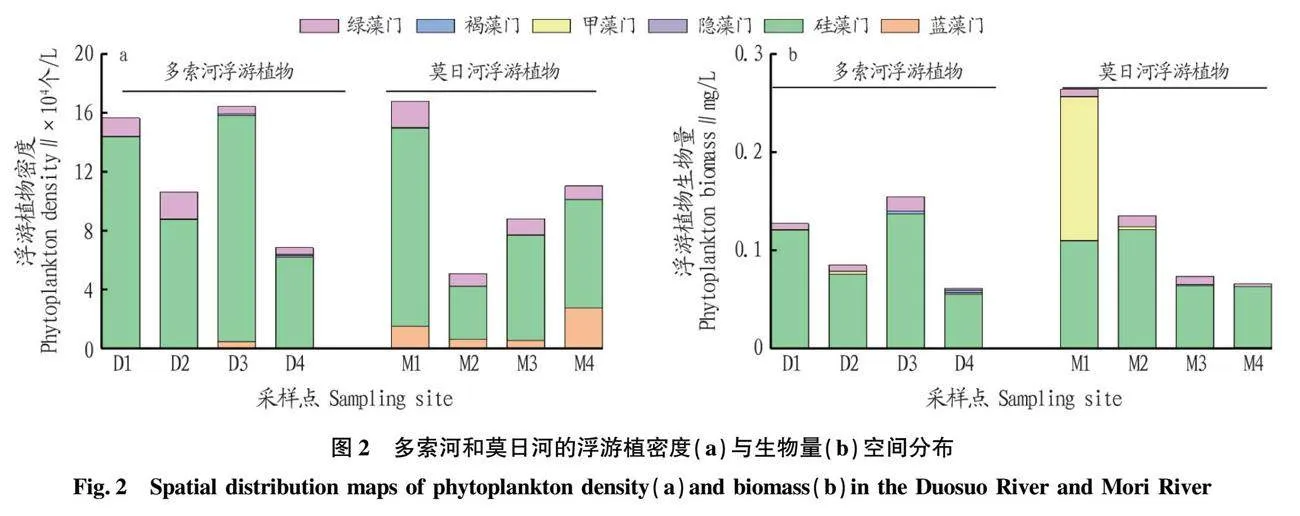
如图2a所示,多索河共鉴定出浮游植物6门21种,隶属于硅藻门、绿藻门、裸藻门、甲藻门、蓝藻门和隐藻门。其中硅藻门在种类组成上占绝对优势,为9种,占比42.86%,其余依次为绿藻门(5种)、裸藻门(3种)、甲藻门(2种)、蓝藻门(1种)、隐藻门(1种),分别占比23.81%、14.29%、9.52%、4.76%、4.76%。莫日河共鉴定出浮游植物6门19种,隶属于硅藻门、绿藻门、裸藻门、甲藻门、蓝藻门和隐藻门。其中硅藻门在种类组成上同多索河占绝对优势,为9种,占比47.36%,其余依次为绿藻门(3种)、裸藻门(2种)、甲藻门(2种)、蓝藻门(2种)、隐藻门(1种),分别占比15.79%、10.53%、10.53%、10.53%、5.26%。其中2条河流共划分出浮游植物优势种3门11种(表1),硅藻门、绿藻门为主要优势门类(Y≥0.02)。
2.2.2 浮游动物群落组成。
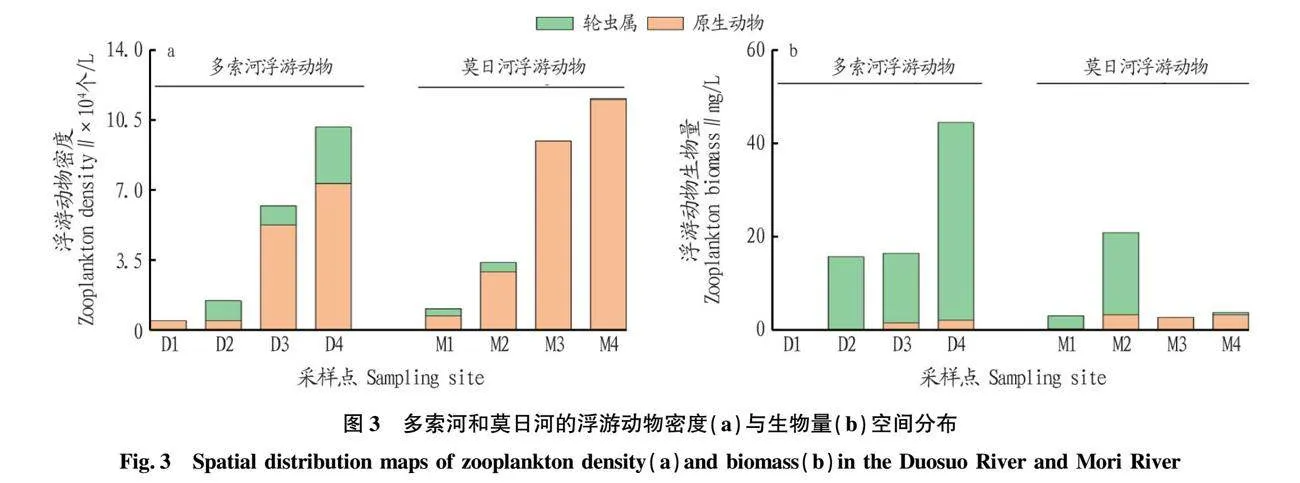
如图2a所示,多索河共检出浮游动物15种,分属2门2纲。其中以原生动物种类数最多,为11种,占总种类数的73.33%;轮虫为4种,占总种类数的26.67%;莫日河共检出包括轮虫类和原生动物等在内的浮游动物9种,其中原生动物为7种,占比77.78%;轮虫为2种,占比为22.22%;而大型浮游动物枝角类和桡足类在以上各采样点中均未检出。浮游动物优势种包括轮虫属与小型原生动物(表1),其中砂壳虫为2条河流中主要优势种(Y≥0.02)。
2.3 浮游生物群落空间变化
2.3.1 浮游植物密度及生物量空间变化。
如图2所示,多索河浮游植物密度变化范围为6.85×104~16.45×104 个/L,平均密度为12.40×104 个/L。浮游植物密度在D3点出现最高值,为16.45×104 个/L;在D4点出现最低值,仅6.85×104 个/L。整体上,多索河浮游植物密度呈现为上游高、下游低的特点;多索河各点位浮游植物生物量变化范围为0.061~0.154 mg/L,均值为0.107 mg/L。各采样点中,多索河浮游植物生物量在D3点出现最高值,而在D4点出现最低值,其变化趋势与密度高度一致。
莫日河各点位浮游植物密度变化范围为5.07×104~16.81×104 个/L,均值为10.46×104 个/L。各采样点中,莫日河浮游植物密度最高值出现在M1,而至M2点浮游植物密度大幅下降,并出现最低值(5.07×104个/L),之后沿河流流向浮游植物密度呈现上升趋势。莫日河各点位浮游植物生物量变化范围为0.066~0.263 mg/L,均值为0.134 mg/L。与多索河相比,莫日河浮游植物生物量偏高,主要是莫日河浮游植物中以细胞个体相对较大的甲藻门的数量占据优势所致。
2.3.2 浮游动物密度及生物量空间变化。
如图3a所示,多索河各点位浮游动物密度的变化范围为0.50×104~10.15×104 个/L,平均值为4.59×104 个/L,浮游动物的密度处于较低水平,主要与个体较小的原生动物数量占据优势有关。多索河各点位浮游动物的生物量变化范围为0.16~44.43 mg/L,均值为19.18 mg/L。各采样点中,多索河浮游动物的密度与生物量由上游至下游表现为上升趋势。
莫日河浮游动物的密度变化范围为0.11×104~1.16×104 个/L,平均密度为0.64×104 个/L,其中莫日河浮游动物密度的变化趋势与多索河一致。莫日河浮游动物生物量变化范围为0.30~20.80 mg/L,均值为7.58 mg/L。其中浮游动物生物量在中上游出现最高值,达到20.80 mg/L,而在中下游出现最低值,仅为0.30 mg/L,这与个体较大的晶囊轮虫在中上游数量较多有关。
2.4 浮游生物多样性空间变化
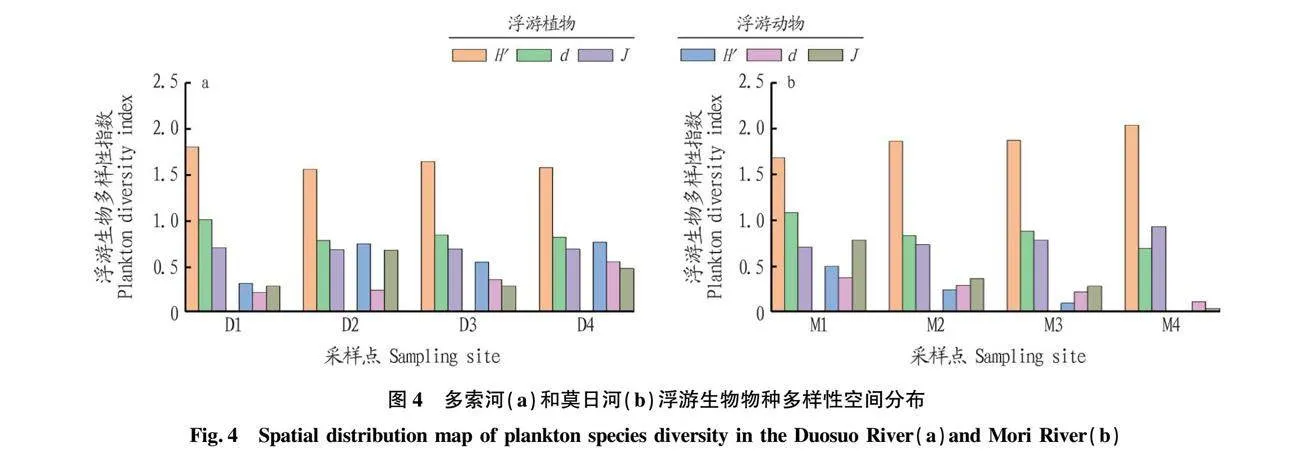
如图4a所示,多索河中浮游植物Shannon-Wiener多样性指数(H′)均值为1.64±0.10,变化范围为1.55~1.80;Margalef丰富度指数(d)均值为0.86±0.09,变化范围为0.78~1.00;Pielou均匀度指数(J)均值为0.69±0.01,变化范围为0.64~0.70;H′、D、J最大值均出现在上游,且沿流向变化较为均匀。浮游动物Shannon-Wiener多样性指数(H′)均值为0.58±0.18,变化范围为0.31~0.76;Margalef丰富度指数(d)均值为0.33±0.13,变化范围为0.21~0.54;Pielou均匀度指数(J)均值为0.42±0.16,变化范围为0.28~0.67;H′、d值均沿流向方向呈现上升趋势,表现为下游>中游>上游。
如图4b所示,莫日河中浮游植物的Shannon-Wiener多样性指数(H′)均值为1.86±0.12,变化范围为1.68~2.04;Margalef丰富度指数(d)均值为0.87±0.14,变化范围为0.69~1.08;Pielou均匀度指数(J)均值为0.79±0.09,变化范围为0.70~0.92;H′、J值均沿流向方向呈现上升趋势,表现为下游>中游>上游;d值则沿流向方向下降,表现上游>中游>下游。浮游动物的Shannon-Wiener多样性指数(H′)均值为0.21±0.18,变化范围为0.01~0.50;Margalef丰富度指数(d)均值为0.24±0.10,变化范围为0.11~0.37;Pielou均匀度指数(J)均值为0.36±0.27,变化范围为0.03~0.78;H′、d、J最大值均出现在上游,且沿流向方向呈现下降趋势,表现为上游>中游>下游。
2.5 浮游生物与环境因子相关性分析
2.5.1 浮游植物与环境因子相关性分析。
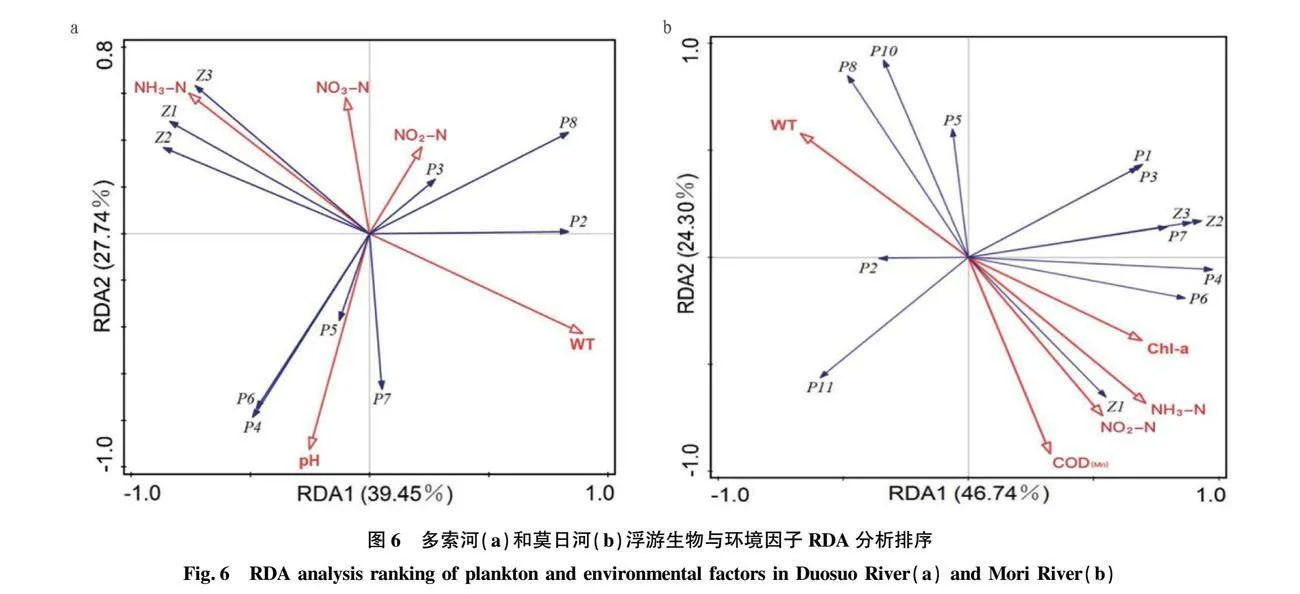
如图5(Pearson相关性分析)所示,多索河中浮游植物生物量和密度与pH、亚硝酸盐氮呈极显著正相关(P<0.01)。莫日河中氨氮和亚硝酸盐氮与浮游植物的生物量呈显著负相关(P<0.05);高锰酸盐指数与浮游植物的密度呈极显著负相关(P<0.01)。如图6(冗余分析)所示,环境因子在第1、2轴对多索河与莫日河中浮游生物群落密度的累计贡献率分别达到67.19%和71.04%,表明环境因子只是影响浮游生物群落密度的多个因素之一。多索河中水温、pH、氨氮、硝酸盐氮、亚硝酸盐氮为影响浮游生物生长发育繁殖的主要环境因子。其中水温与蛾眉藻呈极显著正相关(P<0.01);pH与针杆藻、舟形藻、桥弯藻、异极藻呈极显著正相关(P<0.01);亚硝酸盐氮与蛾眉藻、脆杆藻、河壳藻呈极显著正相关(P<0.01)。莫日河中高锰酸盐指数、氨氮、亚硝酸盐氮、水温、叶绿素a为影响浮游生物生长发育繁殖的主要环境因子,氨氮、亚硝酸盐氮、高锰酸盐指数与舟形藻、河壳藻、绿球藻呈极显著负相关(P<0.01);水温与舟形藻、河壳藻、绿球藻呈显著正相关(P<0.05)。
2条河流中硅藻门为浮游植物中最大优势种且为环境因子的积极响应门类,其主要原因为2条河流处于高寒、高海拔地区,水温常年较低,水温通过影响浮游植物光合作用、呼吸作用的酶活性与营养盐的吸收速率,影响浮游植物的发育与增殖[25],而硅藻门相比于蓝藻门、绿藻门具有较强的低温适应能力[26]。此外该次调查河流中氮营养物质主要以硝酸盐氮的形式存在,Goldman[27-28]研究表明,硅藻适合生存在硝酸盐氮浓度较高的水环境中。其次Vis[29]指出硅藻细胞外覆硅质细胞壁的主要成分为二氧化硅,高海拔地区湖泊河流硅酸盐含量往往较高[30],硅酸盐是硅藻硅质化过程的重要物质来源[31],所以导致硅藻门具有高寒高海拔地区更强的生
存能力,在上述各环境因子作用下硅藻门成为2条河流中的最
大优势种。此外浮游植物群落结构的变化和物种多样性指
标能有效地反应水生态环境的改变[32]。当浮游植物以硅藻为优势种逐渐演替为蓝藻为优势种时,往往代表着水体受到污染[33]。莫日河中硝酸盐氮浓度相对于多索河较高,其蓝藻比例亦相对于多索河较高。2条河流除硝酸盐氮浓度外其他环境因子差异不大,推测虽然水温为浮游植物密度与生物量的主要影响因素,但是硝酸盐氮浓度对浮游植物密度与生物量也会产生一定的影响,这与Larios-Muiz[34]研究中所讨论的硝酸盐氮浓度能够影响浮游植物群体结构特征的结果表现一致。
2.5.2 浮游动物与环境因子相关性分析。
如图5(Pearson相关性分析)所示,多索河中浮游动物生物量和密度与水温呈极显著负相关(P<0.01),与氨氮呈极显著正相关(P<0.01)。莫日河中氮营养物质与浮游动物的密度呈极显著正相关(P<0.01)。并且生物量和密度与一般湖泊、水库相比较少,小型浮游动物占绝对优势,这与我国西北地区浮游动物群落结构相似。如图6(冗余分析)所示,多索河中水温与蛾眉藻呈极显著正相关(P<0.01),与砂壳虫、水轮虫、晶囊轮虫呈极显著负相关(P<0.01);氨氮与砂壳虫、水轮虫、晶囊轮虫呈极显著正相关(P<0.01)。莫日河中氨氮、亚硝酸盐氮、高锰酸盐指数与砂壳虫呈极显著正相关(P<0.01),叶绿素a与水轮虫、晶囊轮虫呈显著正相关(P<0.05)。
调查结果表明,原生动物和轮虫与其他大型浮游动物相比,低温适应能力较强,其主要原因为较低的水温一方面使大型浮游动物降低自身的摄食速率[35],另一方面低温导致浮游植物密度与生物量较低[36],进而导致大型浮游动物缺乏食物补给。具体表现为无法适应高寒高海拔的水体环境[37]。而小型浮游动物,如砂壳虫、轮虫等,由于低水平的摄食量与摄食速率,导致其具有更强的低水温生存能力,故上述小型浮游动物在2条河流中占绝对优势。此外2条河流流速较快,河流流速能够影响浮游植物的繁殖、迁徙、分布,使水体产生紊动效应从而降低浮游动物的捕食成功率,间接影响浮游动物的群落结构[38]。
此外,2条河流中浮游动物生物量与密度均受以氨氮为代表的氮营养物质影响,其主要原因为一方面小型浮游动物对氨氮等氮素可以直接吸收与利用,另一方面为小型浮游动物对磷素的响应速率与氮素相比较慢[39-40]。调查表明,砂壳虫具有较强的低水温与氮素适应能力,并且2条河流中砂壳虫均与硅藻门呈负相关(P<0.05),推测其原因为砂壳虫对硅藻门类具有摄食作用[41]。相关分析结果表明,作为浮游植物生物量代表的叶绿素a与浮游动物生物量呈正相关(P<0.05),亦可证明砂壳虫对硅藻门具有摄食作用。
3 结论
(1)调查期间多索河与莫日河分别鉴定出浮游植物6门21种与6门19种,均以硅藻门、绿藻门为主,其中硅藻门的蛾眉藻、脆杆藻、桥弯藻、绿藻门的小球藻均为2条河流中的优势种。
(2)调查期间多索河与莫日河分别鉴定出浮游动物2门15种与2门9种。多索河中砂壳虫、晶囊轮虫为主要优势种,莫日河中砂壳虫、水轮虫、晶囊轮虫为主要优势种。
(3)多索河与莫日河中浮游植物呈现上游多、下游少;浮游动物呈现下游多、上游少的特点。营养盐空间分布差异为主要影响因素。
(4)RDA分析与相关分析结果表明,水温、pH、氮营养物质是影响多索河与莫日河中浮游生物群落结构的主要环境因子,水生态保护与修复应着重加强过度放牧导致的营养盐面源污染。
参考文献
[1] 郭杰,王珂,段辛斌,等.长江荆江段浮游生物群落结构特征及其与环境因子的关系[J].长江流域资源与环境,2020,29(9):1954-1964.
[2] 钱玺亦,李金彪,敖文,等.呼伦湖浮游植物群落季节动态及其与环境因子的关系[J].湖泊科学,2022,34(6):1814-1827.
[3] 秦云霞,周雯,乔永民,等.新丰江水库浮游动物群落结构特征[J].水生态学杂志,2023,44(4):35-43.
[4] LOMARTIRE S,MARQUES J C,GONALVES A M,et al.The key role of zooplankton in ecosystem services:A perspective of interaction between zooplankton and fish recruitment[J].Ecological indicators,2021,129:1-8.
[5] 陶敏,王永明,谢碧文,等.沱江浮游生物群落时空分布及相关环境因子分析[J].水生生物学报,2016,40(2):301-312.
[6] WAN X H,YANG T,ZHANG Q,et al.Joint effects of habitat indexes and physic-chemical factors for freshwater basin of semi-arid area on plankton integrity-A case study of the Wei River Basin,China[J].Ecological indicators,2021,120:1-11.
[7] 郝雅宾,贺文芳,练青平,等.金华地区浮游植物群落结构特征及其对水质的指示作用[J].水生态学杂志,2021,42(6):70-76.
[8] RANGEL L M,SILVA L H S,ROSA P,et al.Phytoplankton biomass is mainly controlled by hydrology and phosphorus concentrations in tropical hydroelectric reservoirs[J].Hydrobiologia,2012,693(1):13-28.
[9] SMUCKER N J,BECKER M,DETENBECK N E,et al.Using algal metrics and biomass to evaluate multiple ways of defining concentration-based nutrient criteria in streams and their ecological relevance[J].Ecological indicators,2013,32:51-61.
[10] 李聪聪,王佟,王辉,等.木里煤田聚乎更矿区生态环境修复监测技术与方法[J].煤炭学报,2021,46(5):1451-1462.
[11] 许泰,鄂崇毅,谢丽倩,等.高原高寒露天矿区氟化物与硫化物特征及污染评价[J].矿业研究与开发,2022,42(1):139-144.
[12] 杨洪允,周雯,乔永民,等.洱海浮游植物群落结构及其与环境因子分析[J].环境科学与技术,2021,44(7):123-132.
[13] 中华人民共和国水利部.水环境监测规范:SL 219—2013[S].北京:中国水利水电出版社,2013.
[14] 环境保护部生态司.全国淡水生物物种资源调查技术规定(试行)[A].北京:环境保护部,2010.
[15] 夏润林,杨竹青,王自蕊,等.南昌青山湖浮游植物种群特征分析[J].江西农业大学学报,2011,33(5):1023-1029.
[16] 胡鸿钧,魏印心.中国淡水藻类:系统、分类及生态[M].北京:科学出版社,2006.
[17] 中国科学院中国孢子植物志编辑委员会.中国淡水藻志[M].北京:科学出版社,2007.
[18] 王家楫.中国淡水轮虫志[M].北京:科学出版社,1961.
[19] 章宗涉,黄祥飞.淡水浮游生物研究方法[M].北京:科学出版社,1991.
[20] 赵会,张坤,彭水秀,等.军山湖、青山湖和瑶湖春夏季节浮游甲壳动物的群落结构及其与环境因子的关系[J].生态学杂志,2018,37(4):1197-1203.
[21] 白海锋,王怡睿,宋进喜,等.渭河浮游生物群落结构特征及其与环境因子的关系[J].生态环境学报,2022,31(1):117-130.
[22] 邱晓鹏,黄廷林,周石磊,等.强降雨对水源水库夏季蓝藻水华的影响[J].西安理工大学学报,2020,36(3):349-356.
[23] 邢剑伟,李小倩,周爱国,等.人类活动对木里冻土区水文环境影响的多元同位素示踪[J].地球科学,2024(5):1891-1906.
[24] LIU W J,JIANG H,GUO X,et al.Time-series monitoring of river hydrochemistry and multiple isotope signals in the Yarlung Tsangpo River reveals a hydrological domination of fluvial nitrate fluxes in the Tibetan Plateau[J].Water research,2022,225(11):98.
[25] 张鹏,刘洋,安瑞志,等.西藏拉萨河中下游原生动物优势种时空生态位[J].林业科学,2022,58(1):78-88.
[26] 刘海平,叶少文,杨雪峰,等.西藏尼洋河水生生物群落时空动态及与环境因子的关系:1.浮游植物[J].湖泊科学,2013,25(5):695-706.
[27] GOLDMAN J C.Potential role of large oceanic diatoms in new primary production[J].Deep sea research part I:Oceanographic research papers,1993,40(1):159-168.
[28] 李慧,刘妍,范亚文,等.三江平原湿地同江地区水域夏季浮游植物群落结构特征[J].植物学报,2014,49(4):440-449.
[29] VIS M L.Freshwater algae of North America:Ecology and classification[J].The journal of the torrey botanical society,2005,132(3):533-534.
[30] 黄杰,邓玥,李天翠,等.怒江真核浮游生物的海拔分布格局及其环境影响因素[J].长江科学院院报,2023(4):59-65.
[31] 黄汇豪,林琪,倪健,等.千岛湖建库以来浮游植物变化过程及其影响因素[J].环境科学学报,2023,43(2):474-483.
[32] 刘静,马克明,张育新,等.温榆河夏季浮游植物群落结构及其与环境因子的关系[J].水生态学杂志,2015,36(5):22-28.
[33] 朱旭宇,黄伟,曾江宁,等.氮磷比对冬季浮游植物群落结构的影响[J].应用与环境生物学报,2013,19(2):293-299.
[34] LARIOS-MUIZ M,GONZLEZ-SILVERA A,CASTRO R,et al.Variability of hydrographic factors,biomass and structure of the phytoplankton community at the entrance to the Gulf of California(spring 2013)[J].Continental shelf research,2022,235:1-46.
[35] ZHENG L P,CHEN B Z,LIU X,et al.Seasonal variations in the effect of microzooplankton grazing on phytoplankton in the East China Sea[J].Continental shelf research,2015,111:304-315.
[36] 张晟曼,何培民,刘炜,等.上海城市河流浮游动物季节变化及其与环境因子的关系[J].水生态学杂志,2022(5):42-48.
[37] LIN Q Q,XU L,HOU J Z,et al.Responses of trophic structure and zooplankton community to salinity and temperature in Tibetan lakes:Implication for the effect of climate warming[J].Water research,2017,124:618-629.
[38] 梁培瑜,王烜,马芳冰.水动力条件对水体富营养化的影响[J].湖泊科学,2013,25(4):455-462.
[39] GENG Y,LI M X,YU R H,et al.Response of planktonic diversity and stability to environmental drivers in a shallow eutrophic lake[J].Ecological indicators,2022,144:1-17.
[40] LV J,WU H J,CHEN M Q.Effects of nitrogen and phosphorus on phytoplankton composition and biomass in 15 subtropical,urban shallow lakes in Wuhan,China[J].Limnologica,2011,41(1):48-56.
[41] 徐翠莲,王有军,胡思敏,等.三亚湾近岸两种优势砂壳纤毛虫对硅藻的摄食初探[J].海洋环境科学,2019,38(6):833-839,855.
