冷内镜黏膜切除术对最大径<20mm结直肠侧向发育型肿瘤的临床疗效
2024-08-04何彤云陆会飞胡丕伟王新强邱雷

[摘要]目的比较冷内镜黏膜切除术(coldsnareendoscopicmucosalresection,CS-EMR)与常规内镜黏膜切除术(endoscopicmucosalresection,EMR)治疗最大径<20mm结直肠侧向发育型肿瘤(colorectallaterallyspreadingtumor,CLST)的临床疗效。方法选取2020年1月至2022年6月湖州市第一人民医院收治的行内镜下切除治疗CLST患者248例,根据随机数字表法将其分为EMR组和CS-EMR组,每组各124例。统计比较两组患者的一般资料、病灶特征、手术相关指标、并发症发生率。结果两组患者的病灶整块切除率、完全切除率及术后复发率比较差异均无统计学意义(P>0.05)。CS-EMR组患者的手术操作时间、住院时间均显著短于EMR组,钛夹数量、住院费用均显著少于EMR组,术中出血、迟发性出血及迟发性穿孔的发生率均显著低于EMR组(P<0.05)。结论在最大径<20mmCLST治疗中,CS-EMR既保留手术相关并发症少的优点,又具有与EMR相似的治疗效果,且减轻患者的费用负担,值得临床借鉴与推广。
[关键词]结直肠侧向发育型肿瘤;内镜黏膜切除术;冷内镜黏膜切除术;临床疗效
[中图分类号]R735.3[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.19.005
Clinicalefficacyofcoldsnareendoscopicmucosalresectionfor<20mmcolorectallaterallyspreadingtumor
HETongyun1,LUHuifei2,HUPiwei3,WANGXinqiang1,QIULei2
1.DepartmentofAnesthesiology,theFirstPeople’sHospitalofHuzhou,Huzhou313000,Zhejiang,China;2.DepartmentofGastroenterology,theFirstPeople’sHospitalofHuzhou,Huzhou313000,Zhejiang,China;3.DepartmentofPathology,theFirstPeople’sHospitalofHuzhou,Huzhou313000,Zhejiang,China
[Abstract]ObjectiveTocomparetheclinicalefficacyofcoldsnareendoscopicmucosalresection(CS-EMR)withconventionalendoscopicmucosalresection(EMR)inthetreatmentof<20mmcolorectallaterallyspreadingtumor(CLST).MethodsAtotalof248CLSTpatientsundergoingendoscopicresectiontreatedintheFirstPeople’sHospitalofHuzhoufromJanuary2020toJune2022wereselectedanddividedintoEMRgroupandCS-EMRgroupaccordingtorandomnumbertablemethod,with124casesineachgroup.Thegeneraldata,focalfeatures,surgicalindicatorsandcomplicationrateoftwogroupswerestatisticallycompared.ResultsTherewerenosignificantdifferencesinenblocresectionrate,completeresectionrateandpostoperativerecurrenceratebetweentwogroups(P>0.05).TheoperationtimeandhospitalstayinCS-EMRgroupweresignificantlyshorterthanthoseinEMRgroup,thenumberoftitaniumclipsandhospitalizationcostsweresignificantlylowerthanthoseinEMRgroup,andtheincidenceofintraoperativebleeding,delayedbleedinganddelayedperforationweresignificantlylowerthanthoseinEMRgroup(P<0.05).ConclusionIntreatmentofCLSTwithamaximumdiameterof<20mm,CS-EMRnotonlyretainstheadvantagesoffewersurgery-relatedcomplications,butalsohassimilartherapeuticeffectasEMR,andreducesthecostburdenofpatients,whichisworthyofclinicalreferenceandpromotion.
[Keywords]Colorectallaterallyspreadingtumor;Endoscopicmucosalresection;Coldsnareendoscopicmucosalresection;Clinicaleffect
结直肠癌是常见恶性肿瘤之一,其发病率居中国恶性肿瘤第2位,死亡率则居中国恶性肿瘤第5位[1-2]。结直肠癌的转归与分期密切相关,进展期结直肠癌5年生存率约为70%,一旦发生远处转移,5年生存率仅为12%,而早期结直肠癌5年生存率高达90%[3-4]。结直肠侧向发育型肿瘤(colorectallaterallyspreadingtumor,CLST)是一种直径≥10mm沿肠壁周围侧向生长的扁平型肿瘤,是公认的结直肠癌的癌前病变[5]。多项研究证实与结直肠癌最为常见的癌前病变结直肠腺瘤性息肉相比,CLST在3年内具有更高的概率进展为结直肠癌[6-7]。近年来,随着临床内镜医生对染色内镜、放大内镜操作的熟练掌握及对CLST认知水平的加深,CLST的内镜检出率也在逐年升高[8]。
对大部分癌前病变及早期结直肠癌患者而言,内镜下早诊早治可有效改善临床结局,从而达到降低结直肠癌发病率和死亡率的目的[9]。CLST的治疗方式可分为内镜下切除和外科手术切除,内镜下切除因其创伤小、恢复快、住院时间短、住院费用低等优势已成为CLST治疗的首选方式,CLST内镜下切除主要包括内镜黏膜切除术(endoscopicmucosalresection,EMR)、内镜黏膜下剥离术(endoscopicsubmucosaldissection,ESD)[10]。临床研究显示结肠镜筛查明确诊断的CLST中,最大径<20mm的CLST占检出总数的50%以上[11-12]。EMR和ESD均可有效治疗最大径<20mm的CLST,但ESD的手术操作难度较大,手术时间长,出血及穿孔风险高[13]。而EMR因其技术成熟、操作简便、手术相关并发症发生率低等优势已在大部分医院普遍开展[14]。冷内镜黏膜切除术(coldsnareendoscopicmucosalresection,CS-EMR)是对标准圈套技术的改进,现已在结直肠息肉切除中广泛应用,但关于CS-EMR治疗CLST的相关研究甚少。本研究分析CS-EMR与传统EMR治疗最大径<20mmCLST的安全性及有效性,现将结果报道如下。
1资料与方法
1.1一般资料
前瞻性纳入2020年1月至2022年6月湖州市第一人民医院收治的行内镜下切除治疗CLST患者248例,根据随机数字表法将其分为EMR组和CS-EMR组,每组各124例。纳入标准:①经肠镜检查确诊为CLST,且最大径<20mm;②年龄18~75岁,男女不限;③临床资料完整;④自愿签订知情同意书者。排除标准:①存在凝血功能障碍者;②近1周内使用过抗凝药物或抗血小板药物者;③合并炎症性肠病者;④合并重要脏器严重病变者。本研究经湖州市第一人民医院医学伦理委员会批准。
1.2手术方法
1.2.1术前肠道准备所有患者于手术前日20:00饮用1000ml聚乙二醇(250ml/15min);术前4~6h服用2000ml聚乙二醇(250ml/15min)。
1.2.2手术器械OlympusCF-H290I电子肠镜(日本奥林巴斯公司),一次性体内注射治疗针(型号:M00518301,美国波士顿公司),一次性圈套器(型号:MTNPFS-E-24/23,南京微创),高频电切装置(型号:VIO200D,德国爱尔博公司),和谐夹(型号:ROCC-D-26-195,南京微创)。
1.2.3手术过程所有患者手术均由同一医生完成,手术全程使用丙泊酚静脉麻醉,术中密切监测生命指征。内镜下常规探查并观察CLST位置、大小及形态,明确病变边界后于病灶周边黏膜下多点注射亚甲基美兰生理盐水,使病灶充分隆起,侧缘清晰可见。完成上述操作后,EMR组患者经活检孔道送入圈套器,将病灶连同边缘外2mm的正常黏膜逐渐收紧上提使其与肠壁保持一定距离,将凝切功率设置为30W进行电凝电切将其完整切除;CS-EMR组患者经活检孔道送入圈套器,将病灶连同边缘外2mm的正常黏膜逐渐收紧后直接套取病灶切除。两组患者切除后均用生理盐水清洗创面,采用钛夹预防性夹闭创面,切除病灶送病理诊断。
1.3观察指标
①患者一般资料:包括性别、年龄、肠镜检查适应证、波士顿评分、合并症等。②病灶一般资料:病灶最大径、病灶位置(右半结肠、左半结肠及直肠)、病灶形态(结节混合型、颗粒均一型、扁平隆起型及假凹陷型)[15]、病理类型(腺瘤、锯齿状病变、腺癌)[16]、组织学类型(低级别上皮内瘤变、高级别上皮内瘤变、浸润癌)[17]。③手术相关指标:操作时间(从注射针插入活检孔道至创面封闭结束)、钛夹数量、住院时间、住院费用、整块切除率、完全切除率、术后复发率(术后3、6、12个月进行结肠镜检查,如切除部位瘢痕处及邻近2mm内发现可疑病灶均留取标本行组织学评估,如结果证实为肿瘤性病变则考虑复发)。④手术相关并发症:术中出血、迟发性出血、术中穿孔及迟发性穿孔。
1.4统计学方法
采用SPSS21.0软件进行统计学分析。计量资料均符合正态分布以均数±标准差(![]() )表示,组间比较采用t检验;计数资料以例数(百分率)[n(%)]表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
)表示,组间比较采用t检验;计数资料以例数(百分率)[n(%)]表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2结果
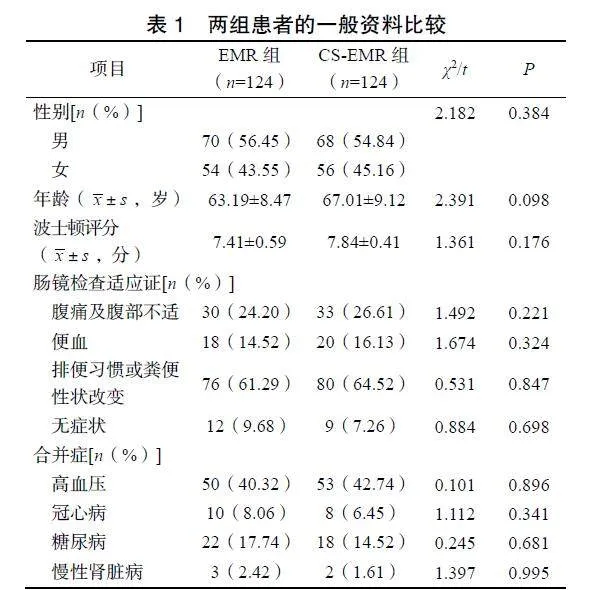
2.1两组患者的一般资料比较
两组患者的年龄、性别、波士顿评分、肠镜检查适应证及合并症情况比较差异均无统计学意义(P>0.05),见表1。
2.2两组患者的病灶一般资料比较
两组患者的病灶最大径、位置、形态、病理类型、组织学类型比较差异均无统计学意义(P>0.05),见表2。
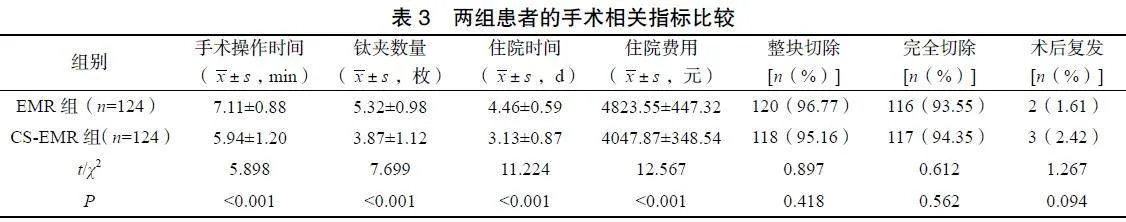
2.3两组患者的手术相关指标比较
CS-EMR组患者的手术操作时间、住院时间均显著短于EMR组,钛夹数量、住院费用均显著少于EMR组(P<0.05);两组患者的病灶整块切除率、完全切除率及术后复发率比较差异均无统计学意义(P>0.05),见表3。
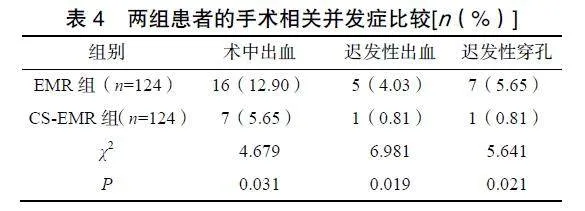
2.4两组患者的手术相关并发症比较
两组患者均未发生术中穿孔;EMR组患者的术中出血、迟发性出血及迟发性穿孔发生率均显著高于CS-EMR组(P<0.05),见表4。
3讨论
随着内镜技术的进步,CLST的检出率越来越高,中国CLST的检出率约为0.8%,国外CLST的检出率约为0.93%[18]。与相似大小的腺瘤性息肉相比,CLST浸润性癌的发生率较低,且较少侵犯血管,内镜下切除预后较好[19]。本研究中两组患者的性别、年龄、肠镜检查适应证、波士顿评分及合并症等一般资料及病灶一般资料均无显著差异,提示研究具有可比性。同时,两组患者CLST的病灶位置分布、病灶形态、病理类型及组织学类型构成比均与既往报道大致相仿[20-21]。
相较于结直肠肿瘤ESD手术,EMR技术成熟,操作难度低,并发症发生率低,便于普及。欧洲胃肠内镜学会指南推荐EMR可用于治疗>10mm的无蒂或扁平结直肠病变,但当病变大小超过20mm时,EMR的整块切除率明显降低,因此EMR通常适用于直径<20mm的病变[21-23]。近年来,CS-EMR作为一项有价值的改进技术获得临床广泛关注,现已有多项临床研究证实CS-EMR在直径≥10mm甚至≥20mm结直肠腺瘤性息肉切除中可确保切缘水平并有效切除肿瘤,其治疗效果与传统EMR相当[24-25]。
本研究结果显示,对最大径<20mm的CLST,CS-EMR的整块切除率、完整切除率及术后复发率均与EMR相仿,提示两种方法的治疗效果相当。这主要由于两种术式均采用黏膜下注射使病灶及其周边隆起,从而达到病灶及其周边正常黏膜被准确切除的效果。同时,本研究发现与EMR相比,CS-EMR在保证整块切除率、完整切除率及术后复发率的基础上,还可显著减少钛夹使用数量,缩短操作时间和住院时间,降低住院费用。这与CS-EMR无需通电凝切有关,使其省去高频电设备及一次性电极片安装设置和电凝电切操作所需的时间,节省一次性电极片及黏膜下注射针的耗材损耗,缩小手术创面从而减少创面封闭所需的钛夹数量,最终降低住院费用及缩短住院时间。
出血和穿孔是内镜下结直肠肿瘤手术的常见并发症[26]。传统EMR需进行高频电流切除操作,期间势必对局部产生一定的热损伤,易引起出血、穿孔等情况,而CS-EMR无需通电凝切,直接使用圈套器将病灶收紧切除,避免电烧灼对局部黏膜及血管造成的损伤,有效缩小创面,并可及时清晰地观察创面损伤情况,从而降低出血与穿孔的风险。本研究中,两组患者在操作过程中均未发生穿孔,CS-EMR组患者术中出血、迟发性出血及穿孔的发生率均显著低于EMR组,而较低的出血和穿孔发生率也有助于缩短住院时间及节省住院费用。
综上所述,CS-EMR和EMR对最大径<20mmCLST的治疗效果差异不大,但相较于EMR,CS-EMR治疗具有操作时间短、并发症少、住院时间短及住院费用少等优势。因此,CS-EMR有望成为最大径<20mmCLST患者的安全治疗选择。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] SUNGH,FERLAYJ,SIEGELRL,etal.Globalcancerstatistics2020:GLOBOCANestimatesofincidenceandmortalityworldwidefor36cancersin185countries[J].CACancerJClin,2021,71(3):209–249.
[2] ZHANGL,CAOF,ZHANGG,etal.TrendsinandpredictionsofcolorectalcancerincidenceandmortalityinChinafrom1990to2025[J].FrontOncol,2019,9:98.
[3] 中华医学会消化内镜学分会,中国抗癌协会肿瘤内镜学专业委员会.中国早期结直肠癌筛查及内镜诊治指南(2014年,北京)[J].胃肠病学,2015,20(6):345–365.
[4] DESANTISCE,LINCC,MARIOTTOAB,etal.Cancertreatmentandsurvivorshipstatistics,2014[J].CACancerJClin,2014,64(4):252–271.
[5] SEK,LAMBERTR,ALLENJI,etal.Nonpolypoidneoplasticlesionsofthecolorectalmucosa[J].GastrointestEndosc,2008,68(4Suppl):S3–S47.
[6] FEARONER,VOGELSTEINB.Ageneticmodelforcolorectaltumorigenesis[J].Cell,1990,61(5):759–767.
[7] OKAMOTOT,TANAKAS,HARUMAK,etal.Clinicopathologicevaluationoncolorectallaterallyspreadingtumor(LST)[J].NihonShokakibyoGakkaiZasshi,1996,93(2):83–89.
[8] 张菊嫦,王学青,李爱民,等.结直肠侧向发育型肿瘤的临床病理特征和治疗方法的发展趋势分析[J].中华消化杂志,2017,37(2):88–93.
[9] ZAUBERAG,WINAWERSJ,O'BRIENMJ,etal.Colonoscopicpolypectomyandlong-termpreventionofcolorectal-cancerdeaths[J]. NEnglJMed,2012,366(8):687–696.
[10] BAEJH,YANGDH,LEEJY,etal.Clinicaloutcomesofendoscopicsubmucosaldissectionforlargecolorectalneoplasms:Acomparisonofprotrudingandlaterallyspreadingtumors[J].SurgEndosc,2016,30(4):1619–1628.
[11] 郝钰洁.结直肠侧向发育型肿瘤的临床病理特征及内镜下治疗效果分析[D].大连:大连医科大学,2022.
[12] 李继昂.结直肠侧向发育型肿瘤的临床病理特征及内镜治疗疗效分析[D].兰州:兰州大学,2023.
[13] BURGESSNG,HOURIGANLF,ZANATISA,etal.Riskstratificationforcovertinvasivecanceramongpatientsreferredforcolonicendoscopicmucosalresection:Alargemulticentercohort[J].Gastroenterology,2017,153(3):732–742.
[14] 李继昂,冯洁,黄晓俊.结直肠侧向发育型肿瘤内镜下治疗的研究进展[J].中华消化内镜杂志,2023,40(7):566–570.
[15] ISHIGAKIT,KUDOSE,MIYACHIH,etal.Treatmentpolicyforcoloniclaterallyspreadingtumorsbasedoneachclinicopathologicfeatureof4subtypes:Actualstatusofpseudo-depressedtype[J].GastrointestEndosc,2020,92(5):1083–1094.
