扬州市某医院早期自然流产胚胎染色体微阵列分析
2024-08-04张敏胡苏玮孙安萍童鸣李茜
[摘要]目的探讨染色体微阵列分析(chromosomalmicroarrayanalysis,CMA)在早期自然流产中的病因学诊断价值,并研究流产物染色体异常与早期自然流产的关系。方法回顾性分析2017年6月至2022年12月在扬州市妇幼保健院确诊的432例患者的早期自然流产胚胎CMA结果,并分析不同胎停孕周与染色体数目异常和拷贝数异常之间的关联性。结果CMA成功检测428例,共有270例检出染色体异常,包括染色体数目异常212例,拷贝数异常53例和单亲二倍体5例。在染色体异常中染色体三体数目异常占比较大,其中又以16号染色体三体最为常见;拷贝数异常中检测出31例致病性和可能致病性拷贝数异常,22例临床意义不明的拷贝数异常。染色体数目异常在不同胎停孕周的差异无统计学意义(P>0.05),拷贝数异常检出率在孕10~11+6周时最高。结论CMA可明确早期自然流产的病因学诊断,其不仅可检测染色体数目异常,还可检出拷贝数异常甚至染色体微缺失综合征、染色体微重复综合征;本研究中引起自然流产最主要的原因是染色体数目异常。
[关键词]早期流产;染色体微阵列分析;染色体数目异常;拷贝数异常
[中图分类号]R715.5[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.18.017
ChromosomalmicroarrayanalysisofembryosduringearlyspontaneousabortioninahospitalinYangzhou
ZHANGMin,HUSuwei,SUNAnping,TONGMing,LIQian
MedicalGeneticCenter,YangzhouMaternalandChildHealthCareHospitalAffiliatedtoYangzhouUniversity,Yangzhou225002,Jiangsu,China
[Abstract]ObjectiveToexplorethevalueofchromosomalmicroarrayanalysis(CMA)forthediagnosisofearlyspontaneousabortion,andtoinvestigatetherelationshipbetweenchromosomalabnormalitiesandearlyspontaneousabortion.MethodsAtotalof432casesembryoswerecollectedfromJune2017toDecember2022whichoccurearlyspontaneousabortioninYangzhouMaternalandChildHealthHospital.Weretrospectivelyanalyzetheresultsofchromosomalmicroarrayanalysis,andanalyzethecorrelationbetweendifferentgestationalweeksandnumericalchromosomalabnormalitiesandcopynumbervariations.ResultsAtotalof428specimensweresuccessfullyanalyzedbytheCMA.Chromosomalabnormalitieswereidentifiedin270specimens,including212casesofnumericalchromosomalabnormalitiG8EX7lwW3No+xYlyR1RoYw==es,53casesofcopynumbervariations,and5casesofuniparentaldisomy.Mostchromosomalabnormalitiesaretrisomies,with16-trisomywasthemostcommon.Amongthecopynumbervariations,31casesofpathogenicandlikelypathogenicweredetected,and22casesofclinicallyunknowncopynumberabnormalitiesweredetected.Therewasnostatisticallysignificantdifferenceinnumericalchromosomalabnormalitiesamongdifferentgestationalweeks(P>0.05),whilethepositiverateofcopynumbervariationswashighestat10-11+6weeksofpregnancy.ConclusionCMAcanclarifytheetiologicaldiagnosisofearlyspontaneousabortion.Itcannotonlydetectchromosomalabnormalities,butalsocandetectcopynumbervariationsandevenchromosomemicrodeletionsyndrome,chromosomemicroduplicationsyndrome.Inthestudy,numericalchromosomalabnormalitiesarethemaincauseofspontaneousabortion.
[Keywords]Earlyabortion;Chromosomalmicroarrayanalysis;Numericalchromosomalabnormality;Copynumbervariations
自然流产在妊娠妇女中的发生率为10%~15%[1];分为早期流产和晚期流产。早期流产指妊娠12周前的流产,妊娠12周至不足28周的流产称为晚期流产;大多数流产发生在孕早期,即早期流产[2]。早期自然流产的原因众多,包括胚胎染色体异常、母体因素、环境等,目前认为最常见的原因是胚胎染色体异常,尤其染色体数目异常[3]。传统检测流产组织染色体异常的方法为细胞核型分析技术,但由于其细胞培养周期长、成功率低,在检测流产物组织中达不到理想效果。
随着生命科学和分子生物学的飞速发展,新的遗传学方法可在不需要通过绒毛组织培养的情况下进行检测,如荧光原位杂交技术(fluorescenceinsituhybridization,FISH)和染色体微阵列分析(chromosomalmicroarrayanalysis,CMA)等。FISH虽具有高度特异性、操作简单、敏感性强等优点,但目前FISH技术的荧光计数探针较少,只有13、16、18、21、22、X和Y染色体7种探针,因此无法检测其他染色体的异常,从而限制该技术的应用[4]。目前,CMA可对胚胎组织的全基因组进行扫描且具有不需要培养细胞、高通量、高分辨率、自动化检测等优点。CMA不仅可检测各种导致基因组不平衡变异的染色体异常,甚至是细胞核型无法发现的染色体微缺失或微重复;还可明确异常染色体的来源和性质,弥补染色体核型分析的不足,提高异常染色体的检出率[5-6]。利用CMA可明确早期胚停的原因,从而分析胚胎染色体异常的类型,找出早期自然流产的原因;为产前诊断提供有力的证据,为临床医生提供新的思路,对夫妻双方再妊娠具有重要的指导作用[7]。因此,本研究回顾性分析扬州市妇幼保健院432例早期自然流产胚胎组织的CMA检测结果,以研究自然流产的遗传病因机制,探讨在早期自然流产中CMA技术的重要性。
1对象与方法
1.1研究对象
选取2017年6月至2022年12月在扬州市妇幼保健院确诊为早期自然流产的432例患者为研究对象,患者年龄23~43岁,胎龄孕周为5~12周。采用CMA对收集的早期流产胚胎组织进行检测分析。所有患者在接受充分临床咨询后,均自愿参加本研究并签署知情同意书。本研究经扬州市妇幼保健院伦理委员会审批通过(伦理审批号:2022091)。
1.2研究方法
1.2.1样本采集在进行人工流产术时,使用负压吸引器采集5~15mg绒毛组织,经无菌生理盐水浸泡,尽快送达医学遗传中心实验室。所有样本均用生理盐水反复浸润冲洗干净,以尽量去除母体组织和血渍,并将绒毛组织分成两份,其中一份置于–80℃冰箱备用。
1.2.2CMA方法绒毛组织的基因组DNA采用QIAGEN公司提供的DNA基因组提取试剂盒(绒毛)进行提取,绒毛组织DNA浓度及纯度采用Nanodrop2000核酸分析测试仪进行测定,以保证DNA浓度≥10ng/μl。A260/A280为1.8~2.0。
利用Affymetrix公司提供的试剂盒,按照严格的操作规范流程进行酶切反应、连接反应、聚合酶链反应(polymerasechainreaction,PCR)和产物纯化过程、片段化、标记、杂交等步骤,利用CytoScan750K对早期流产胚胎组织进行全基因组范围的扫描。通过ChAS软件观察扫描分析的结果,并统计分析染色体异常的结果。使用ChromosomeAnalysisSuite软件分析CMA结果,参照DGV、OMIM、DECIPHER、UCSC、ISCA等数据库及本实验室内部已有数据,从而对自然流产胚胎组织的拷贝数异常进行致病性判读。根据美国医学遗传学与基因组学学会(AmericanCollegeofMedicalGenetics,ACMG)指南[8],将拷贝数异常(copynumbervariations,CNVs)分为5类:①致病性CNVs;②可能致病性CNVs;③临床意义不明CNVs(variantofuncertainsignificance,VOUS);④良性CNVs;⑤可能良性CNVs。对CMA结果检测为染色体异常的胚胎进行父母双方染色体溯源,以明确异常染色体的来源。
1.3统计学方法
采用SPSS27.0统计学软件对数据进行处理分析。计数资料以例数(百分率)[n(%)]表示,比较采用c2检验。P<0.05为差异有统计学意义。
2结果
2.1自然流产胚胎组织CMA检测结果
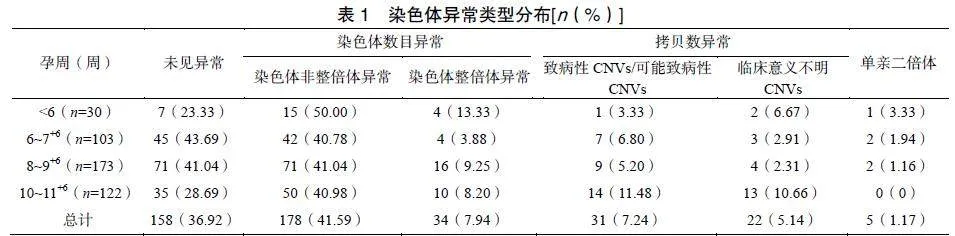
采用CMA技术对432例早期自然流产样本进行检测,检测成功率为99.07%(428/432)。在检测成功的428例早期自然流产胚胎中,染色体异常检出率63.08%(270/428),染色体数目异常212例(49.53%,212/428),拷贝数异常53例(12.38%,53/428),单亲二倍体5例(1.17%,5/428)。非整倍体异常检出率在不同胚停孕周中为40.78%~50.00%,而在拷贝数异常中致病性和可能致病性CNVs的检出率为3.33%~11.48%,临床意义不明的VOUS检出率为2.31%~10.66%,见表1。
2.2自然流产胚胎染色体数目异常分析
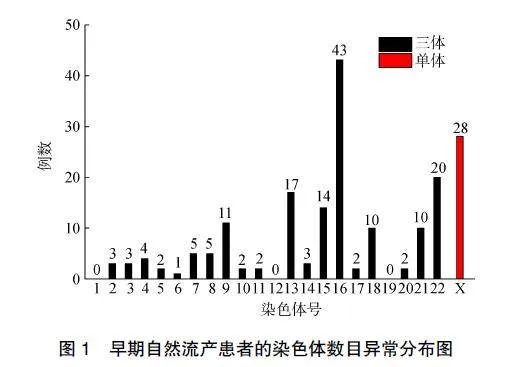
428例早期流产胚胎组织样本通过CMA检测共发现270例染色体异常,其中染色体数目异常212例,在所有染色体异常中占比最大(78.52%)。染色体数目异常分为非整倍体异常与整倍体异常,最常见的是非整倍体异常共178例,见图1,包括染色体三体146例(82.02%)、染色体单体28例(15.73%)、3例为47XXY、1例为47XYY。在性染色体异常中,主要以45XO多见(共28例),占所有染色体数目异常的13.21%。在染色体单体中均为45XO。染色体三体中主要以常染色体三体常见,尤其是16号染色体三体43例(29.45%),其次为22号染色体三体20例(13.70%)、13号染色体三体17例(11.64%)、15号染色体三体14例(9.59%)、9号染色体三体11例(7.53%)等,而1号、12号、19号染色体未发现染色体三体情况。在428例自然流产胚胎组织中发现34例整倍体异常且全部为三倍体。
2.3胎停孕周对不同染色体异常类型的分析
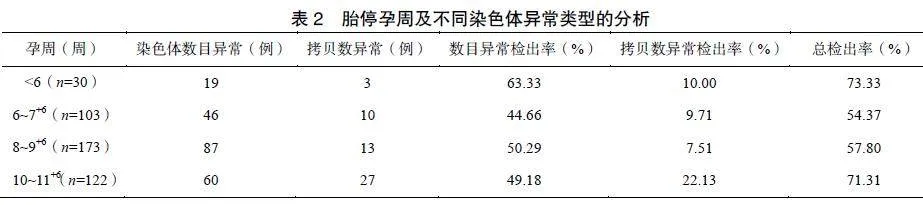
将所有检测成功的流产组织按胎停孕周分为孕<6周、6~7+6周、8~9+6周和10~11+6周,并对不同染色体类型进行分析。结果显示确诊为早期自然流产的孕周多集中在8~9+6周(173/428),其次为10~11+6周(122/428)、6~7+6周(103/428)和<6周(30/428)。孕<6周和孕10~11+6周在所有染色体类型异常中总检出率均较高,见表2。孕<6周胎停的总例数较少,可能与生化妊娠相关,胚胎随着月经排出体外,不易被识别。孕<6周流产胚胎染色体数目异常检出率最高(19/30,63.33%),四组染色体数目异常比较差异无统计学意义(P=0.346);染色体拷贝数异常检出率在孕10~11+6周时最高(27/122,22.13%),孕10~11+6周拷贝数异常与其他各胚停孕周比较差异有统计学意义(P<0.05);孕<6周、6~7+6周和8~9+6周拷贝数异常比较差异无统计学意义(P>0.05)。
2.4自然流产胚胎拷贝数异常和单亲二倍体分析
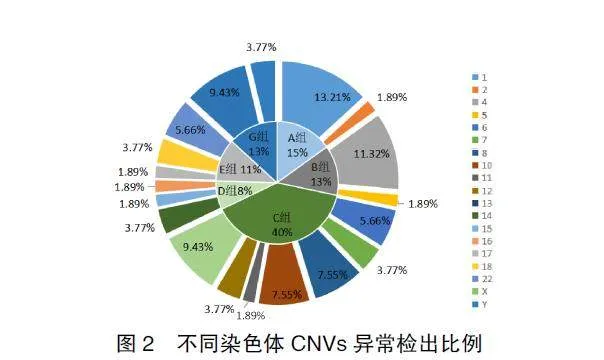
在早期流产胚胎组织标本中共检出53例拷贝数异常,占所有染色体异常的19.63%(53/270)。在拷贝数异常中共检出29例致病性CNVs、2例可能致病CNVs及22例VOUS,本研究中CNVs涉及19条染色体。致病性CNVs片段大小为0.16~103Mb,其中片段>10Mb21例(72.41%,21/29),3~10Mb1例(3.45%,1/29),<3Mb7例(24.14%,7/29),即本研究检测到21例致病性拷贝数异常为大片段缺失或重复,8例为致病性染色体微缺失或微重复。本研究中均为常见致病性染色体微缺失或微重复:1q21.1微重复1例、22q11.2微重复2例、Xq22.2微重复1例、22q11.2微缺失2例、Xp22.13微缺失1例、17p12微缺失1例及1p36.3微缺失1例,这些常见的染色体微缺失或微重复主要与智力障碍、发育迟缓等临床症状有关。关于自然流产是否与染色体微缺失或微重复相关,可能取决于微缺失或微重复是否位于基因关键的位置、剂量敏感性及是否伴随其他重要临床表型,由于本研究样本量较小,其与自然流产的关联性还不能明确。此外,将染色体按照国际标准命名分组(A~G组),在不同染色体CNVs异DIcWT1AYLTzlscqQWjKM1g==常中发现1号染色体的阳性检出最多,占总CNVs的13.21%(7/53),其次依次为4号染色体(6/53,11.32%)、X染色体(5/53,9.43%)和22号染色体(5/53,9.43%),不同染色体CNVs异常检出情况见图2。本研究中CMA技术还检测出5例全基因组单亲二倍体(uniparentaldisomy,UPD),即胚胎的1~22号染色体和X染色体均来自于父亲或母亲。
3讨论
临床上诊断早期自然流产并不难,但诊断早期自然流产的原因较为困难(早期自然流产的原因有很多,包括胚胎染色体因素、母体因素、环境因素等),而CMA技术的检测应用使越来越多的早期流产胚胎组织得到明确的诊断。目前CMA技术在流产物中的应用主要涉及反复流产、胎死宫内、死产、核型分析培养失败等。CMA技术的出现为临床医生评估夫妻双方再孕风险提供新的思路,在优生、优育方面具有重要的价值。
本研究检测432例早期自然流产标本,成功检测428例,在检测成功的标本中共检出染色体异常270例(63.08%),与文献报道基本一致。这表明早期自然流产与胚胎染色体异常有着密切的关联,胚胎染色体异常是早期自然流产的重要因素[9-10]。在染色体异常中,染色体数目异常占比最大,表明早期自然流产最主要的致病原因是染色体数目异常。在染色体数目异常中主要为非整倍体异常,其中非整倍体异常主要以染色体三体为主,在染色体三体中以16号染色体三体为主,这与既往报道一致[11]。16号三体为导致早期自然流产(孕12周以前)最常见的三体,与其染色体的结构较特殊有关,它在基因组中是低拷贝重复序列最丰富的常染色体之一且不分离率最高,因此16号染色体三体是早期流产最主要的原因[12]。值得注意的是,本研究中并未发现1号染色体三体和19号染色体三体的情况,可能与本研究样本量较小及群体差异有关,回溯文献也很少见1号染色体三体和19号染色体三体的报道,目前具体机制尚不清楚。有研究推测1号染色体为人类最大的染色体,因此在减速分裂的过程中不易发生不分离的现象[1];而19号染色体则被认为是胚胎发育的关键,包含多个胚胎发育的关键基因,在妊娠发生和维持的过程中发挥重要的作用[13];因此19号染色体三体情况可能发生在妊娠更早的时期,如生化妊娠期,而不易被识别,其原因尚不清楚。绝大多数染色体非整倍体异常具有胚胎期致死性,但大多数的非整倍体异常的发生是胎儿新发变异,夫妻双方下一胎再孕育患儿的风险低;但如果检出D组(13、14、15号)染色体和G组(21和22号)染色体非整倍体,则需父母进行核型分析验证是否为罗氏易位携带者,从而预估再次生育后代的患病风险。
染色体拷贝数异常也是自然流产的重要原因之一,拷贝数异常包括染色体缺失、重复或多片段的缺失或重复。这类变异影响基因表达的方式有很多,如基因发生断裂、基因剂量敏感变化、位置变化等,从而导致胚胎的发育异常,这可能是引起胚胎停育的原因。本研究共检出53例染色体拷贝数异常,在染色体拷贝数异常中共检出29例为临床意义明确的致病性拷贝数异常;其中21例出现染色体大片段缺失和重复(>10Mb),其对胚胎的发育有着极大的影响,大量的功能基因包含其中,可引起胚胎严重发育迟缓、畸形甚至胚停。CMA技术不仅能检测出非整倍体异常、整倍体异常、染色体的大片段重复或缺失,还可检测出传统染色体核型分析无法发现的染色体微缺失或微重复。染色体微缺失或微重复是指染色体上缺失或重复的片段不是特别长,一般<10Mb,其与早期自然流产的相关性至今还不明确;但有研究表明,微缺失或微重复可能影响某些基因的剂量敏感性,而这些基因剂量的改变也会影响胚胎的发育生长,也有可能导致流产的发生[14]。
本研究中8例流产物出现染色体致病性微缺失或微重复,主要涉及1q21.1微重复、22q11.2微缺失、1p36微缺失及22q11.2微重复等区域。1q21.1微重复导致1q21.1重复综合征,主要涉及大头畸形、神经认知异常等异常表型[15];22q11.2微缺失导致22q11.2缺失综合征,该综合征涉及先天性心脏病、特征性面部畸形、智力障碍、免疫缺陷等临床表型[16];1p36微缺失导致1p36缺失综合征,主要涉及先天性膈疝、智力低下、心血管畸形等[17];22q11.2微重复综合征,可引起智力障碍、发育迟缓等临床表现[18]。在上述染色体微缺失或微重复中,均为致病性拷贝数异常,其胚胎致死性并没有染色体非整倍体异常那么强,只在表型严重时会导致胎儿死亡[11]。这些致病性微缺失或微重复的检出对于指导再生育具有一定的意义,但本研究中染色体微缺失或微重复相关的样本量较小,且目前的研究中此类型CNVs与自然流产的关联并不明确。本研究中还检出22例临床意义不明CNVs,主要是受限于现阶段医学对疾病的认知,目前无法给出所有致病性未知CNVs的准确判读,但随着VOUS的积累,会为产前遗传咨询提供更多的帮助。本研究发现CNVs最常见为1号染色体,其次为4号染色体、X染色体和22号染色体,可能是1号染色体携带最多的基因,所以更容易发生CNVs。本研究还检测出5例UPD,UPD的发生主要是由于等位染色体或某染色体片段来自于同一亲源,但目前没有充分的证据证明UPD会导致胚停,只能提示胎儿隐性遗传病的患病概率大大增加。传统的细胞核型检测和FISH技术均无法检测到UPD的存在,这显示出CMA在检测单亲二倍体上的独特优势[19]。
本研究进一步根据胎停孕周对不同染色体异常类型进行分析,结果提示发生早期自然流产的孕周多集中在8~9+6周,且孕<6周和孕10~11+6周染色体异常的总检出率较高。孕<6周绝大多数是染色体非整倍数变异,这提示<6a2d42a2a05a72884111edddb4c6eaa91周的胚停大多数与染色体数目异常有关。这是由于细胞分裂异常所致,胚胎无法正常发育,最终导致胎停。而基因组拷贝数异常检出率在10~11+6周最高,这表明某些CNVs变异可能在孕早期不参与或较少参与重要发育机制;但随胚胎发育各基因开始表达,某些CNVs变异涉及的基因对胚胎发育起关键的作用,其变异可引起胚胎严重发育迟缓、畸形甚至胚停。
综上所述,CMA技术不仅可检测出胚胎的染色体数目异常,还可检测出胚胎的染色体拷贝数异常,甚至是胚胎单亲二倍体,以此更全面了解胚胎停育的原因。如果早期自然流产的原因为胚胎单纯的染色体数目异常,异常再次发生的概率较小;而早期自然流产的原因为胚胎基因组拷贝数异常,这表明夫妻双方染色体异常携带的可能性较大,再次发生异常的风险较高,需要进一步对夫妻双方进行染色体的延伸检测,这对后续再次生育具有重要的意义。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] 顾崇娟,温灿良,李玲,等.1514例自然流产绒毛染色体微阵列检测分析[J].实用妇产科杂志,2023,39(1):61–66.
[2] MUTTUKRISHNAS,JAUNIAUXE,GREENWOLDN,etal.CirculatinglevelsofinhibinA,activinAandfollistatininmissedandrecurrentmiscarriages[J].HumReprod,2002,17(12):3072–3078.
[3] DUY,CHENL,LINJ,etal.Chromosomalkaryotypeinchorionicvilliofrecurrentspontaneousabortionpatients[J].BiosciTrends,2018,12(1):32–39.
[4] FAUZDARA,CHOWDHRYM,MAKROORN,etal.Rapid-prenataldiagnosisthroughfluorescenceinsituhybridizationforpreventinganeuploidyrelatedbirthdefects[J].IndianJHumGenet,2013,19(1):32–42.
[5] 吴淑花,姚吉龙,刘洋,等.染色体微阵列分析技术在早期自然流产胚胎遗传学检测中的价值[J].中国优生与遗传杂志,2018,26(7):17–18,37.
[6] REDDYUM,PAGEGP,SAADEGR,etal.Karyotypeversusmicroarraytestingforgeneticabnormalitiesafterstillbirth[J].NEnglJMed,2012,367(23):2185–2193.
[7] 卢建,黄伟伟,王继成,等.染色体微阵列技术在自然流产胚胎组织染色体检测中的应用[J].中国优生与遗传杂志,2017,25(7):38–40.
[8] RIGGSER,ANDERSENEF,CHERRYAM,etal.Technicalstandardsfortheinterpretationandreportingofconstitutionalcopy-numbervariants:AjointconsensusrecommendationoftheAmericanCollegeofMedicalGeneticsandGenomics(ACMG)andtheClinicalGenomeResource(ClinGen)[J].GenetMed,2020,22(2):245–257.
[9] 余宏盛,郭红,沈双双,等.染色体核型分析联合SNP-array技术在不良妊娠史孕妇产前诊断中的应用[J].中华妇产科杂志,2018,53(3):155–159.
[10] WANGY,LIY,CHENY,etal.Systematicanalysisofcopy-numbervariationsassociatedwithearlypregnancyloss[J].UltrasoundObstetGynecol,2020,55(1):96–104.
[11] 彭继苹,袁海明.染色体微阵列分析技术在2600例流产物中的应用[J].遗传,2018,40(9):779–788.
[12] 李雯雯,阳鑫妙,张鑫丽,等.染色体微阵列对流产组织染色体异常的检测分析[J].中国卫生检验杂志,2022,32(16):1974–1978.
[13] FOUNDSSA,STOLZDB.Geneexpressionoffourtargetsinsituofthefirsttrimestermaternal-fetoplacentalinterface[J].TissueCell,2020,64:101313.
[14] COLLEYE,HAMILTONS,SMITHP,etal.Potentialgeneticcausesofmiscarriageineuploidpregnancies:Asystematicreview[J].HumReprodUpdate,2019,25(4):452–472.
[15] UPADHYAIP,AMIRIEF,GULERIAVS,etal.Recurrent1q21.1deletionsyndrome:Reportonvariableexpression,nonpenetranceandreviewofliterature[J].ClinDysmorphol,2020,29(3):127–131.
[16] DELIOM,GUOT,MCDONALD-MCGINNDM,etal.Enhancedmaternaloriginofthe22q11.2deletioninvelocardiofacialandDiGeorgesyndromes[J].AmJHumGenet,2013,92(3):439–447.
[17] JORDANVK,ZAVERIHP,SCOTTDA.1p36deletionsyndrome:Anupdate[J].ApplClinGenet,2015,8:189–200.
[18] DIMATTEOF,BETTINP,FERRARIG,etal.22q11.2microduplicationsyndromeandjuvenileglaucoma[J].OphthalmicGenet,2018,39(4):532–538.
[19] KOTZOTD.Prenataltestingforuniparentaldisomy:Indicationsandclinicalrelevance[J].UltrasoundObstetGynecol,2008,31(1):100–105.
(收稿日期:2023–10–31)
(修回日期:2024–05–16)
