中性粒细胞与淋巴细胞比值与血液透析患者预后的关系
2024-08-04李洛华张思雨
[摘要]目的探讨中性粒细胞与淋巴细胞比值(neutrophiltolymphocyteratio,NLR)与维持性血液透析(maintenancehemodialysis,MHD)患者全因死亡之间的关系。方法对九江市第一人民医院肾内科于2018年1月1日至2020年8月31日接受MHD治疗的患者进行观察,所有患者均随访至死亡、失访或截至日期(2023年8月31日)。根据NLR四分位数分为四组,采用Kaplan-Meier法比较各组患者的生存率,利用Cox回归分析NLR与全因死亡之间的相关性,并采用Logistic回归分析高NLR水平的影响因素。结果共443例患者纳入研究,平均生存时间21.51个月,NLR水平的中位数(四分位数间距)为3.84(2.55,5.79);Kaplan-Meier生存曲线显示NLR>5.79的患者全因死亡率较高(χ2=19.824,P<0.001)。多因素校正后四组间的全因死亡风险差异有统计学意义(P<0.05)。多因素Logistic回归结果显示高血清白蛋白是NLR>5.79的保护因素(P<0.05)。结论NLR>5.79是MHD患者全因死亡的独立危险因素,可作为评估MHD患者死亡风险的指标之一。
[关键词]中性粒细胞与淋巴细胞比值;维持性血液透析;死亡率;炎症
[中图分类号]R11[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.18.011
Therelationshipbetweentheneutrophiltolymphocyteratioandtheprognosisofhemodialysispatients
LILuohua,ZHANGSiyu
DepartmentofNephrology,theFirstpeople’sHospitalofJiujiangCity,Jiujiang332000,Jiangxi,China
[Abstract]ObjectiveToexaminetheassociationbetweenneutrophiltolymphocyteratio(NLR)andall-causemortalityinpatientsundergoingmaintenancehemodialysis(MHD).MethodsPatientswhoreceivedMHDtreatmentintheDepartmentofNephrology,thefirstpeople’sHospitalofJiujiangCityfromJanuary1,2018toAugust31,2020wereobserved.Allthepatientswerefolloweduntiltheydied,werelosttofollow-up,orreachedthecutoffdateofAugust31,2023.Accordingtopatients’NLRquartilevaluewasdividedintofourgroups,groupsofpatientswerecomparedwith themethodofKaplan-Meieranalysisofsurvivalrates,usingCoxregressionmodelanalysisoftheNLRandthecorrelationbetweenforall-causemortality,inpatientswithhighlevelsofNLRisanalyzedusingLogisticregressionanalysisofinfluencingfactors.ResultsAtotalof443patientswereenrolledinthisstudy.Theaveragesurvivaltimewas21.51months,andthemedian(interquartilerange)ofNLRwas3.84(2.55,5.79);Kaplan-Meiersurvivalcurveshowedthatall-causemortalitywashigherinpatientswithNLR>5.79(χ2=19.824,P<0.001).Thehazardratiosforall-causedeathamongthefourgroupsremainedstatisticallysignificantaftermultivariateadjustment(P<0.05).MultivariateLogisticregressionanalysisshowedthathighserumalbuminwasaprotectivefactorforNLR>5.79(P<0.05).ConlusionNLR>5.79isanindependentriskfactorforall-causedeathinpatientswithMHD,anditcanbeusedasoneofthevaluableindexestoevaluatetheriskofdeathinpatientswithMHD.
[Keywords]Neutrophiltolymphocyteratio;Maintenancehemodialysis;Mortality;Inflammation
随着终末期肾病(end-stagerenaldisease,ESRD)患病人数的不断增加,慢性肾脏病(chronickidneydisease,CKD)的治疗成为全球面临的公共健康问题之一[1]。据统计,全球每年约有44万例CKD患者进入ESRD阶段,维持性血液透析(maintenancehemodialysis,MHD)是常用的一种肾脏替代治疗方式,MHD患者每年死亡率为5%~27%[2]。心血管疾病(cardiovasculardisease,CVD)、糖尿病、高脂血症等传统危险因素已不能完全阐述MHD患者的高死亡率;有研究表明MHD患者体内的炎症是引起其死亡的一个主要因素[3-4]。当前,CKD患者炎症状态的常用指标包括C反应蛋白(C-reactiveprotein,CRP)、白细胞介素(interleukin,IL)-6和肿瘤坏死因子-α(tumornecrosisfactorα,TNF-α)等[5]。中性粒细胞与淋巴细胞比值(neutrophiltolymphocyteratio,NLR)是近年来发现的反映机体炎症状态的一种炎症标志物,由于非侵入性且操作简便而成为研究热点。有研究表明,NLR可预测肿瘤、冠心病等各类患者的预后[5]。但目前关于NLR在MHD患者中的临床应用报道较少,本研究探讨MHD患者NLR对其预后的价值。
1资料与方法
1.1一般资料
选取九江市第一人民医院肾内科于2018年1月1日至2020年8月31日进行MHD治疗的患者作为研究对象,所有对象均随访至死亡、失访或研究截至时间2023年8月31日,终点事件为全因死亡。纳入标准:①年龄≥18岁;②MHD治疗≥3个月。排除标准:①急性炎症活动期的患者;②患有血液系统疾病的患者;③恶性肿瘤的患者。本研究经九江市第一人民医院伦理委员会审批通过(伦理审批号:JJSDYRMYY-YXLL-2023-48)。
1.2资料收集与分组
收集患者的人口学、实验室相关检查和透析相关检查等基线资料。使用EPI公式估算肾小球滤过率(estimatedglomerularfiltrationrate,eGFR)[6];计算患者的体质量指数(bodymassindex,BMI)。所有患者于九江市第一人民医院血液透析室接受MHD治疗,平均透析3次/周,4h/次。基线NLR为2.55(3.84,5.79),平均为4.82。根据基线NLR的四分位数进行分组,Q1组:NLR≤2.55,Q2组:2.55<NLR≤3.84,Q3组:3.84<NLR≤5.79,Q4组:NLR>5.79。
1.3统计学方法
采用SPSS26.0统计学软件对数据进行处理分析。符合正态分布的计量资料以均数±标准差(![]() )表示,比较采用t检验;不符合正态分布的计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,比较采用Kruskal-WallisH检验。计数资料以例数(百分率)[n(%)]表示,比较采用c2检验。采用Kaplan-Meier法比较不同组的生存率。使用Cox回归分析患者死亡的危险因素。采用二元Logistic回归分析探讨NLR>5.79的危险因素。将单因素分析中P<0.05及临床重要因素纳入多因素分析。P<0.05为差异有统计学意义。
)表示,比较采用t检验;不符合正态分布的计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,比较采用Kruskal-WallisH检验。计数资料以例数(百分率)[n(%)]表示,比较采用c2检验。采用Kaplan-Meier法比较不同组的生存率。使用Cox回归分析患者死亡的危险因素。采用二元Logistic回归分析探讨NLR>5.79的危险因素。将单因素分析中P<0.05及临床重要因素纳入多因素分析。P<0.05为差异有统计学意义。
2结果
2.1基线资料
共443例MHD患者纳入研究,其中男274例(61.9%);平均年龄(53.52±15.20)岁;透析时间(21.51±10.74)个月。原发病中慢性肾小球肾炎252例(56.9%)、糖尿病肾病79例(17.8%)、高血压性肾损害41例(9.3%)、多囊肾13例(2.9%)、梗阻性肾病8例(1.8%)及其他疾病50例(11.3%)。
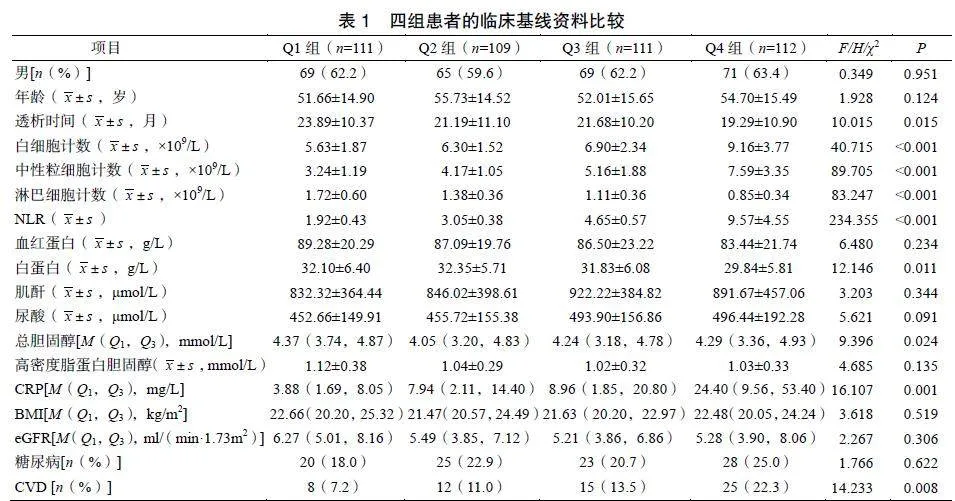
2.2四组患者的临床基线资料比较
结果显示四组患者的透析时间、白细胞计数、中性粒细胞计数、淋巴细胞计数、NLR、血清白蛋白、总胆固醇、CRP和CVD病史差异均有统计学意义(P<0.05);糖尿病病史、性别等差异无统计学意义(P>0.05),见表1。
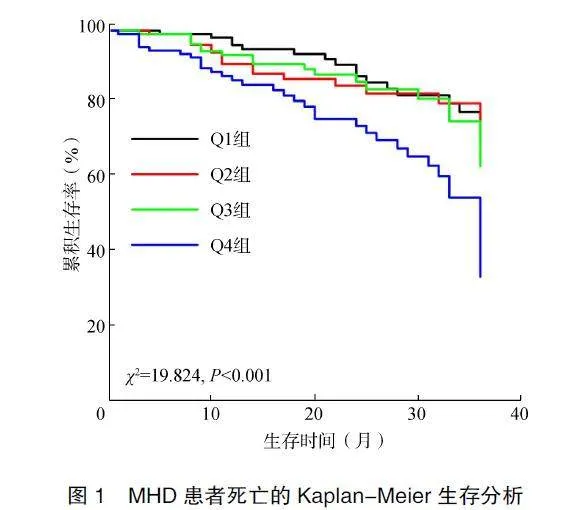
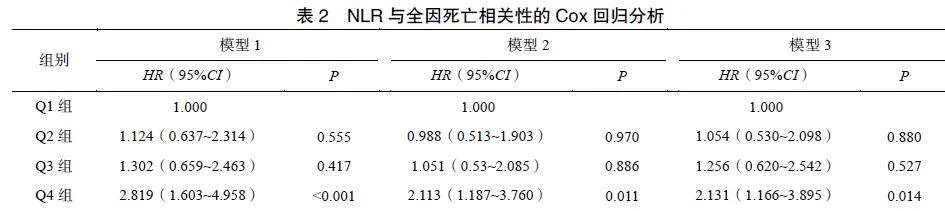
2.3NLR与全因死亡的关系
比较四组患者的生存率。结果显示Q4组患者的生存率最低(χ2=19.824,P<0.001),见图1。将NLR作为连续变量纳入Cox回归,结果显示NLR与全因死亡存在正相关(HR=1.079,95%CI:1.041~1.12,P<0.001)。此外,将NLR作为分类变量纳入模型,单因素Cox回归结果提示Q4组的全因死亡的风险比Q1组增加(HR=2.819,95%CI:1.603~4.958,P<0.001)。在校正年龄、BMI、糖尿病和CVD后,Q4组的全因死亡风险较Q1组增加111.3%(HR=2.113,95%CI:1.187~3.76,P=0.011)。进一步校正血红蛋白、血清白蛋白、尿酸、血肌酐和总胆固醇后,上述结果仍有统计学意义,表明NLR是MHD患者的全因死亡的独立危险因素,见表2。
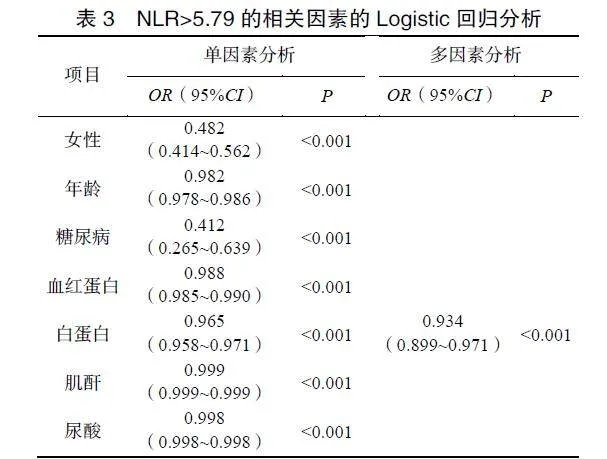
2.4NLR>5.79的相关因素
将单因素Logistic回归分析中P<0.05的变量进行多因素分析,结果显示血清白蛋白(OR=0.934,95%CI:0.899~0.971,P<0.001)是NLR>5.79发生的独立保护因素,见表3。
3讨论
研究显示ESRD的发病率在全球范围内不断升高[7]。微炎症状态在MHD患者中普遍存在,从而增加肾衰患者的慢性并发症,使MHD患者病死率显著增高[8]。研究显示NLR与CKD的进一步发展紧密相关[9]。多项研究显示,在CVD、肝硬化和慢性肾脏病等各种慢性病中,NLR的值越高则炎症状态越严重、预后越差[10-12]。此外,有研究显示,NLR可预测血液透析患者的死亡率[13-14]。本研究同样发现,NLR与MHD患者的死亡密切相关,校正混杂因素后,NLR与患者全因死亡仍有正相关性。
本研究结果显示Q4组白细胞计数、中性粒细胞计数显著高于Q1组,淋巴细胞计数低于Q1组。其机制可能是血液流变性能的改变和血管黏附性的增加与中性粒细胞被激活有关;中性粒细胞黏附分子CD11b/CD18、CD62等表达增加,有助于中性粒细胞穿透过血管内皮细胞,损伤大血管及微血管,出现相应的并发症,且低水平的相对淋巴细胞计数同样与CKD的进展有关[15]。本研究中Q4组的CVD比例高于Q1组,这与既往报道的结果一致[15]。推测NLR与CVD之间的关系机制:中性粒细胞是可引发炎症反应的细胞,其作用包括加剧内皮功能的障碍、激活巨噬细胞及促进泡沫细胞的形成[16]。
本研究Kaplan-Meier生存曲线显示NLR>5.79的患者全因死亡率显著较高。多因素Cox回归分析发现,基线NLR>5.79是MHD患者全因死亡的独立危险因素。Reddan等[17]也同样证明了以上观点。在ESRD中慢性炎症非常普遍,并与不良临床结局相关,这种炎症归因于各种潜在因素,包括感染、促炎细胞因子清除减少、尿毒症环境、氧化应激等[18]。此外,中性粒细胞释放趋化物质(如IL-8),进一步促使中性粒细胞向肾脏迁移并激活,从而加剧肾小球损伤的发生。
本研究中单因素Logistic回归显示,血清白蛋白与NLR>5.79的发生呈负相关,经多因素校正后,白蛋白仍是NLR>5.79的独立保护因素。Okyay等[9]研究也表明,血清白蛋白与NLR有很好的相关性。炎症可升高中性粒细胞和减低淋巴细胞使NLR增高,炎症状态同时可下调白蛋白基因转录而导致血清白蛋白水平降低[19-20];而且,血清白蛋白和淋巴细胞计数都是评估营养状态的指标。因此,血清白蛋白和NLR具有相似的病理生理学基础。另外,单因素分析结果显示女性是NLR>5.79的保护因素,这可能与女性患者体内的雌激素水平较高有关,而17β-雌二醇具有抗炎作用,它可抑制巨噬细胞的渗出及细胞因子如IL-1β和TNF-α的释放。这一系列反应可减少白细胞的黏附和浸润,从而发挥抗炎的作用[21-22]。校正混杂因素后,性别与NLR无明显相关,可能与本研究样本量较小有关,将来还需要更多的临床研究来验证。
本研究有一定的局限性:①本研究是一项单中心的小样本量回顾性研究;②本研究应用基线数据,并未排除已使用抗菌药物、纠正营养及脂质代谢紊乱等药物的患者,也未考虑随访期间的数据波动;③本研究只有患者死亡的数据,而没有记录患者的具体主要死因。因此,对于NLR在MHD患者中危险预测因子的确定,仍需要多中心的前瞻性临床研究来证实。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] 孟婕,王晓阳,李肖肖,等.红细胞分布宽度与持续不卧床腹膜透析患者死亡的相关性[J].中华肾脏病杂志,2018,34(2):87–93.
[2] ORTIZA,COVICA,FLISERD,etal.Epidemiology,contributorsto,andclinicaltrialsofmortalityriskinchronickidneyfailure[J].Lancet,2014,383(9931):1831–1843.
[3] STENVINKELP,HEIMBÜRGERO,PAULTREF,etal.Strongassociationbetweenmalnutrition,inflammation,andatherosclerosisinchronicrenalfailure[J].KidneyInt,1999,55(5):1899–1911.
[4] FUNGF,SHERRARDDJ,GILLENDL,etal.Increasedriskforcardiovascularmortalityamongmalnourishedend-stagerenaldiseasepatients[J].AmJKidneyDis,2002,40(2):307–314.
[5] STENVINKELP,KETTELERM,JOHNSONRJ,etal.IL-10,IL-6,andTNF-alpha:Centralfactorsinthealteredcytokinenetworkofuremia-thegood,thebad,andtheugly[J].KidneyInt,2005,67(4):1216–1233.
[6] LEVEYAS,STEVENSLA,SCHMIDCH,etal.Anewequationtoestimateglomerularfiltrationrate[J].AnnInternMed,2009,150(9):604–612.
[7] 夏敏,张萍,盛凯翔,等.老年终末期肾病患者血液透析和腹膜透析的预后分析[J].中华肾脏病杂志,2016,32(8):584–591.
[8] TURKMENK,TONBULHZ,TOKERA,etal.Therelationshipbetweenoxidativestress,inflammation,andatherosclerosisinrenaltransplantandend-stagerenaldiseasepatients[J].RenFail,2012,34(10):1229–1237.
[9] OKYAYGU,INALS,ONEÇK,etal.Neutrophiltolymphocyteratioinevaluationofinflammationinpatientswithchronickidneydisease[J].RenFail,2013,35(1):29–36.
[10] BHATT,TELIS,RIJALJ,etal.Neutrophiltolymphocyteratioandcardiovasculardiseases:Areview[J].ExpertRevCardiovascTher,2013,11(1):55–59.
[11] GÜNAYE,SARINÇULAŞLIS,AKARO,etal.Neutrophil-to-lymphocyteratioinchronicobstructivepulmonarydisease:Aretrospectivestudy[J].Inflammation,2014,37(2):374–380.
[12] BIYIKM,UCARR,SOLAKY,etal.Bloodneutrophil-to-lymphocyteratioindependentlypredictssurvivalinpatientswithlivercirrhosis[J].EurJGastroenterolHepatol,2013,25(4):435–441.
[13] AHBAPE,SAKACIT,KARAE,etal.Neutrophil-to-lymphocyteratioandplatelet-tolymphocyteratioinevaluationofinflammationinend-stagerenaldisease[J].ClinNephrol,2016,85(4):199–208.
