基于生物信息学分析丹参酮ⅡA联合紫杉醇治疗乳腺癌的潜在作用机制
2024-07-12权甜曾悦侯益石林冷衍恩刘金凤王霞
权甜 曾悦 侯益 石林 冷衍恩 刘金凤 王霞
基金项目:德阳市重点研发项目(编号:No.2023SZZ111、No.2023SZZ115);中江县2023年科技计划项目(编号:No.ZJKJSF2311)
作者简介:权甜,硕士研究生,初级药师,研究方向:临床药学、肿瘤学。
通信作者:王霞,大学本科,主治医师,研究方向:肿瘤疾病的诊疗。E-mail:1826948976@qq.com
【摘要】目的 基于生物信息学分析丹参酮ⅡA联合紫杉醇治疗乳腺癌的潜在作用机制,为临床治疗提供参考。方法 检索紫杉醇、丹参酮ⅡA的共同潜在药物靶点,使用venny 2.1获取其与乳腺癌相关靶点的交集靶点,使用STRING及DAVID数据库对交集靶点进行蛋白质互作网络(PPI)与富集分析。结果 共获取紫杉醇潜在药物靶点298个,丹参酮ⅡA潜在药物靶点333个,乳腺癌相关靶点17 089个,交集靶点187个。丹参酮ⅡA联合紫杉醇治疗乳腺癌的核心靶点为原癌基因酪氨酸蛋白激酶(SRC)、磷酸肌醇 3-激酶调节亚基 1(PIK3R1)、雌激素受体 1(ESR1)、丝氨酸和苏氨酸激酶(AKT1)、热休克蛋白90 α家族A类成员1(HSP90AA1)、视黄醇X受体α
(RXRA)、表皮生长因子受体(EGFR)、大鼠肉瘤蛋白同源蛋白(HRAS)、丝裂原活化蛋白激酶 1(MAPK1)、胰岛素样生长因子1
受体(IGF1R)。富集分析结果显示:排名前5位的细胞组分(CC)为胞质、细胞质、纤维凝胶蛋白-1颗粒腔、细胞外的外来体、复合受体;排名前5位的生物过程(BP)为对凋亡过程的负向调控、蛋白质自身磷酸化、蛋白质磷酸化、蛋白激酶B信号的正向调节、视黄酸受体信号通路;排名前5的分子功能(MF)为RNA聚合酶Ⅱ转录因子活性、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、锌离子结合、蛋白酪氨酸激酶活性、酶结合。结论 丹参酮ⅡA联合紫杉醇可能通过SRC、PIK3R1、ESR1、AKT1、HSP90AA1等核心靶点达到减毒增效作用,并调控PI3K/AKT等凋亡信号通路,介导细胞凋亡、氧化应激等多个生物过程治疗乳腺癌。
【关键词】丹参酮ⅡA;紫杉醇;乳腺癌;网络药理学
【中图分类号】R966 【文献标识码】A 【文章编号】2096-2665.2024.10.0007.05
DOI:10.3969/j.issn.2096-2665.2024.10.003
乳腺癌是女性最常见的恶性肿瘤之一,近三十年来,中国的乳腺癌发病率呈持续上升趋势[1-2]。目前,临床治疗该疾病多采用化疗治疗、靶向药物治疗等综合治疗手段。紫杉醇是从短叶红豆杉中分离出来的二萜类化合物,其在乳腺癌、子宫癌、肺癌及其他肿瘤中的治疗效果良好[3]。但有研究证明,紫杉醇可通过氧化应激、细胞凋亡、铁死亡等机制引起心脏毒性[4-6]。为减少紫杉醇的心脏毒性,增加其疗效和安全性,临床上常将其与丹参酮ⅡA连用。丹参酮ⅡA具有抗炎和抗氧化的药理活性,可通过促进血管生成,发挥心脏保护作用,能有效治疗心血管疾病[7]。基于此,本研究采用网络药理学的方法,系统分析紫杉醇联合丹参酮ⅡA治疗乳腺癌的潜在作用机制,为其基础研究和临床应用提供参考,现报道如下。
1 材料与方法
1.1 丹参酮ⅡA和紫杉醇的共同潜在药物靶点收集 在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov)中检索“丹参酮ⅡA”和“紫杉醇”的SMILES和MOL2,并将SMILES输入Swiss Target Prediction(http://www.swisstargetprediction.ch),将MOL2输入PharmMapper (https://PharmMapper (lilab-ecust.cn),分别获取丹参酮ⅡA和紫杉醇的潜在药物靶点。去除重复及可信度为0的靶点后,收集丹参酮ⅡA和紫杉醇共同的潜在药物靶点。
1.2 乳腺癌相关靶点获取 将关键词“Breast cancer”录入DisGeNET(https://www.disgenet.org/)、GeneCards(https://www.genecards.org/)、OMIM (https://omim.org)、TTD(http://db.idrblab.net/ttd/)中搜索所有与乳腺癌相关的靶基因,在DisGeNET和GeneCards数据库中根据分数筛选出前2 000个靶点。将2 000个靶点归一化并导入Uniprot数据库(https://www.uniprot.org/),以获得Uniprot ID。汇总 Uniprot ID后,删除所有重复项,得到乳腺癌相关靶点。
1.3 交集靶点获取 使用Venny 2.1软件获取紫杉醇、丹参酮ⅡA和乳腺癌的交集靶点,并绘制Venny图。
1.4 蛋白质互作网络(PPI)构建 将交集靶点输入STRING11.0,应用Cytoscpace3.10.1软件绘制PPI网络图,节点大小和颜色可根据图中的度数进行调整。
1.5 GO和KEGG通路富集分析 将1.3中得到的交集靶点导入DAVID数据库(https://david.ncifcrf.gov/),限定物种为“Homo Sapiens”,进行GO和KEGG通路富集分析。分别选取GO通路富集分析结果中生物过程(BP)、细胞组分(CC)和分子功能(MF)中 P值从小到大排名前10的条目及KEGG通路富集分析结果中P值从小到大排名前15的条目,导入分析网站(http://www.bioinformatics.com.cn/),绘制GO及KEGG可视化图。
2 结果
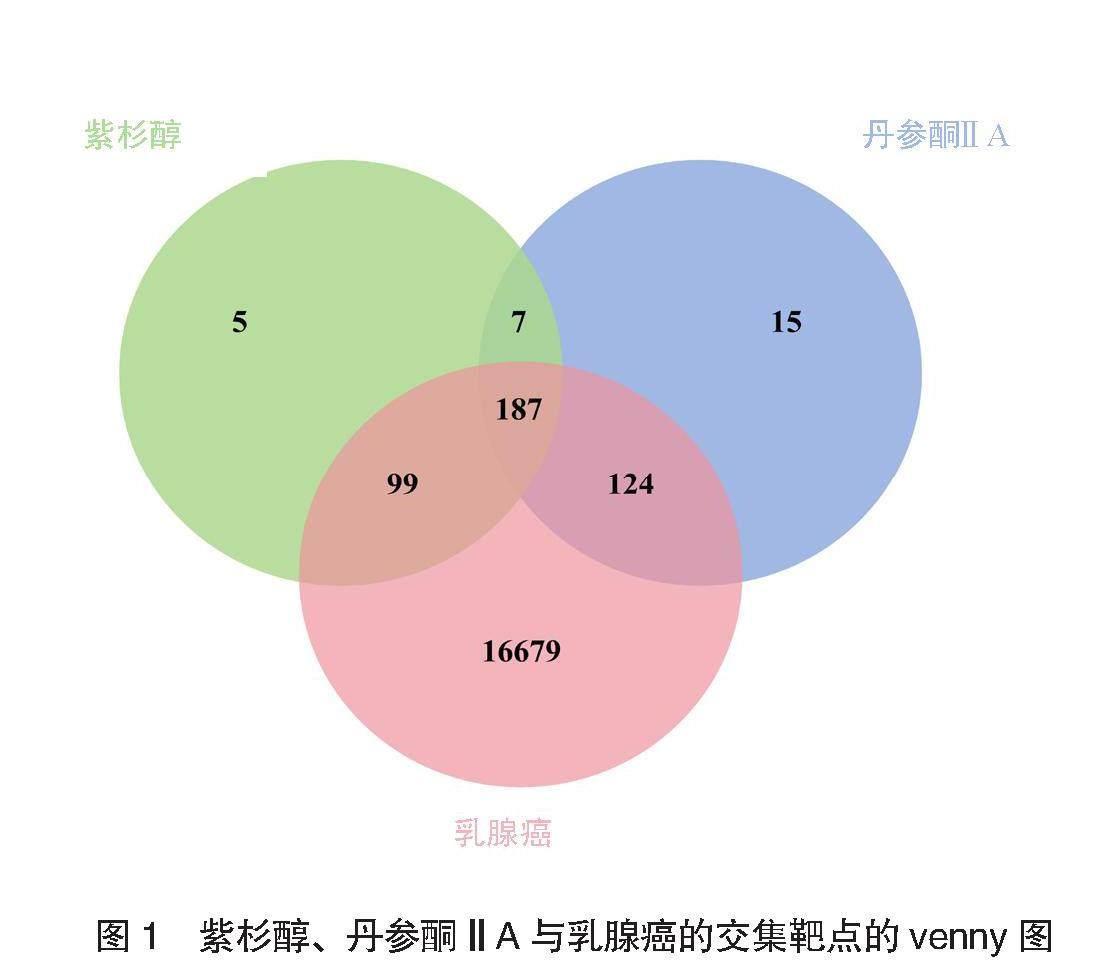
2.1 靶点收集结果 共获取紫杉醇潜在药物靶点298个,丹参酮ⅡA潜在药物靶点333个,乳腺癌相关靶点17 089个,交集靶点187个,见图1。
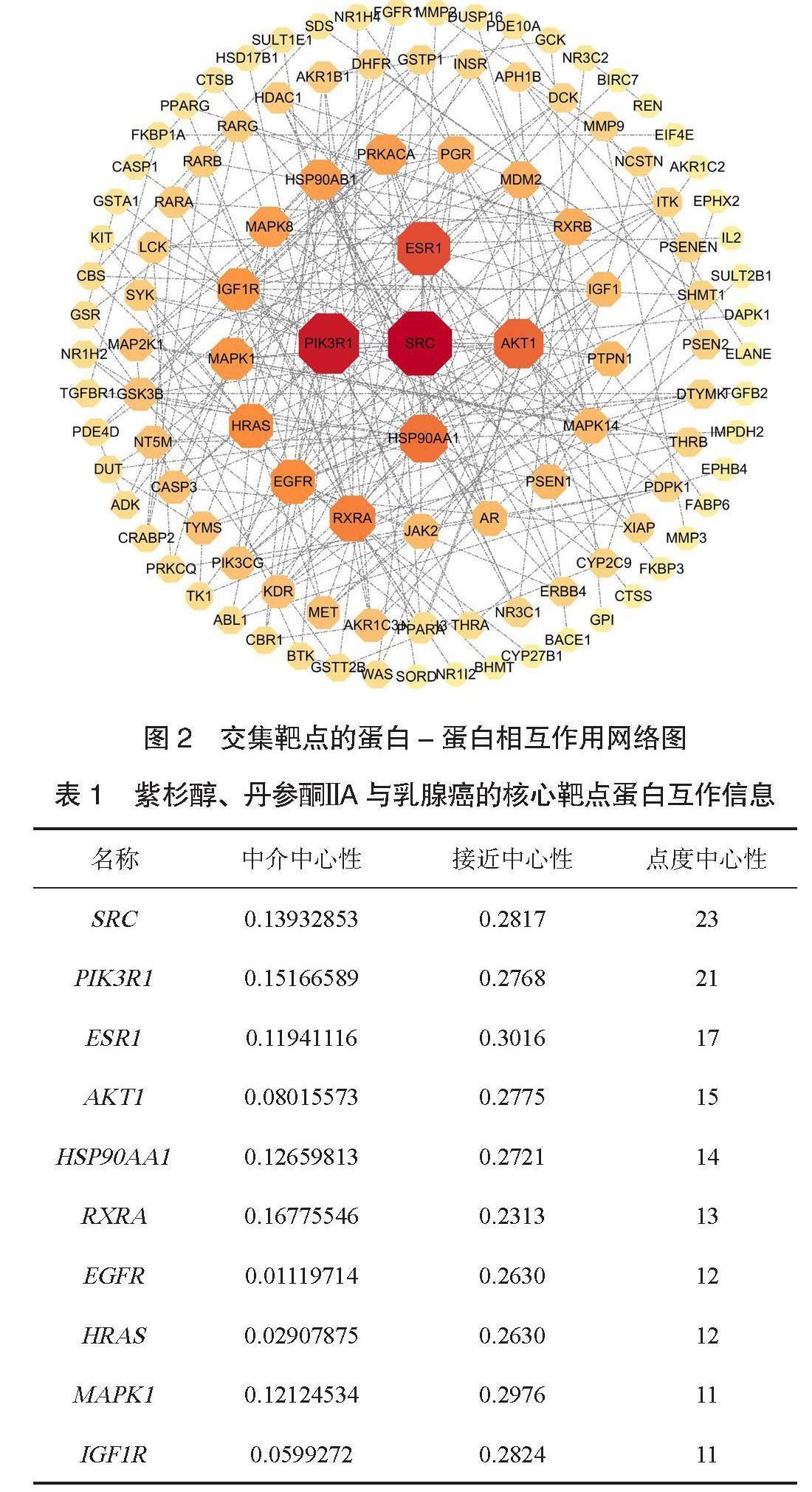
2.2 PPI网络及核心靶点 将图1中187个交集靶点导入Cytoscape 3.10.1软件建立PPI网络,见图2。通过Cytoscape3.10.1软件分析数据,筛选出紫杉醇联合丹参酮ⅡA治疗乳腺癌的前10个核心靶点,分别为原癌基因酪氨酸蛋白激酶(SRC)、磷酸肌醇 3-激酶调节亚基1(PIK3R1)、雌激素受体 1(ESR1)、丝氨酸和苏氨酸激酶1(AKT1)、热休克蛋白90 α家族A类成员1(HSP90AA1)、视黄醇X受体α(RXRA)、表皮生长因子受体(EGFR)、大鼠肉瘤蛋白同源蛋白(HRAS)、丝裂原活化蛋白激酶 1(MAPK1)、胰岛素样生长因子1受体(IGF1R),见表1。
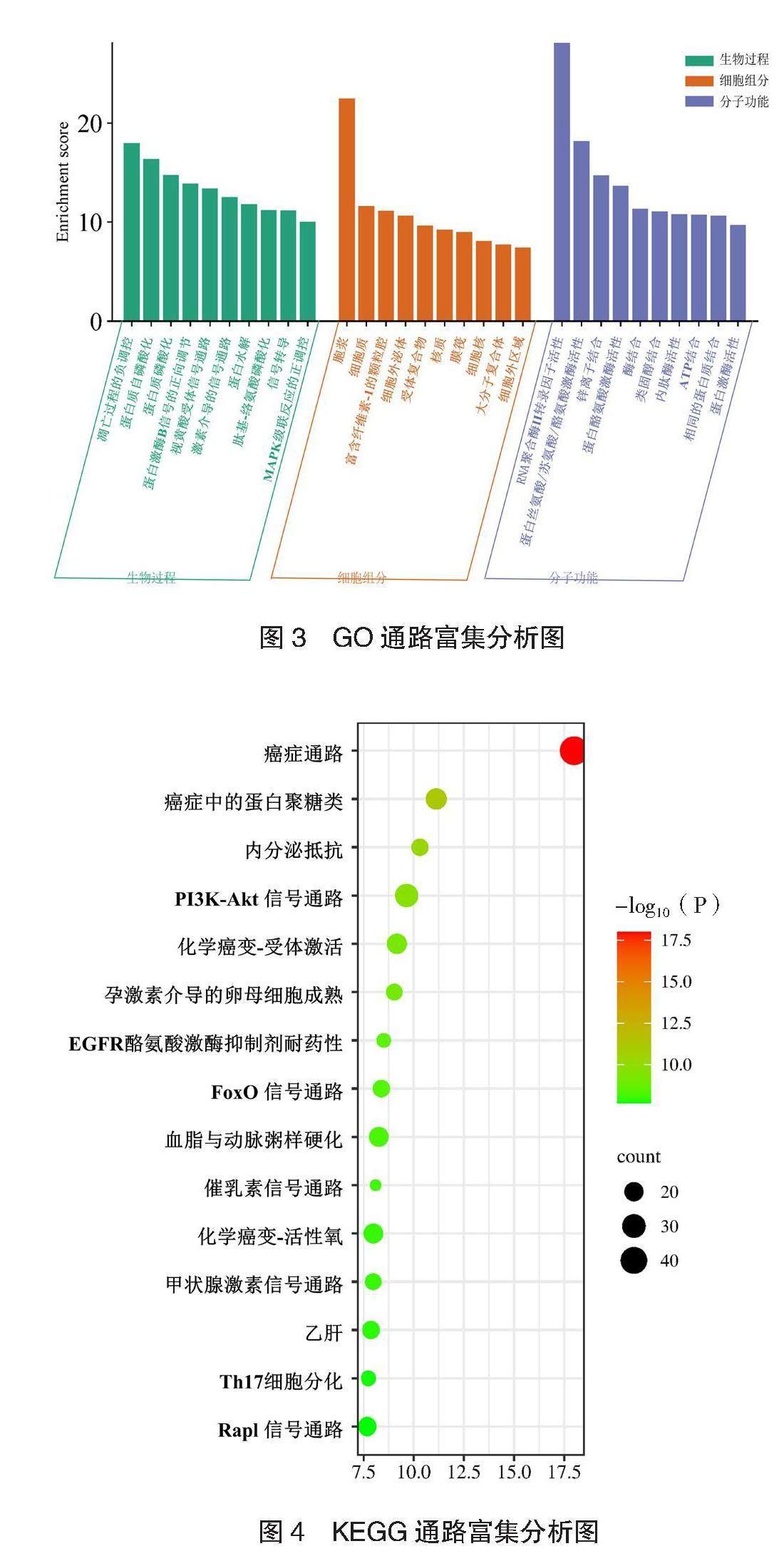
2.3 GO和KEGG通路富集分析结果 选取GO富集前10个条目,KEGG富集前15条目进行可视化,见图3、
图4。排名前5位的CC为胞质、细胞质、纤维凝胶蛋白-1颗粒腔、细胞外的外来体、复合受体。排名前5位BP为对凋亡过程的负向调控、蛋白质自身磷酸化、蛋白质磷酸化、蛋白激酶B信号的正向调节、视黄酸受体信号通路。排名前5的MF为RNA聚合酶Ⅱ转录因子活性、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、锌离子结合、蛋白酪氨酸激酶活性、酶结合。
3 讨论
乳腺癌是中国发病率最高的女性恶性肿瘤,严重威胁女性生命健康。在晚期乳腺癌患者治疗中,以紫杉醇类为基础的单药或联合用药方案(联合他滨类、铂类、单抗等)是目前治疗乳腺癌患者的一线首选方案。但有研究显示,长期使用紫杉醇类药物患者耐药率可达30%,且紫杉烷类药物剂量蓄积可导致心脏毒性[8]。心脏毒性已成为抗癌治疗的主要不良反应,其可能在治疗期间急性出现,也可能在治疗后数年内长期出现[9]。临床上,常将紫杉醇与丹参酮ⅡA联合使用,以提高治疗安全性。
乳腺癌根据内在基因表达上可以分为管腔上皮A型(Luminal A)、管腔上皮B型(Luminal B)、人表皮生长因子受体2(HER-2)阳性型及三阴性4种分子分型,不同分型的乳腺癌特异性病机皆是在肝郁脾虚、气机郁滞的基础上进一步发而来[10]。丹参是我国常用的大宗药材之一,具有活血化瘀,清心除烦等功效,其化学成分包括萜类化合物、酚酸类化合物及内酯类化合物,其中丹参酮ⅡA、隐丹参酮、丹参酮Ⅰ等是丹参发挥药效的主要化合物,具有抗炎、抗肿瘤等药理活性。丹参酮ⅡA已被证明具有多种药理活性,在心脏保护药物开发方面具有广阔的前景[11]。
有研究显示,丹参酮ⅡA通过激活磷酸腺苷活化蛋白激酶/哺乳动物雷帕霉素靶蛋白(AMPK-mTOR)信号通路,对抗IGF-ⅡR信号级联反应来抑制细胞凋亡,保护心肌细胞并改善心功能[12-14]。Hu 等[15]研究发现,丹参
酮ⅡA通过诱导死亡结构域相关蛋白(DAXX)、磷酸化激活的细胞外调节蛋白激酶1/2(p-ERK1/2)和磷酸化丝裂原细胞外激酶(p-MEK)的表达,来抑制凋亡相关蛋白,从而阻止心肌结构改变和肌原纤维破坏。丹参酮ⅡA还可通过电压依赖性阴离子通道1(VDAC1)抑制铁死亡、细胞凋亡,从而改善心肌缺血/再灌注损伤[16]。丹参酮ⅡA治疗乳腺癌是通过靶向类固醇敏感性调节蛋白相关脂类转运体结构域13(miR-125b/STARD13)轴减弱乳腺癌细胞的干性[17]。Liu等[18]研究发现,丹参酮ⅡA通过下调BCL2和上调TP53蛋白促进三阴性乳腺癌细胞凋亡。丹参酮ⅡA增强了阿霉素对乳腺癌的化疗效果,同时降低其不良反应,包括骨髓抑制、心脏毒性和肾毒性[19]。这些研究均提示丹参酮ⅡA具有较为明显的抗乳腺癌的活性。
网络药理学是一门借用计算机辅助预测方法系统研究和探索药物与疾病之间的复杂关系的综合性学科[20]。系统生物学认为,癌症等是由多个基因突变导致生物网络系统平衡被破坏而引起的。网络药理学用于分析多组分药物对人体的相互作用,有助于找到药物有效成分的治疗靶点,提高药物的疗效,减少药物不良反应。
本研究使用网络药理学分析结果显示,丹参酮ⅡA、紫杉醇与乳腺癌有187个交集靶点;丹参酮ⅡA联合紫杉醇治疗乳腺癌的核心靶点为SRC、PIK3R1、ESR1、AKT1、HSP90AA1、RXRA、EGFR、HRAS、MAPK1、IGF1R,主要与癌症中的蛋白聚糖类、内分泌的阻力、PI3K-Akt信号通路、化学致癌作用-受体活化通路相关。分析原因为:⑴Src激酶家族是具有酪氨酸蛋白激酶活性的蛋白质,包括Src、Blk、Fgr、Fyn、Hck、Lyn、Lck、Yes和Yrk等,在细胞增殖、分化、运动和定位等细胞进程中都发挥重要作用。临床上,多种SRC激酶抑制剂包括博舒替尼、达沙替尼等也广泛用于乳腺癌治疗的临床研究[21]。⑵PI3K通路包括 PI3K 催化亚基PIK3CA和 PI3K 调节亚基 PIK3R1,是癌症中最常改变的通路,敲除PIK3R1基因可使癌症对MEK抑制剂如(曲美替尼)敏感[22]。⑶ESR1基因突变可以发生在原发肿瘤中,并且在晚期乳腺癌转移过程中突变频率增加[23],PI3K/AKT/mTOR 通路与维持内分泌耐药有关,并已成为许多治疗阳性乳腺癌的新药的靶点[24]。⑷丝氨酸/苏氨酸激酶家族共发现了3种高度同源的亚型,即AKT1、AKT2和AKT3。通过抑制PI3K/Akt/mTOR通路诱导三阴性乳腺癌细胞凋亡[25]。⑸热休克蛋白(HSP)广泛存在各种生物细胞当中,当应激发生时,HSP可大量表达、起到抗炎、抗细胞凋亡及抗氧化作用。HSP20通过在心脏过表达,减少抗肿瘤药物诱导的心脏毒性,减少心脏细胞凋亡[26]。
综上所述,丹参酮ⅡA联合紫杉醇可能通过SRC、PIK3R1、ESR1、AKT1、HSP90AA1等核心靶点达到减毒增效作用,并调控PI3K/AKT等凋亡信号通路,介导细胞凋亡、氧化应激等多个生物过程治疗乳腺癌。
参考文献
CHHIKARA B S, PARANG K. Global cancer statistics 2022: The trends projection analysis[J]. Chemical Biology Letters, 2023, 10(1): 451.
TAO X, LI T, GANDOMKAR Z, et al. Incidence, mortality, survival, and disease burden of breast cancer in China compared to other developed countries[J]. Asia Pac J Clin Oncol, 2023, 19(6): 645-654.
AL-MAHAYRI Z N, ALAHMAD M M, ALI B R. Current opinion on the pharmacogenomics of paclitaxel-induced toxicity[J]. Expert Opin Drug Metab Toxicol, 2021, 17(7): 785-801.
ALI Y A, AHMED O M, SOLIMAN H A, et al. Rutin and hesperidin alleviate paclitaxel-induced nephrocardiotoxicity in wistar rats via suppressing the oxidative stress and enhancing the antioxidant defense mechanisms[J].Evid Based Complement Alternat Med, 2023: 5068304.
REN S, HUANG T, OU D, et al. Inhibition of TNF-α and JNK signaling pathway can reduce paclitaxel-induced apoptosis of mouse cardiomyocytes[J].Appl Bionics Biomech, 2022: 8460121.
ZHU L, CHEN L. Progress in research on paclitaxel and tumor immunotherapy. Cell Mol Biol Lett, 2019, 24: 40.
GUO R, LI L, SU J, et al. Pharmacological activity and mechanism of tanshinone ⅡA in related diseases[J]. Drug Des Devel Ther., 2020, 14: 4735-4748.
WERIDA R H, ELSHAFIEY R A, GHONEIM A, et al. Role of alpha-lipoic acid in counteracting paclitaxel- and doxorubicin-induced toxicities: A randomized controlled trial in breast cancer patients[J]. Support Care Cancer, 2022, 30(9): 7281-7292.
MUDDTW J R, KHALID M, GUDDATI A K. Cardiotoxicity of chemotherapy and targeted agents[J]. Am J Cancer Res, 2021, 11(4): 1132-1147.
张一鸣,田辛晨,王宇飞,等.基于分子分型的乳腺癌中医精准辨治思路探讨[J].北京中医药大学学报, 2023, 46(7): 1025-1031.
Zhou Z Y, Zhao W R, Zhang J, et al. Sodium tanshinone ⅡA sulfonate: A review of pharmacological activity and pharmacokinetics[J]. Biomed Pharmacother, 2019, 118: 109362.
ZHANG X, WANG Q, WANG X, et al. Tanshinone ⅡA protects against heart failure post-myocardial infarction via AMPKs/mTOR-dependent autophagy pathway[J].Biomed Pharmacother, 2019, 112: 108599.
CHAI R, YE Z, XUE W,et al. Tanshinone ⅡA protects against heart failure post-myocardial infarction via AMPKs/mTOR-dependent aut Tanshinone ⅡA inhibits cardiomyocyte pyroptosis through TLR4/NF-κB p65 pathway after acute myocardial infarction[J]. Front Cell Dev Biol, 2023, 11: 1252942.
CHOU S L, RAMESH S, KUO C H, et al.Tanshinone ⅡA inhibits Leu27IGF-Ⅱ-induced insulin-like growth factor receptor Ⅱ signaling and myocardial apoptosis via estrogen receptor-mediated Akt activation[J].Environ Toxicol, 2022, 37(1): 142-150.
HU T, ZOU H X, LE S Y, et al.Tanshinone ⅡA confers protection against myocardial ischemia/reperfusion injury by inhibiting ferroptosis and apoptosis via VDAC1[J].Int J Mol Med, 2023, 52(5): 109.
FANG Y, DUAN C, CHEN S, et al. Tanshinone ⅡA inhibits myocardial infarct via decreasing of the mitochondrial apoptotic signaling pathway in myocardiocytes[J]. Int J Mol Med, 2021, 48(2): 158.
LI X, JIA Q, ZHOU Y, et al.Tanshinone ⅡA attenuates the stemness of breast cancer cells via targeting the miR-125b/STARD13 axis[J].Exp Hematol Oncol, 2022, 11(1): 2.
LIU J, ZHANG C, LIU S, et al. Tanshinone ⅡA promotes apoptosis by downregulating BCL2 and upregulating TP53 in triple-negative breast cancer[J]. Naunyn Schmiedebergs Arch Pharmacol, 2023, 396(2): 365-374.
LI K, LIU W, ZHAO Q,et al. Combination of tanshinone ⅡA and doxorubicin possesses synergism and attenuation effects on doxorubicin in the treatment of breast cancer[J]. Phytother Res, 2019, 33(6): 1658-1669.
TANG J, AITTOKALLIO T. Network pharmacology strategies toward multi-target anticancer therapies: From computational models to experimental design principles[J]. Curr Pharm Des, 2014, 20(1): 23-36.
LUO J, ZOU H, GUO Y, et al. SRC kinase-mediated signaling pathways and targeted therapies in breast cancer[J]. Breast Cancer Res, 2022 ,24(1): 99.
TURTURRO S B, NAJOR M S, YUNG T, et al. Somatic loss of PIK3R1 may sensitize breast cancer to inhibitors of the MAPK pathway[J]. Breast Cancer Res Treat, 2019 ,177(2): 325-333.
孔启超,王伏生.晚期乳腺癌ESR1基因突变患者内分泌治疗相关研究进展[J].现代肿瘤医学, 2024, 32(1): 189-193.
NUNNERY S E, MAYER I A. Targeting the PI3K/AKT/mTOR pathway in hormone-positive breast cancer[J]. Drugs, 2020, 80(16): 1685-1697.
SHARMA P, KHAN M A, NAJMI A K, et al. Myricetin-induced apoptosis in triple-negative breast cancer cells through inhibition of the PI3K/Akt/mTOR pathway[J]. Med Oncol, 2022, 39(12): 248.
LAN Y, WANG Y, HUANG K, et al. Heat shock protein 22 attenuates doxorubicin-induced cardiotoxicity via regulating inflammation and apoptosis[J]. Front Pharmacol, 2020, 25(11): 257.
