基于网络药理学和分子对接技术的2,3-吲哚醌抗少弱精症机制研究
2024-07-05倪倍倍代梦毕晓林赵志臣岳旺隋忠国
倪倍倍 代梦 毕晓林 赵志臣 岳旺 隋忠国
摘要:为研究2,3-吲哚醌(isatin, ISA)治疗少弱精症的可能作用靶点和作用机制,基于公共数据库分别获取ISA作用靶点和少弱精症相关疾病靶点,确定交集靶点,采用Cytoscape 软件获取核心靶点。通过GO功能富集和KEGG通路分析交集靶点,采用分子对接预测ISA与靶点蛋白的结合能力。研究结果显示,ISA干预少弱精症主要涉及氧化应激、细胞凋亡和炎症等生物学过程,并与p53信号通路、细胞衰老通路和IL-17信号通路密切相关;经筛选确定8个核心靶点,ISA与其中6个核心靶点稳定结合。这表明,ISA可能通过作用于核心靶点CASP3、TP53、ESR1、PTGS2、TNF和ANXA5,调控p53信号通路和IL-17信号通路发挥抗少弱精症作用。
关键词:2,3-吲哚醌;网络药理学;少弱精症;分子对接
中图分类号:R963
文献标志码:A
不孕不育作为全球公共卫生问题,影响约15%的夫妇,其中男性因素约占一半[1]。少弱精症是造成男性不育主要因素,其发生率约占男性不育症患者75%左右,严重影响男性生殖健康[2]。少弱精症包括少精症(oligospermia)和弱精症(asthenozoospermia),以精子密度和活动力下降为特征。少弱精症的发生与精浆异常、环境、精索静脉曲张等因素相关[3],具体发病机制仍未完全阐明,且缺乏有效的治疗药物[4],亟待开发抗少弱精症新药。2,3-吲哚醌(isatin,ISA)作为广泛存在于动植物体内天然小分子化合物,是人体组织和体液中一种重要内源性生物活性物质[5]。研究发现,ISA具有抗氧化应激、抗凋亡、抗炎、抗肿瘤、抗衰老、神经保护和抗菌等多种生物学活性[6]。哺乳动物大鼠各组织中ISA呈特异性分布,输精管和精囊中ISA浓度最高且百倍高于其他组织[7-8]。这一现象提示ISA可能对精子有特殊保护作用。本课题组前期动物实验结果显示,ISA可改善少弱精症模型大鼠精子活动力及促进精子发生,但作用机制尚不明确[9]。因此,本文利用网络药理学和分子对接技术,筛选ISA抗少弱精症的关键靶点,获取ISA抗少弱精症的信号通路,以预测ISA治疗少弱精症的可能机制。
1 研究方法
1.1 ISA作用靶点筛选获取
PubChem数据库输入“isatin”后,基于Chemical-Gene Co-Occurrences in Literature、Protein Bound 3-D Structures、Chemical-Target Interactions和BioAssay Results收集化合物—蛋白质相互作用靶点信息。获得ISA 2D结构图后,分别上传至pharmMapper数据库和Swiss Target Prediction数据库,预测ISA作用靶点。合并3个数据库所得靶点,去除重复后确定ISA作用靶点。借 助 UniProt 数 据 库(http://www.uniprot.org/)规范ISA作用靶点的基因名称。
1.2 少弱精症相关疾病靶点筛选
以“oligospermia”和“asthenozoospermia”为关键词,检索GeneCards数据库(https://www. genecards.org)和DisGeNET 数据库(https://www.disgenet.org/)中与少弱精症相关的疾病靶点。根据相关性分数(Relevance score)值筛选GeneCards数据库检索结果,只接受大于相关性分数值中位数的靶点。合并2个数据库所得疾病靶点,去除重复后确定与少弱精症相关的疾病靶点。
1.3 蛋白—蛋白互作网络构建和核心靶点筛选
ISA作用靶点与少弱精症相关疾病靶点分别上传至在线Venny平台(http://bioinformatics.psb.ugent.be/webtools/Venn/)完成映射,得药物疾病交集靶点。导入交集靶点至线数据库STRING(https://string-db.org/),完成蛋白-蛋白互作(protein-protein interaction,PPI)分析。PPI分析结果导入Cytoscape 3.7.2 软件后,采用插件Cyot NCA 分析其度中心性(Degree Centrality,DC)、特征向量中心性(Eigenvector Centrality,EC)、介数中心性(Betweenness Centrality,BC)和紧密中心性(Closeness Centrality,CC)的网络拓扑特征值。以超过上述4种网络拓扑特征值的中位数作为筛选标准,确定核心靶点。
1.4 GO富集分析和KEGG 信号通路分析
使用R 4.1.2软件中ClusterProfiler包,针对交集靶点完成基因本体(Gene Ontology,GO)功能富集和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析。取GO富集分析的富集基因数前10位做可视化处理。KEGG通路分析结果以P < 0.05为筛选标准,按P由小到大取前20位做可视化处理。
1.5 分子对接
RCSB PDB蛋白质结构数据库(https://www.rcsb.org/)下载核心靶点的蛋白3D结构。PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载ISA分子的3D结构,通过Open Babel软件完成格式转换。借助Auto Dock Tools优化ISA分子结构,核心靶点蛋白结构做脱水和氢化处理。优化后的ISA分子和核心靶点蛋白保存为PDBQT格式。左卡尼汀(少弱精症常用治疗药物)作为阳性对照[10],与ISA做相同处理。采用Auto Dock Tools软件做分子对接,对接结果使用PyMOL可视化。
2 结果
2.1 ISA作用靶点及少弱精症相关疾病靶点
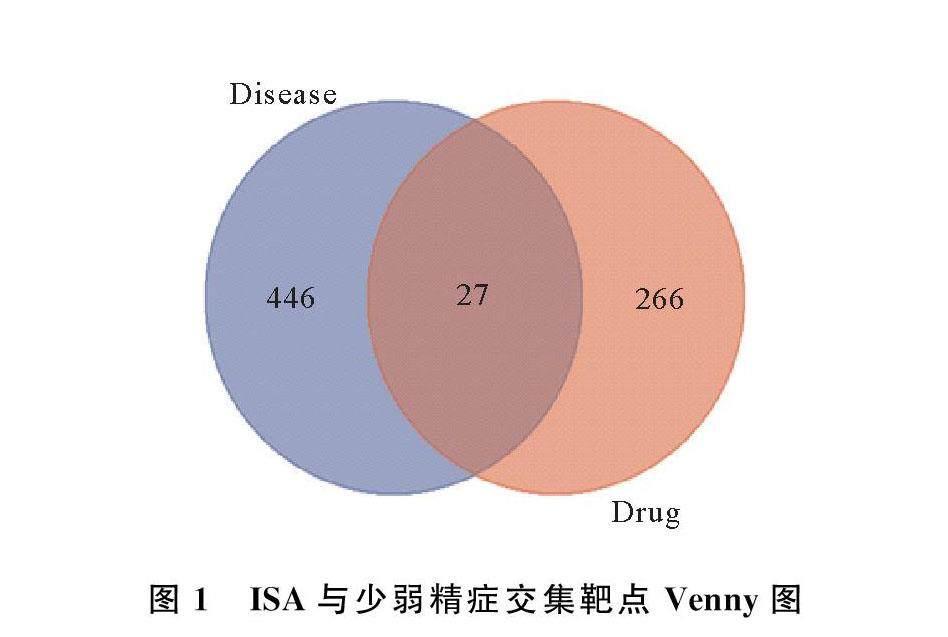
通过PubChem数据库筛选后得121个ISA作用靶点,通过PharmMapper数据库得89个ISA作用靶点,通过Swiss target Prediction数据库筛选后得109个作用靶点,合并所得ISA作用靶点并去除重复,共得266个ISA作用靶点。通过GeneCards数据库筛选得440个少弱精症相关疾病靶点,经DisGeNET 数据库检索得381个少弱精症相关疾病靶点,合并所得疾病靶点并去除重复,最终确定466个疾病靶点。
2.2 PPI网络构建和核心靶点确定
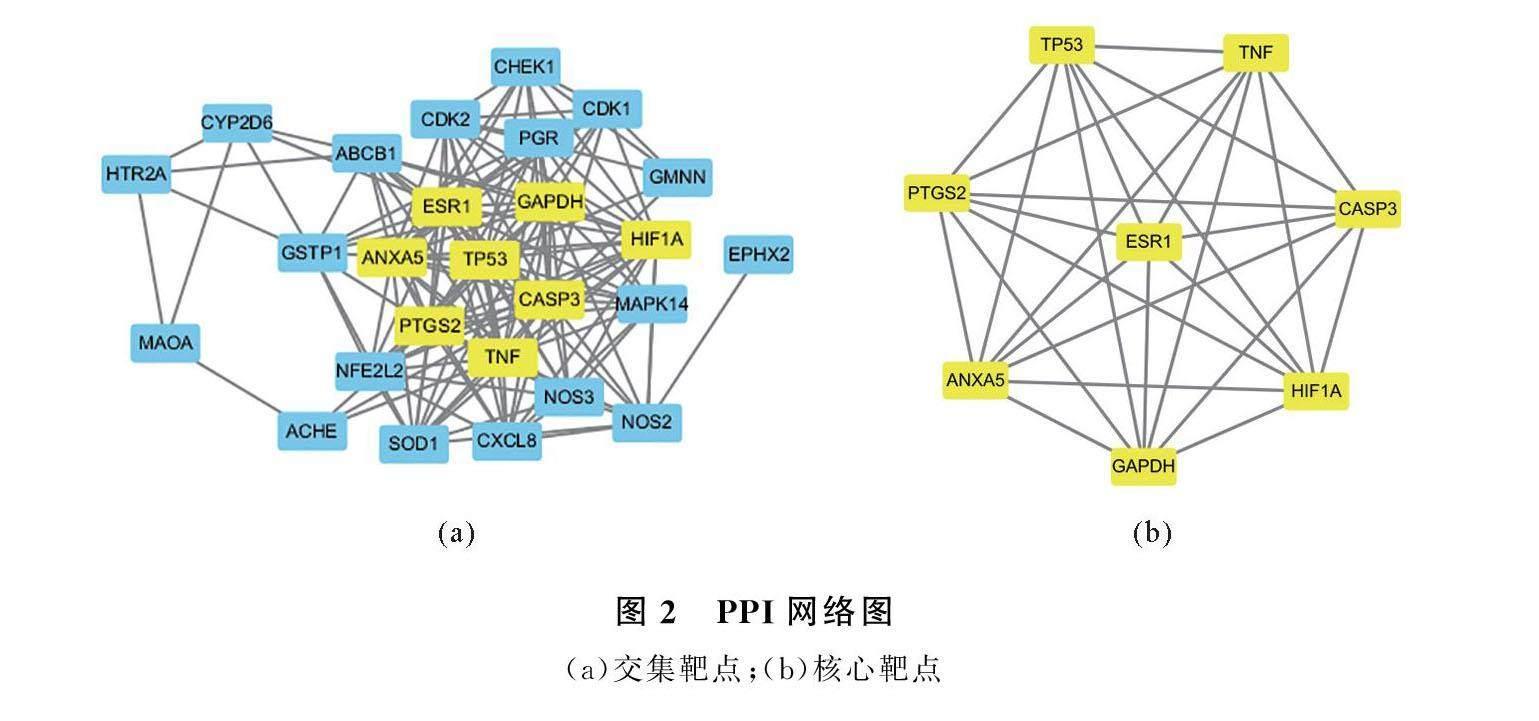
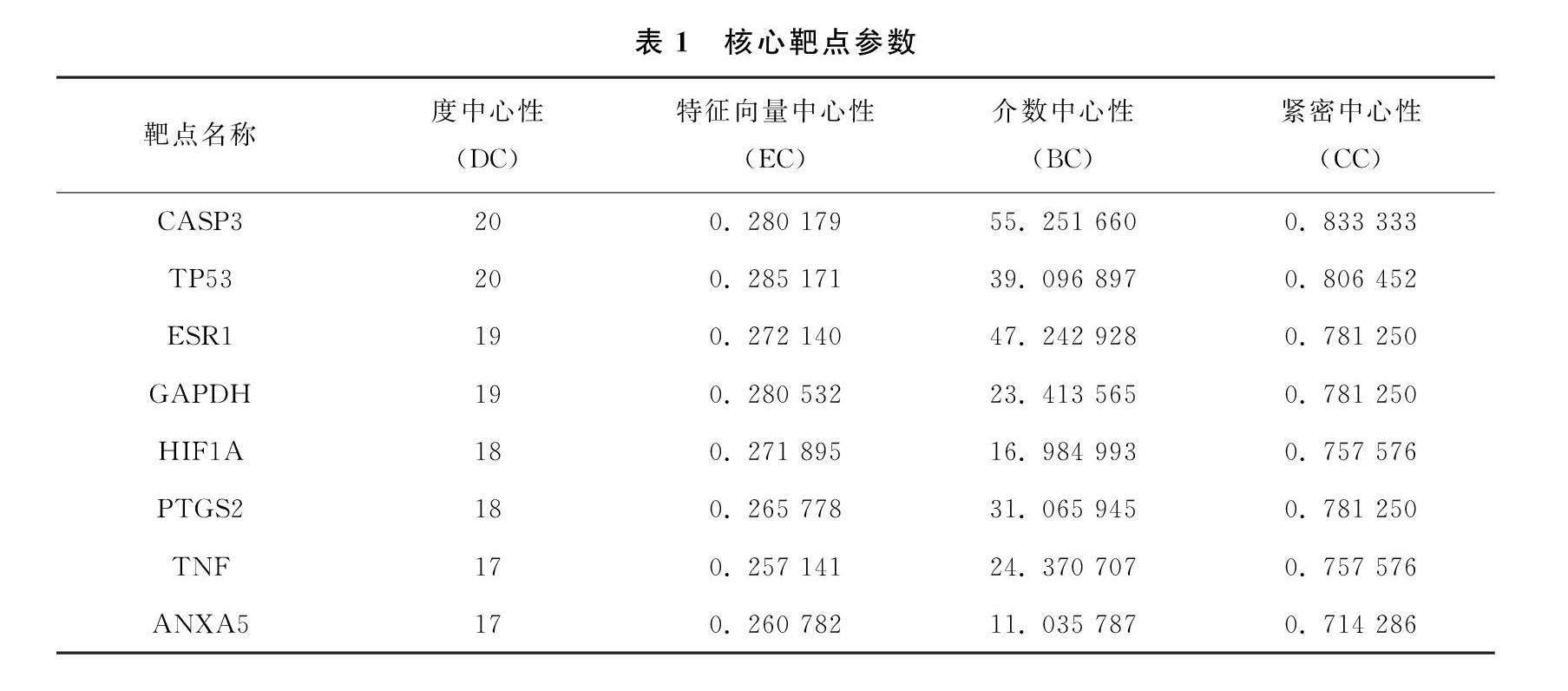
通过分别上传ISA作用靶点与少弱精症相关疾病靶点至在线Venny 平台映射后,得27个交集靶点(图1)。交集靶点导入STRING数据库,做交集靶点PPI网络分析(图2(a))。基于Cytoscape 软件的Cyto NCA插件,拓扑分析交集靶点PPI网络,计算DC、EC、BC和CC中位数分别为12、019、83和063。由表1和图2(b)可知,有8个交集靶点参数大于上述参数中位数,则确定为核心靶点,分别是细胞凋亡相关半胱氨酸蛋白酶3(CASP3)、肿瘤蛋白p53(TP53)、雌激素受体1(ESR1)、甘油醛-3-磷酸脱氢酶(GAPDH)、缺氧诱导因子-1α(HIF1A)、前列腺素内过氧化物酶2(PTGS2)、肿瘤坏死因子(TNF)和膜联蛋白A5(ANXA5)。
2.3 GO功能富集和KEGG通路分析
利用R 4.1.2软件中ClusterProfiler包,针对ISA与少弱精症的交集靶点做GO功能富集分析和KEGG通路富集分析。GO分析结果显示,与生物过程(biological processes,BP)相关条目共905条,主要涉及对外源性刺激的反应、氧化应激反应、活性氧代谢过程、细胞周期调控、对肿瘤坏死因子反应和对凋亡信号通路的反应等;与细胞组分(cellular components,CC)相关条目有20条,主要包括转录调控复合物、膜阀、质膜微区和过氧化物酶体等;与分子功能(molecular functions,MF)相关条目有63条,主要包括DNA结合转录因子结合、转录共调节因子结合、转录共激活因子调节、氧化还原酶活性等。根据富集基因数,分别选取BP、CC和MF前10位条目绘制条形图(图3(a))。KEGG通路富集分析共得相关通路78条,主要包括p53信号通路、细胞衰老通路和IL-17信号通路等,按P由小到大选取前20条目绘制条形图(图3(b))。
2.4 分子对接
查阅以往研究成果[11-18],确定核心靶点蛋白与小分子结合位点,使用Grid模块参照结合位点设置对接盒子参数(表2)。ISA与8个核心靶点(CASP3、TP53、ESR1、GAPDH、HIF1A、PTGS2、TNF和ANXA5)分别做分子对接和可视化分析(图4)。分子对接的结合自由能越小,配体与受体结合越稳定,相互作用的可能性越大[19]。结合能小于0 kcal·mol-1时,说明配体与受体有结合潜力;结合能小于-5 kcal·mol-1时,说明配体与受体结合稳定[20]。由表3可知,阳性药左卡尼汀与8个核心靶点对接结合能均小于0 kcal·mol-1,仅与TNF的结合能小于-5 kcal·mol-1。ISA与8个核心靶点结合能均小于0 kcal·mol-1,与CASP3、TP53、ESR1 、PTGS2、TNF和ANXA5的结合能小于-5 kcal·mol-1。
3 讨论
影响精子数量和质量的因素包括氧化应激、炎症、免疫紊乱和DNA损伤等[21]。本研究GO功能富集分析表明ISA主要通过参与氧化应激、细胞凋亡和炎症生物学过程发挥作用,此生物学过程与既往研究中影响精子数量和质量的因素一致。本研究中KEGG通路分析推测ISA可能通过调控p53信号通路、细胞衰老通路和IL-17信号通路发挥改善少弱精症的作用,p53信号通路是与细胞凋亡相关的重要通路之一。正常的精子发生过程中,凋亡是机体清除过量或异常生精细胞、维持正常精子数量的重要方式,但精子过多凋亡则是少弱精症的重要原因之一[22]。研究发现,男性少弱精症患者中p53表达增加,凋亡活跃[23]。动物实验显示,删除调节因子Pumilio 1,可导致p53强烈激活并导致精母细胞凋亡和精子生成破坏,而去除p53可挽救Pumilio 1缺失小鼠的细胞凋亡并改善精子生成[24]。衰老可影响男性生殖力,胰岛素信号通路是衰老相关关键信号通路之一,抑制胰岛素信号通路可改善生殖衰老及提高生育能力[25]。IL-17信号通路通过激活核因子κB(nuclear factor-κB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路介导炎症的发生和发展[26],病毒感染情况下精液中IL-17异常高表达并对精子存活率及精子密度产生负面影响[27]。
靶点蛋白互作网络筛选出核心靶点后,分子对接验证显示ISA与核心靶点蛋白的结合力及结合靶标数量均优于阳性药左卡尼汀。ISA与CASP3、TP53、ESR1、PTGS2、TNF和ANXA5结合稳定(结合能<-5 kcal·mol-1),可能是ISA抗少弱精症的关键靶点,并普遍与凋亡和炎症相关。CASP3是细胞凋亡的主要执行者,接受上游信号被激活后作为特异性底物诱发细胞染色质浓集、DNA片段化,从而促进凋亡[28]。研究调查发现,少弱精症患者的精子中CASP3活性显著升高,CASP3蛋白表达增加,说明少弱精症患者精子细胞凋亡活跃[29]。TP53是凋亡相关p53信号通路的关键成分,可与受损DNA结合而阻滞细胞周期,诱导细胞凋亡,TP53过度激活会导致精子过多凋亡而发生少弱精症[30]。研究发现,相较于正常精子细胞,弱精子细胞中TP53表达显著增加[21]。ESR1所表达的雌激素受体α可调控精子发生和成熟[31],ESR1敲除小鼠睾丸萎缩,精子数目减少,导致生殖能力下降甚至不育[32]。PTGS2又名环氧化酶-2,是体内催化花生四烯酸合成前列腺素的诱导型关键酶,低氧环境下,PTGS2可被HIF1A诱导产生,在输精管及附睾中组成型表达并参与炎症反应[33]。TNF 是炎症反应的核心细胞因子,通过诱导炎症基因表达及诱导细胞死亡驱动炎症反应[34]。男性生殖系统中TNF水平增加可降低精子活力、破坏线粒体功能和DNA完整性,相较于生育力正常的男性,少弱精症患者精液中TNF水平显著升高[21]。ANXA5属于Ca2+依赖的磷脂结合蛋白家族,Ca2+存在时,胞外ANXA5与凋亡细胞外翻的特征标志物磷酯酰丝氨酸特异性结合可示踪凋亡细胞;胞内ANXA5则有促凋亡作用[35]。ISA稳定结合的关键靶点与凋亡和炎症密切相关,推测ISA抗少弱精症的机制最可能涉及的通路是凋亡相关p53信号通路和炎症相关IL-17信号通路,为后续研究指明方向。
4 结论
本研究采用网络药理学和分子对接方法,通过化学信息学数据库和生物信息学数据库,筛选了ISA抗少弱精症的核心靶点和通路,预测了ISA抗少弱精症机制。ISA可能通过作用于核心靶点CASP3、TP53、ESR1、PTGS2、TNF和ANXA5,调控p53信号通路和IL-17信号通路发挥抗少弱精症作用。今后将围绕关键靶点和通路开展动物及细胞实验研究,为开发抗少弱精症新药提供参考。
参考文献
[1]HEIDARY Z, SALIMINEJAD K, ZAKI-DIZAJI M, et al. Genetic aspects of idiopathic asthenozoospermia as a cause of male infertility[J]. Human Fertility, 2020, 23(2): 83-92.
[2]邓伟民, 孙大林, 蔡滨, 等. 淫羊藿苷基于PLCγ1/AKT/eNOS/NO信号通路改善大鼠少弱精症[J]. 中药材, 2023, 46(7): 1772-1776.
[3]刘媛, 葛平玉. 中医药治疗少、弱精子症的现状[J]. 贵阳中医学院学报, 2019, 41(6): 79-83.
[4]杨晶, 袁轶峰, 朱文雄, 等. 调治天癸方对环磷酰胺致少弱精症模型大鼠生精细胞凋亡的影响[J]. 中成药, 2019, 41(11): 2785-2787.
[5]GLOVER V, HALKET J M, WATKINS P J, et al. Isatin: Identity with the purified endogenous monoamine oxidase inhibitor tribulin[J]. Journal of Neurochemistry, 1988, 51(2): 656-659.
[6]MEDVEDEV A, BUNEEVA O, GNEDENKO O, et al. Isatin, an endogenous nonpeptide biofactor: A review of its molecular targets, mechanisms of actions, and their biomedical implications[J]. Biofactors, 2018, 44(2): 95-108.
[7]ARMANDO I, GLOVER V, SANDLER M. Distribution of endogenous benzodiazepine receptor ligand-monoamine oxidase inhibitory activity (tribulin) in tissues[J]. Life Science, 1986, 38(22): 2063-2067.
[8]WATKINS P, CLOW A, GLOVER V, et al. Isatin, regional distribution in rat brain and tissues[J]. Neurochemistry International, 1990, 17(2): 321-323.
[9]岳旺, 石振艳, 刘占涛, 等. 吲哚-2,3-二酮在制备改善生精障碍药物中的应用: 102210675B[P]. 2012-07-04.
[10] 杨文军, 董志灵, 卢友. 生精片联合左卡尼汀治疗少弱精症的疗效及其对精子质量的影响[J]. 临床合理用药, 2023, 16(9): 124-127.
[11] KANEKO N, AGO H, MATSUDA R, et al. Crystal structure of annexin V with its ligand K-201 as a calcium channel activity inhibitor[J]. Journal of Molecular Biology, 1997, 274(1): 16-20.
[12] CHOONG I C, LEW W, LEE D, et al. Identification of potent and selective small-molecule inhibitors of caspase-3 through the use of extended tethering and structure-based drug design[J]. Journal of Medicinal Chemistry, 2002, 45(23): 5005-5022.
[13] CELIK L, LUND J D D, SCHITT B. Conformational dynamics of the estrogen receptor α: Molecular dynamics simulations of the influence of binding site structure on protein dynamics[J]. Biochemistry, 2007, 46(7): 1743-1758.
[14] JENKINS J L, TANNER J J. High-resolution structure of human D-glyceraldehyde-3-phosphate dehydrogenase[J]. Acta Crystallographica Section D-Structural Biology, 2006, 62: 290-301.
[15] DAMES S A, MARTINEZ-YAMOUT M, DE GUZMAN R N, et al. Structural basis for Hif-1α/CBP recognition in the cellular hypoxic response[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(8): 5271-5276.
[16] LUCIDO M J, ORLANDO B J, VECCHIO A J, et al. The crystal structure of aspirin-acetylated human cyclooxygenase-2: Insight into the formation of products with reversed stereochemistry[J]. Biochemistry, 2016, 55(8): 1226-1238.
[17] HE M M, SMITH A S, OSLOB J D, et al. Small-molecule inhibition of TNF-α[J]. Science, 2005, 310: 1022-1025.
[18] KUSSIE P H, GORINA S, MARECHAL V, et al. Structure of the MDM2 oncoprotein bound to the p53 tumor suppressor transactivation domain[J]. Science, 1996, 274: 948-953.
[19] 徐奥, 周慧玲, 沈铁柱, 等. 基于GEO基因芯片结合网络药理学和分子对接技术探究玉屏风散治疗原发性肾病综合征的作用机制研究[J]. 中国处方药, 2023, 21(10): 1-7.
[20] 杨爱霞, 鲁力, 柳佚雯. 基于网络药理学及分子对接验证探讨退热解毒灵清热抗炎机制[J]. 中国医院药学杂志, 2021, 41(21): 2186-2191.
[21] GHANDEHARI-ALAVIJEH R, ZOHRABI D, TAVALAEE M, et al. Association between expression of TNF-α, P53 and HIF1α with asthenozoospermia[J]. Human Fertility, 2019, 22(2): 145-151.
[22] 王平, 戴研平, 杨薇, 等. 不育患者凋亡生精细胞与ACP超微结构的关系[J]. 检验医学, 2018, 33(6): 472-475.
[23] RAHBAR S, NOVIN M G, ALIZADEH E, et al. New insights into the expression profile of MicroRNA-34c and P53 in infertile men spermatozoa and testicular tissue[J]. Cellular and Molecular Biology, 2017, 63(8): 77-83.
[24] CHEN D, ZHENG W, LIN A P, et al. Pumilio 1 suppresses multiple activators of p53 to safeguard spermatogenesis[J]. Current Biology, 2012, 22 (5): 420-425.
[25] SEPIL I, HOPKINS B, DEAN R, et al. Male reproductive aging arises via multifaceted mating-dependent sperm and seminal proteome declines, but is postponable in Drosophila[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(29): 17094-17103.
[26] LI X X, BECHARA R, ZHAO J J, et al. Interleukin 17 receptor-based signaling and implications for disease[J]. Nature Immunology, 2019, 20(12): 1594-1602.
[27] QIAN L, LI Q, LI H B. Effect of hepatitis B virus infection on sperm quality and oxidative stress state of the semen of infertile males[J]. American Journal of Reproductive Immunology, 2016, 76(3): 183-185.
[28] 黄健清, 梁红玲, 张绪超, 等. CASP3与Cleaved-CASP3在肺癌中的表达及意义[J]. 实用医学杂志, 2012, 28(8): 1247-1250.
[29] MOHAMMADI P, MESBAH-NAMIN S A, MOVAHEDIN M. Attenuation of aquaporin-3 may be contributing to low sperm motility and is associated with activated caspase-3 inasthenozoospermic individuals[J]. Andrologia, 2021, 53(8): e14119.
[30] DE MORAIS M P, CURADO R F, E SILVA K S F, et al. Male idiopathic infertility and the TP53 polymorphism in codon 72[J]. Genetics and Molecular Research, 2016, 15(4): gmr15048882.
[31] 孟繁超, 李海松, 王彬, 等. 基于网络药理学探讨菟丝子-枸杞子治疗少弱精子症的作用机制[J]. 中国男科学杂志, 2022, 36 (3): 29-37.
[32] 李新阳, 孙自学. 基于网络药理学和分子对接探讨益肾通络补气方对少弱精症大鼠雌激素受体的影响[J]. 中成药, 2021, 43(11): 3216-3221.
[33] SALVOLINI E, BULDREGHINI E, LUCARINI G, et al. Interleukin-1β, cyclooxygenase-2, and hypoxia-inducible factor-1α in asthenozoospermia[J]. Histochemistry and Cell Biology, 2014, 142(5): 569-575.
[34] VAN LOO G, BERTRAND M J M. Death by TNF: A road to inflammation[J]. Nature Reviews Immunology, 2023, 23(5): 289-303.
[35] 王小杰, 李欣, 武彦秋, 等. 膜联蛋白A5的结构与功能研究进展[J]. 承德医学院学报, 2010, 27(4): 413-415.
Mechanistic Study of Isatin Against Oligoasthenozoospermia
Based on Network Pharmacology and Molecular Docking
NI Bei-bei1a, DAI Meng1a, BI Xiao-lin1b, ZHAO Zhi-chen1a,YUE Wang2, SUI Zhong-guo1a
(1. a. Department of Pharmacy, b. Department of Nutrition, The Affiliated Hospital of Qingdao University, Qingdao 266000, China;
2. Nursing and Health College, Qingdao Huanghai University, Qingdao 266427, China)
Abstract:
To investigate the potential targets and mechanisms of isatin (ISA) in the treatment of oligoasthenozoospermia, targets of ISA and disease-related targets were identified utilizing public databases to find intersecting targets. Core targets were then determined using Cytoscape software. GO functional enrichment and KEGG pathway analyses on the intersecting targets were conducted, and molecular docking was used to predict the binding affinity of ISA with core target proteins. The results indicate that ISA′s intervention in oligoasthenozoospermia primarily involves biological processes such as oxidative stress, apoptosis, and inflammation, and is closely related to the p53 signaling pathway, the cell senescence pathway, and the IL-17 signaling pathway. After screening, eight core targets were identified, with ISA stably binding to six of them. Those suggest that ISA may exert its anti-oligoasthenospermia effects by modulating the p53 signaling pathway and the IL-17 signaling pathway through core targets including CASP3, TP53, ESR1, PTGS2, TNF and ANXA5.
Keywords: isatin; network pharmacology; oligoasthenozoospermia; molecular docking
