油茶根际土壤拮抗菌分离鉴定及其对油茶炭疽病的防效
2024-07-03桑梦科刘君昂周国英
桑梦科 刘君昂 周国英

doi:10.15889/j.issn.1002-1302.2024.10.019
摘要:油茶炭疽病是由多种真菌引起的主要危害油茶叶片和果实的病害,其发生严重时会影响油茶的产量。为从土壤中寻找对油茶炭疽病具有生防潜力的拮抗菌,通过稀释涂布平板法分离出可人工培养的微生物与指示菌平板对峙试验,经过初筛和复筛确定目标菌株。对目标菌株进行形态特征观察、生理生化鉴定及功能验证。利用盖玻片斜插法于显微镜下观察目标菌株对指示菌菌丝的影响,并进行抑菌谱试验。利用离体刺伤接种试验,验证目标菌株对油茶炭疽病发生的防治效果和治疗效果。通过16S rDNA基因扩增技术、gyrA基因扩增技术,对目标菌株进行分子鉴定。结果表明:从土壤中分离出可培养不同菌落形态的菌株 34 株,结合初筛、复筛,将菌株YFB-10-3-2确定为目标菌株。菌株YFB-10-3-2具有产生解淀粉酶、解纤维素酶、蛋白酶的能力和固氮功能,能使指示菌菌丝膨大、弯曲。进一步试验发现,目标菌株对10种病原菌的抑制率为46%~72%,表明该菌株具有抑菌广谱性。室内试验发现,该菌株对油茶炭疽病有68.11%的预防效果和28.60%的治疗效果,结合形态特征和生理生化试验,通过双基因分子鉴定,将菌株YFB-10-3-2鉴定为贝莱斯芽孢杆菌。综上,菌株YFB-10-3-2具有开发成为油茶炭疽病生防菌剂的巨大潜力。
关键词:油茶;拮抗细菌;分离;鉴定;离体防效;生物防治
中图分类号:S763.744;S182 文献标志码:A
文章编号:1002-1302(2024)10-0145-08
收稿日期:2023-06-13
基金项目:中央财政林业科技推广示范资金(编号:[2022]XT18);湖南省林业科技攻关与创新项目(编号:XLKY202321);湖南省油茶产业发展资金(编号:湘财资环指[2023]16号、66号)。
作者简介:桑梦科(1996—),男,河南平舆人,硕士研究生,主要从事生物农药研究。E-mail:1604306243@qq.com。
通信作者:周国英,博士,教授,博士生导师,主要从事微生物资源开发与利用、林业微生物、植物检疫方面的研究。E-mail:s2393694264@outlook.com。
油茶为山茶科(Theaceae) 山茶属(Camellia)植物中油脂含量较高且具有栽培经济价值的一类植物的总称,是我国特有的油料树种,主要种植于秦岭、淮河以南地区,至今已有2 300多年的种植历史。油茶籽压榨出的茶油对人体具有多种功效,素有“东方橄榄油”的美誉。2022年5月国家林业和草原局指出,到2025年全国油茶种植面积力争超过600万hm2。随着种植面积的扩大,油茶病害的发生率提高。油茶炭疽病是影响油茶产量最主要的病害之一,每年由油茶炭疽病引起的油茶减产达10%~30%,重病区可减产50%以上,给种植户带来了巨大的经济损失[1]。油茶炭疽病发生时,多以在油茶发病期喷洒多菌灵进行治疗;然而化学药剂的施用不仅会引起病原菌产生抗药性,同时带来环境污染,也给油茶的农副产品带来农药残留问题。生防菌的筛选及应用,不仅可以给油茶炭疽病的防治提供新的思路,还能避免农药残留和环境污染。
土壤中分布着大量细菌,每1 g土壤中细菌数量高达 109个。这些细菌中既有在人类生产生活中起负作用的,也有起促进作用的,土壤拮抗细菌是具有促进作用的细菌。油茶炭疽病拮抗细菌的研究已有相关报道,但从土壤中分离出油茶炭疽病拮抗细菌却鲜有报道。目前仅有宋光桃从土壤中分离到223株细菌,最终筛选出 Z17、Z26这2株抑菌率超过 50%的菌株;经过16S rDNA基因扩增技术将Z17鉴定为克氏拟杆菌(Paenibacillus kribbensis),将Z26鉴定为短短芽孢杆菌(Brevibacillus brevis);但却未对2种菌株进行刺伤接种试验及林间试验[2]。本研究从土壤中寻找新的油茶炭疽病拮抗菌株,对其进行鉴定并进行刺伤接种试验,对其生防效果进行验证,旨在为油茶炭疽病的生物防治分离出新的菌种。
1 材料与方法
1.1 试验材料
1.1.1 供试土壤 采集于湖南天华油茶科技股份有限公司湖南攸县油茶产业基地(27.203 697°N,113.377 083°E)。
1.1.2 供试菌株 果生刺盘孢菌(Colletotrichum fructicola)、彩绒革盖菌 (Coriolus versicolor)、油茶软腐病菌(Agaricodochium camelliae)、喀斯特炭疽菌(C. karstii)、隐秘刺盘孢菌(C. aenigma)、胶孢炭疽菌(C. gloeosporioides)、暹罗炭疽菌(C. siamense)、油茶叶枯病菌(Pestalotiopsis microspora)、哈锐炭疽菌(C. horii)、山茶炭疽菌 (C. camelliae),均保存于中南林业科技大学南方人工林病虫害防控国家林业局重点实验室森林微生物菌种保藏中心。其中,果生刺盘孢菌为引起湖南油茶炭疽病的主要病原菌。
1.1.3 供试油茶 油茶叶片采集于国家油茶工程技术研究中心。
1.1.4 主要培养基 LB培养基:胰蛋白胨10 g、NaCl 10 g、酵母提取物5 g、琼脂20 g (液体LB不加琼脂)、pH值自然,用于拮抗细菌分离、纯化及培养。PDA培养基:新鲜马铃薯200 g、葡萄糖20 g、琼脂 20 g、 水1 000 mL、pH值自然,用于油茶致病菌的培养及拮抗试验。
1.1.5 主要仪器设备和试剂 超净工作台(苏州净化设备有限公司),恒温培养箱,恒温振荡器(IS-EDD3),BioPhotometer核酸蛋白快速检测仪,灭菌锅,电泳仪,2×T5 Super PCR Mix(Basic)(湖南擎科生物技术有限公司),DL5000 DNA marker(湖南擎科生物技术有限公司)。
1.1.6 试验时间和地点 于2022年9月采集土壤,带回中南林业科技大学生科楼A座进行后续试验。
1.2 试验方法
1.2.1 生防菌株的分离纯化 称取10 g土壤置于装有90 mL无菌水的250 mL灭菌锥形瓶中,充分振荡后,以10倍浓度梯度进行稀释,分别取10-1、10-3、10-5、10-7梯度稀释后的溶液 100 μL 于LB固体培养基进行涂布平板。37 ℃恒温培养箱内避光倒置培养2 d后,挑取形态不同的单个菌落进行分离纯化,处理后的菌株保存在 4 ℃冰箱中待用。
1.2.2 生防菌株的初筛 以湖南油茶炭疽病的主要病原菌果生刺盘孢菌为指示菌进行生防细菌的筛选,对分离出的细菌进行3点对峙试验。在 PDA平板(d=90 mm)中央接种直径为6 mm的果生刺盘孢菌,以果生炭疽菌为中心,以等边三角形分布的顶点(顶点离果生刺盘孢菌中心距离为25 mm)接种上述已分离出的细菌,进行拮抗试验,每株细菌重复试验3次,以只在PDA中心接种果生刺盘孢菌为空白对照组。培养4 d后进行抑菌率测定。抑菌率=(对照组菌落面积-处理组菌落面积)/对照组菌落面积×100%。
1.2.3 生防菌株的复筛 参照尚笑男等的方法[3]进行拮抗细菌的复筛。
1.2.4 生防菌株形态特征观察及生理生化鉴定 将筛选出的拮抗细菌通过涂布平板法于37 ℃恒温培养箱中倒置培养 48 h 后,进行单个菌落的形态观察;观察革兰氏染色后的菌株。参照《常见细菌系统鉴定手册》《伯杰氏细菌鉴定手册》,对筛选出的拮抗菌株进行生理生化鉴定。
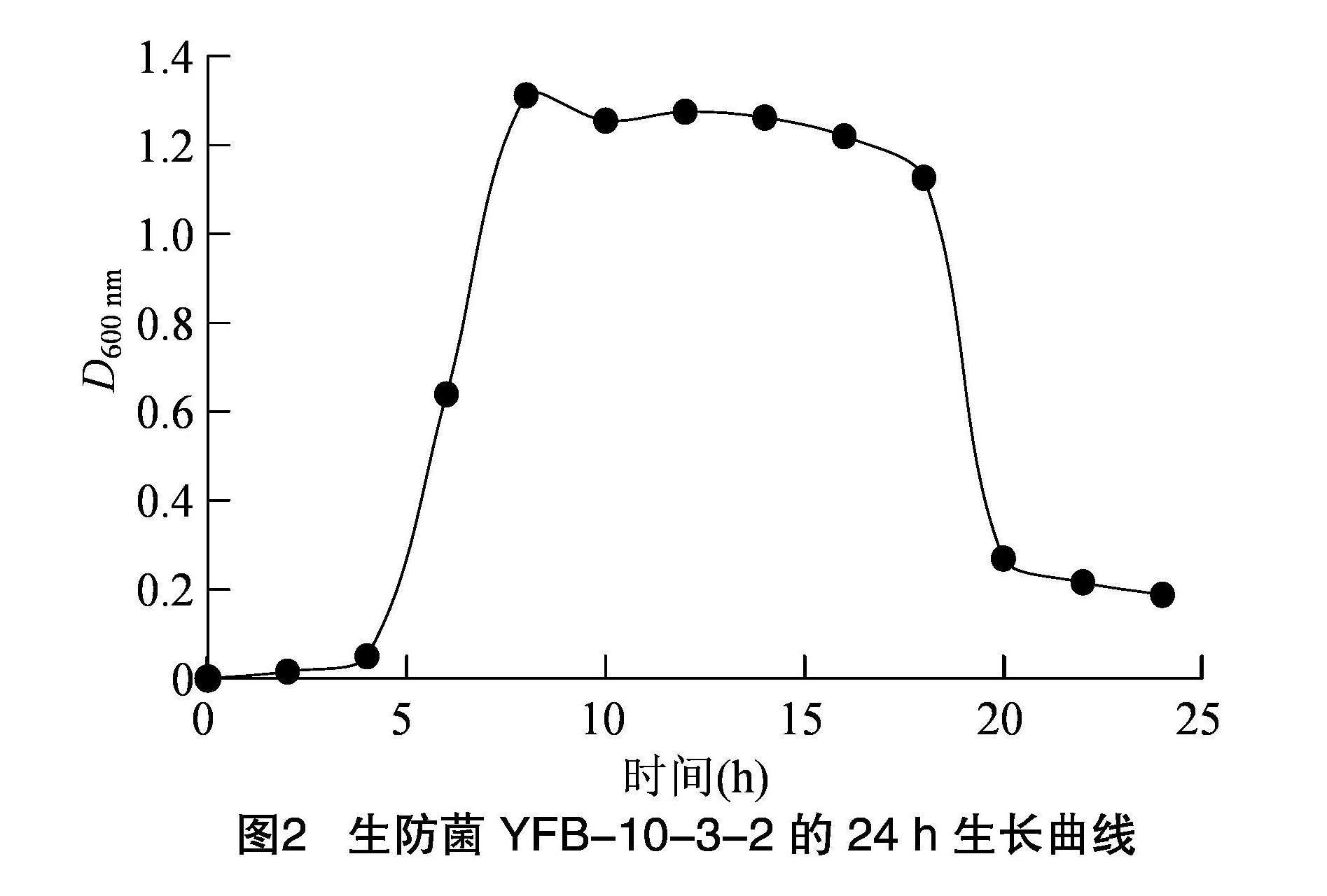
1.2.5 生防菌株生长曲线的测定 利用接种环,将在LB培养基中培养 48 h 后的拮抗菌取1环于 100 mL 液体LB培养基中,于37 ℃、220 r/min条件下进行培养。当D600 nm为 0.5时,按照1%的接种量接种到装有液体LB的三角瓶中,于37 ℃、220 r/min条件下进行培养,进行3组技术重复试验。分别取培养0、2、4、6、8、10、12、14、16、18、20、22、24 h的菌液,以液体LB培养基为对照,测定吸光度D600 nm。利用Excel绘制生防菌株的生长曲线。
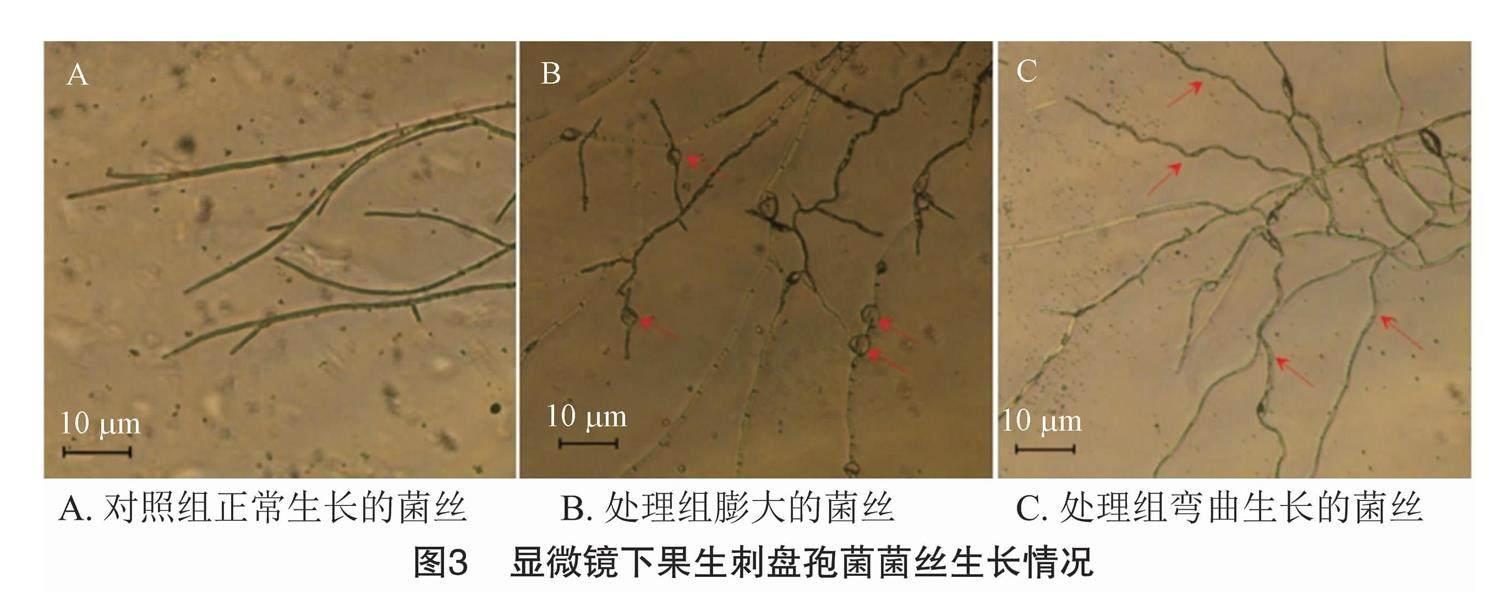
1.2.6 生防菌株对果生刺盘孢菌菌丝的影响 于超净工作台内,采用两点对峙法在PDA平板上接种拮抗细菌、果生刺盘孢菌,取已灭菌的盖玻片,倾斜45°插入拮抗细菌、果生刺盘孢菌两者中央,使盖玻片平面与拮抗细菌、果生刺盘孢菌两者连线平行,重复上述方法;以不接拮抗细菌为对照组,当菌丝着生于盖玻片时,取下盖玻片,于光学显微镜下分别观察处理组与对照组的菌丝形态。
1.2.7 生防菌株功能验证 参考孙科等的方法[4-11]分别对生防细菌的固氮、溶有机磷、溶无机磷、解钾、产蛋白酶、产纤维素、产淀粉酶、产铁载体、产 IAA的能力进行测定。
1.2.8 生防菌株抑菌谱的测定 参照“1.2.2”节中的方法对生防菌株进行抑菌谱的测定。
1.2.9 生防菌株离体刺伤防效测定 预防试验:选取油茶秋梢上健康无病害的叶片,75%乙醇消毒 30 s,无菌水冲洗3次,待叶片干燥后用蜡油对叶柄位置进行密封,以保持叶片尽可能长时间离体培养。选取叶片表面对称位置处,用无菌注射器针头刺穿2处,其中一处接种生防细菌无菌发酵液 10 μL,同一叶片的另一处接种未接菌的液体LB培养基无菌发酵液10 μL。将处理过的叶片置于 9 mm 平板中(平板内侧放有无菌水打湿的无菌脱脂棉),然后对平板进行封口,置于28 ℃恒温培养箱,24 h后每处各接种孢子浓度为1×108个/mL的果生刺盘孢菌孢子悬浮液10 μL。而后置于 28 ℃ 恒温培养箱,5 d后计算离体防效,预防效果=(对照病斑直径-处理病斑直径)/对照病斑直径×100%。综合预防效果为各叶片预防效果的平均值。
治疗试验:试验前油茶叶片处理参照预防试验中方法。2个刺穿处先接种孢子浓度为1×108个/mL的果生刺盘孢菌孢子悬浮液10 μL,24 h后于2个接种处的1处接种10 μL生防细菌无菌发酵液,另1处接种未接菌无菌发酵液10 μL。5 d后计算离体防效,治疗效果=(对照病斑直径-处理病斑直径)/对照病斑直径×100%。综合治疗效果为各叶片治疗效果的平均值。
1.2.10 生防菌株的分子生物学鉴定 将已分离纯化的拮抗细菌接种于装有液体LB培养基的三角瓶中,于 37 ℃、220 r/min培养12 h后得到菌悬液。
16S rDNA 基因扩增:采用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1 492R (5′-TACGCDTACCTTGTTACDACTT-3′)进行基因扩增。PCR 反应体系:2×T5 Super PCR Mix(Basic)25.0 μL,上、下游引物(10 μmol/L)各 2.0 μL,DNA模板2.0 μL(用菌悬液代替),ddH2O 19.0 μL;PCR反应条件:98 ℃ 3 min;98 ℃ 10 s,57 ℃ 10 s,72 ℃ 30 s,35个循环;72 ℃ 5 min;4 ℃保存。
gyrA基因扩增:采用引物gyrA-F(5′-CAGTCAGGAAATGCGTACGTCCTT-3′)和gyrA-R(5′-CAAGGTAATGCTCCAGGCATTGCT-3′)进行基因扩增。PCR 反应体系:2×T5 Super PCR Mix(Basic)25.0 μL,上、下游引物(10 μmol/L)各 2.0 μL,DNA模板 2 μL (用菌悬液代替),ddH2O 19.0 μL;PCR 反应条件:98 ℃ 3 min;98 ℃ 10 s,63 ℃ 10 s,72 ℃ 30 s,35个循环;72 ℃,5 min;4 ℃保存。
后续将4 ℃保存样品送至湖南擎科生物技术有限公司进行测序,将获得的序列提交至GenBank中,利用BLAST对所提交序列的同源性进行比对分析,并利用 MEGA-11采用N-J法构建分子系统发育树。
1.2.11 数据统计与分析 利用Excel、MEGA-11软件进行数据分析。
2 结果与分析
2.1 生防菌株的分离、纯化和筛选
从样品中分离获得不同菌落形态的菌株34株,其中3株对指示菌株果生刺盘孢菌具有明显的抑制作用。最终选取对果生刺盘孢菌抑制效果最好(培养96 h后抑制率可达56.17%)的菌株YFB-10-3-2进行后续试验。
2.2 生防菌株菌落形态及生理生化鉴定
将生防菌株在固体LB平板上于28 ℃培养 2 d,观察发现菌株YFB-10-3-2单菌落形态为近圆形,边缘不整齐,颜色为白色不透明状,中间光滑、干燥(图1),通过革兰氏染色发现该菌株为革兰氏阳性菌。对其进行部分生理生化试验,结果如表1所示。
2.3 生防菌株生长曲线的测定
对YFB-10-3-2发酵液进行24 h测定吸光度D600 nm,由图2可知,在 0~4 h细菌生长处于迟缓期,这个阶段细菌体内积累大量有利于分裂的物质,为对数期的到来做准备;4~8 h细菌生长处于对数期,由于前期物质的大量积累,这个阶段的细菌生长迅速,呈现出几何增长状态;8~18 h细菌生长处于稳定期,此时细菌不断消耗培养基中的营养物质,同时有害物质不断积累;18~20 h细菌处于衰亡期,由于稳定期营养物质的大量消耗以及有害物质的积累,导致细菌死亡数量超过活菌数量,细菌出现菌体自溶现象;20~24 h由于自溶现象细菌裂解,体内物质释放,此时培养基以细菌的代谢产物为主(图2)。
2.4 生防菌株对果生刺盘孢菌菌丝的影响
通过盖玻片斜插法,对着生于盖玻片上的菌丝进
行观察。与对照组相比,处理组能够使指示菌株果生刺盘孢菌菌丝发生膨大、弯曲,影响菌丝的正常生长,从而影响果生刺盘孢菌的生长发育及繁殖(图3)。
2.5 生防菌株功能验证
对拮抗菌株进行功能验证发现,刚果红使拮抗菌株YFB-10-3-2周围染色较浅(图4-A),说明菌株YFB-10-3-2具有产纤维素酶的功能。碘液不能使含淀粉平板上的菌株YFB-10-3-2周围变蓝,说明菌株YFB-10-3-2具有产分解淀粉酶的功能(图4-B)。经过连续 3 代的接续培养,菌株仍能在阿须贝培养基上生长,说明菌株YFB-10-3-2具有固氮功能(图4-C)。经过培养发现,菌落周围具有透明光圈,说明菌株YFB-10-3-2 具有产蛋白酶的功能(图4-D)。经过试验发现,拮抗菌株YFB-10-3-2 不具有解无机磷、解有机磷、解钾、产IAA、产铁载体的功能。
2.6 生防菌株抑菌谱的测定
生防菌YFB-10-3-2与病原真菌通过平板对峙培养4 d后发现,生防菌YFB-10-3-2对供试病原真菌具有较好的抑制效果,对病原真菌具有广谱抑菌作用(图5)。其中,生防菌YFB-10-3-2对隐秘刺盘孢菌抑制率最大,达到71.22%;对油茶叶枯病菌抑制率最小,只有46.50%;对其他病原真菌抑制率为50.00%~71.00%(表2)。
2.7 生防菌株离体刺伤防效的测定
2.7.1 预防试验
通过试验可知,生防菌YFB-10-3-2对不同品种油茶刺伤接种果生刺盘孢菌的预防效果不同,综合预防效果为68.11%,具有较好的预防效果(图6)。
2.7.2 治疗试验
对油茶叶片先刺伤接种致病菌果生刺盘孢菌,再进行接种生防菌YFB-10-3-2进行治疗。结果表明,生防菌YFB-10-3-2 对已被果生刺盘孢菌侵染的油茶叶片具有一定的治疗作用,其综合治疗效果达28.60%(图7)。
2.8 生防菌株分子鉴定
将扩增的16S rDNA基因片段测序后,得到全长1 421 bp的序列,将该序列提交到GenBank中(登录号OQ586059),利用MEGA-11软件采用N-J法构建分子系统发育树(图8),生防菌YFB-10-3-2与贝莱斯芽孢杆菌(NR 116240.1、NR 075005.2)聚为一支,分支支持率为100.00%。对该菌株gyrA基因片段进行扩增, 得到全长940 bp的序列, 将该序列提交到GenBank中(登录号OQ632933),与已知序列进行同源性比对,图9结果显示与该菌株的gyrA基因同源性较高的菌株均属于芽孢杆菌属,生防菌
YFB-10-3-2 与贝莱斯芽孢杆菌(OP867063.1、OP561960.1、OP56957.1)聚为一支,分支支持率为 100.00%。结合其形态和生理生化特征,将生防菌YFB-10-3-2 鉴定为贝莱斯芽孢杆菌。
3 讨论
贝莱斯芽孢杆菌最早于1999年被分离出,2005年被首次报道和命名[12]。随着学者对生防菌种的筛选和鉴定,具有生防效果的贝莱斯芽孢杆菌被大量报道,贝莱斯芽孢杆菌大多从土壤中分离,也有学者从植物的根、茎、叶、鳞茎中分离出具有生防效果的贝莱斯芽孢杆菌[13-17]。相关研究表明,贝莱斯芽孢杆菌不仅具有生防效果,也具有良好的促生效果[18-20]。也有一些研究结果显示,贝莱斯芽孢杆菌具有较好的杀线虫效果[21]。近年来,化学药剂的频繁使用使得病原菌和害虫产生了抗药性,生态环境也受到巨大破坏;生防菌剂的使用不仅可以延缓病原菌和害虫抗药性的产生,对生态环境也较为友好。因此, 生防菌的研发与应用对农林业健康发展和生态环境的良性恢复具有重要意义。
本试验从土壤中分离获得1株细菌YFB-10-3-2,通过16S rDNA基因和gyrA基因分子鉴定,结
合形态特征及生理生化特征,综合鉴定细菌YFB-10-3-2为贝莱斯芽孢杆菌,经研究发现细菌 YFB-10-3-2使病原菌丝发生膨大和弯曲,这与Li等的研究结果[22-23]相似。也有研究表明,贝莱斯芽孢杆菌能使致病菌菌丝体顶端肿胀或破裂[24]。Baptista等在电子显微镜下观察出贝莱斯芽孢杆菌CMRP 4489的无菌上清液通过引起菌丝结构变形,进而扭曲和损伤病原菌丝,从而使真菌生长受到抑制[25]。Wang等通过病原菌丝体可被台盼蓝染成蓝色发现,贝莱斯芽孢杆菌FKM10能使病原菌菌丝体细胞膜受损[26]。有学者深入研究贝莱斯芽孢杆菌对病原菌丝生长产生的影响时发现,贝莱斯芽孢杆菌E2产生的脂肽能使黄曲霉的菌丝异常肿胀、扭曲和塌陷[27],这与Park等的研究结果[28]相同。Zhao等研究证明,贝莱斯芽孢杆菌 A4的无菌上清液处理后,能够诱导灰霉菌菌丝细胞中的活性氧形成关键基因的表达,从而导致菌丝的氧化损伤[29]。以上研究表明,贝莱斯芽孢杆菌具有较好的抑制菌丝生长的效果,这也为细菌 YFB-10-3-2后续对菌丝生长影响机理的研究提供了理论依据。
通过平板对峙试验发现,细菌YFB-10-3-2对10种病原菌具有较好的抑制效果,表明细菌YFB-10-3-2具有广谱抑菌性。Feng等同样证明了,贝莱斯芽孢杆菌对多种病原菌具有抑菌广谱性[30-32]。油茶叶片的离体刺伤接种试验表明,细菌YFB-10-3-2对油茶叶片感染果生炭疽菌的预防效果(68.11%)大于治疗效果(28.60%)。Chen等在研究贝莱斯芽孢杆菌ZW-10对离体水稻稻瘟病的预防和治疗效果中发现,ZW-10对稻瘟病的预防比治疗效果更显著[33]。Nifakos等的研究具有类似的结果[34-36]。而方园等则发现,贝莱斯芽孢杆菌SF327对水稻白叶枯病的治疗效果明显优于预防效果[37]。离体刺伤接种试验可为细菌 YFB-10-3-2 作为生防菌的开发与应用提供必要的试验基础。
4 结论
试验分离出1株对油茶炭疽病具有较好抑制作用的细菌YFB-10-3-2,结合生理生化及双基因分子进行鉴定,最终将该细菌鉴定为贝莱斯芽孢杆菌。盖玻片斜插法试验表明,细菌YFB-10-3-2 能影响油茶炭疽病主要致病菌果生刺盘孢菌的正常生长。平板对峙试验表明,细菌YFB-10-3-2对多种致病菌的生长具有抑制作用。油茶叶片离体刺伤试验表明,细菌YFB-10-3-2对油茶炭疽病发生的预防效果大于油茶炭疽病发生后治疗效果。
参考文献:
[1]徐丽萍,檀根甲. 油茶主要病害流行与生态条件的关系和生态调控技术[J]. 安徽农业大学学报,2015,42(2):272-275.
[2]宋光桃. 油茶主要病害检测和生物控制技术研究[D]. 长沙:中南林业科技大学,2012:73-82.
[3]尚笑男,刘君昂,冯福山,等. 油茶内生拮抗细菌的筛选、鉴定及防效[J]. 中国生物防治学报,2021,37(3):575-583.
[4]孙 科,耿凤英,于秋菊,等. 牛蒡根内生固氮菌分离、鉴定及培养条件优化的研究[J]. 中国酿造,2021,40(11):133-137.
[5]杨 茉,高 婷,李滟璟,等. 辣椒根际促生菌的分离筛选及抗病促生特性研究[J]. 生物技术通报,2020,36(5):104-109.
[6]许世洋,范雨轩,汪学苗,等. 辣椒镰孢根腐病防病促生细菌的筛选及其效应[J]. 微生物学报,2022,62(7):2735-2750.
[7]郗蓓蓓,叶建仁. 高效钾细菌的筛选鉴定及对植物的促生长效应[J]. 河南农业科学,2020,49(2):81-88.
[8]李正风,朱 杰,唐 丽,等. 烟草秸秆中产纤维素酶细菌筛选、鉴定及酶活测定[J]. 西南农业学报,2020,33(3):645-650.
[9]张晓瑞,刘晓晖,付 博,等. 烟草中淀粉降解菌的筛选、鉴定及发酵工艺优化[J]. 食品与机械,2021,37(2):34-41.
[10]许佳露,张 平,李美芳,等. 产铁载体菌株的分离、培养条件优化及初步应用[J]. 微生物学通报,2022,49(3):1004-1016.
[11]陈 越,李虎林,朱诗苗,等. 产吲哚乙酸(IAA)促生菌的分离鉴定及对烟草种子萌发和幼苗生长发育的影响[J]. 作物杂志,2020(2):176-181.
[12]Ruiz-García C,Béjar V,Martínez-Checa F,et al. Bacillus velezensis sp.nov.,a surfactant-producing bacterium isolated from the river Vélez in Málaga,southern Spain[J]. International Journal of Systematic and Evolutionary Microbiology,2005,55(Pt 1):191-195.
[13]Chen L,Shi H,Heng J Y,et al. Antimicrobial,plant growth-promoting and genomic properties of the peanut endophyte Bacillus velezensis LDO2[J]. Microbiological Research,2019,218:41-48.
[14]王若琳,徐伟芳,王 飞,等. 桑树内生拮抗菌的分离鉴定及其对桑断枝烂叶病的生防初探[J]. 微生物学报,2019,59(11):2130-2143.
[15]Kang X X,Zhang W L,Cai X C,et al. Bacillus velezensis CC09:a potential ‘vaccine for controlling wheat diseases[J]. Molecular Plant-Microbe Interactions,2018,31(6):623-632.
[16]Li F Z,Zeng Y J,Zong M H,et al. Bioprospecting of a novel endophytic Bacillus velezensis FZ06 from leaves of Camellia assamica:production of three groups of lipopeptides and the inhibition against food spoilage microorganisms[J]. Journal of Biotechnology,2020,323:42-53.
[17]Khan M S,Gao J L,Chen X Q,et al. The endophytic bacteria Bacillus velezensis lle-9,isolated from Lilium leucanthum,harbors antifungal activity and plant growth-promoting effects[J]. Journal of Microbiology and Biotechnology,2020,30(5):668-680.
[18]Torres M,Llamas I,Torres B,et al. Growth promotion on horticultural crops and antifungal activity of Bacillus velezensis XT1[J]. Applied Soil Ecology,2020,150:103453.
[19]Myo E M,Liu B H,Ma J J,et al. Evaluation of Bacillus velezensis NKG-2 for bio-control activities against fungal diseases and potential plant growth promotion[J]. Biological Control,2019,134:23-31.
[20]Fan B,Wang C,Song X F,et al. Bacillus velezensis FZB42 in 2018:the gram-positive model strain for plant growth promotion and biocontrol[J]. Frontiers in Microbiology,2018,9:2491.
[21]Asaturova A M,Bugaeva L N,Homyak A I,et al. Bacillus velezensis strains for protecting cucumber plants from root-knot nematode Meloidogyne incognita in a greenhouse[J]. Plants,2022,11(3):275.
[22]Li S Y,Ma J P,Li S Y,et al. Comparative transcriptome analysis unravels the response mechanisms of Fusarium oxysporum f. sp. cubense to a biocontrol agent,Pseudomonas aeruginosa gxun-2[J]. International Journal of Molecular Sciences,2022,23(23):15432.
[23]Won S J,Moon J H,Ajuna H B,et al. Biological control of leaf blight disease caused by Pestalotiopsis maculans and growth promotion of Quercus acutissima carruth container seedlings using Bacillus velezensis CE 100[J]. International Journal of MolecμLar Sciences,2021,22(20):11296.
[24]Hamaoka K,Aoki Y,Suzuki S. Isolation and characterization of endophyte Bacillus velezensis KOF112 from grapevine shoot xylem as biological control agent for fungal diseases[J]. Plants,2021,10(9):1815.
[25]Baptista J P,Teixeira G M,de Jesus M L A,et al. Antifungal activity and genomic characterization of the biocontrol agent Bacillus velezensis CMRP 4489[J]. Scientific Reports,2022,12:17401.
[26]Wang C Q,Zhao D Y,Qi G Z,et al. Effects of Bacillus velezensis FKM10 for promoting the growth of Malus hupehensis Rehd. and inhibiting Fusarium verticillioides[J]. Frontiers in Microbiology,2020,10:2889.
[27]Li S J,Xu X G,Zhao T Y,et al. Screening of Bacillus velezensis E2 and the inhibitory effect of its antifungal substances on Aspergillus flavus[J]. Foods,2022,11(2):140.
[28]Park G,Nam J,Kim J,et al. Structure and mechanism of surfactin peptide from Bacillus velezensis antagonistic to fungi plant pathogens[J]. Bulletin of the Korean Chemical Society,2019,40(7):704-709.
[29]Zhao H L,Liu K,Fan Y Z,et al. Cell-free supernatant of Bacillus velezensis suppresses mycelial growth and reduces virulence of Botrytis cinerea by inducing oxidative stress[J]. Frontiers in Microbiology,2022,13:980022.
[30]Feng B Z,Chen D D,Jin R X,et al. Bioactivities evaluation of an endophytic bacterial strain Bacillus velezensis JRX-YG39 inhabiting wild grape[J]. BMC Microbiology,2022,22(1):170.
[31]Rungsirivanich P,Parlindungan E,OConnor P M,et al. Simultaneous production of multiple antimicrobial compounds by Bacillus velezensis ML122-2 isolated from Assam tea leaf [Camellia sinensi var.assamica (J.W.Mast.) Kitam.][J]. Frontiers in Microbiology,2021,12:789362.
[32]Chen M C,Wang J P,Liu B,et al. Biocontrol of tomato bacterial wilt by the new strain Bacillus velezensis FJAT-46737 and its lipopeptides[J]. BMC Microbiology,2020,20(1):160.
[33]Chen Z,Zhao L,Chen W Q,et al. Isolation and evaluation of Bacillus velezensis ZW-10 as a potential biological control agent against Magnaporthe oryzae[J]. Biotechnology & Biotechnological Equipment,2020,34(1):714-724.
[34]Nifakos K,Tsalgatidou P C,Thomloudi E E,et al. Genomic analysis and secondary metabolites production of the endophytic Bacillus velezensis Bvell:a biocontrol agent against Botrytis cinerea causing bunch rot in post-harvest table grapes[J]. Plants,2021,10(8):1716.
[35]杨婉艺,姜 毅,汤 静,等. 无花果采后炭疽病原菌鉴定及贝莱斯芽孢杆菌防治效果[J]. 食品科学,2023,44(15):204-211.
[36]冯江鹏,邱莉萍,梁秀燕,等. 草莓胶孢炭疽菌拮抗细菌贝莱斯芽孢杆菌JK3的鉴定及其抗菌活性[J]. 浙江农业学报,2020,32(5):831-839.
[37]方 园,彭勇政,廖长贵,等. 一株具有防病促生功能的贝莱斯芽孢杆菌SF327[J]. 微生物学报,2022,62(10):4071-4088.
