?QuEChERS -高效液相色谱-串联质谱法检测甘薯和土壤中烯效唑残留的方法研究?
2024-06-30左仁芳戴桂金王妙张玉涵罗杰熊浩刘志邦陈武瑛张卓
左仁芳 戴桂金 王妙 张玉涵 罗杰 熊浩 刘志邦 陈武瑛 张卓

摘要:采用改良的QuEChERS方法进行前处理,建立了甘薯和土壤中烯效唑残留的QuEChERS-高效液相色谱-串联质谱检测方法。样品用含0.1%乙酸的乙腈振荡提取,经C18净化剂进行基质净化,采用C18反相色谱柱分离,进行LC-MS/MS检测。结果表明:烯效唑在0.000 5~1.0 mg/L浓度范围内,质量浓度与对应的峰面积间呈良好的线性关系,相关系数为0.995 1~0.995 9;在0.002、0.02、0.20 mg/kg 3个添加水平下,烯效唑在甘薯和土壤中的平均回收率为90.3%~106.7%,相对标准偏差为0.6%~3.6%,方法定量限为0.002 mg/kg。该方法方便快捷、精准定量、检测灵敏,适用于甘薯和土壤样品中烯效唑的检测。
关键词:烯效唑;甘薯;高效液相色谱-串联质谱;残留;方法
中图分类号:O657.63文献标识码:A文章编号:1006-060X(2024)05-0090-06
Determination of Uniconazole Residue in Sweet Potatoes and Soil by
QuEChERS-HPLC-MS/MS
ZUO Ren-fang1,DAI Gui-jin2,WANG Miao3,ZHANG Yu-han3,LUO Jie3,XIONG Hao3,
LIU Zhi-bang3,CHEN Wu-ying3,ZHANG Zhuo3
(1. Plant Protection and Inspection Station, Fenghuang County Bureau of Agriculture and Rural Affairs, Fenghuang 416200, PRC; 2. Agricultural Characteristic Industry Service Center, Fenghuang County Bureau of Agriculture and Rural Affairs, Fenghuang 416299, PRC; 3. Hunan Institute of Plant Protection, Hunan Academy of Agricultural Sciences, Changsha 410125, PRC)
Abstract: A method for determining the uniconazole residue in sweet potatoes and soil was established by the combination of improved QuEChERS (quick, easy, cheap, effective, rugged, and safe) with high-performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). Each sample was extracted by shaking with acetonitrile containing 0.1% (volume fraction) acetic acid, purified by C18 purification agent, separated by reversed-phase C18 column chromatography, and detected by LC-MS/MS. The results showed good linearity between the peak area and the uniconazole concentration within the range of 0.000 5-1.0 mg/L (R2 of 0.995 1-0.995 9). The recovery of uniconazole in sweet potatoes and soil at the spike levels of 0.002, 0.02, and 0.20 mg/kg ranged from 90.3% to 106.7% with the relative standard deviations (RSDs) of 0.6%-3.6%. The established method showed the limit of quantification (LOQ) of 0.002 mg/kg. With easy operation, high sensitivity, and high accuracy, the established method is suitable for the detection of uniconazole in sweet potatoes and soil.
Key words: uniconazole; sweet potato; high-performance liquid chromatography-tandem mass spectrometry; residue; method
甘薯[Ipomoea batatas(L.)Lam]属于旋花科植物,适应性强,广泛种植于热带、亚热带和暖温带地区,是一种重要的粮食作物。甘薯起源于拉丁美洲,目前中国是世界上最大的甘薯生产国和消费国,主要将甘薯用于食品、动物饲料和工业加工等方面。在甘薯生产过程中,常因物候条件、品种等原因出现甘薯茎叶徒长的现象,导致甘薯地下部分产量降低、淀粉含量下降,严重影响甘薯的经济产量[1];而喷施外源化学调控剂可有效抑制茎叶徒长,从而增加块根产量[2]。
烯效唑(Uniconazole)作为一种新型植物生长调节剂,可以调控多种植物的生理功能,如生长发育、光合和呼吸作用、矿质营养和碳水化合物的代谢与分配和植物抗性等,是目前中国农业生产中使用面积最广的植物生长延缓剂之一[3]。研究表明,对块根、块茎类作物施加烯效唑,可抑制茎叶的生长,增加其根冠比,促进光合同化产物向作物产品器官(果实、种子、块根、块茎等)的分配,从而增加作物产量和增强作物抗逆能力[4-6],因此烯效唑现已广泛应用于薯类、萝卜等块根块茎类作物[7]。在实际生产中,过量使用植物生长调节剂会影响动物及人体健康,如低于日允许摄入量浓度的矮壮素仍会对动物的繁殖能力产生不良影响[8]。此外,烯效唑施用不当会造成残留超标,而我国食品中农药最大残留限量标准GB 2763—2021[9]尚未对烯效唑在甘薯中的最大残留限量进行规定。因此需要创建甘薯中烯效唑残留的检测方法,用以评估烯效唑应用于甘薯生产的安全性。
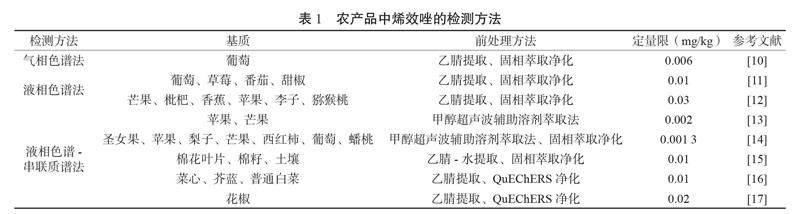
目前检测烯效唑残留主要采用的方法有气相色谱法(GC)[10]、液相色谱法(HPLC)[11]和液质联用法(HPLC-MS/MS)[4]等,但由于烯效唑具有相对分子质量较大、气化温度高、极性较强等特点,采用气相色谱法的检测效果不理想,所以采用液相色谱法[10-12]和液质联用法[13-17]检测烯效唑残留更常见。另张良等[18]采用包被抗体直接竞争模式建立了苹果中烯效唑的酶联免疫吸附分析法,该方法中烯效唑的检出限(LOD)为0.024 μg/kg。表1总结了3种检测方法测定不同农产品中烯效唑残留的前处理方法和方法定量限(LOQ)。国内外关于农产品中烯效唑残留的检测主要涉及叶类蔬菜和水果等,但在甘薯中还尚未见相关报道。该研究通过改良的QuEChERS方法对甘薯和土壤中烯效唑进行提取和净化,建立甘薯和土壤中烯效唑残留的QuEChERS-高效液相色谱-串联质谱检测方法,为评估烯效唑在甘薯生产中应用的安全性提供技术支撑。
1 材料与方法
1.1 材料与试剂
甘薯和土壤空白样品采自凤凰县林峰乡土洞村红薯种植基地,烯效唑标准品购自德国Dr. Ehrenstorfer公司,色谱级甲酸、甲醇和乙腈购自默克化工技术(上海)有限公司,分析级乙酸、乙腈和氯化钠购自国药集团化学试剂有限公司,PSA、C18和石墨化炭黑(GCB)购自天津博纳艾杰尔科技有限公司。
1.2 仪器与设备
CPA225D电子天平(德国赛多利斯公司),多管涡旋振荡仪(杭州瑞诚仪器有限公司),TDL-40B低速台式离心机(上海安亭科学仪器厂),移液器(Eppendorf艾本德公司),Centrifuge 5424高速离心机(Eppendorf艾本德公司),LC1290-AB SCIEX 4500Q高效液相色谱-三重四极杆质谱联用系统(美国Aglient公司和美国SCIEX公司)。
1.3 分析方法
1.3.1 样品前处理 称取5 g均质后的甘薯样品于50 mL离心管中,加入5 mL双蒸水,轻微振荡混匀后浸泡5 min,加入10 mL含0.1%(体积分数)乙酸的乙腈溶液,涡旋振荡10 min,加入5 g NaCl,颠倒混匀后再涡旋振荡2 min,4 500 r/min转速下低速离心5 min。取1.5 mL上清液至装有50 mg C18净化剂的2 mL离心管中,涡旋30 s后在10 000 r/min转速下高速离心5 min,取上清液过0.2 μm有机滤膜,滤液待LC-MS/MS检测。
称取5 g土壤样品于50 mL离心管中,加入10 mL双蒸水,轻微振荡混匀后浸泡5 min,加入10 mL乙腈提取液,涡旋振荡10 min,加入5 g NaCl,颠倒混匀后涡旋振荡2 min,4 500 r/min转速下低速离心5 min。取1.5 mL上清液至装有50 mg C18净化剂的2 mL离心管中,涡旋30 s后在10 000 r/min转速下高速离心5 min,取上清液过0.2 μm有机滤膜,滤液待LC-MS/MS检测。
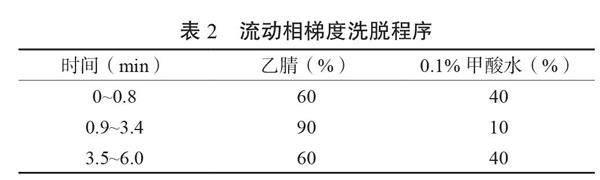
1.3.2 仪器条件 液相模块:色谱分离柱为ZORBAX Eclipse Plus C18色谱柱(3 mm×100 mm,1.8 ?m);柱温箱设为25℃,进样量设为1.0 μL;流动相A为乙腈,流动相B为0.1%甲酸水溶液,流速为0.4 mL/min;流动相梯度洗脱程序如表2所示。
质谱模块:使用电喷雾离子源(ESI),离子源温度500℃,离子喷雾电压5 500 V,喷雾气压和辅助加热气压310.3 kPa,气帘气压275.8 kPa,采用多反应监测模式(MRM)进行检测。烯效唑质谱测定参数设置为:保留时间2.49 min,母离子291.9,子离子70.0*和125.1,锥孔电压51 V,碰撞能59 eV和29 eV;其中“*”表示定量离子。
1.3.3 标准溶液的配制 准确称取烯效唑标准品0.010 1 g配制成1 000 mg/L的母液;准确量取烯效唑母液,用乙腈逐级稀释成1.0、0.5、0.1、0.05、0.01、0.005、0.001和0.000 5 mg/L标准溶液。将甘薯和土壤空白样品进行前处理得到空白基质溶液,稀释得到浓度梯度为1.0、0.5、0.1、0.05、0.01、0.005、0.001和0.000 5 mg/L的基质标准溶液。将可检测出烯效唑溶剂标准溶液的最小浓度定义为方法检出限(LOD)。
1.3.4 添加回收试验 将空白甘薯和土壤样品前处理后进行添加回收试验,添加水平分别设置为0.002、0.02和0.2 mg/kg,每个水平重复5次,通过计算添加回收率及其对应的相对标准偏差考察方法精确度,将最小添加浓度水平定义为方法定量限(LOQ)。
1.3.5 基质效应 由于质谱离子丰度易受甘薯和土壤样品复杂基质的干扰,根据公式(1)计算甘薯和土壤样品的基质效应(ME),根据ME值的范围判定基质效应的强弱[19]。
式中,km为空白基质标准溶液所制得的标准曲线的斜率,ks为溶剂标准溶液所制得的标准曲线的斜率。
2 结果与分析
2.1 仪器条件的确定
烯效唑分子含有羟基,在电喷雾下易离子化,所以选取ESI源作为质谱离子源。首先在ESI+模式下通过质谱调谐优化找到母离子291.9,然后优化碰撞能量选择响应值较高的碎片子离子作为定量离子70.0和定性离子125.1。烯效唑在C18色谱柱上的保留效果好,比较不同有机流动相(甲醇和乙腈)的烯效唑洗脱效果,结果表明乙腈-0.1%甲酸水作为流动相时,色谱峰形对称,信号稳定,保留时间为2.49 min。
2.2 提取方法的改良
在常规QuEChERS方法中,提取溶剂通常选择乙腈,但不同的农药结构、样品基质、提取液pH值条件对农药的提取效果均有很大影响。前期研究表明在乙腈提取液中加入不同比例的乙酸,可以更好的将烯效唑从复杂基质中提取出来[16-17]。该研究比较了乙腈和含0.1%乙酸的乙腈对甘薯中烯效唑提取效率的影响,由图1 A可知,用乙腈提取的平均回收率为75.43%,而用含0.1%乙酸的乙腈提取的平均回收率为89.12%,因此选择含0.1%乙酸的乙腈作为甘薯中烯效唑的提取溶剂。
在QuEChERS前处理方法中,分散固相萃取净化过程中常见的吸附剂有C18、PSA和GCB。其中C18是一种广谱性的非极性净化剂,能有效吸附基质中微量的非极性杂质;PSA属于氨基吸附剂,它能够通过氢键除去基质中的有机酸、糖等物质;而GCB具有极强的吸附能力,能去除部分色素,但有时也会吸附某些农药[16]。该研究分别以50 mg C18、50 mg C18+50 mg GCB、50 mg PSA和50 mg PSA+50 mg GCB为净化剂,比较其对甘薯中烯效唑回收率的影响。由图1 B可知,50 mg C18、50 mg C18+50 mg GCB、50 mg PSA和50 mg PSA+50 mg GCB为净化剂时,甘薯中烯效唑的平均回收率分别为92.18%、79.51%、86.84%和78.63%,因此选择C18作为固相萃取净化的净化剂。
2.3 分析方法的线性关系、准确度
由表3可知,在0.000 5~1.0 mg/L浓度范围内,烯效唑在基质中均呈良好的线性关系,相关系数为0.995 1~0.995 9,表明该研究建立的甘薯和土壤中烯效唑残留的分析方法能满足农药残留分析所要求的准确度。此外,烯效唑在甘薯和土壤中的基质效应分别为5.5%和6.2%,表明甘薯和土壤提取液经过净化后,均可以消除大部分基质杂质的干扰,因此该方法中数据的校准采用基质标准曲线进行,以消除基质效应的影响。
由表4可知,烯效唑在甘薯中的平均回收率为90.4%~106.7%,相对标准偏差(RSD)为0.6%~2.3%;烯效唑在土壤中的平均回收率为90.3%~94.6%,RSD为1.2%~3.6%。烯效唑在甘薯和土壤中的定量限以最小添加浓度表示,均为0.002 mg/kg。烯效唑在溶剂、甘薯空白基质和土壤空白基质中的色谱图见图2、图3和图4。由图2、图3和图4可知,在该研究方法中,甘薯和土壤中各浓度烯效唑的色谱峰均能较好地与基线分离,可以满足甘薯和土壤中烯效唑残留分析检测的要求。
3 讨论与结论
该研究通过改良的QuEChERS方法提取甘薯和土壤中的烯效唑,在提取溶剂乙腈中加入乙酸,提高了提取效率。质谱技术现已广泛应用于农产品中农药残留的检测,但农产品的复杂基质会对化合物在质谱中的响应产生干扰,从而影响分析结果的准确度,因此在农产品的农药残留检测中应考虑基质效应[17]。经分散固相净化剂C18净化处理后,烯效唑在甘薯和土壤中的基质效应分别为5.5%和6.2%,属于弱基质效应,表明甘薯和土壤提取液经过净化后,均可以消除大部分基质杂质的干扰。此外,烯效唑在0.000 5~1.0 mg/L浓度范围内,质量浓度与对应的峰面积间呈良好的线性关系,相关系数为0.995 1~0.995 9,这表明该研究建立的甘薯和土壤中烯效唑残留的分析方法能满足农药残留分析所要求的准确度。在0.002、0.02、0.2 mg/kg这3个添加水平下,烯效唑在甘薯和土壤中的平均回收率为90.3%~106.7%,相对标准偏差为0.6%~3.6%,方法定量限均为0.002 mg/kg。总体而言,该研究建立了检测甘薯和土壤中的烯效唑残留的QuEChERS-高效液相色谱-串联质谱检测方法,该方法前处理操作简单,方法灵敏度高,各种性能指标符合农药残留试验准则的相关要求,具备了较高的检测精度和检测通量,可为评估烯效唑在甘薯中应用的安全性提供技术支撑。
参考文献:
[1] 王欣,李强,曹清河,等. 中国甘薯产业和种业发展现状与未来展望[J]. 中国农业科学,2021,54(3):483-492.
[2] RADEMACHER W. GROWTH RETARDANTS:effects on gibberellin biosynthesis and other metabolic pathways[J]. Annual Review of Plant Physiology and Plant Molecular Biology,2000,51:501-531.
[3] 汪宝卿,解备涛,王庆美,等. 甘薯内源激素和化学调控研究进展[J]. 山东农业科学,2010,42(1):51-56,62.
[4] 胡启国,刘亚军,王文静,等. 烯效唑对甘薯产量和生长发育的影响[J]. 山西农业科学,2018,46(8):1299-1301,1395.
[5] 解备涛,王庆美,张海燕,等. 植物生长调节剂对甘薯产量和激素含量的影响[J]. 华北农学报,2016,31(1):155-161.
