?地肤对土壤镉胁迫的生理生化响应?
2024-06-30黎标郭佳源谭璐王凡杨海君谭菊
黎标 郭佳源 谭璐 王凡 杨海君 谭菊
摘要:为探究地肤对酸性土壤中重金属镉(Cd)污染的抗性和敏感性,分别在初始土壤pH值6.1(T处理组)、pH值5.0(TS处理组)条件下,设置不同浓度Cd(1.253、1.553、2.153、2.753、4.253和10.253 mg/kg)胁迫盆栽控制试验,研究了2种pH值和不同Cd浓度处理对地肤生理生化指标的影响。结果表明:(1)Cd胁迫对地肤根总长度、总表面积、总体积、平均直径及根尖数影响均不明显,其中1.253~2.753 mg/kg Cd胁迫下的地肤根、茎及全株生物量变化较小,对土壤镉的耐受性较强,且能较好地适应偏酸性土壤环境;T处理组地肤根系生长发育整体上优于TS处理组。(2)土壤镉含量对地肤光合作用的抑制性不明显,但土壤pH值降低会提高地肤叶片光合色素含量。(3)地肤根部SOD、POD活性、MDA含量整体上高于茎部,相同Cd浓度处理下,土壤pH值升高会提高地肤根茎SOD活性,降低MDA含量。地肤的抗氧化酶系统在防御土壤镉污染胁迫方面起到显著保护作用。
关键词:Cd胁迫;地肤;生理响应;抗氧化系统;积累分布
中图分类号:Q945.78 文献标识码:A 文章编号:1006-060X(2024)05-0043-08
Physiological and Biochemical Responses of Kochia scoparia (L.) Schrad. to
Soil Cadmium Stress
LI Biao1,2,GUO Jia-yuan2,TAN Lu2,WANG Fan3,YANG Hai-jun2,TAN Ju4
(1. Hunan Zhongtuo Environmental Engineering Co., Ltd., Changsha 410000, PRC; 2. College of Environment and Ecology, Hunan Agricultural University, Changsha 410128, PRC; 3. Changsha Environmental Protection Vocational College, Changsha 410004, PRC; 4. Changsha Ecological and Environmental Monitoring Center of Hunan Province, Changsha 410001, PRC)
Abstract: This study aims to investigate the tolerance and sensitivity of Kochia scoparia (L.) Schrad. to cadmium (Cd) contamination in acid soil. Pot experiments were designed with different Cd concentrations (1.253, 1.553, 2.153, 2.753, 4.253, and 10.253 mg/kg) under initial pH 6.1 (T group) and pH 5.0 (TS group) to evaluate the effects of different pH values and Cd concentrations on the physiological and biochemical parameters of K. scoparia. The experiments yielded the following results. (1) Cd stress had insignificant effects on the root length, root surface area, root volume, average root diameter, and root tip number of K. scoparia. The plants exposed to 1.253~2.753 mg/kg Cd showcased mild changes in the root biomass, stem biomass, and whole plant biomass, demonstrating strong tolerance to Cd stress and adaptation to acid soil. The root growth in the T group was better than that in the TS group. (2) Soil Cd stress had slight inhibitory effect on the photosynthesis of K. scoparia, while the decrease in soil pH increased the photosynthetic pigments in the leaves. (3) The root of K. scoparia had higher activities of superoxide dismutase (SOD) and peroxidase (POD) and higher content of malonaldehyde (MDA) than the stem. Under the same Cd concentration, the increase in soil pH enhanced SOD activity and reduced MDA content in the root and stem. The antioxidases of K. scoparia played a significant role in protecting the plant from soil Cd stress.
Key words: cadmium stress; Kochia scoparia (L.) Schrad.; physiological response; antioxidant system; accumulation and distribution
土壤既是自然环境的构成要素,更是农业生产最重要的自然资源。土壤重金属污染严重制约我国农业的可持续发展[1]。相比其他重金属,镉(Cd)的生物毒性强,可抑制植物根系生长,破坏叶绿素结构而减弱光合作用,最终导致农作物产量和质量下降,并通过食物链传递危害人体健康[2]。如何实现重金属Cd污染耕地安全利用,已成为我国农业环境科学研究领域的难题与热点。近年来,相关研究印证了重金属污染土壤植物修复技术具有广阔的前景[3],
现已筛选出的80余种Cd超富集植物在Cd污染土壤修复中发挥了较大作用[4-5]。然而,研究者发现,过量的Cd进入植物体后,会对植物的生理活动产生负面影响[6],根际作为植物与其生长环境之间物质交换的主要场所,其形态、生长状况和空间分布直接决定着植物对重金属的富集能力和吸收效率[7],
在重金属被吸收和向上转运时,根系的生长发育也不可避免地受到影响[8-10]。当植物受到重金属胁迫时,其内部会形成超氧阴离子自由基(O2-·)、过氧化氢(H2O2)等活性氧自由基(ROS),ROS能自由穿越膜系统,致使细胞内各个区域受损,导致膜脂过氧化、酶失活以及DNA破坏,最终引发植物减产或死亡[11],这显示了抗氧化防御系统在植物耐受重金属方面起到的关键作用。目前,对重金属引发的植物抗氧化防御反应途径有超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)以及非酶的抗氧化物等。其中SOD、CAT是抗氧化防御系统中重要的保护酶,起到清除活性氧自由基,维持膜系统的稳定性,减轻氧化胁迫危害。此外,抗氧化酶活性以及植物重要的一个生理指标——叶绿素含量,能从侧面揭示植物对重金属的耐性机制[12]。Cd胁迫不仅会影响植物叶绿素合成,并破坏植物体内原有的叶绿体,而且对叶绿素a和叶绿素b(Chla和Chlb)的影响作用也较明显[13]。
地肤[Kochia scoparia (L.) Schrad.]作为藜科地肤属植物,成熟后可制作扫帚。目前关于地肤的营养成分、耐盐生理特性[14]等方面的研究比较多,也有地肤对矿区土壤重金属污染耐受性、累积性和富集能力的研究报道[15-17],尚未见土壤Cd胁迫下地肤的生理生化响应的报道。笔者采用盆栽控制试验探究地肤对土壤Cd胁迫的生理响应,有助于揭示地肤对Cd积累的机理,对于筛选和培育合适的镉超积累植物提供科学依据。
1 材料和方法
1.1 试验材料
试验时间为2021年5月3日至2021年10月14日。供试盆栽土壤按照自然土和营养土4∶1体积比混合,每盆土壤质量为10 kg(约占盆体积的4/5),混合后试验用基质土pH值6.10,含水率25.88%,总Cd含量1.253 mg/kg,有效态Cd含量 0.942 mg/kg。自然土来自试验地农田表层土(0~20 cm),去除土壤中植物残体和石子后充分碾细;营养土购于厦门市花仙谷农业有限公司。
供试植物地肤为藜科地肤属一年生草本植物,试验所用地肤苗采自长湖村科研合作基地。盆栽试验地位于湖南农业大学耘园基地。在地肤移栽培植期,每间隔7~10 d浇水1次,待植株生长至25~30 cm,追施有机肥水溶液(N+P2O5+K2O≥5%,总Cd含量0.07 mg/kg),每间隔35 d追一次肥。
1.2 试验设计
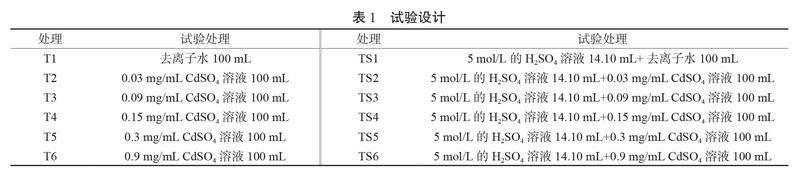
在原pH值6.1的基础上,添加5 mol/L H2SO4溶液14.10 mL,设置pH值6.1(T处理)和5.0(TS处理)2种土壤酸碱度;在原总Cd含量1.253 mg/kg的基础上,依次添加Cd2+浓度(CdSO4溶液制备)0、0.03、0.09、0.15、0.3和0.9 mg/mL的溶液 100 mL,盆栽土壤实测Cd浓度分别为1.253、1.553、2.153、2.753、4.253和10.253 mg/kg,具体见表1。每个处理设3个空白对照,4个重复,T处理和TS处理各42盆,每盆土壤平衡14 d后,于2021年5月17日统一移栽地肤幼苗,成熟期地肤样品采集时间为2021年10月14日。
1.3 测定项目与方法
在每处理中选取3盆地肤株高、长势、冠幅等一致的地肤,并在每处理的3盆中各移出1株完整植株,用陶瓷剪刀剪下其根、茎鲜样后,立即用液氮冷冻保存于-80℃冰箱,用于抗氧化酶分析。将同盆中3株地肤的根系、茎分装于封口袋并编号,采用根系扫描仪先对地肤的根系形态进行分析后,取根系和茎样品分别置于105℃烘箱中杀青30 min,70℃烘干至恒重(约48 h),称量并记录茎和根系干重,将烘干后的样品(根系和茎)粉碎,过100目筛(孔径0.15 mm),用于Cd含量测定。
地肤的株高采用卷尺测定,测定标准为盆土水平面到植株最尖端的绝对高度,每处理测定3次,取平均值。地肤根系形态指标采用根系扫描仪(Expression 11000XL)扫描后,利用Win RHIZOTM 2000软件系统分析根系的平均直径、总长度、总表面积、总体积及根尖数。地肤植株Cd含量采用湿式消解法和石墨炉原子吸收分光光度法测定[18];叶绿素含量采用丙酮、乙醇混合液萃取法测定[19];丙二醛(MDA)含量采用硫代巴比妥酸法测定[20];SOD活性采用氮蓝四唑光还原法测定[21];POD活性采用愈创木酚法测定[20]。类胡萝卜素的提取参考王琴飞等[22]的方法并做相应的调整。
1.4 数据处理
采用SPSS 25.0软件中的单因素方差分析试验数据(ANOVA),数据的多重比较则运用最小显著差数法(LSD)。用重复度量法分析不同浓度Cd处理、不同pH值及二者交互效应对地肤根系、茎Cd含量的影响。使用GraphPad Prime 8.3作图。
2 结果与分析
2.1 镉胁迫对地肤根系形态特征的影响
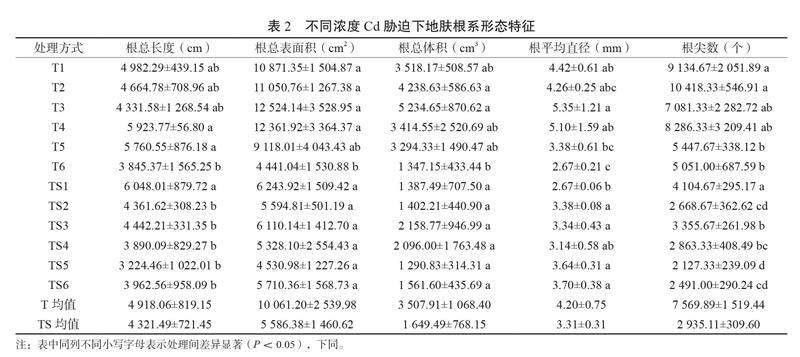
如表2所示,在T1~T3处理下,根总表面积、总长度、平均直径、总体积均无显著变化。在T4~T6处理下根系指标均呈下降趋势,其中,T4和T5处理地肤根总长度、根总表面积、根总体积、根系平均直径变化不显著,但T5处理下的根尖数显著降低(P<0.05),下降了40.37%;T6处理的根总长度与总体积变化不显著,但根总表面积、根系平均直径和根尖数均显著下降(P<0.05),降幅分别为59.15%、39.59%和44.71%,T6处理较T4处理的地肤根总长度、根总表面积以及根系平均直径均显著下降(P<0.05)。可以看出,T处理组的Cd胁迫对地肤根系形态影响程度视具体指标而不同,其中对根尖数影响最为明显。
TS处理组的结果表明,在TS2~TS6处理的根总表面积、根总体积与TS1相比均无显著差异,其中TS1处理下的根总长度、根总表面积和根尖数均为最高,TS2处理下的根总长度、根尖数与TS1相比显著降低(P<0.05),但根系平均直径与TS1相比则上升了26.59%(P<0.05)。
2.2 镉胁迫对地肤叶片光合色素含量的影响
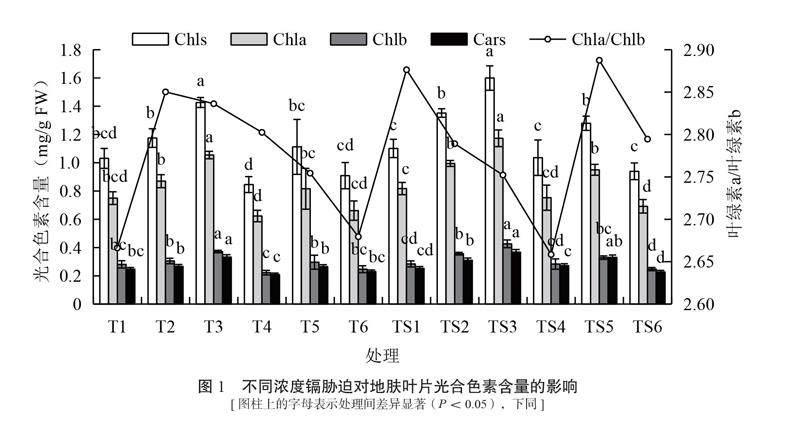
不同浓度Cd胁迫对地肤叶片叶绿素a(Chla)、叶绿素b(Chlb)及类胡萝卜素(Cars)含量的影响见图1。从图1可知,随着Cd浓度增加,T处理组地肤叶片光合色素(Chls)含量总体呈“上升–下降–上升–下降”的变化趋势。其中T3处理叶片Chla、Chlb以及Cars含量最高,且与T1处理存在显著差异(P<0.05),相比T1处理,Chla、Chlb以及Cars含量分别上升40.65%、32.21%和34.72%,其余处理下的Chls含量与T1处理相比均无显著差异。地肤叶片Chla、Chlb以及Cars含量在T4处理下最低,与T1相比分别下降了16.88%、20.92%和15.26%。TS处理组的Chla、Chlb以及Cars分析结果与T处理组的变化趋势相一致,Chla、Chlb以及Cars含量在TS3处理下达到最高,与TS1处理相比分别上升了43.53%、50.00%和45.18%(P<0.05),在TS6处理下为最低,与TS1处理相比分别下降了15.36%、12.88%和10.24%。
2.3 镉胁迫对地肤生长及生物量的影响
由表3可知,T处理组地肤的株高随土壤Cd浓度升高呈“降低–升高–降低”变化趋势,且T6处理下地肤的株高比T1处理下降了15.54%。地肤总生物量和茎生物量在T2~T6处理下均升高,相比T1,T5和T6处理下地肤总生物量显著增加(P<
0.05),且T6处理下茎生物量增加了51.79%。地肤根系生物量从T1至T5处理逐渐升高,T5处理下根系生物量为T1的2.22倍。在TS处理组,地肤总生物量、根系生物量、茎生物量均呈先降后升的趋势。各处理间地肤株高均无显著差异,随着土壤Cd浓度升高,地肤株高变化不显著。相比TS1处理,TS3和TS4处理下地肤茎生物量显著降低(P<0.05),分别下降了42.73%和38.84%,TS4、TS5及TS6处理下地肤根系生物量分别下降了47.19%、61.82%和51.22%。对比不同pH值与相同Cd浓度下地肤的生长情况发现,除T2和TS2处理外,其余浓度Cd胁迫下TS处理组的地肤株高均大于T处理组。除T4和TS4、T5和TS5处理外,其余浓度Cd胁迫下TS处理组下地肤总生物量均大于T处理组,且TS1处理下地肤总生物量、茎生物量和根系生物量在所有Cd处理中均最高,说明地肤在酸性土壤环境中也能正常生长,打破了地肤耐碱性土的局限[18]。地肤茎生物量远高于根系生物量,说明地肤茎为Cd主要积累部位,适宜作为Cd污染土壤的目标修复植物。在T处理组,地肤根冠比值在0.189~0.360之间,均值为0.282;而TS处理组的根冠比值在0.210~0.516之间,均值0.367,其中TS1~TS4处理地肤根冠比分别高于T1~T4处理。
2.4 镉胁迫对地肤抗氧化酶活性和丙二醛含量的影响
2.4.1 超氧化物歧化酶(SOD)活性 Cd胁迫对地肤SOD活性的影响见图2。由图2a可知,T处理组地肤根部SOD活性随土壤Cd处理浓度的升高呈“升高–降低–升高–降低”的变化趋势,而茎部SOD活性呈现先升高后降低的趋势,且相同Cd浓度胁迫下,地肤根部SOD活性大于茎部。地肤根部、茎部SOD活性在T2处理下达到峰值,显著高于T1处理
(P<0.05),分别是T1处理的1.10倍和1.18倍。除T2和T6处理外,其余处理根部SOD活性与T1处理差异不显著,T6处理下根部SOD活性显著低于T1处理,下降了9.39%;T2和T3处理下茎部SOD活性显著高于T1处理(P<0.05),其余处理下则无显著差异。TS处理组地肤根部SOD活性呈“降低–升高–降低–升高”的变化趋势,茎部SOD活性呈“降低–升高–降低”的变化趋势。除TS2外,其余TS处理下根部SOD活性均高于茎部。此外还发现,TS1处理下根部和茎部SOD活性最高,TS5处理下根部和茎部SOD活性最低,与TS1处理相比,TS5处理下根部SOD活性下降了23.74%(P<0.05),茎部SOD活性下降了13.91%。
相同浓度Cd胁迫和不同pH值处理下,地肤根部、茎部SOD活性变化见图2b。由图2b可知,T处理组地肤根部、茎部SOD活性整体均高于TS处理组,可见土壤酸度可在一定程度上有利于稳定地肤SOD活性。
2.4.2 过氧化物酶(POD)活性 Cd胁迫对地肤POD活性的影响见图3。由图3a可知,T处理组地肤根部POD活性呈现“升高–降低–升高–降低”的变化趋势,而茎部POD活性呈现先升后降的趋势,且地肤根部POD活性显著高于茎部(P<0.05)。地肤根部、茎部POD活性在T2处理下达到峰值,分别是T1处理的1.09倍、2.29倍。T3、T5和T6处理根部POD活性显著低于T1(P<0.05),T2~T4处理茎部POD活性显著高于T1处理(P<0.05),为T1处理的1.64~2.29倍。在TS处理组,地肤根部POD活性呈“降低–升高–降低”的变化趋势,茎部POD活性呈“升高–降低–升高–降低”的变化趋势,且根部POD活性显著高于茎部。在TS5处理下,根部POD活性达到最高,是TS1处理的1.24倍,TS3处理下根部POD活性最低,显著低于TS1处理(P<0.05),下降了36.34%,而茎部POD活性在TS2处理下为最高,相比TS1处理显著上升了93.48%;在TS6处理下茎部POD活性最低,相比TS1显著降低了43.78%(P<0.05)。
相同浓度Cd和不同pH值处理下,地肤根部、茎部POD活性变化见图3b。由图3b可知,当Cd添加浓度为0~0.9 mg/kg,T处理组地肤根部POD活性高于TS处理组,而当Cd添加浓度为1.5~9.0 mg/kg,T处理组地肤根部POD活性低于TS处理组;当Cd添加浓度为0~1.5 mg/kg和9.0 mg/kg时,T处理组地肤茎部POD活性显著高于TS处理组,而在Cd添加浓度为3.0 mg/kg,T处理组地肤茎部POD活性显著低于TS处理组。
2.4.3 丙二醛(MDA)含量 Cd胁迫对地肤MDA含量的影响如图4所示。由图4a可知,T处理组地肤根部MDA含量均大于茎部,地肤根部MDA含量呈先升高后降低趋势,在T2处理下,根部MDA 含量最高,显著高于T1处理,是T1处理的1.36倍;在T6处理下根部MDA最低,相比T1处理下降了32.53%(P<0.05);地肤茎部MDA含量呈“升高–降低–升高–降低”的趋势,在T2和T5处理时达到峰值,其中T2茎部MDA含量显著高于T1,是T1处理的5.49倍,除T2处理外,其余处理下茎部MDA含量与T1处理相比均无显著差异。TS处理组地肤根部MDA含量呈“升高–降低–升高–降低”的变化趋势,茎部MDA含量则呈“降低–升高–降低”的变化趋势。在TS2处理下,根部MDA含量达到最高,相比TS1处理上升38.31%;茎部MDA含量在各浓度Cd胁迫下均无显著差异。
相同浓度Cd和不同pH值处理下地肤根部、茎部MDA含量见图4b。TS处理组的地肤根部MDA含量均显著高于T处理组(P<0.05);除Cd添加浓度为0.3 mg/kg外,其他TS处理组茎部MDA含量显著高于T处理组(P<0.05)。
3 讨论
植物根系在应对重金属污染方面起着关键作用,当暴露于Cd胁迫环境时,根系形态很可能发生改变[19],而根系形态决定了其从土壤中获取养分的能力。根长、根表面积、根体积及根平均直径被认为是描述植物根部获取养分能力的重要指标。在研究中,高浓度Cd处理下(T6和TS6)地肤的根总表面积、平均直径、总根长、根尖数等形态指标受到显著影响而降低,可见高浓度Cd胁迫可对地肤根系产生明显伤害,表现在根系形态特征的变化,直接影响地肤根系的吸收能力,也间接导致地肤株高的降低,这与田晓锋等[20]的研究结果一致。TS处理组的根总表面积、总根长及根尖数均小于T处理组,说明土壤酸度会影响根系生长。
光合作用是植物获取物质和能量的基础,光合色素含量是对重金属感应敏感的生理指标之一。已有研究报道,Cd胁迫可通过影响叶片叶绿体结构、光能吸收、光合电子传递、气孔导度和卡尔文循环的酶活性来抑制光合作用[21]。在研究中,低浓度Cd胁迫下(T1~T3)地肤叶绿素含量呈上升趋势,而在高浓度Cd胁迫下(T5~T6)叶绿素含量逐渐下降,可能是因为地肤在低浓度Cd胁迫下所吸收的重金属含量少,植株体内抗氧化酶的解毒作用使叶绿素含量保持在一个稳定的水平,但过量的Cd则破坏了叶绿素合成,导致叶绿素含量降低。
高浓度重金属能抑制植物根尖细胞分裂,降低根系代谢活力,干扰根系对Ca、Mg、Fe等矿质元素的吸收与运输,使得植物体内营养代谢过程紊乱,进而影响植物地上部的生长发育,并导致生物量出现一定程度的下降,而低浓度则会刺激植物生长,即“低促高抑”现象[23]。在研究中,随土壤Cd胁迫浓度的升高,地肤植株生物量整体呈现出升高的趋势,且地肤茎生物量明显高于根系。出现这种情况,可能是地肤具有强耐盐碱特性,这种耐盐植物同样表现出对Cd较强的耐受性,其原因可能是地肤自身存在对Cd的耐受和解毒机制,比如植物螯合素、金属硫蛋白和应激蛋白等的作用[24],具体原因需进一步深入研究。
重金属胁迫可导致植物细胞内活性氧(ROS)的产生,并且对植物生长有害。学界普遍认为,重金属对植物细胞的损害主要是由于细胞中产生过量的ROS所导致,如超氧阴离子自由基(O2-·)、羟基自由基(·OH)和过氧化氢(H2O2)等[25]。因此,减轻植物在重金属胁迫下的氧化应激损伤非常重要。MDA是植物细胞受胁迫时发生膜脂过氧化的最终产物,其含量可直接反映植物细胞氧化损伤程度。在研究中,T处理组地肤根系组织的MDA含量在T2~T6处理时下降,说明随着Cd浓度升高,地肤根系组织的抗氧化酶活性(SOD、POD)构成了地肤的活性氧清除系统,有效清除地肤根部细胞的自由基和过氧化物;地肤茎中的MDA含量在T3~T5处理时升高,T6处理时降低,这与姚俊修等[26]的研究结果一致。T处理组地肤根系、茎组织中的MDA含量在Cd胁迫下显著低于TS处理组,说明土壤酸胁迫同样可导致地肤体内产生大量MDA,使得细胞膜受损严重,这与戴学斌等[27]发现黑麦草中MDA含量随土壤pH值升高而显著降低的结果一致。
抗氧化酶系统对于植物抵御逆境胁迫非常重要,在重金属胁迫下可协同清除由其产生的活性氧基团,从而保护植物细胞不受破坏[28]。SOD是抗氧化防御系统中重要的酶类,可迅速催化超氧化物分解成H2O和O2,POD则是另一种对植物生长发育至关重要的抗氧化酶,可对逆境胁迫迅速作出响应。低浓度Cd胁迫可诱导抗氧化酶活性提高,当Cd浓度超过其承受阈值后,植物体内的抗氧化酶活性受到抑制,从而对组织和细胞生物膜及酶系统造成破坏,影响蛋白质合成等多种代谢活动,进而对植物产生损害。在研究中,随着Cd处理浓度增加,地肤茎部SOD、POD活性均呈现出先升后降的趋势,同于赵胡等[29]研究重金属胁迫下秋茄叶片的抗氧化酶变化情况。具体来看,当Cd添加浓度在0~0.3 mg/kg范围内时,地肤植株POD、SOD活性随Cd浓度增加而显著增加,MDA含量也呈上升趋势,在Santos等[30]的研究中也发现了类似结果。Cd胁迫虽在一定程度上提高了POD和SOD的活性,但并不能阻止膜脂过氧化的发生,植物自身防御系统仍会遭到破坏。低浓度Cd处理下(0~0.9 mg/kg),T处理组(pH值6.1)地肤根系和茎的SOD、POD活性均高于TS处理组(pH值5.0),表明土壤初始pH值6.1环境下地肤对自由基的清除能力较强。土壤酸度和Cd的双重胁迫可导致地肤植株产生过多的活性氧自由基,超出了地肤所能承受的阈值,致使抗氧化酶活性下降。综上所述,地肤在酸性土壤和Cd的双重胁迫下,其抗氧化酶系统遭到破坏,抑制了抗氧化酶活性,导致MDA大量积累,从而影响地肤生理代谢功能,这
与冷芬等[31]对何首乌受酸性土壤影响的研究结果相一致。
4 结论
(1)土壤镉浓度为1.253~10.253 mg/kg之间的土壤对地肤根系长度、根系表面积、根系体积、根系平均直径、根尖数均未产生显著影响。其中1.253~2.753 mg/kg镉胁迫下的地肤根、茎及全株生物量变化较小,对土壤镉的耐受性较强,且能较好地适应偏酸性土壤环境。pH值6.1处理组地肤根系生长发育整体上优于pH值5.0处理组。
(2)土壤镉含量对地肤光合作用的抑制性不明显,但土壤pH降低会提高地肤叶片光合色素含量。
(3)地肤根部SOD、POD活性、MDA含量整体上高于茎部,相同Cd浓度处理下,土壤pH值升高会提高地肤根茎SOD活性,降低MDA含量。地肤的抗氧化酶系统在防御土壤镉污染胁迫方面起到显著保护作用。
参考文献:
[1] 张云霞,宋波,宾娟,等. 超富集植物藿香蓟(Ageratum conyzoides L.)对镉污染农田的修复潜力[J]. 环境科学,2019,40(5):2453-2459.
[2] 宋波,杨子杰,张云霞,等. 广西西江流域土壤镉含量特征及风险评估[J]. 环境科学,2018,39(4):1888-1900.
[3] 杨晓远,王海娟,王宏镔. 龙葵(Solanum nigrum L.)超富集镉的生理和分子机制研究进展[J]. 生态毒理学报,2020,15(6):72-81.
[4] RIZWAN M,ALI S,QAYYUM M F,et al. Use of Maize(Zea mays L.)for phytomanagement of Cd-contaminated soils:a critical review[J]. Environmental Geochemistry and Health,2017,39(2):259-277.
[5] WANG P,DENG X J,HUANG Y A,et al. Root morphological responses of five soybean [Glycine max(L.)Merr] cultivars to cadmium stress at young seedlings[J]. Environmental Science and Pollution Research International,2016,23(2):1860-1872.
[6] 王效瑾,高巍,赵鹏,等. 小麦幼苗根系形态对镉胁迫的响应[J]. 农业环境科学学报,2019,38(6):1218-1225.
[7] GE L Q,CANG L,YANG J,et al. Effects of root morphology and leaf transpiration on Cd uptake and translocation in rice under different growth temperature[J]. Environmental Science and Pollution Research International,2016,23(23):24205-24214.
[8] WEI S H,ZHOU Q X. Phytoremediation of cadmium-contaminated soils by Rorippa globosa using two-phase planting[J]. Environmental Science and Pollution Research International,2006,13(3):151-155.
[9] 孙瑞莲. 镉超积累植物的生态特征及污染耐性机理分析[D]. 沈阳:中国科学院研究生院(沈阳应用生态研究所),2006.
[10] ZHANG H H,LI X,XU Z S,et al. Toxic effects of heavy metals Pb and Cd on mulberry(Morus alba L.)seedling leaves:Photosynthetic
function and reactive oxygen species (ROS) metabolism responses[J].
Ecotoxicology and Environmental Safety,2020,195:110469.
[11] 麻莹,王晓苹,姜海波,等. 盐碱胁迫下碱地肤体内的有机酸积累及其草酸代谢特点[J]. 草业学报,2017,26(7):158-165.
[12] RA?KO M,OZD?N D,KU?EROV? G,et al. Occurrence and uptake of heavy metals by selected terrestrial orchids in extreme conditions of initial soils on previous mining sites[J]. Biologia,2021,76(7):2113-2122.
[13] 熊敏先,吴迪,许向宁,等. 土壤重金属镉对高等植物的毒性效应研究进展[J]. 生态毒理学报,2021,16(6):133-149.
[14] ZHANG Q,CHEN H F,HUANG D Y,et al. Water managements limit heavy metal accumulation in rice:Dual effects of iron-plaque formation and microbial communities[J]. Science of the Total Environment,2019,687:790-799.
[15] 李雅博,李婷,韩莹琰,等. 叶用莴苣热激蛋白基因LsHsp70-2711的克隆及高温胁迫下的功能分析[J]. 中国农业科学,2017,50(8):1486-1494.
[16] 王学奎. 植物生理生化实验原理和技术2版[M]. 北京:高等教育出版社,2006.
[17] 路文静,李奕松. 植物生理学实验教程[M]. 北京:中国林业出版社,2012.
[18] 田浩然,杨傲,刘航铄,等. 盐碱胁迫对碱地肤的生物量及含氮化合物的影响[J]. 草业科学,2019,36(7):1837-1842.
[19] BORGES K L R,HIPPLER F W R,Carvalho M E A,et al. Nutritional status and root morphology of tomato under Cd-induced stress:Comparing contrasting genotypes for metal-tolerance[J]. Scientia Horticulturae,2019,246:518-527.
[20] 田晓锋,魏虹,贾中民,等. 重金属镉(Cd2+)对梧桐幼苗根生长及根系形态的影响[J]. 西南师范大学学报(自然科学版),2008,33(2):93-98.
[21] AZHAR M,ZIA UR REHMAN M,ALI S,et al. Comparative effectiveness of different biochars and conventional organic materials on growth,photosynthesis and cadmium accumulation in cereals[J]. Chemosphere,2019,227:72-81.
[22]王琴飞,张如莲,徐丽,等. HPLC测定西番莲中叶黄素和β-胡萝卜素[J]. 热带作物学报,2016,37(3):609-614.
[23] 公勤,王玲,戴同威,等. 铜处理对菠菜幼苗矿质营养吸收和细胞超微结构的影响[J]. 应用生态学报,2019,30(3):941-950.
[24] SALT D E,RAUSER W E. MgATP-dependent transport of phytochelatins across the tonoplast of oat roots[J]. Plant Physiology,1995,107(4):1293-1301.
[25] RAMA DEVI S,PRASAD M N V. Copper toxicity in Ceratophyllum demersum L.(Coontail),a free floating macrophyte:
Response of antioxidant enzymes and antioxidants[J]. Plant Science,1998,138(2):157-165.
[26] 姚俊修,陈甘牛,李善文,等. 镉胁迫对黑杨派无性系生理生化特性及生长的影响[J]. 北京林业大学学报,2020,42(4):12-20.
[27] 戴学斌,许瑜兴,邓义,等. 土壤酸胁迫对黑麦草生长生理及镉富集特征的影响[J]. 水土保持研究,2021,28(6):389-396.
[28] 马永龙,朱珠,王艳莉,等. 中国沙棘幼苗对土壤镉生理耐性和富集转运特征的性别差异[J]. 西北植物学报,2023,43(2):285-294.
[29] 赵胡,唐俊,郑文教. 重金属Cu2+胁迫对红树植物秋茄幼苗生长及某些生理特性的影响[J]. 海洋科学,2016,40(4):65-72.
[30] SANTOS D,DUARTE B,CA?ADOR I. Biochemical and photochemical feedbacks of acute Cd toxicity in Juncus acutus seedlings:The role of non-functional Cd-chlorophylls[J]. Estuarine,Coastal and Shelf Science,2015,167:228-239.
[31] 冷芬,杨在君,吴一超,等. 土壤pH值对何首乌生理及其光合特性和有效成分含量的影响[J]. 西北植物学报,2020,40(9):1566-1573.
(责任编辑:肖彦资)
收稿日期:2023-11-30
基金项目:湖南省自然科学基金科教联合基金(2022JJ60096)
作者简介:黎标(1989—),男,湖南衡阳市人,工程师,主要从事污染防控研究。
通信作者:谭菊
