?湖南多花黄精快速繁殖体系的建立?
2024-06-30唐铭鑫符天昊杨韬坛沈子豪龚海健欧跃红刘叶蔓宁露云
? 唐铭鑫 符天昊 杨韬坛 沈子豪 龚海健 欧跃红 刘叶蔓 宁露云

摘要:该研究分别以叶片、根状茎、芽以及种子为外植体,基于前人研究对培养基配方进行优化,共确定了21种培养基配方,从中筛选适用于湖南多花黄精的最佳萌发培养基、最佳增殖培养基以及最佳生根培养基配方,建立了湖南多花黄精快速繁殖体系。结果表明:以当年采收的种子为外植体,消毒后纵切再接种培养效果较好;最佳萌发培养基配方为:B5+1.0 mg/L 6-BA+0.5 mg/L KT+30 g/L蔗糖+6.0 g/L琼脂+2.0 mg/L GA3;最佳增殖培养基配方为:MS+4.0 mg/L 6-BA+0.2 mg/L NAA+30 g/L蔗糖+6.5 g/L琼脂;最佳生根培养基配方为:1/2 MS+1.0 mg/L NAA+30 g/L蔗糖+6.5 g/L琼脂。该研究为湖南多花黄精组培苗的生产奠定了坚实的理论基础,为进一步扩大多花黄精的人工种植规模提供了技术支撑。
关键词:多花黄精;组织培养;萌发;增殖;生根
中图分类号:S567.239文献标识码:A文章编号:1006-060X(2024)05-0007-06
A Rapid Propagation System for Polygonatum cyrtonema in Hunan
TANG Ming-xin1,FU Tian-hao1,YANG Tao-tan1,SHEN Zi-hao1,GONG Hai-jian1,OU Yue-hong2,
LIU Ye-man1,NING Lu-yun1
(1. Hunan University of Chinese Medicine, Changsha 410208, PRC; 2. Loudi Zhifang Biotechnology Co., Ltd., Loudi 417000, PRC)
Abstract: This study aimed to establish a rapid propagation system for Polygonatum cyrtonema in Hunan. With the leaves, rhizomes, buds, and seeds as explants, 21 media were designed based on the available studies, and the optimal media for germination, propagation, and rooting of P. cyrtonema were selected. The results indicated the fresh seeds harvested in the current year were the best explants, and those disinfected and cut longitudinally showcased good performance in tissue culture. The optimal medium for germination was B5 + 1.0 mg/L 6-BA + 0.5 mg/L KT + 30 g/L sucrose + 6.0 g/L agar + 2.0 mg/L GA3. The optimal medium for propagation was MS + 4.0 mg/L 6-BA + 0.2 mg/L NAA + 30 g/L sucrose + 6.5 g/L agar. The optimal medium for rooting was 1/2 MS +
1.0 mg/L NAA + 30 g/L sucrose + 6.5 g/L agar. The findings lay a theoretical foundation for producing tissue culture seedlings and provide technical support for expanding the planting scale of P. cyrtonema in Hunan.
Key words: Polygonatum cyrtonema; tissue culture; germination; propagation; rooting
中药黄精味甘性平,具有养阴润肺、补气健脾的功效,主治心悸气短、肺燥干咳、久病津亏口干、体虚乏力以及糖尿病、高血压等症,属于常用的药食同源植物[1]。据《中华人民共和国药典》记载,中药黄精为百合科(Liliaceae Juss)黄精属(Polygonatum Mill)植物黄精(Polygonatum sibiricum Red.)、滇黄精(Polygonatum kingianum Coll. et Hemsl.)或多花黄精(Polygonatum cyrtonema Hua)的干燥根茎[2]。其中,黄精在内蒙古武川、卓资、凉城和河北遵化、兴隆、承德等地区分布较多;滇黄精主要分布于云南、四川及贵州等地;多花黄精则主要集中在湖南、安徽、湖北、浙江等南方地区[3]。湖南省内分布的黄精资源十分丰富,有多花黄精、卷叶黄精、轮叶黄精、滇黄精、二苞黄精、长梗黄精、湖北黄精和垂叶黄精等,其中分布最广的为多花黄精,品质上乘且蕴藏量大,是我国多花黄精的主要产地之一[4]。随着对多花黄精的开发利用,其野生资源远远不能满足市场需求,发展人工栽培技术、扩大多花黄精的人工种植规模具有重要的现实意义。
多花黄精结实量大,但种子存在形态休眠和生理休眠现象[5-6],成苗率低,育苗周期长(播种后2 a才能长出真叶)[7],在一定程度上限制了多花黄精的栽培和应用。在多花黄精常规栽种中,通常以根状茎进行繁殖,一般选用长势好且具有健康芽头的根状茎做种[8],也可以选择1~2年生且健壮、无病害的根状茎先端的幼嫩部分栽种[9]。但由于移栽时期、种苗标准不一,成活率不高,需要大量补苗,并且成活后的植株生长不一致,严重制约了多花黄精的标准化生产。此外,虽然根状茎繁殖取材方便、操作简便,但是需要耗费大量的药用部位,成本较高,并且长期利用无性繁殖容易造成感染病害、品种退化等问题。
随着植物生物技术的快速发展,科研工作者对多花黄精的高效再生体系进行了积极探索,目前已取得了一些进展:王辉等[10]以多花黄精种子萌发后的幼芽为启动材料进行组织培养,选出了最佳愈伤组织诱导、不定芽增殖及生根培养方案;莫勇生等[11]以多花黄精无菌种子为外植体,选出了多花黄精组培过程中启动培养、继代培养及生根壮苗的最佳培养基配方;陈松树等[12]则建立了以叶片为起始材料的多花黄精再生体系,在MS培养基的基础上添加不同浓度的2,4-D、NAA和6-BA,成功筛选出诱导愈伤组织、丛生芽以及生根的最佳培养基配方;吴宇函等[13]以未成熟的多花黄精果实为外植体,成功建立了植株组培快繁体系;刘芳源等[14]以多花黄精根状茎为外植体筛选出芽增殖系数较高的配方。此外,还有一些以种子、根状茎为外植体的多花黄精组培体系的报道[15-18]。但是,不同地区的多花黄精种质资源遗传背景存在差异,故其组织培养体系可能不能通用。
湖南省为多花黄精的主要产地之一,栽培规模大,亟需大量种苗,导致目前多花黄精种苗价格居高不下。该研究分别以叶片、根状茎、芽以及种子为外植体,基于前人研究对培养基配方进行优化,筛选适用于湖南多花黄精的最佳萌发培养基、最佳增殖培养基以及最佳生根培养基配方,建立湖南多花黄精快速繁殖体系,旨在为多花黄精组培苗的工厂化生产以及稳定供应奠定坚实的理论基础,为扩大多花黄精的人工栽培提供技术支撑。
1 材料与方法
1.1 试验材料
研究所用多花黄精外植体材料均来自湖南省怀化市雪峰山林场,于2022年9月收集成熟的多花黄精果实,人工去除果皮、清洗晾干后将种子保存于4 ℃冰箱备用,视为当年采收种子。同时,冰箱里保存有2021年采收的种子,视为往年种子。
1.2 试验方法
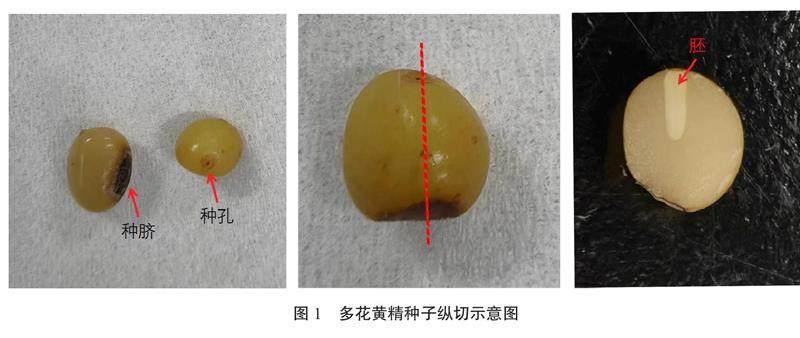
1.2.1 外植体处理 首先将外植体(叶片、根状茎、芽和种子)用清水洗净,并放到流水下冲洗过夜,之后在超净工作台中操作:75%酒精润洗45 s,0.1%升汞消毒7 min,无菌水冲洗5遍,置于无菌滤纸上吸干备用。将消毒后的叶片切成0.8 cm×0.8 cm的小块;将根状茎切成长0.8 cm、宽0.8 cm、厚0.3 cm的小块;将带芽根状茎切去多余部分,保留芽头;将种子直接接种到培养基中,或沿种孔和种脐的方向纵切,保留含有白色胚的部分(图1);将上述处理后的外植体放到对应的培养基中。
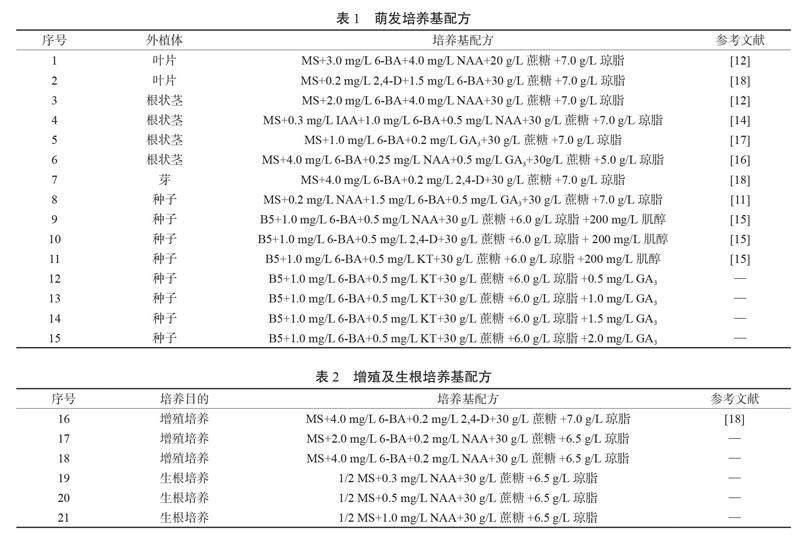
1.2.2 培养基配方 该研究共确定了21种培养基配方,其中萌发培养基配方见表1,增殖和生根培养基配方见表2。MS、1/2 MS以及B5培养基购自青岛海博生物技术有限公司,所有激素均购自Sigma公司,蔗糖、琼脂和肌醇购自上海麦克林生化科技股份有限公司。
1.2.3 培养方法 配方1~6:以叶片和根状茎为外植体分别培养3批,每批12个皿,每个皿接种12~15块外植体;配方7:以基地采的地下根状茎芽为外植体培养3批,每批12瓶,每瓶接种2~3个芽;配方8~11:以完整种子和纵切种子作为外植体分别培养3批,每批12个皿,每个皿接种6~12颗种子;配方12~15:将种子纵切后接种,分别培养3批,每批12个皿,每个皿接种6~12颗种子;配方16~18:以无菌种子萌发的初生根状茎为外植体,每个配方培养3批,每批15瓶,每瓶接种1~3个芽;配方19~21:将增殖培养得到的丛生芽按单个生长点切下(同时带有部分根状茎组织),垂直插入培养基中,每个配方接种3批,每批15瓶,每瓶2~3棵。
1.2.4 灭菌与培养条件 所有培养器皿、接种工具以及不同配方的培养基均在121 ℃、0.125 MPa条件下灭菌25 min后使用(其中GA3为抽滤灭菌);所有培养基pH调至5.8~6.0;组培室培养条件设置为:光照强度2 000 lx、温度25 ℃、湿度80%、白天和黑夜各12 h。
1.3 数据处理
采用SPSS 22软件对数据进行处理与统计学分析。
2 结果与分析
2.1 萌发培养基配方的筛选
2.1.1 以叶片、根状茎和芽为外植体的培养情况 在配方1~6号培养基中,叶片及根状茎都在培养30 d内褐化死亡;在配方7号培养基中,根状茎芽陆续污染死亡(可能是使用的地下根状茎芽携带大量土壤微生物,外植体消毒难度较高导致消毒不彻底),而未出现污染的材料直至60 d后也无任何生长迹象,芽头一直处于休眠状态。可见,配方1~7号培养基不适用于湖南多花黄精的培养。
2.1.2 以种子为外植体的培养情况 在配方8号培养基中,完整种子和纵切种子在培养40 d后均未萌发;在配方9~11号培养基中,完整种子培养40 d后未萌发,但纵切种子培养20 d即生出初生根状茎和芽,开始萌发,以多花黄精种子为外植体的组织培养过程见图2。培养40 d后对纵切种子萌发率进行统计(图3),结果表明,配方9~11号培养基中的萌发率都比较低。为了提高萌发率,该研究在配方11的基础上进行了改良,得到了配方12~15。同样将种子纵切后接种,培养至40 d统计萌发率。如图3所示,在添加GA3后,多花黄精种子萌发率有了显著提高,尤其是配方14和配方15。以上结果均来自当年采收的新鲜种子。同时,该研究对保存在冰箱的往年种子进行了相同的萌发试验,发现往年种子内生菌较多,污染严重,无法进行后续试验。由此可知,往年种子不适合作为外植体进行多花黄精的快速繁殖,应以当年采收的新鲜种子为宜。
2.2 增殖培养基配方的筛选
为了筛选适合湖南多花黄精芽增殖的培养基配方,该研究在前人研究结果(配方16)的基础上另外设计了配方17和18,并以由种子萌发后分化的带芽初生根状茎为材料进行增殖培养。培养结果发现,在18号培养基中,10 d后便可看到初生根状茎明显膨大,并伴随多个芽生长点的分化,之后陆续长出叶片。根据图4可知,与另外2个配方相比,配方18的芽长势最旺,叶片肥厚浓绿。最后对培养40 d的材料进行芽增殖倍数的统计(图5),发现配方18的芽增殖倍数最高,可达19.48倍,显著高于配方16和配方17。这些结果说明配方18比较适合湖南多花黄精芽的增殖培养。
2.3 生根培养基配方的筛选
生根培养是生产组培苗的一个重要过程。1/2 MS培养基是植物组织培养中常用的生根培养基,与MS培养基相比,1/2 MS培养基中大量元素减半,更有利于生根。该研究在1/2 MS培养基的基础上添加不同浓度的NAA,设计了配方19~21,探讨多花黄精芽的生根情况。培养10 d后,配方21中出现根的分化,其他配方在15~20 d后才陆续出现根的分化。30 d后观察3个配方中芽的生根情况,根据图6可知,配方21中的根系明显比另外2个配方发达,更有利于后续的炼苗移栽。对3个配方中芽的生根率进行统计,根据图7可知,配方21的生根率高达90.62%,显著高于配方19和20。
3 讨论与结论
湖南省内分布的黄精资源丰富,其中多花黄精分布最广、品质上乘且蕴藏量大[4]。近年来,人们对多花黄精的需求持续增高,湖南各地区开始大量种植多花黄精,如娄底新化、怀化洪江、益阳安化等地。大规模的种植需要大量的种苗,而多花黄精种子存在休眠机制,因而繁殖难度较大,且长期利用根状茎繁殖易造成品种退化[19],这些不利因素极大地制约了湖南多花黄精种植规模的扩大。植物组织培养技术具有繁殖速度快、脱毒、占用空间小等优势,目前已经成功应用到多种植物的种苗生产
中[20-22]。目前,植物组织培养技术也已经开始应用到多花黄精的种苗研究中[10-18],但是鲜有关于湖南多花黄精组织培养体系的报道。因此,该研究在前人的研究基础上对不同阶段的培养基配方进行了优化,以期建立适用于湖南多花黄精的快速繁殖体系。
首先,该研究发现配方1~8均不能诱导愈伤组织与芽的萌发,其中叶片和根状茎最终都褐化死亡,而芽和种子均不能解除休眠。配方1~8所参考的研究中的试验材料均来自不同地区,可见由于材料的遗传背景不同,使用同一配方进行培养,结果也会存在差异。此外,参考钟灿等[15]的配方9~11进行培养时,发现种子萌发率较低。GA3常用于解除种子休眠[23],因此,该研究基于配方11进行改良,在配方中添加了不同浓度的GA3,结果配方14和15中种子萌发率显著高于其它配方。但是,目前配方中最高的萌发率还不到20%,故后续还需要进一步优化配方,提高种子萌发率。
在增殖培养中,3个配方都能促进初生根状茎中芽的增殖并形成愈伤组织,但配方18的增殖倍数显著高于其他2个配方。可见,2,4-D和NAA虽然都是生长素类的植物激素,但是在湖南多花黄精芽的增殖过程中NAA效果更好。在生根培养中,设计了3个配方,其中配方19的生根率明显低于配方20和21,且长出的根系稀疏;而配方21中多花黄精根系发达且生根率高达90.62%。而根据王辉等[10]的研究:1/2 MS+0.1 mg/L NAA为最适宜的生根培养基配方,这个配方中NAA的浓度低于笔者研究设计配方的NAA浓度,出现这种差异的原因可能是试验材料的产区不同,说明湖南多花黄精的生根诱导需要较高浓度的NAA。
综上所述,基于前人研究经验,该研究对培养基配方进行了优化,最终成功建立了湖南多花黄精快速繁殖体系:以当年采收的种子为外植体,消毒后进行纵切再接种培养;最佳萌发培养基配方为:B5+1.0 mg/L 6-BA+0.5 mg/L KT+30 g/L蔗糖+6.0 g/L琼脂+2.0 mg/L GA3;最佳增殖培养基配方为:MS+4.0 mg/L 6-BA+0.2 mg/L NAA+30 g/L蔗糖+6.5 g/L琼脂;最佳生根培养基配方为:1/2 MS+1.0 mg/L NAA+30 g/L蔗糖+6.5 g/L琼脂。该研究为湖南多花黄精组培苗的生产奠定了坚实的理论基础,为进一步扩大湖南多花黄精的人工种植规模提供了技术支撑。
参考文献:
[1] 郑汉臣,蔡少青. 药用植物学与生药学[M]. 北京:人民卫生出版社,2004.
[2] 国家药典委员会. 中华人民共和国药典-一部:2020年版[M]. 北京:中国医药科技出版社,2020.
[3] 董治程. 不同产地黄精的资源现状调查与质量分析[D]. 长沙:湖南中医药大学,2012.
[4] 梁忠厚,李有清,邹青,等. 湖南省黄精产业发展现状与对策[J]. 湖南生态科学学报,2020,7(3):35-42.
[5] 陈怡,柳雪晨,陈松树,等. 多花黄精种子萌发过程的形态和解剖研究[J]. 种子,2020,39(2):5-10.
[6] 陈怡,杨赋祺,陈松树,等. 多花黄精种子萌发过程的内源激素含量变化研究[J]. 中药材,2020,43(3):523-527.
[7] LIU R,LU J,XING J Y,et al. Transcriptome and metabolome analyses revealing the potential mechanism of seed germination in Polygonatum cyrtonema[J]. Scientific Reports,2021,11:12161.
[8] 田启建,赵致,谷甫刚. 栽培黄精种苗的分级及移栽时期的选
择[J]. 贵州农业科学,2010,38(6):93-95.
[9] 罗敏,章文伟,邓才富,等. 药用植物多花黄精研究进展[J]. 时珍国医国药,2016,27(6):1467-1469.
[10] 王辉,肖小君,唐晨,等. 多花黄精(Polygonatum cyrtonema Hua)高效再生体系的建立[J]. 分子植物育种,2022,20(16):5386-5393.
[11] 莫勇生,卢拓方,邱展鸿,等. 多花黄精组培苗快速繁殖体系建立研究[J]. 中国现代中药,2018,20(4):445-449.
[12] 陈松树,张雪,赵致,等. 以叶片为外植体的多花黄精组织培
养[J]. 北方园艺,2018(14):136-142.
[13] 吴宇函,俞涵曦,韩晓文,等. 多花黄精植株再生及繁殖研究[J]. 种子,2019,38(7):90-95.
[14] 刘芳源,王钰,开桂青,等. 多花黄精组培体系建立及薯蓣皂苷等含量测定[J]. 生物学杂志,2017,34(6):93-96.
[15] 钟灿,劳嘉,金剑,等. 基于激素及其配比探讨多花黄精种子组培体系的建立[J]. 北方园艺,2020(13):118-123.
[16] 刘剑东,幸菲菲,彭思静,等. 多花黄精丛生芽的诱导与增殖条件[J]. 植物生理学报,2020,56(6):1277-1285.
[17] 饶宝蓉,刘忠辉,周先治,等. 栽培基质对多花黄精组培苗生长的影响[J]. 中草药,2020,51(24):6337-6344.
[18] 何艳,朱玉球,肖波,等. 多花黄精组织培养体系的研究[J]. 中国中药杂志,2019,44(10):2032-2037.
[19] 宁露云,李芷仪,李志远,等. 多花黄精繁殖技术与分子生物学研究进展[J/OL]. 分子植物育种,1-21[2023-12-10]. http://kns.cnki.net/kcms/detail/46.1068.S.20220520.1817.021.html.
[20] 郝征,靳茜,何富强,等. 草莓种苗脱毒及繁育技术研究进展[J]. 分子植物育种,2023,21(12):4006-4013.
[21] 张冰冰,叶艳英,周劲松,等. 双边栝楼的组织培养与快速繁殖[J]. 种子,2022,41(6):127-131,136,149.
[22] 张成才,王升,王月枫,等. 药用植物组织培养技术在中药资源可持续发展中的应用研究[J]. 中国中药杂志,2023,48(5):1186-1193.
[23] 王锐,张志敏,姚琪馥,等. 生长物质处理剂对梵净山多花黄精种子萌发的影响[J]. 中药材,2019,42(5):982-984.
(责任编辑:王婷)
收稿日期:2023-12-18
基金项目:湖南省自然科学基金项目(2023JJ40482);湖南中医药大学2022年度校级大学生创新训练项目;湖南省教育厅科学研究项目(22C0189);2023年湖南省重点研发计划(2023SK2046);2022年度中医药民族医药国际联合实验室开放基金(2022GJSYS09);湖南中医药大学校级科研项目(2021XJJJ015)
作者简介:唐铭鑫(2002—),男,湖南衡阳市人,本科生,研究方向为植物生物技术。
通信作者:刘叶蔓,宁露云
