高中化学“碱金属元素”的项目式教学实践
2024-06-30张锦程
张锦程


一、项目主题内容分析
项目式学习(PBL)是以建构主义理论为指导,以小组协作的形式进行规划和解决项目任务的学习方式。学生通过经历事先精心设计的项目和一连串任务,在复杂及真实的学习环境中不断进行探索和学习,从而获得所需知识,解决项目过程中碰到的问题,实现有意义的学习。2019人教版必修一教材,把第四章第一节“原子结构与元素周期表”划分为3个课时,其中最后一个课时为“原子结构与元素的性质”。新教材采用了预测的方法,引导学生发现碱金属元素之间性质的相似性和递变规律。“探秘碱金属,‘预见119”项目创意新颖,紧贴学生实际,涉及到的知识规律性强。在教学中,笔者将项目拆分成“初探钠和钾”“再探碱金属”“‘预见119”3个任务展开,在问题解决过程中借助“预测一观察一解释”的POE策略、从“位置一结构一性质”视角研究元素的性质,根据碱金属元素性质的相似性和递变性,让学生预测未知元素的性质,设计专属名片,体会科学与艺术的结合,感受化学学科魅力。
二、项目教学目标
1.通过预测钾的化学性质,观察钾与氧气、水反应的实验,认识钠与钾性质的相似性和不同之处,培养“宏微结合”和“变化观念”的核心素养;
2.通过预测锂、铷、铯的化学性质,观察碱金属单质与氧气、水反应的实验,理解同主族元素性质的递变规律及与原子结构的关系,发展“科学探究”与“证据推理”的核心素养;
3.能从位、构、性视角研究元素的性质,通过预测未知元素性质和为未知元素设计名片,体会“预测”这种方法在化学科学研究中的应用,发展“科学态度”与“创新意识”的核心素养。
三、教学流程
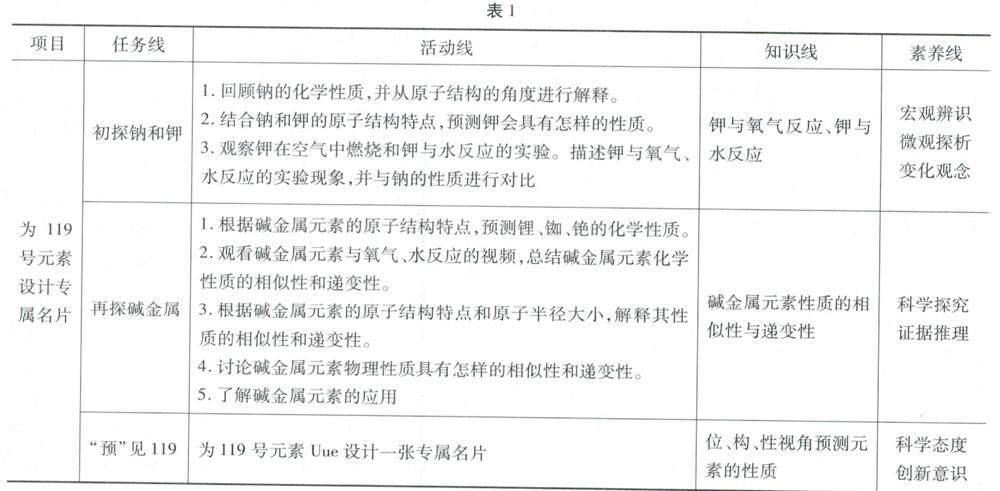
具体教学流程见表1。
四、项目实施过程及学生学习成果
[创设情境]镓是化学史上第一个先从理论预言后在自然界中被发现验证的元素。1871年,门捷列夫发现元素周期表中铝元素下方有个间隙尚未被占据,他预测这种未知元素的相对原子量大约是68,密度为5.9g/cm3,性质与铝相似,他的这一预测被法国化学家布瓦博德兰证实。
[学生活动]2名学生分别扮演门捷列夫和布瓦博德兰,表演元素镓的发现过程中2人争论的故事。
[问题引入]门捷列夫能够根据元素的位置预测元素的性质,同学们想不想成为和门捷列夫一样厉害的化学家、预言家呢?目前,俄罗斯和日本科学家正尝试合成119号元素Uue,如何预测该元素的性质并为它设计一张专属名片呢?
[学生观点]根据元素周期表的编排规则,119号元素位于第8周期第ⅠA族。可以效仿门捷列夫,通过第ⅠA族中已经学过的金属钠的性质,预测119号元素的性质。
[过渡]钠和119号元素都位于第ⅠA族,但钠位于第3周期,119号元素位于第8周期,直接通过钠的性质预测119号元素的性质是否合理呢?我们不妨先通过钠的性质预测位于钠下方的钾的性质,再找到碱金属元素性质的规律,从而预测119号元素的性质。
[任务1]初探钠和钾
[教师]回忆金属钠的化学性质,描述钠与氧气、水反应的实验现象。
[学生]钠在常温下与氧气反应生成氧化钠,在加热条件下生成过氧化钠。钠与水反应生成氢氧化钠和氢气。常温下,银白色的钠表面很快变暗;加热条件下,钠先熔化,再剧烈燃烧,产生黄色火焰,生成淡黄色固体。钠与水反应,钠浮在水面上,熔成光亮的小球,四处游动,发出嘶嘶的响声,滴入酚酞,溶液变红。
[教师]如何从结构的角度解释钠具有的化学性质?
[学生]钠原子的最外层电子数为1,容易失去电子形成钠离子。
[教师]根据钾的原子结构,你认为钾会具有怎样的性质?
[学生]钾原子的最外层电子数也为1,也容易失去电子形成钾离子,具有金属性,具体表现在也能和氧气反应,也能和水反应。
[教师]钾的性质是否和预测的一样呢?观察实验,描述实验现象。
[演示实验]钾与氧气反应、钾与水反应。
[学生]钾与氧气反应,先熔化再剧烈燃烧,产生紫色火焰,生成黄色固体。钾与水反应,钾浮在水面上,熔成光亮的小球并剧烈燃烧,四处游动,发出爆炸声,滴入酚酞,溶液变红。
[教师]钾与氧气反应生成的黄色固体有过氧化钾(K2O2)和超氧化钾(KO2)。比较钠和钾与氧气、水反应的实验现象,你能得出什么结论?
[学生]钠和钾都能与氧气和水反应,且钾更活泼。
[过渡]钠和钾性质上有相似性和不同之处,这样的规律是只存在于这2种元素之间还是所有的碱金属元素之间呢?
[任务2]再探碱金属
[教师]根据碱金属元素的原子结构特点(见表2),预测锂、铷、铯的化学性质。
[学生]锂、铷、铯的最外层电子数都为1,容易失去电子形成+1价的离子,具有金属性,具体表现为可以与氧气和水反应。
[教师]事实和推测是否一致呢?观看视频,并尝试总结碱金属元素的化学性质。
[视频]碱金属单质与氧气和水的反应。
[教师]锂与氧气反应只生成氧化锂;钠与氧气反应,常温下生成氧化钠,加热时生成过氧化钠;钾与氧气反应,常温下生成氧化钾,加热时生成过氧化钾和超氧化钾;铷和铯,除了生成氧化物、过氧化物、超氧化物以外,还会生成臭氧化物。你认为碱金属单质与氧气的反应有怎样的规律?
[学生]碱金属单质,从锂到铯,与氧气的反应越来越剧烈,生成物越来越复杂。
[教师]无论哪种碱金属单质,与水反应都会生成对应的氢氧化物和氢气,那么通过视频,你发现碱金属单质与水的反应又有怎样的规律呢?
[学生]碱金属单质,从锂到铯与水的反应越来越剧烈。
[教师]将碱金属单质与氧气和水反应的规律总结成一句话,就是碱金属元素,从锂到铯,金属性逐渐增强。结构决定性质。如何从结构的角度,解释碱金属元素性质的相似性与递变性呢?
[学生]碱金属元素原子的最外层电子数都为1,都容易失去电子形成+1价的离子,都表现金属性,具有相似性。
[学生]碱金属元素,从上到下,核电荷数依次增多,电子层数依次增大,原子半径依次增大,原子核对最外层电子的引力依次减小,失去电子的能力依次增大,金属性逐渐增强。
[教师]化学性质具有相似性和递变性,物理性质呢?观察表格(见表3),总结规律。
[学生]碱金属元素,从锂到铯,都为银白色金属(除了铯略带金色光泽),都很柔软,密度依次增大,钠钾反常,熔沸点依次降低。
[教师]钠钾合金的熔点低于纯金属钠和钾的熔点,因此钠钾合金常用作核反应堆的导热剂。性质决定用途。碱金属元素还被用作锂电池、碱金属蒸气激光器、铷铯原子钟等等。
[过渡]找到了碱金属元素的相似性和递变性,就可以预测119号元素的性质了。
[任务3]“预”见119
[教师]尝试预测119号元素的性质,并为它设计一张专属名片。
[学生]设计名片(如图1所示)。
五、项目教学反思(略)
(收稿日期:2024-01-35)
