把握原则 赏析离子推断的分类
2024-06-30王震
王震
离子推断是离子性质的具体应用,它是基于离子的特征性质与特征反应,根据一定的实验现象(如沉淀的颜色、气体的气味、溶液颜色的变化等),排除有关离子的相互干扰,通过定性分析或定量计算,推断出溶液中有关离子是否存在。
一、关于离子推断的原则
1.肯定性原则:利用离子的特征性质,由实验现象推出溶液中肯定不存在或肯定存在的离子。
2.互斥性原则:肯定某些离子存在的同时,结合离子共存规律,否定某些离子的存在。
3.电中性原则:溶液中有阳离子和阴离子,且阴、阳离子所带电荷数相等,即溶液呈电中性。
4.进出性原则:所加试剂引入的离子和实验过程中生成的离子对后续实验的干扰。
二、关于离子推断的分类
1.定性型离子推断
定性型离子推断主要从定性的角度考查有关离子的性质。求解此类试题要利用有关离子的特征性质,把握离子的推断原则,根据有关实验现象,通过定性分析,推断出溶液中存在离子的种类。
例题1 某一无色溶液可能会含有下列离子K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO2-4、Cl-、I-、HCO3-中的若干种。将该溶液进行实验,得到如下现象:
①测得该溶液的pH=1;
②取该溶液加入Cu片和稀硫酸,产生的无色气体遇空气变为红棕色;
③取该溶液加入BaCl2溶液,可产生白色沉淀;
④取③中反应后的上层溶液,加入AgNO3溶液,可产生不溶于稀硝酸的白色沉淀;
⑤取该溶液,加入烧碱溶液,可产生白色沉淀,当烧碱过量时,沉淀部分溶解。
(1)该溶液中,一定不存在的离子为____;一定存在的离子为____;不确定是否存在的离子为
(2)为了进一步确定其他离子,写出应该补充的实验:____。
解析 (1)因为该溶液为无色,则可根据“肯定性原则”可知该溶液中Fe2+一定不存在。通过实验①可知该溶液呈酸性,则根据“互斥性原则”可知该溶液中HCO-3一定不存在。通过实验②根据“肯定性原则”可以得知,该溶液中NO3-一定存在;因为在酸性条件下N03-具有强氧化性,则根据“互斥性原则”可知该溶液中I-一定不存在。通过实验③根据“肯定性原则”可知,该溶液中SO2-4一定存在;因为SO2-4与Ba2+能够反应,则根据“互斥性原则”可知该溶液中Ba2+一定不存在。由实验④根据“进出性原则”可知不能确定该溶液中有Cl-存在,因为实验③中引入了Cl-。由实验⑤根据“肯定性原则”可知,该溶液中Mg2+、Al3+肯定存在。综合上述可知,该溶液中一定存在的离子是NO3-、SO2-4、Mg2+、Al3+;该溶液中一定不存在的离子是Fe2+、HCO3-、I-、Ba2+;不能确定该溶液中是否存在的离子是K+、Cl-。
(2)由上述分析可知,K+和Cl-需要进一步确定。K+的检验:可以用焰色试验,若焰色呈紫色(需透过蓝色的钴玻璃观察),可确定K+存在;Cl-的检验:向溶液中加入足量的Ba(NO3)2溶液,过滤后向滤液中加入AgNO3溶液,再加入稀硝酸,若白色沉淀不溶解,可确定Cl-存在。
因此答案为:
(1)NO3-、SO2-4、Mg2+、Al13+;Fe2+、HCO-3、I-、Ba2+;K+、Cl-。
(2)K+的检验:可以用焰色试验,若焰色呈紫色(需透过蓝色的钴玻璃观察),可确定K+存在;Cl-的检验:向溶液中加入足量的Ba(NO3)2溶液,过滤后向滤液中加入AgNO3溶液,再加入稀硝酸,若白色沉淀不溶解,可确定Cl-存在。
2.定量型离子推断
定量型离子推断主要从定量的角度考查有关离子的性质。求解此类试题要利用有关离子的特征性质,根据有关实验现象和实验数据,排除有关离子的干扰,并结合离子推断原则,通过定量计算推断出有关离子是否存在。
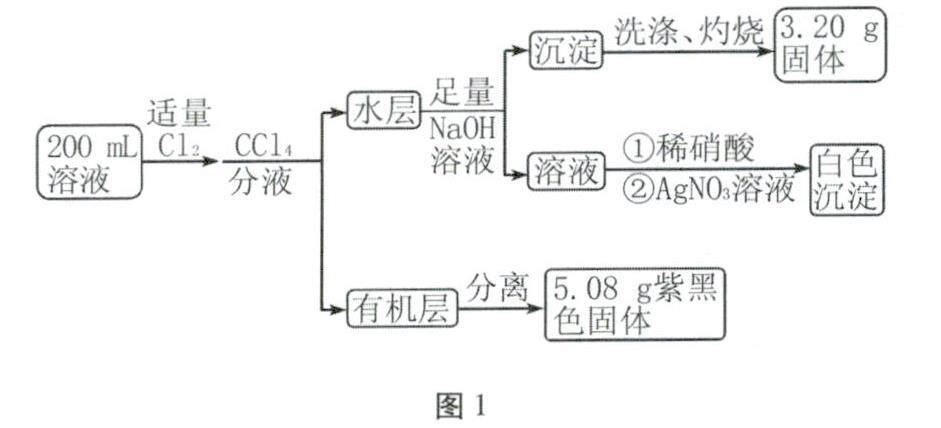
例题2 在常温情况下,pH=1的某溶液中可能存在K+、Fe3+、Fe2+、I-、Cl-、CO2-3中的某几种,现取200mL该溶液进行如图1所示实验。该溶液中一定存在的离子为____,该溶液中一定不存在的离子为____,需进一步确定该溶液中是否存在的离子为____。
解析 200mL该溶液中含有H+的物质的量为n(H+)=0.1mol·L-1×0.2L=0.02mol,由“互斥性原则”知该溶液中一定不存在CO2-3;向该溶液中通入适量Cl2,分液后最终得到紫黑色固体是单质I2,则根据“肯定性原则”可知该溶液中一定存在I-;从而由“互斥性原则”知,该溶液中一定不存在Fe3+。5.08g I2的物质的量为0.02mol,则该溶液中含有I-的物质的量为0.04mol。因水层中加入足量NaOH溶液,最终生成的Fe(OH)3沉淀经洗涤、灼烧得到的3.20g固体为Fe2O3,则根据“肯定性原则”可知该溶液中一定存在Fe2+,且n(Fe2+)=(3.20g/160g·mol-1)×2=0.04mol。0.04molFe2+和0.02mol H+所带正电荷的总物质的量为0.04mol×2+0.02mol=0.10mol,0.04mol I-所带负电荷的物质的量为0.04mol,则根据“电中性原则”可知该溶液中一定存在Cl-。综上所述,该溶液一定存在的离子为H+、Fe2、I-、CI-,该溶液中一定不存在的离子为CO2-3、Fe3+,需要进一步确定该溶液中是否存在的离子为K+。
因此答案为:H+、Fe2+、I-、Cl-,CO2-3、Fe3+,K+。
例题3 某混合溶液可能含下列溶液中的几种:NH4+、K+、Ba2+、Cl-、CO2-3、SO2-4、Mg2+,将200mL该溶液分成2等份进行实验:
①向一份中加入足量烧碱溶液并加热,收集0.224L气体(标准状况),产生0.58g白色沉淀;
②向另一份中加入BaCl2溶液足量,产生6.99g白色沉淀。
通过该实验其溶液推断正确是( )。
A.K+可能存在
B.Ba2一定不存在
C.CO2-3可能存在
D.100mL该溶液中若含有0.01mol Cl-,则K+的物质的量浓度为0.04mol·L-l
解析 由实验①可知,生成氨的物质的量为0.224 L/22.4L·mol-1=0.01mol,生成Mg(OH)2沉淀的物质的量为0.58g/58g·mol-1=0.01mol,则根据“肯定性原则”可知该溶液中一定存在NH4+和Mg2+,NH4+和Mg2+的物质的量均为0.01mol;从而根据“互斥性原则”可知,该溶液中一定不存在CO2-3,C错误。由实验②可知,生成BaSO4沉淀的物质的量为6.99g/233g·mol-1=0.03mol,则根据“肯定性原则”可知该溶液中一定存在SO2-4,其物质的量为0.03mol;从而根据“互斥性原则”可知,该溶液中一定不存在Ba2+,B正确。因0.01mol NH4+和0.01mol Mg2+所带正电荷的物质的量为0.03mol,0.03mol SO2-4所带负电荷的物质的量为0.06mol,根据“电中性原则”可知该溶液中一定存在K+,但无法确定该溶液中是否存在Cl-,A错误。100mL该溶液中若含有0.01mol Cl-,根据“电中性原则”可得:n(K+)+2n(Mg2+)+n(NH4+)=2n(SO2-4)+n(Cl-),即n(K+)+2×0.01mol+0.01mol=2×0.03mol+0.01mol,解得n(K+)=0.04mol;从而可知,c(K+)=0.04mol/0.1L=0.4mol·L-1,D错误。
因此答案为B。
(收稿日期:2024-01-30)
