大豆根瘤菌定向微生态研究与应用
2024-06-28曹轶崔文靖马瑞强
曹轶 崔文靖 马瑞强

摘要:我国大豆根瘤菌种质资源丰富,但其应用进展缓慢,接种面积仅占全国大豆总种植面积的1%~3%。造成该问题的原因主要是根瘤菌不能产芽孢,其抗逆能力较差,导致产品货架期短,应用效果不稳定。为实现根瘤菌产品多元化、功能化、差异化,提高产品活性与应用效果,使用定向微生态(directed micro-ecology,DME)体系优化培养策略,实现根瘤菌、芽孢杆菌的定向扩培及应用。通过单因素实验及响应面法获得根瘤菌最优培养基( 25.5 mL·L?1 糖蜜液、15.2 g·L?1酵母膏、pH 6.98),在DME培菌机中使用该配方可以实现根瘤菌(100 L·min?1,20 h) 及芽孢杆菌( 150 L·min?1,14 h) 菌量50倍以上的扩增,达到(20~50)×108 CFU·mL?1,且杂菌率控制在5%以下。盆栽接种实验表明,DME扩培菌株接种处理的效果显著优于实验室常规培养菌株的同等接种处理,这表明DME培菌机培养的功能微生物应用效果更好。根瘤菌与芽孢杆菌的复配组合可以协助根瘤菌更好地实现其共生功能,具体表现在苗期结瘤数增加、叶绿素含量增加,并且最终的产量与单接种菌株相比也增加了近20%。定向微生态(DME)体系通过定向营养和生长控制,使得目标功能微生物在含有多种微生物的微生态环境中,达到应用级别的产量和纯度,实现与纯培养菌株相同的功能,对于促进根瘤菌的产业化、加快功能菌株的推广应用具有重要意义和应用价值。
关键词:定向微生态体系;根瘤菌;芽孢杆菌
doi:10.13304/j.nykjdb.2023.0758
中图分类号:S182 文献标志码:A 文章编号:10080864(2024)04021510
氮气是空气中含量最高的组分,而植物却无法直接利用,需要固氮作用将分子态氮被还原成氨和其他含氮化合物才可以被植物吸收利用。生物固氮是土壤氮素的主要来源,其中,根瘤菌-豆科作物共生固氮作用固定的氮含量占自然界总固氮量的65%以上[1],大豆-根瘤菌共生体系最为高效。合理利用大豆根瘤菌固氮体系对于农业生态可持续发展和提高大豆产量具有至关重要的作用。
根瘤菌在国际上已经得到非常广泛的应用,美国、巴西、阿根廷等多个国家和地区都在生产和应用大豆根瘤菌剂,根瘤菌接种率达到了95%以上,可替代80%~100% 的氮肥,大豆单产在3 000 kg·hm?2以上[2]。我国大豆根瘤菌种质资源非常丰富[34],但应用进展缓慢,其接种面积占全国大豆总种植面积的1%~3%,且集中在东北地区,大豆产量在2 250 kg·hm?2左右[5]。就大豆根瘤菌应用效果而言,我国利用率较低的原因主要有以下几点:长期以来过量使用氮肥,造成土壤氮素含量高,而根瘤菌对氮素极为敏感[6],导致结瘤固氮效率偏低;研发人员偏重关注根瘤菌的固氮效率,而忽略了根瘤菌的抗逆能力及环境适应能力[7],导致根瘤菌不能在植物根际有效生存和定殖;由于根瘤菌对于不同的大豆品种具有不同的匹配性[8],这对于我国丰富的土壤类型和大豆品种来说是个挑战;根瘤菌不能产芽孢,其抗逆能力较差,导致根瘤菌产品货架期很短[9],应用效果不稳定。因此,深入了解根瘤菌生长繁殖、共生匹配特性,探索生物工程手段改良作物品种及根瘤菌菌种,优化生产流程,以提高根瘤菌生产效率和应用效果,对于进一步推广和应用根瘤菌具有重要作用。
提升根瘤菌的产品活性和质量稳定性是维持其稳定高效应用的保障。挖掘高效固氮且抗逆能力优良的根瘤菌菌种有助于实现根瘤菌稳定高效的固氮,提升大豆产量[10]。由于根瘤菌固氮酶需要铁、钼这些微量元素,因此根瘤菌搭配这些微量元素可以提升其固氮活性[8]。近年来,越来越多的研究人员利用根瘤菌复合促生菌接种大豆,一方面促进了大豆根瘤菌的结瘤效率,另一方面在促生、生防上也具有积极作用[1112]。
目前,根瘤菌主流的产品形态以液体制剂为主,室温下货架期可达到1年[13]。根瘤菌产品货架期短、使用效果不稳定是制约根瘤菌产业发展的主要因素之一。将微生物产品的生产前置到应用端,实现就地生产就地应用,是解决这一限制因素的方法之一。为了实现微生物产品的就地标准化生产和便捷化操作,绿氮生物科技有限公司(简称“绿氮生物”)提出定向微生态(directed microecology,DME)的概念,其原理是在含有目标微生物和多种环境微生物的微生态环境中,通过施加有利于目标功能微生物的定向选择压,使其在种间竞争中取得优势,在特定培养时间内占据微生物群落的主导地位,表现为优势微生物,且来自环境微生物的污染率低,从而使目标微生物在应用中有效发挥功能。基于DME原理,绿氮生物开发了定向微生态系统,根据应用需求确定目标功能微生物(功能模块,function, F),确定与之相匹配的定向培养基(营养模块,nutrition, N)与工艺模型(工艺模块,process, P),通过定向微生态培菌机(生产模块,production, P)实现目标功能微生物的就地标准化生产和应用。通过串联这4大模块建立“FNPP”循环,实现定向微生态应用体系的迭代升级。
本研究针对大豆根瘤菌在大豆种植上的应用,对大豆根瘤菌的扩培硬件设备、培养策略与应用效果进行评估。为定向微生态(DME)系统在农业微生物上的应用提供理论基础和技术支持。
1 材料与方法
1.1 材料
1.1.1 菌株
大豆根瘤菌菌株为黄淮海优势菌种Sinorhizobium fredii GN85 (宿主为齐黄34),由本实验室保存。枯草芽孢杆Bacillus subtilis GN125、贝莱斯芽孢杆菌Bacillus velezensis GN138、地衣芽孢杆菌Bacillus licheniformis GN263分离自山东圣丰种业科技有限公司试验田,兼具促生及生防功能。
1.1.2 主要试剂和仪器
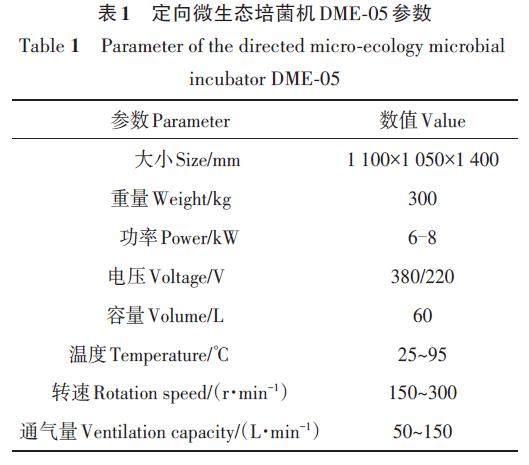
糖蜜液购自武汉京世达实业有限公司,酵母粉和酵母膏购自安琪酵母股份有限公司。定向微生态培菌机(DME-05),绿氮生物;显微镜(BK6000),重庆奥特光学仪器有限公司;恒温摇床 (MQD-B1T),上海旻泉仪器有限公司;恒温培养箱(LHS-70SC),无锡玛瑞特科技有限公司;便携式叶绿素仪(SPAD-502PLUS),日本柯尼卡美能达株式会社。
定向微生态菌培机包括温控元件、加热及降温模块、搅拌电机、气泵及滤菌膜、自动投料菌盒等,温度控制范围25~95 ℃,转速、通气量均可定量调控,主要参数如表1所示。
1.1.3 培养基
根瘤菌培养基活化及种子液制备均采用TY 培养基(1 L):蛋白胨5 g、酵母粉3 g、CaCl2 0.6 g,pH 7.0。
芽孢杆菌培养基活化及种子液制备均采用LB培养基(1 L):胰蛋白胨10 g、酵母粉5 g、NaCl10 g,pH 7.0。
MY0培养基(1 L):10 mL糖蜜液,酵母膏5 g、酵母提取物3 g、K2HPO4 0.3 g、KH2PO4 0.3 g、MgSO4·7H2O 0.2 g、NaC1 0.1 g、KNO3 0.8 g、MnSO40.01 mg、FeCl3 0.01 mg,初始pH 7.0。
1.2 菌株活化及种子液制备
用灭菌竹签蘸取S. fredii GN85菌液,在TY固体培养基上划线,于恒温培养箱中28 ℃倒置培养。挑取单菌落接到5 mL液体培养基中,28 ℃、180 r·min?1再培养2~3 d,按5% (体积分数)接种量转接到200 mL液体培养基中,28 ℃、180 r·min?1,振荡培养至OD600 3.0左右。
1.3 菌量计数
采用稀释平板计数法计算活菌数,将根瘤菌种子液进行10?1~10?7梯度稀释,选择合适稀释梯度吸取100 μL进行TY固体平板稀释涂布,恒温培养箱内28 ℃倒置培养3 d计数并计算最终菌量。
1.4 单因素实验设计
以根瘤菌为材料,以MY0培养基作为出发培养基,探索碳源(糖蜜液)、氮源(酵母膏)及pH对扩培有效活菌数的影响,所有实验均在摇瓶内进行。
糖蜜液含量分别设定为1.0%、1.5%、2.0%、2.5%、3.0%(体积分数),其他培养基组分保持不变,将初始pH 调整为7.0。28 ℃、180 r·min?1,培养2 d对发酵液进行计数,以确定碳源对最终菌量的影响并获得最佳糖蜜液含量。
将酵母膏含量分别设定为0.5%、1.0%、1.5%、2.0%、2.5%(质量体积分数),糖蜜液按照最佳添加量,初始pH7.0,28 ℃、180 r·min?1,培养2 d对发酵液进行计数,以确定最佳酵母膏含量。
设置pH 6.0、6.5、7.0、7.5、8.0,糖蜜液和酵母膏按照最佳添加量,28 ℃、180 r·min?1,培养2 d对发酵液进行计数,以确定最佳pH。
1.5 响应面优化培养基配方
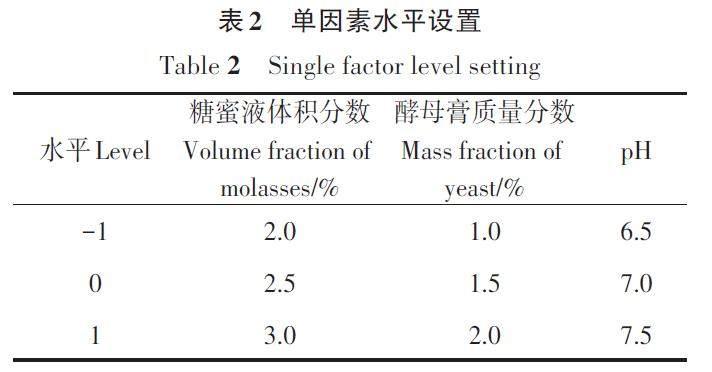
利用Design Expert v13.0.1.0 进行响应面分析。以糖蜜液含量、酵母膏含量、pH 作为自变量,以有效活菌数作为响应值,设计3 因素3 水平(表2)的响应面分析试验,优化培养基配方。
1.6 DME 培菌机扩繁菌株的应用效果验证
1.6.1 DME 培菌机通气量和培养时间的确定
为研究DME培菌机通气量和培养时间对扩繁菌株的影响,设置50、100、150 L·min?1 3个通气量,根瘤菌设置20、40 h 2个培养时间,芽孢杆菌设置14、20 h 2个培养时间,以确定最佳培养条件,利用优化后的MY0最优培养基和培养时间对根瘤菌和芽孢杆菌分别进行扩大培养。MY0最优培养基(1 L):25.5 mL 糖蜜液、15.2 g 酵母膏、K2HPO4 0.3 g、KH2PO4 0.3 g、MgSO4·7H2O 0.2 g、NaC1 0.1 g、KNO3 0.8 g、MnSO4 0.01 mg、FeCl3 0.01 mg,pH 6.98。DME培菌机装液量45 L,灭菌温度设置为90 ℃,维持10 min。待降温至30 ℃后,分别接种根瘤菌和芽孢杆菌种子液200 mL (100×108 CFU·mL?1),使得初始菌量在0.2×108 CFU·mL-1。转速180 r·min?1,培养温度30 ℃。稀释涂布后计算活菌数,并统计非根瘤菌或非芽孢杆菌数在总菌数所占比例。
1.6.2 大豆生长实验
供试大豆品种为齐黄34,由山东圣丰种业科技有限公司提供。根瘤菌实验室常规培养菌液制备参照1.2。芽孢杆菌实验室常规培养流程如下:将芽孢杆菌接种于LB固体培养基上,30 ℃恒温倒置培养;培养2 d 后转接到5 mL液体培养基中,20 ℃、200 r·min?1再培养1 d天,按5% 接种量转接到200 mL 液体培养基中,28 ℃、200 r·min?1,培养1 d即获得到种子液。根瘤菌及芽孢杆菌DME培菌机发酵流程参照1.6.1进行。根瘤菌活菌数调整为6×106 CFU·mL?1,芽孢杆菌统一调整为2×106 CFU·mL?1通过室外土壤盆栽实验检测DME培养菌的应用效果。以尿素作为氮源,设置完全无氮(0 N)、80%氮(80%N)及全氮(100%N,霍格兰营养液的氮素水平)3个氮素水平不接菌的处理为对照。在80%N条件下进行接菌实验,设置只接根瘤菌处理(GN85)、以及接根瘤菌+枯草芽孢杆菌(GN85+GN125)、根瘤菌+贝莱斯芽孢杆菌(GN85+GN138)、根瘤菌+地衣芽孢杆菌(GN85+GN263)共4 个处理。每个处理9 盆,3 个重复(每个重复3盆),每盆5棵大豆;在大豆出芽一周后用移液器接种施菌,每株接种总量5 mL(2种菌处理的各接种2.5 mL)。45 d后统计表型数据,叶绿素使用便携式叶绿素仪(SPAD-502PLUS)进行测定,根瘤数待根冲洗干净后直接摘取计数。
此外,实验室条件下MY0常规培养的根瘤菌及芽孢杆菌菌株进行同等条件的复配及接种,与上述处理对应,设置只接根瘤菌的处理(GN85lab),以及接根瘤菌+枯草芽孢杆菌(GN85+GN125lab)、根瘤菌+贝莱斯芽孢杆菌(GN85+GN138lab)、根瘤菌+地衣芽孢杆菌(GN85+GN263lab)的处理。
1.7 表型测定
自下往上选取第1片三叶复叶,使用便携式叶绿素仪(SPAD-502PLUS)测定叶绿素含量,重复3次取平均值作为该处理的叶绿素含量,每盆所有植株的叶绿素含量的平均值表征一盆处理的平均叶绿素水平。根瘤数待根冲洗干净后直接摘取计数,每盆所有植株的根瘤数的平均值表征一盆处理的平均结瘤水平。收获期收集所有豆荚,对每株的豆荚进行烘干处理,之后收集种子,将其水分控制在8%以下即可,以大豆种植密度约30万株·hm?2计算理论产量(kg·hm?2)。
理论产量=大豆种植株密度×单株均产量(1)
1.8 数据分析
实验数据作图采用GraphPad软件,采用SPSS软件进行ANOVA单因素方差分析和t 检验。
2 结果与分析
2.1 培养基碳源、氮源、pH 对根瘤菌生长的影响
为了最大化培养目标菌株根瘤菌,对根瘤菌培养配方的碳、氮源和pH进行单因素试验。单因素实验均呈单峰曲线,表明设置的范围包含最适条件,随着糖蜜液、酵母膏添加量及pH的增加,根瘤菌有效活菌数呈现递增趋势,超过最佳值后有效活菌数呈下降趋势(图1)。糖蜜液的最适添加量为2.5%,S. fredii GN85最大活菌数约为45×108CFU·mL?1,添加量过高或过低都会影响最终的活菌数;酵母膏的最适添加量为1.5%,GN85的最大活菌数约为40×108 CFU·mL?1;起始pH 为7.0 时,GN85 达到最大活菌数,约为42×108 CFU·mL?1。综合来看,实现培养达到最大的活菌数,需要调整合适的糖蜜液、酵母膏添加量及初始pH,这些数值过高或过低均会对最终活菌数有较大影响。
2.2 根瘤菌MY0 培养基配方优化结果分析
培养基配方优化实验结果表明,因素间不同水平的组合对于最终的有效活菌数有着较大差异,有效活菌数最低为29×108 CFU·mL?1,最高为53×108 CFU·mL?1。通过回归分析对表3实验数据进行拟合,得到二阶多项式方程模型。
Y=41+4.85A+1.88B+1.25C+1.25AB-BC-1.63A2-2.13A2-8.88B2 (2)
式中,Y 表示最终有效活菌数,A 代表糖蜜液,B 代表酵母膏,C 代表pH。
该模型经ANOVA检验了二次回归方程拟合的显著性(表4)。F 值为20.71,P 值为0.037 1(<0.05),表明二次回归方程显著。失拟项P 值为0.399 9 (>0.05),表明不显著,模型适当。模型回归系数(R2)为0.932 2,调整后的决定系数(RAdj2)为0.901 6,表明该模型具有较高的显著性。
最后,利用响应面法进一步分析3个因素在最终有效活菌数上的相互作用及其最佳水平,三维响应面曲线和相应的等高线图如图2所示。结果表明,糖蜜液、酵母膏、pH间的相互作用都较强。根据响应面分析,当糖蜜液、酵母膏用量和pH分别为25.5 mL·L?1、15.2 g·L?1和6.98时,预测有效活菌数的最大值为48.28×108 CFU·mL?1。
2.3 根瘤菌及芽孢杆菌在DME 培菌机上的扩培测试
从图3A可以看出,在不同培养时间,通气量较好的是100 L·min?1,且根瘤菌培养40 h的有效活菌数明显高于培养20 h的有效活菌数;尽管40 h有效活菌数较高,为(30~40)×108 CFU·mL?1,但其污染率却高达10%~30%,随着通气量的增加污染率显著递增,而培养20 h 的污染率均可以控制在4% 以下。因此,对根瘤菌而言,通气量控制在100 L·min?1,培养时间控制在20 h,可以达到高纯度扩培菌株的要求。
此外,还以根瘤菌最优培养基为基础测试了3株兼具促生、生防功能的芽孢杆菌的扩培效果(图3B)。结果发现,3株芽孢杆菌均在14 h达到最大有效活菌数,为(20~30)×108 CFU·mL?1,而20 h的培养时间下其有效活菌数均显著降低,降低至10×108 CFU·mL?1以下。3株芽孢杆菌在14 h培养时间内,随着通气量的增加其有效活菌数也显著提升;培养20 h有效活菌数较低,且其污染率在10% 左右,通气量的增加同样也会提升污染率,而培养14 h的污染率均可以控制在5%以下。因此,对于芽孢杆菌言,通气量控制在150 L·min?1,培养时间控制在14 h,可以达到高纯度扩培菌株的要求。
综合来看,根瘤菌及芽孢杆菌在合适通气量及培养时间下均可以实现50倍以上的扩增,且污染率控制在5%以下。
2.4 DME 培菌机在功能微生物上的应用测试
为了验证DME培菌机扩培后的功能微生物的应用效果,设计大豆盆栽实验,采集苗期数据及收获期数据来进行验证,结果如图4所示。
可以看出,实验室常规培养菌株(标记lab)与DME培菌机扩培菌株应用效果无显著差异,表明DME培菌机扩培菌株可以实现实验室常规培养菌株的正常功能,表现在最终的产量无显著性差异。相比于0 N、80%N、100%N不接菌处理,80%N接种根瘤菌GN85显著提升了结瘤数,其中根瘤菌复合枯草芽孢杆菌是所有菌株处理中显著促进结瘤的,并且叶绿素含量高于100%N处理。值得注意的是,定向微生态扩培菌株的接种处理显著性地优于实验室常规培养菌株的接种处理。此外,通过对最终的单株均产及理论产量计算发现,0 N处理有着最低的产量,与苗期数据类似,根瘤菌复合枯草芽孢杆菌依然是所有菌株处理中产量提升最显著的,并且定向微生态菌液复合处理相比于实验室常规培养菌液复合处理对产量有一定提升,而其他菌株处理与100%N、80%N处理间无显著性差异。
综合看来,DME培菌机对于菌株的功能发挥优于实验室常规培养接种处理,并且GN85+GN125的复配组合不仅促进苗期结瘤固氮,对最终的产量也具有显著的提升作用(约20%)。
3 讨论
一般来说,实验室条件下单一功能微生物有时会有不错的表现,如单一大豆根瘤菌剂的使用可以显著减少氮肥施用、增加大豆产量[14]。但在根瘤菌的实际应用中,实验室可控条件下的促生表型并不能在大田得到较好的复现[15],这表明根瘤菌功能的稳定性普遍较差。为了提升特定功能微生物的表现稳定性,应对复杂多变的土壤环境,采用复合微生物(微生态制剂)的手段往往能起到更稳定的输出效果[1516]。本研究运用DME系统实现大豆根瘤菌等农业功能微生物的定向扩培,并且表现了优于实验室常规培养菌株的应用效果。推测原因是由于DME培菌机并非严格的纯菌扩培,其较低含量的非目标微生物可能对于提升根瘤菌、根瘤菌-芽孢杆菌菌剂功能稳定性具有促进作用,具体原因有待进一步研究分析。
除此之外,导致农业微生物菌株(尤其是非芽孢类菌株)功能难以发挥、实验室表现难以复现的另一主要因素是其产品货架期太短,以致终端用户使用时有效活菌数急剧下降,应用丰度太低,无法产生种群优势。针对这一难题,尽管已经有大量的研究结果表明,添加保护剂可以有助延长功能微生物液体或固体剂型产品的货架期[17],但由于成本偏高,其延长效果不足以支撑商业化落地,也有一些产品型态虽然成本可控但施用方式不友好,例如草炭吸附等,不能用于喷施等菌剂添加方式[18]。DME通过定向营养和生长策略的控制,使得目标功能微生物在含有多种微生物的微生态环境中,达到应用级别的产量和纯度,实现与纯培养菌株相同的功能。本研究对于解决非芽孢类功能微生物货架期短、应用效果不稳定的问题具有积极意义,借助DME 应用系统可以做到“现培鲜用”,无需耗费过多资源去研究延长农业微生物产品的货架期。在本研究中,运用DME系统可以实现目标功能微生物的标准化扩培,并将污染率控制在5%以下,实现农业微生物产品的就地生产和应用,保证功能菌株使用时,仍具有较高有效活菌数。这不仅有效解决了农业微生物产品(尤其是非芽孢类菌株,如根瘤菌)货架期短的劣势,保证了应用效果,更是规避了工厂化大规模发酵生产,以及繁琐的无菌操作流程。类似地,美国Pivot Bio公司委托3Bar Biologics公司开发出兼性厌氧固氮菌便携式发酵系统,能实现每天每毫升2亿菌量的扩增,完成活菌递送系统的搭建 (https://www.3barbiologics.com/)。综合来看,DME系统对于打通我国农业微生物基础研发与产业发展,降低功能微生物的产业化门槛,加快功能菌株的推广应用,对于推动我国农业微生物产业的健康发展具有重要意义。
参考文献
[1] HUNGRIA M, MENDES I C. Nitrogen Fixation with Soybean:The Perfect Symbiosis? Biological Nitrogen Fixation [M]. NewYork: John Wiley & Sons, 2015: 1009-1024.
[2] L?PEZ-GARC?A S L, PERTICARI A, PICCINETTI C, et al ..In-furrow inoculation and selection for higher motility enhancesthe efficacy of Bradyrhizobium japonicum nodulation [J].Agron. J., 2009, 101(2): 357-363.
[3] TIAN C F, ZHOU Y J, ZHANG Y M, et al .. Comparativegenomics of rhizobia nodulating soybean suggests extensiverecruitment of lineage-specific genes in adaptations [J]. Proc.Natl. Acad. Sci. USA, 2012, 109(22): 8629-8634.
[4] 陈文新,汪恩涛. 中国根瘤菌[M]. 北京:科学出版社,2011: 477.
[5] 韩福成.大豆根瘤菌剂技术的推广应用[J].农民致富之友,2016,23: 68.
[6] 关大伟,李力,岳现录,等.我国大豆的生物固氮潜力研究[J].植物营养与肥料学报,2014,20(6): 1497-1504.
GUAN D W, LI L, YUE X L, et al .. Study on potential ofbiological nitrogen fixation of soybean in China [J]. J. PlantNutr. Fert., 2014, 20(6): 1497-1504.
[7] SCHUMPP O, DEAKIN W J. How inefficient rhizobia prolongtheir existence within nodules [J]. Trends Plant Sci., 2010,15(4): 189-195.
[8] 李彦连,王传雷,徐保民,等.徐豆24大豆根瘤菌共生匹配性筛选及应用[J].大豆科学, 2020,39(4):612-620.
LI Y L, WANG C L, XU B M, et al .. Screening and applicationof suitable symbiotic combination between rhizobia andsoybean cultivar Xudou 24 [J]. Soybean Sci., 2020, 39(4):612-620.
[9] 管凤贞,邱宏端,陈济琛,等. 根瘤菌菌剂的研究与开发现状[J].生态学杂志, 2012,31(3):755-759.
GUAN F Z, QIU H D, CHEN J C, et al .. Rhizobium inoculants:research progress and development status [J]. Chin. J. Ecol.,2012, 31(3): 755-759.
[10] 乔李锦,姚莉,徐冲,等.皖豫高效抗逆大豆根瘤菌Y2-4的选育[J].大豆科学 , 2024,43(1):45-53.
QIAO L J, YAO L, XU C, et al .. Screening of highly efficientand stress-tolerant soybean rhizobium Y2-4 used in Anhui andHenan provinces [J]. Soybean Sci., 2024,43(1):45-53.
[11] 李艳萍,张敏,袁梅,等.根瘤菌和复合促生菌对大豆结瘤和生长的影响[J].大豆科学,2017,36(4):583-591.
LI Y P, ZHANG M, YUAN M, et al .. Influence of combinationof rhizobia and compound growth-promoting bacteria on thenodulation and growth of soybean [J]. Soybean Sci., 2017,36(4): 583-591.
[12] CHIBEBA A M, KYEI-BOAHEN S, DE F?TIMAGUIMAR?ES M, et al .. Towards sustainable yield improvement: field inoculation of soybean with Bradyrhizobiumand co-inoculation with Azospirillum in Mozambique [J]. Arch.Microbiol., 2020, 202(9): 2579-2590.
[13] ELSAKHAWY T, GHAZI A, ABDEL-RAHMAN M A.Developing liquid rhizobium inoculants with enhanced longtermsurvival, storage stability, and plant growth promotionusing ectoine additive [J]. Curr. Microbiol., 2021, 78(1):282-291.
[14] 王鹏辉,姜昕,马鸣超,等.一株耐干燥大豆根瘤菌菌株的筛选与固氮效果评价[J].大豆科学,2020,39(1):90-96.
WANG P H, JIANG X, MA M C, et al .. Screening of droughttolerantsoybean rhizobium and its symbiotic compatibilityverification [J]. Soybean Sci., 2020, 39(1): 90-96.
[15] KECSKES M L, CHOUDHURY A T M A, CASTERIANO A V,et al .. Effects of bacterial inoculant biofertilizers on growth,yield and nutrition of rice in Australia [J]. J. Plant Nutr., 2016,39(3): 377-388.
[16] 韦中,杨天杰,任鹏,等.合成菌群在根际免疫研究中的现状与未来 [J].南京农业大学学报,2021,44(4):597-603.
WEI Z, YANG T J, REN P, et al .. Advances and perspectiveson synthetic microbial community in the study of rhizosphereimmunity [J]. J. Nanjing Agric. Univ., 2021, 44(4): 597-603.
[17] HUB?LEK Z. Protectants used in the cryopreservation ofmicroorganisms [J]. Cryobiology, 2003, 46(3): 205-229.
[18] ALONSO S. Novel Preservation Techniques for MicrobialCultures. Novel Food Fermentation Technologies. FoodEngineering Series [M]. Cham: Springer, 2016: 7-33.
(责任编辑:温小杰)
