氮磷钾添加对罗汉松土壤微生物功能多样性的影响
2024-06-27林婷招礼军朱栗琼黄相玲魏国余
林婷 招礼军 朱栗琼 黄相玲 魏国余
DOI: 10.11931/guihaia.gxzw202210059
林婷, 招礼军, 朱栗琼, 等, 2024.
氮磷钾添加对罗汉松土壤微生物功能多样性的影响 [J].
广西植物, 44(5): 895-906.
LIN T, ZHAO LJ, ZHU LQ, et al., 2024.
Effects of nitrogen, phosphorus and potassium additions on functional diversity of soil microorganisms in Podocarpus macrophyllus [J].
Guihaia, 44(5): 895-906.
摘 要: 为揭示罗汉松土壤微生物对不同氮磷钾养分水平的响应及规律,该研究以两年生罗汉松(Podocarpus macrophyllus)幼苗为试验树种,采用L9正交试验控制盆栽土壤的氮磷钾养分水平梯度,使用稀释平板涂布法和Biolog-ECO微平板法探讨不同土壤氮磷钾养分水平对罗汉松土壤微生物量和群落多样性及其对6种碳源的利用特征。结果表明:(1)随氮添加量的增加,土壤细菌(P<0.05)和放线菌数量(P<0.001)减少,真菌(P<0.001)及固氮菌数量(P<0.01)显著增加,土壤微生物群落的Pielou 指数(P<0.001)降低,Simpson指数(P<0.05)和McIntosh指数(P<0.001)升高,从而降低了土壤微生物对6种碳源的利用强度,特别是对难利用碳源胺类(P<0.001)、羧酸(P<0.001)、聚合物(P<0.001)及其他化合物(P<0.001)的利用强度显著降低。(2)磷添加量的增加显著降低了土壤微生物群落的Shannon指数(P<0.05)。(3)钾添加量的增加显著降低了土壤微生物群落的Shannon指数和Pielou指数及微生物群落对碳水化合物和氨基酸(P<0.01)两类易利用碳源的强度。综上所述,氮添加和钾添加是影响罗汉松土壤微生物群落功能多样性的主要因素,在罗汉松培育时应注意少量多次施肥,降低氮和钾的添加量,适当提高磷添加量,以促进罗汉松的生长及其可持续培育。该研究从微生物的角度为罗汉松施肥及管护提供了理论依据。
关键词: L9正交试验, Biolog-ECO, 罗汉松施肥, 碳源利用, 微生物群落功能多样性
中图分类号: Q948.12
文献标识码: A
文章编号: 1000-3142(2024)05-0895-12
收稿日期: 2023-03-04 接受日期: 2023-09-13
基金项目: 国家自然科学基金(31560061)。
第一作者: 林婷(1996—),硕士研究生,研究方向为土壤生态学,(E-mail)gxulinting@163.com。
*通信作者: 招礼军,博士,教授,研究方向为森林生态学,(E-mail)zhlj-70@163.com。
Effects of nitrogen, phosphorus and potassium additions
on functional diversity of soil microorganisms
in Podocarpus macrophyllus
LIN Ting1, ZHAO Lijun1*, ZHU Liqiong2, HUANG Xiangling1, WEI Guoyu3
( 1. College of Forestry, Guangxi University, Nangning 530004, China; 2. Guangxi Vocational University of Agriculture,
Nanning 530009, China; 3. Guangxi Gaofeng State Owned Forest Farm, Nanning 530001, China)
Abstract:
The purpose of the study was to characterize the response, as well as the regularitity of soil microorganisms in Podocarpus macrophyllus to different levels of nitrogen (N), phosphorus (P), and potassium (K). Using two-year old P. macrophyllus seedlings as the test species, the researchers controlled the gradients of N, P and K nutrient levels using the L9 orthogonal test in the potted soil. The dilution plate coating method and Biolog-ECO microplate method were used to explore the effects of different soil nutrient levels on the amount and community diversity of P. macrophyllus soil microorganisms and their utilization characteristics of six carbon sources. The results were as follows: (1) The number of soil bacteria (P<0.05) and actinomycetes (P<0.001) decreased while the number of fungi (P<0.001) and nitrogen-fixing bacteria (P<0.01) increased significantly when different levels of N were added. Additionally, the Pielou index (P<0.001) of the soil microbial community decreased, and the Simpson index (P<0.05) and McIntosh index (P<0.001) increased with increasing N addition. This reduced the intensity of utilization of six carbon sources by soil microorganisms, especially the intensity of utilization of difficult carbon sources such as amines (P<0.001), carboxylic acids (P<0.001), polymers (P<0.001) and other compounds (P<0.001). (2) The increase in P addition significantly reduced the Shannon index of soil microbial community (P<0.05). (3) The increase in K addition significantly reduced the Shannon index (P<0.05) and Pielou index (P<0.05) of the soil microbial community and the intensity of utilization of two easily available carbon sources, carbohydrates (P<0.001) and amino acids (P<0.01), by the microbial community. In conclusion, N addition and K addition are the main factors affecting the functional diversity of soil microbial communities of P. macrophyllus. Attention should be paid to the cultivation of P. macrophyllus by applying fertilizer in small amounts and multiple times, reducing the addition of N and K, and appropriately increasing the addition of P to promote the growth of P. macrophyllus and its sustainable cultivation.
Key words: L9 orthogonal test, Biolog-ECO, Podocarpus macrophyllus, fertilization, carbon source utilization, microbial community functional diversity
罗汉松(Podocarpus macrophyllus)是罗汉松科(Podocarpaceae)罗汉松属(Podocarpus)的多年生常绿针叶乔木,主要分布在我国长江以南的各个省区(Mill, 2003),被广泛用于园林绿化、盆景观赏和医药行业,具有较高的经济价值(霍灿灿等,2023)。近年来,随着人们生活水平的提高,罗汉松盆景也越来越受欢迎。罗汉松生长缓慢,常需要很长时间才能培养成景 (Dickie, 2011),科学施肥不但能促进罗汉松苗木快速生长,缩短成景时间,还对其苗木质量及其可持续培育具有重要意义。
施肥不仅可以促进苗木生长,提升土壤肥力,还对土壤微生物的群落数量和结构具有重要的调控作用(李茂等,2021)。土壤微生物作为土壤生态系统最敏感也是最重要组成部分(Bardgett et al., 2005),在很大程度上决定了物质循环的快慢,并在一定程度上反映土壤状况(Kramer et al., 2013),包括有机质的分解和简单物质的再合成能力(Cusack et al., 2011)、养分循环、生物固氮等重要作用(Hemkemeyer et al., 2021)。土壤微生物对碳源代的利用强度高低是衡量土壤的质量和健康程度、评价土壤生态系统稳定性的重要指标(Yang et al., 2013)。研究表明,土壤中氮磷钾养分含量的添加能显著提高植物土壤微生物量(Jangid et al., 2008; Li et al., 2015)、微生物多样性(Kracmarova et al., 2020)、平均颜色变化率及其对碳源的利用强度 (Jiang et al., 2019)。
目前,有关养分添加对罗汉松土壤微生物群落功能多样性的影响研究鲜少有见。为明确不同氮磷钾添加量在罗汉松苗木培育中的效果并确定氮磷钾的最佳施用量,本研究依托广西大学林学院教学科研基地,采用 L9正交试验设计(Jiang et al., 2021)、稀释平板涂布法和Biolog-ECO微平板法(黄相玲,2019; 李万年等,2022; Ochieno, 2022)对不同氮磷钾添加处理下土壤微生物群落的碳源利用活性进行研究,并结合L9极差分析、冗余分析(redundancy analysis, RDA)和典型关联分析(canonical correlation analysis, CCA)对土壤微生物群落功能多样性进行分析,以期从微生物的角度为罗汉松施肥及管护提供理论依据。
1 材料与方法
1.1 试验地概况
试验地位于中国广西南宁市广西大学内林学院教学科研基地(108°12′ E, 22°50′ N),属南亚热带季风气候,全年日照充足,年均温度约21.8 ℃,年降雨量约1 350 mm,平均相对湿度76%。
1.2 试验设计
本试验采用盆栽法,以两年生罗汉松实生苗为试材,平均株高50 cm,平均地径0.5 cm。盆栽盆规格高45 cm,内径20 cm。供试土壤为森林生土与河砂1∶1混合,森林生土较为贫瘠,能较好地说明养分添加后对土壤微生物功能多样性的影响。2018年3月,每盆装土8 kg,植苗一株。采用L9正交试验设计(Jiang et al., 2021),将氮磷钾添加量各设置3个水平梯度,每个处理15个重复。氮添加选用尿素(N≥46%),磷添加选用过磷酸钙(P2O5≥12%),钾添加选用氯化钾(K2O≥60%),均为速效肥。将肥料与土壤按表1中的设置混合后置于盆中,每周对盆栽进行补水3次,保证苗木的正常生长。2018年7月,测量株高地径,取0~20 cm层盆土,每5盆土合成一个土样,消除个体差异,每个处理共3个混合样供测量。试验土样pH值和有机质、全氮、全磷、全钾、碱解氮、速效磷、速效钾分别为7.5和23.540、0.850、0.336、12.680、0.110、0.007、0.054 g·kg-1。
1.3 土壤微生物量碳、氮的测定
土壤微生物量碳(microbial carbon, MBC)、微生物量氮(microbial nitrogen, MBN)采用氯仿熏蒸法(Knnen et al., 2018)测定。称取10 g新鲜土样于27 ℃、65%湿度的培养箱内培养24 h后取出置于密封性完好的真空干燥器中,同时放入盛有10 mL氯仿的小烧杯和一个盛有50 mL 稀NaOH溶液的小烧杯,真空泵抽真空使氯仿剧烈沸腾5 min后关闭,于25 ℃培养箱黑暗培养24 h。对照为未熏蒸处理。培养结束后每个样品加入50 mL 0.5 mol·L-1 K2SO4溶液,充分振荡后过滤,澄清
溶液立即使用TOC仪测定微生物生物量碳、氮。计算公式如下。
BC=EC-E0KEC;
BN=EN-E1KEN。
式中: BC为微生物量碳;EC为熏蒸样的微生物量碳;E0为未熏蒸样的微生物量碳;KEC为转换系数0.40;BN为微生物量氮;EN为熏蒸样的微生物量氮;E1为未熏蒸样的微生物量氮;KEN为转换系数0.45。
1.4 土壤微生物数量测定
土壤微生物量测定采用稀释平板涂布法测定,主要测量细菌(bacterium)、真菌(fungus)、放线菌(antiobacteria,ACT)和固氮菌(nitrogen-fixing bacterium,NFB) 的数量。细菌用牛肉膏蛋白胨培养基培养,放线菌用高氏1号培养基培养,真菌用马丁氏培养基培养,固氮菌用甘露醇琼脂培养基培养。细菌培养1~2 d,真菌3~5 d,固氮菌4~5 d,放线菌5~7 d,培养结束后取出平板计数。
1.5 土壤微生物功能多样性的测定
使用Biolog-ECO微平板法测定土壤微生物群落功能多样性。将10 g已处理的土样加入灭菌处理的生理盐水中充分振荡,取上层清液稀释得到10-3的菌悬液后接种到Biolog生态板中,置于25 ℃黑暗条件下培养,每间隔24 h用微生物自动鉴定仪上测定590 nm和720 nm的吸光值。测定完成后分别计算每个时间的土壤颜色平均变化率(average well color development, AWCD)。待培养稳定后分别计算Shannon index (H)、Simpson index (D)、McIntosh index (U)和Pielou index (E),评估土壤微生物群落常见种优势度、物种丰富度和均匀度(吴则焰等, 2013)。计算公式如下。
H=-∑Pi×ln(Pi);
D=1-∑(Pi)2;
U= (∑Ni2);
E=HlnS;
AWCD=[∑(Ci-R)]/31。
式中: Ci为31个碳源孔吸光值;R为对照孔吸光值;Pi为每孔吸光值除以所有孔的吸光值;Ni为第i个孔的相对吸光值;S为被微生物利用的碳源种类。
1.6 株高和地径的测定
株高使用钢尺测量;地径使用游标卡尺测量。
1.7 统计分析
采用Excel 2010对原始数据进行整理与统计,利用SPSS 21.0进行Turkey检验分析,用Origin 2021制图。
2 结果与分析
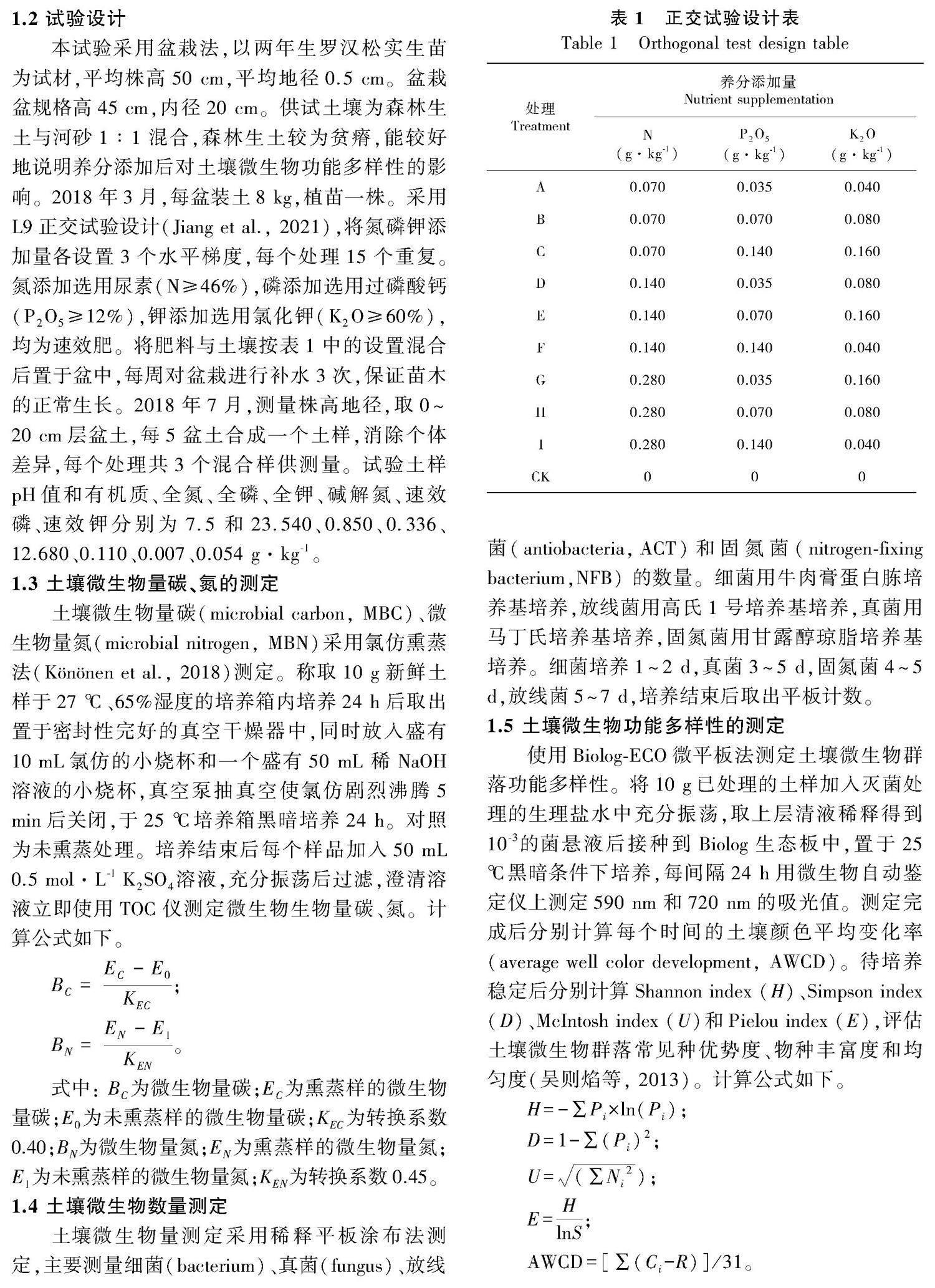
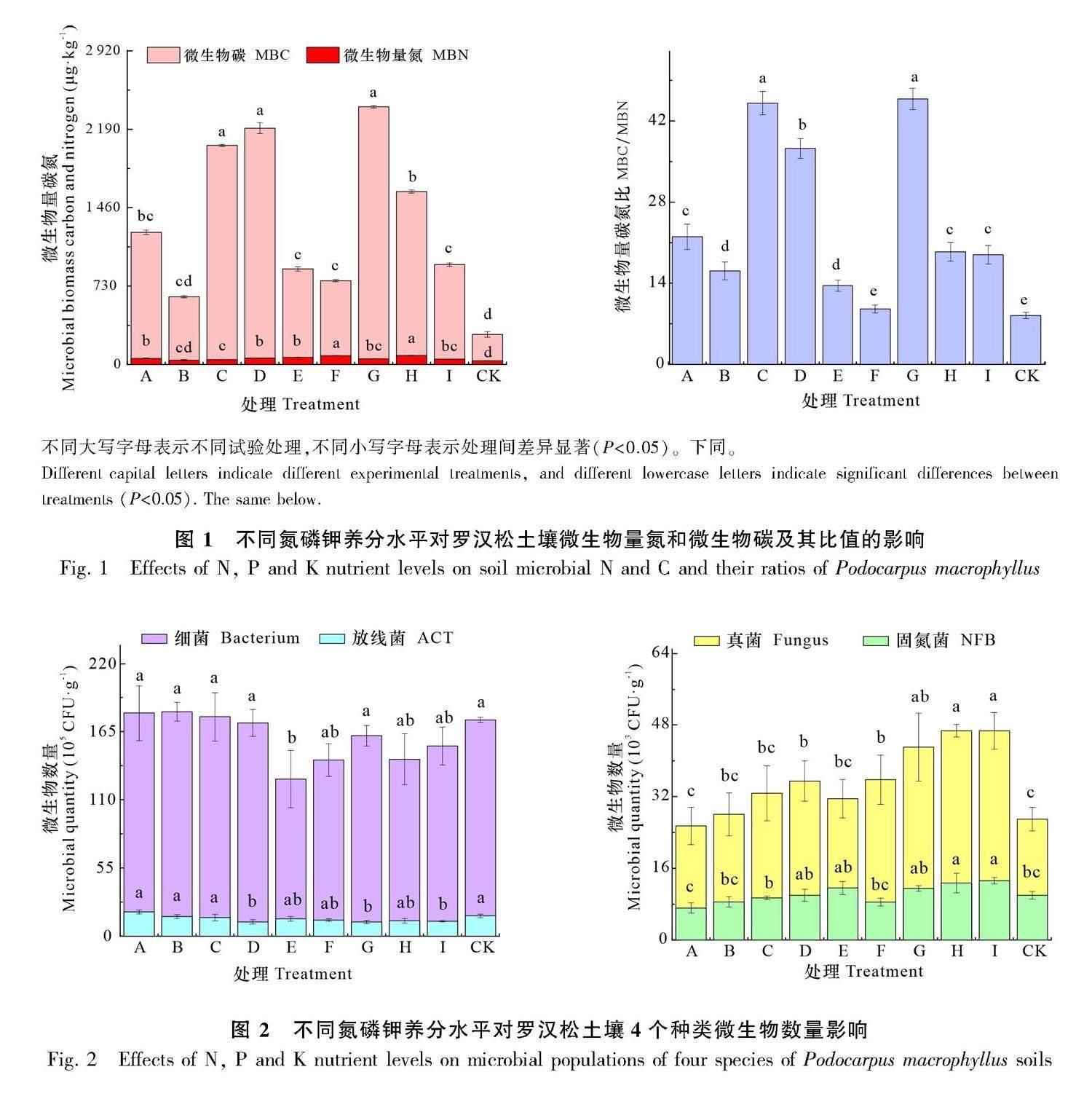
2.1 不同氮磷钾添加水平的罗汉松土壤微生物量
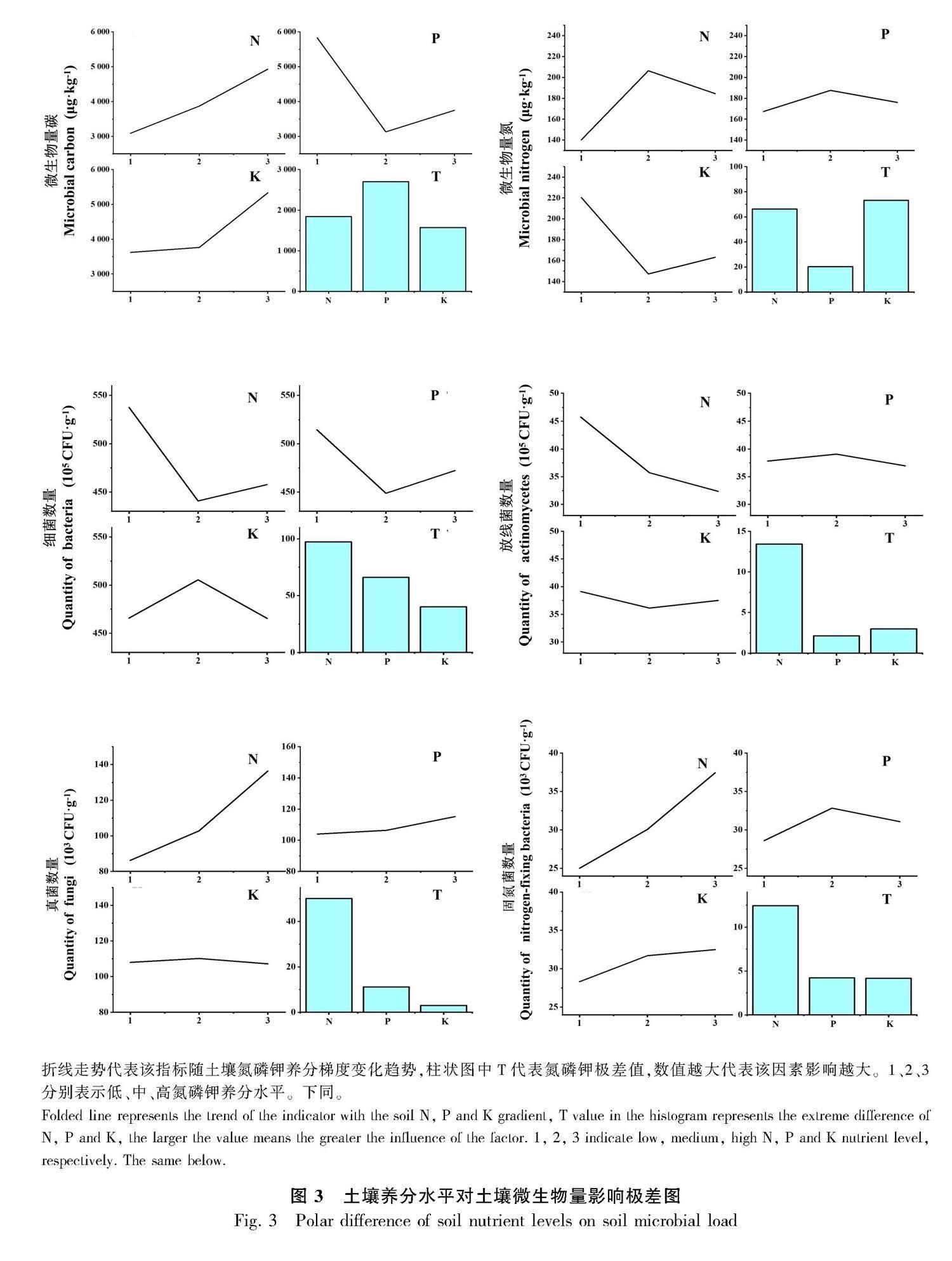
由图1可知,养分添加处理对土壤MBC、MBN、MBC/MBN影响显著,养分添加处理都显著高于对照(CK)处理。由图2可知,罗汉松土壤微生物数量由高到低依次为细菌、放线菌、真菌、固氮菌,数量级依次达到了107、106、104、103。罗汉松土壤中的细菌是主要菌群,占土壤微生物总数的80%以上,其次为放线菌为15%~20%,真菌及固氮菌数量相对占比较小,只占千分之几。细菌与放线菌数量在不同氮磷钾养分水平添加影响下差异不大,真菌与固氮菌数量在不同氮磷钾养分水平添加下显著高于对照处理。由图3可知,土壤MBC指标中磷(P)添加的T值最大,说明土壤MBC受P添加影响最大(下同),氮(N)添加与钾(K)添加的影响程度相当。MBN受土壤N添加和K添加的影响最大,P添加影响最小。N添加对细菌影响最大,其次为P添加,K添加影响最小。N添加对放线菌、真菌和放线菌影响最大,P添加和K添加影响较小,可忽略不计。总体而言,罗汉松土壤MBC与MBN受不同养分调控,其中P添加是影响MBC的主要因子,而N添加和K添加则是罗汉松土壤MBN的主要影响因子。
2.2 不同氮磷钾添加水平的罗汉松土壤微生物多样性指数
由表2可知,与对照比较,氮磷钾添加显著提高了罗汉松土壤微生物Shannon指数、Simpson指数、McIntosh指数、Pielou指数。由图4可知,在微生物多样性的4项指标中,不同养分添加对土壤微生物的影响程度不同。N、P、K添加均对Shannon指数起到较大的影响作用,其中T值最大的为N和P添加,K添加的T值最小。在Simpson指数和McIntosh指数指标中,N添加的T值最大,P和K添加的T值较小,可忽略不计。在Pielou指数指标中,N、P、K添加均对其起到较大的影响作用,其中T值最大为N添加,其次为P添加,最小为K添加。
2.3 不同氮磷钾添加水平的罗汉松土微生物群落不同碳源利用特征
由图5可知,养分水平的AWCD在培养24 h后进入快速增长期,在培养120 h将Biolog的碳源消耗后逐渐趋于稳定。A处理5类土壤微生物碳源利用显著高于其他处理。Biolog微平板上有96个微孔,共31种碳源,将其按照化学基团性质分为6类,即胺类(amines)、羧酸类(carboxylic acids,CAA)、多聚物类(polymers)、碳水化合物类(carbohydrate)、氨基酸类(amino acids,AMA)以及其他化合物(other compounds,OC)。由图6可知,A处理土壤养分水平下微生物对所有碳源的利用较高。碳水化合物类、氨基酸类、羧酸类、多聚类物和其他化合物在I处理处利用特征最低。对照处理对氨基酸类和碳水化合物碳源利用程度最低,对其余碳源利用均表现较好。
2.4 不同氮磷钾添加水平的罗汉松幼苗株高和地径增量
由表3可知,罗汉松株高及地径增量受土壤养分水平影响趋势与微生物群落功能多样性响应趋势一致。养分添加处理高于对照处理,N添加对罗汉松株高生长影响最大,其次为P添加,K添加影响最小;N添加对罗汉松地径生长影响最大,其次为K添加,P添加影响最小。
2.5 氮磷钾添加对罗汉松土壤微生物群落功能多样性的影响分析
由图7和图8可知,氮磷钾养分添加对罗汉松土壤微生物群落功能多样性有显著影响,其中N添加是影响罗汉松土壤微生物群落功能多样性的主导因子。罗汉松土壤真菌数量(P<0.001)、固氮菌数量(P<0.01)、Simpson指数(P<0.05)、 McIntosh指数(P<0.001)均与N添加量呈显著正相关,细菌数量(P<0.05)、放线菌数量(P<0.001)、AWCD(P<0.001)、Pielou指数(P<0.001)、MBC/N(P<0.05)、胺类碳源利用强度(P<0.001)、羧酸类碳源利用强度(P<0.001)、多聚物碳源利用强度 (P<0.001)、 其他化合物碳源利用强度 (P<0.001)均与N添加量呈显著负相关。Shannon指数(P<0.05)与P添加量呈显著负相关。Shannon指数(P<0.05)、Pielou指数(P<0.05)、氨基酸类碳源利用强度(P<0.01)、碳水化合物类碳源利用强度(P<0.001)与K添加量呈显著负相关。罗汉松株高增量和地径增量与N添加呈负相关,与K添加呈正相关,但均未达到显著水平,而罗汉松的株高增量(P<0.001)和地径增量(P<0.01)与P添加量呈显著正相关。由图8可知,微生物功能多样性指标之间存在不同程度的相关性。细菌和放线菌数量及微生物群落丰富度和均匀度与6种碳源利用强度呈不同程度正相关,而真菌和固氮菌数量及微生物群落一致性和优势度则与6种碳源利用强度呈不同程度负相关。
3 讨论
3.1 氮磷钾添加对罗汉松土壤微生物量及其多样性的影响
本研究中罗汉松土壤中的细菌是主要菌群,占土壤微生物总数的80%以上,其次为放线菌,为15%~20%,真菌及固氮菌数量相对占比较小,只占千分之几,与张笑宇(2018)研究结论一致。本研究中, 养分添加尤其是N添加显著增加了真菌的数量,可能与真菌的适应性有关,研究表明真菌更适应在氮磷钾添加的环境中生长(Zhou et al., 2016; Fang et al., 2019)。同时,N添加会导致植物根系或土壤微生物对P需求的增加, 导致土壤
磷酸酶活性的升高,从而间接提高了土壤真菌的数量(Norisada et al., 2006; Ushio et al., 2010)。罗汉松土壤中的固氮菌数量可观,Li YY等(2019)研究表明土壤N添加会引起固氮菌与其他微生物竞争从而降低土壤固氮菌的数量。本研究中,N添加显著提高了罗汉松土壤固氮菌的数量。孙琪琪等(2022)研究表明N添加对不具固氮功能的结瘤根系中的固氮菌起促进作用,而罗汉松根部存在的大量根瘤,可能是罗汉松土壤固氮菌随N添加增加的原因。固氮菌的固氮作用能提高土壤有效氮的含量(Huang et al., 2014),从而与土壤N添加形成正反馈关系,更加强了N添加对土壤微生物功能多样性的影响。本研究中, 高养分添加降低了细菌和放线菌的数量,但降低的幅度较小,说明养分添加对细菌和放线菌影响较小,这一结果与Li YL等(2019)研究一致。碳氮比是影响土壤微生物结构的重要因素 (Williamson et al., 2005),说明在土壤有机碳不变的情况下,氮添加量是影响土壤微生物结构的主要因素。
Shannon指数体现了微生物群落的丰富度、Simpson指数展现其优势度、 McIntosh指数表征基于群落物种多维空间距离的多样性指数,简单而言就是微生物群落的一致性,Pielou指数说明其均匀度。本研究中,微生物群落的多样性主要受到N的影响,结合N添加对细菌和放线菌的抑制作用及对真菌和固氮菌的促进作用。在未添加有机养分的情况下,N添加可能通过改变了土壤有机物的组成,从而改变了土壤食物链中有机物的流通,影响了微生物的代谢活性(苏丹等,2015),N添加量的增加可能降低或抑制罗汉松土壤中敏感性较高的微生物的数量及多样性(王慧颖等, 2018),并使土壤中的优势菌群更具优势,一致性更高。例如,土壤中的腐生真菌尤其是担子菌与养分添加呈正相关(Wang et al., 2017)。同时,该真菌的竞争力和数量的提高导致其他微生物种类生长缓慢甚至消失。久而久之,土壤微生物多样性严重下降,菌群单一,不利于罗汉松生长与发育。
3.2 氮磷钾添加对罗汉松土壤微生物碳源利用特征及功能多样性的影响
不同氮磷钾添加量对罗汉松土壤微生物碳源利用强度影响显著,而土壤微生物群落对不同碳源利用能力反映了土壤微生物群落功能多样性变化(田雅楠和王红旗, 2011)。本研究中,土壤微生物对碳源的利用强度与养分添加及土壤微生物的多样性有显著的相关性,与苏煜和黄劭理(2022)的研究一致。不同的养分添加会对罗汉松幼苗产生不同影响从而影响其分根系的分泌物种类及数量,本研究中氮磷钾添加的氨基酸和碳水化合物类的利用强度显著高于对照处理,说明氨基酸和碳水化合物是罗汉松根系的主要分泌物,而这些分泌物是土壤微生物较易利用和利用强度最大的碳源(Chapin et al., 1993; Zhang et al., 2020),被微生物转化后合成植物生长所需的调节剂能被植物吸收利用,促进植物生长(李茂等,2021)。胺类、羧酸、聚合物和其他化合物是土壤碳源中受特异性微生物影响的类型( Hiraishi & Khan, 2003; Zhalnina et al., 2018; 张胜男等, 2020),这类难利用碳源随着养分添加量的增加显著下降,可能由于N、P、K添加量的增加提高了土壤的盐浓度(Zhou et al., 2017)而导致土壤微生物对碳源的利用强度显著下降(Wang et al., 2020; Wang et al., 2022)。本研究还表明,N添加通过降低土壤细菌和放线菌的数量和提高土壤真菌和固氮菌的数量,降低了微生物群落的丰富度、均匀度并提高了微生物群落一致性和优势度, 从而间接地降低土壤微生物群落对难利用碳源的强度,进而导致罗汉松土壤质量及土壤生态系统稳定性的下降,不利于罗汉松的生长发育。本研究中,罗汉松株高增量和地径增量与P添加呈显著正相关,体现出盆栽罗汉松对P元素的偏好。本文中的L9极差分析和相关性分析结论较为一致,具有较高的可信度,但本研究为盆栽试验,供试苗木为两年生罗汉松幼苗,试验时间也只有4个月,具有一定的局限性,适用于人工栽培环境,在野外是否具有相似结论仍需要实地进一步探究。
4 结论
不同养分添加水平对土壤微生物功能多样性具有显著影响。总体而言,养分添加对罗汉松的土壤微生物群落功能多样性及其生长普遍高于对照组,说明罗汉松生长喜肥。但是,各指标随氮磷钾各个元素添加量的不同出现了不同的响应情况。其中,N添加是影响其变化的主导因子。N添加量的增加显著降低了土壤细菌和放线菌的数量、微生物群落的丰富度和均匀度,增加了土壤真菌和固氮菌的数量、微生物群落的优势度和一致性,从而降低了罗汉松土壤微生物对难利用碳源的强度,而固氮菌与氮含量的正反馈效应加深了该项影响。P添加量的增加显著降低了土壤微生物群落的丰富度。K添加量的增加显著降低了土壤微生物群落的丰富度和均匀度及微生物群落对易利用碳源的强度。因此,在罗汉松培育中仍需要进行施肥管护,但在施肥时应注意少量多次,并适当减少N和K的添加量,增加P添加量,为罗汉松的生长营造良好的土壤生态环境,以促进罗汉松的生长及其可持续培育。
参考文献:
BARDGETT RD, BOWMAN WD, KAUFMANN R, et al., 2005. A temporal approach to linking aboveground and belowground ecology [J]. Trends Ecol Evol, 20(11): 634-641.
CHAPIN FS, MOILANEN LH, KIELLAND K, 1993. Preferential use of organic nitrogen for growth by a non-mycorrhizal arctic sedge [J]. Nature, 361: 150-153.
CUSACK D, SILVER W, TORN M, et al., 2011. Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests [J]. Ecology, 92: 621-632.
DICKIE I, 2011. Ecology of the Podocarpaceae in tropical forests: Podocarp roots, mycorrhizas, and nodules [M]. Washington, DC: Smithsonian Institution Scholarly Press: 168-176.
FANG XM, ZHANG XL, CHEN FS, et al., 2019. Phosphorus addition alters the response of soil organic carbon decomposition to nitrogen deposition in a subtropical forest [J]. Soil Boil Biochem, 133: 119-128.
HEMKEMEYER M, SCHWALB S, HEINZE S, et al., 2021. Functions of elements in soil microorganisms [J]. Microbiol Res, 252: 126832.
HIRAISHI A, KHAN ST, 2003. Application of polyhydroxyalkanoates for denitrification in water and wastewater treatment [J]. Appl Microbiol Biotechnol, 61(2): 103-109.
HUANG XL, 2019. Effects of fertilization on soil enzyme activity and microbial community function diversity of Podocarpus macrophyllus [D]. Nangning: Guangxi University. [黄相玲, 2019. 施肥对罗汉松土壤酶活性及微生物群落功能多样性的影响 [D]. 南宁: 广西大学.]
HUANG XM, LIU SR, WANG H, et al., 2014. Changes of soil microbial biomass carbon and community composition through mixing nitrogen-fixing species with Eucalyptus urophylla in subtropical China [J]. Soil Boil Biochem, 73: 42-48.
HUO CC, ZHU LQ, ZHAO LJ,et al., 2023. Functional diversity of rhizosphere soil microbial communities of three species of Pinus koraiensis [J]. Chin J Trop Agric, 43(2): 1-7. [霍灿灿, 朱栗琼, 招礼军, 等, 2023. 三种罗汉松根际土壤微生物群落功能多样性 [J]. 热带农业科学, 43(2): 1-7.]
JANGID K, WILLIAMS MA, FRANZLUEBBERS AJ, et al., 2008. Relative impacts of land-use, management intensity and fertilization upon soil microbial community structure in agricultural systems [J]. Soil Boil Biochem, 40(11): 2843-2853.
JIANG B, XIA WJ, WU T, et al., 2021. The optimum proportion of hygroscopic properties of modified soil composites based on orthogonal test method [J]. J Cleaner Prod, 278: 123828.
JIANG J, WANG YP, YANG YH, et al., 2019. Interactive effects of nitrogen and phosphorus additions on plant growth vary with ecosystem type [J]. Plant Soil, 440(1): 523-537.
KNNEN M, JAUHIAINEN J, STRAKOV P, et al., 2018. Deforested and drained tropical peatland sites show poorer peat substrate quality and lower microbial biomass and activity than unmanaged swamp forest [J]. Soil Boil Biochem, 123: 229-241.
KRACMAROVA M, KRATOCHVILOVA H, UHILK O, et al., 2020. Response of soil microbes and soil enzymatic activity to 20 years of fertilization [J]. Agronomy, 10(10): 1542.
KRAMER S, MARHAN S, HASLWIMMER H, et al., 2013. Temporal variation in surface and subsoil abundance and function of the soil microbial community in an arable soil [J]. Soil Boil Biochem, 61: 76-85.
LI J, LI ZA, WANG FM, et al., 2015. Effects of nitrogen and phosphorus addition on soil microbial community in a secondary tropical forest of China [J]. Biol Fertil Soils, 51(2): 207-215.
LI M, LIN KM, ZHENG MM, et al., 2021. Effects of nitrogen fertilization on microbial functional diversity in a light-medium for Cunninghamia lanceolata (Lamb.) Hook seedlings [J]. Chin J Appl Environ Biol, 27(1): 54-61. [李茂, 林开敏, 郑鸣鸣, 等, 2021. 指数施肥对杉木苗期基质中微生物功能多样性的影响 [J].应用与环境生物学报, 27(1): 54-61.]
LI WN, LUO YM, HUANG ZY, et al., 2022. Effects of mixed young plantations of parashorea chinensis on soil microbial functional diversity and carbon source utilization [J]. Chin J Plant Ecol, 46(9): 1109-1124. [李万年, 罗益敏, 黄则月, 等, 2022. 望天树人工幼林混交对土壤微生物功能多样性与碳源利用的影响 [J]. 植物生态学报, 46(9): 1109-1124.]
LI YY, PAN FX, YAO HY, 2019. Response of symbiotic and asymbiotic nitrogen-fixing microorganisms to nitrogen fertilizer application [J]. J Soils Sediments, 19: 1948-1958.
LI YL, TREMBLAY J, BAINARD LD, et al., 2019. Long-term effects of nitrogen and phosphorus fertilization on soil microbial community structure and function under continuous wheat production [J]. Environ Microbiol, 22(3): 1066-1088.
MILL RR, 2003. Towards a biogeography of the Podocarpaceae [J]. Acta Hortic, 615: 137-147.
NORISADA M, MOTOSHIGE T, KOJIMA K, et al., 2006. Effects of phosphate supply and elevated CO2 on root acid phosphatase activity in Pinus densiflora seedlings [J]. J Plant Nutr Soil Sci, 169: 274-279.
OCHIENO D, 2022. Soil microbes determine outcomes of pathogenic interactions between Radopholus similis and Fusarium oxysporum v5w2 in tissue culture banana rhizospheres starved of nitrogen, phosphorus, and potassium [J]. Front Sustain Food Syst, 6: 706072.
SU D, ZHANG K, CHEN FL, et al., 2015. Effects of nitrogen application on carbon metabolism of soil microbial communities in eucalyptus plantations with different levels of soil organic carbon [J]. Acta Ecol Sin, 35 (18): 5940-5947. [苏丹, 张凯, 陈法霖, 等, 2015. 施氮对不同有机碳水平桉树林土壤微生物群落碳代谢的影响 [J]. 生态学报, 35(18): 5940-5947.]
SUN QQ, ZHENG YM, YU TY, et al., 2022. Responses of soil diazotrophic diversity and community composition of nodulating and non-nodulating peanuts(Arachis hypogaea L.) to nitrogen fertilization [J]. Acta Agron Sin, 48(10): 2575-2587. [孙棋棋, 郑永美, 于天一, 等, 2022. 施氮对不同结瘤特性花生土壤固氮菌多样性和群落组成的影响 [J]. 作物学报, 48(10): 2575-2587.]
SU Y, HUANG SL, 2022. Effects of bio-organic fertilizer on flue-cured tobacco photosynthetic characteristics and rhizosphere soil microorganism [J]. J Agric Sci Technol, 24(1): 164-171. [苏煜, 黄劭理, 2022. 增施生物有机肥对烤烟光合特性及根际土壤微生物的影响 [J]. 中国农业科技导报, 24(1): 164-171.]
TIAN YN, WANG HQ, 2011. Application of biolog to study of environmental microbial function diversity [J]. Environ Sci Technol, 34(3): 50-57. [田雅楠, 王红旗, 2011. Biolog法在环境微生物功能多样性研究中的应用 [J]. 环境科学与技术, 34(3): 50-57.]
USHIO MK, KITTAYAMA TC, BALSER, 2010. Tree species effects on soil enzyme activities through effects on soil physicochemical and microbial properties in a tropical montane forest on Mt. Kinabalu, Borneo [J]. Pedobiologia, 53: 227-233.
WANG HY, XU MG, ZHOU BK, et al., 2018. Response and driving factors of bacterial and fungal community to long-term fertilization in black soil [J]. Sci Agric Sin, 51(5): 914-925. [王慧颖, 徐明岗, 周宝库, 等, 2018. 黑土细菌及真菌群落对长期施肥响应的差异及其驱动因素 [J]. 中国农业科学, 51(5): 914-925.]
WANG JC, SONG Y, MA TF, et al., 2017. Impacts of inorganic and organic fertilization treatments on bacterial and fungal communities in a paddy soil [J]. Appl Soil Ecol, 112: 42-50.
WANG Z, WANG S, BIAN T, et al., 2022. Effects of nitrogen addition on soil microbial functional diversity and extracellular enzyme activities in greenhouse cucumber cultivation [J]. Agriculture, 12(9): 1366.
WANG WJ, TAN JD, WANG Y, et al., 2020. Responses of the rhizosphere bacterial community in acidic crop soil to pH: Changes in diversity, composition, interaction, and function [J]. Sci Total Environ, 700: 134418.
WILLIAMSON WM, WARDLE DA, YEATES GW, 2005. Changes in soil microbial and nematode communities during ecosystem decline across a long-term chron [J]. Soil Boil Biochem: 1289-1301.
WU ZY, LIN WX, CHEN ZF, et al., 2013. Variations of soil microbial community diversity along an elevational gradient in mid-subtropical forest [J]. Chin J Plant Ecol, 37(5): 397-406.
WU ZH, LIN WX, CHEN ZF, et al., 2013. Variations of soil microbial community diversity along an elevational gradient in mid-subtropical forest [J]. Chin J Plant Ecol, 37(5): 397-406. [吴则焰, 林文雄, 陈志芳, 等, 2013. 中亚热带森林土壤微生物群落多样性随海拔梯度的变化 [J]. 植物生态学报, 37(5): 397-406.]
YANG Y, WU L, LIN Q, et al., 2013. Responses of the functional structure of soil microbial community to livestock grazing in the Tibetan alpine grassland [J]. Glob Chang Biol, 19: 637-648.
ZHALNINA K, LOUIE KB, HAO Z, et al., 2018. Dynamic root exudate chemistry and microbial substrate preferences drive patterns in rhizosphere microbial community assembly [J]. Nat Microbiol, 3: 470-480.
ZHANG SN, YAN DR, HUANG HG, et al., 2020. Effects of short-term fencing on soil microbial community structure in Ulmus pumila scattered woodland of Horqin Sandy Land [J]. Chin J Ecol, 39(9): 2860-2867. [张胜男, 闫德仁, 黄海广, 等, 2020. 短期封育对科尔沁沙地榆树疏林土壤微生物群落结构的影响 [J]. 生态学杂志, 39(9): 2860-2867.]
ZHANG XY, 2018. Analysis of soil microbial characteristics of tobacco fields and their influencing factors [D]. Zhengzhou: Zhengzhou University. [张笑宇, 2018. 烟田土壤微生物特征及其影响因素分析 [D]. 郑州: 郑州大学.]
ZHOU J, JIANG X, ZHOU BK, et al., 2016. Thirty four years of nitrogen fertilization decreases fungal diversity and alters fungal community composition in black soil in northeast China [J]. Soil Boil Biochem, 95: 135-143.
ZHOU Z, WANG C, ZHENG M, et al., 2017. Patterns and mechanisms of responses by soil microbial communities to nitrogen addition [J]. Soil Biol Biochem, 115: 433-441.
(责任编辑 李 莉 王登惠)
