‘曼赛龙柚’种子不同发育期高温耐性研究
2024-06-27安雪姣杨兰文彬陈利钢
安雪姣 杨兰 文彬 陈利钢

DOI: 10.11931/guihaia.gxzw202308024
安雪姣, 杨兰, 文彬, 等, 2024.
‘曼赛龙柚种子不同发育期高温耐性研究 [J].
广西植物, 44(5): 961-971.
AN XJ, YANG L, WEN B, et al., 2024.
High-temperature tolerance of Citrus maxima ‘Mansailong seeds at different developmental stages [J].
Guihaia, 44(5): 961-971.
摘 要: 全球变暖导致极端高温频发,植物种子不可避免地置身于高温胁迫环境之中。为探究种子高温耐性的生理基础,该文以中间型种子‘曼赛龙柚(Citrus maxima ‘Mansailong)为实验材料,对不同发育阶段的种子进行高温处理,并同步检测各个发育时期种子的形态变化、可溶性蛋白和热稳定蛋白含量以及细胞超显微结构的变化。结果表明:(1)在花后23周到49周的整个发育过程中,种子含水量明显降低,鲜重显著增加,干重与鲜重的百分比也有明显的提高,这些指标均是在花后31周前后快速变化,到花后41周趋于稳定。(2)种子在花后29周获得完全的成苗能力和初步的高温耐性,此后高温耐性逐渐增加,并在花后37~49周之间快速提高。与种子高温耐性的变化相似,种子中可溶性蛋白和热稳定蛋白含量在花后23~49周均呈连续升高趋势,相关性分析表明在整个发育过程中这两者的积累与种子的高温耐性呈显著正相关。(3)超显微结构观察发现,随着种子的发育,线粒体逐渐减少,胚轴细胞体积逐渐变小,细胞中脂质体逐渐增多并且排列趋于规则,同时液泡由小变大且后期的液泡中充斥着黑色絮状物。综上所述,‘曼赛龙柚种子在花后41周达到生理成熟,没有明显的成熟脱水过程;其高温耐性是在发育过程中获得并逐渐提高,直到种子发育的后期;种子中可溶性蛋白和热稳定蛋白含量的增加及细胞超显微结构的变化对种子高温耐性的发育具有重要贡献。
关键词: 高温胁迫, 中间型种子, 细胞超显微结构, 可溶性蛋白, 热稳定蛋白, 种子发育
中图分类号: Q944.59
文献标识码: A
文章编号: 1000-3142(2024)05-0961-11
收稿日期: 2023-10-11 接受日期: 2023-11-20
基金项目: 国家自然科学基金(31971573)。
第一作者: 安雪姣(1996—),硕士研究生,主要从事种子生物学研究,(E-mail)anxuejiao@xtbg.ac.cn。
*通信作者: 文彬,博士,研究员,主要从事保护生物学和种子生物学研究,(E-mail)wenb@xtbg.org.cn。
High-temperature tolerance of Citrus maxima
‘Mansailong seeds at different developmental stages
AN Xuejiao1,2, YANG Lan1, WEN Bin1*, CHEN Ligang1
( 1. CAS Key Laboratory of Tropical Plant Resources and Sustainable Use, Xishuangbanna Tropical Botanical Garden, Chinese Academy of
Sciences, Mengla 666303, Yunnan, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China )
Abstract: The seeds are invariably exposed to high-temperature conditions since global warming frequently causes abnormally high temperature. In order to investigate the physiological basis of high-temperature tolerance in seeds, we used intermediate Citrus maxima ‘Mansailong seeds as the research material, heated the seeds at different developmental stages, and simultaneously detected changes in seed morphology, contents of soluble protein and heat-stable protein, and cellular ultrastructure. The results were as follows: (1) The seed moisture content dramatically dropped between 23 and 49 weeks after flowering (WAF), whereas the percentage of DW/FW and fresh weight increased significantly. All of these indicators began to change quickly from 31 WAF and stabilized around 41 WAF. (2) At 29 WAF, the seeds acquired full seedling formation ability and a preliminary tolerance to high temperature; from there, the high-temperature tolerance gradually grew and improved quickly between 37 and 49 WAF. The improvement in high-temperature tolerance was accompanied by a steady increase in contents of soluble protein and heat-stable protein of seeds, from 23 to 49 WAF. The results of the correlation analysis showed a substantial positive correlation between the accumulation of heat-stable protein and soluble protein and the ability of seeds to tolerate high temperature. (3) Ultrastructural observation showed that the number of mitochondria progressively dropped as the seed developed, the volume of the embryonic axis cells gradually decreased, and the number of lipid bodies in the cells gradually rose and their arrangement became more and more regular. In addition, the vacuoles enlarge at the same time, and at a later stage, they were packed with black floccules. In conclusion, the C. maxima ‘Mansailong seeds reach physiological maturity at 41 WAF without any noticeable maturation drying; the ability to tolerate high temperature is acquired during seed development and is further enhanced until a later stage; changes in cellural ultrastructure and an increase in contents of soluble protein and heat-stable protein of seeds are essential in helping the seeds develop their high-temperature tolerance.
Key words: high-temperature stress, intermediate seeds, cellular ultrastructure, soluble protein, heat-stable protein, seed development
种子发育是植物个体发育的最初阶段,对外界环境条件极为敏感,种子发育的好坏,不仅影响种子本身的品质,同时也可能影响到下一代的生长发育(毛培胜等,2001)。随着全球变暖,高温和极端高温天气愈加频繁,植物不可避免地被置身于高温环境中,种子发育也会受到高温胁迫。种子在发育过程中经历高温对其质量和产量都会产生极大影响,如水稻种子在发育过程中暴露于高温中一段时间,会对其寿命、含水量、发芽能力等产生极大的影响(Rahman & Ellis, 2019)。高桂珍(2015)比较了具有不同高温耐性的油菜种子,发现高温处理后种子的发芽势和发芽率均与单株产量和全株干重成极显著正相关,发芽指数和发芽率与产量和千粒重呈极显著正相关,说明种子的耐热性与植株的生长发育状态有关,植物生长发育状态好、产量高,种子的耐热性也强。
目前,关于种子不同发育期高温耐性的研究还很匮乏,但很显然种子的高温耐性与其脱水耐性密切相关,我们从种子的脱水耐性研究中可以得到许多启示。种子的高温耐性可能在发育过程中逐步获得,不同发育阶段的种子具有不同的高温耐性。同时,不同储藏特性的种子具有不同的发育模式:正常性种子在发育后期经历成熟脱水,细胞代谢活动减弱,出现细胞脱分化现象,同时大量积累热稳定蛋白和可溶性蛋白(Prieto-Dapena et al., 2006),在发育的最后阶段,干物质积累停止,含水量急剧下降;而在顽拗性种子的发育过程中,干物质持续积累,直到脱落时种子仍保持很高的含水量(Bewley et al., 2013)。可溶性蛋白对种子萌发也很重要,其含量增加不仅能够使种子保持较低的渗透势,利于种子吸水萌发,而且会增强种子对逆境的适应能力(秦尧等,2022)。可溶性蛋白在胁迫条件下具有保护生物膜和大分子的作用,对种子的抗逆性获得至关重要(Wehmeyer et al., 1996;Trk et al., 2001),其中与种子的高温耐性具有密切联系的是热稳定蛋白(黎茵等,2010)。如秦尧等(2022)对正常性的菜豆种子高温耐性的研究发现,适宜浓度水杨酸处理可以提高其可溶性蛋白的含量,同时增加了其高温耐性。相反,原产于热带雨林中的顽拗性种子,在发育后期可能缺少热稳定蛋白或热稳定蛋白积累不够(Farrant et al., 1992),其抗逆性明显不足,并且随着萌发的启动,种子的热稳定蛋白含量逐渐减少,其高温耐性也逐步降低(Burke & O′Mahony, 2001)。据此我们推测,种子高温耐性的获得与种子发育过程中的细胞结构、代谢活性及保护性蛋白质合成有关。
柚(Citrus maxima)是著名的热带亚热带水果,栽培广、产量大、耐贮藏,我国的种植面积和产量均居世界首位。我国是柚的起源中心和分布中心,具有丰富的种质资源和悠久的种柚历史(沈德绪等,1998)。前期的研究表明,‘曼赛龙柚种子是中间型种子(Wen et al., 2010),虽然在脱水耐性方面与正常性种子比较靠近,其高温耐性却与顽拗性种子比较相近,但又不完全相同,因此具有一定的特殊性(An et al., 2023)。本文通过研究发育过程中‘曼赛龙柚种子高温耐性的变化,探讨‘曼赛龙柚种子高温耐性形成的生理机制,为今后制定抗高温技术措施提供科学依据。
1 材料与方法
1.1 材料
实验选用在西双版纳广为栽培的‘曼赛龙柚(Citrus maxima ‘Mansailong),其花期大致在每年1月中旬至3月下旬,果实成熟期10月中旬(杨坤,2001)。有研究表明,‘曼赛龙柚种子在花后180天达到生理成熟,完成形态建成并获得发芽能力(薛鹏和文彬,2015)。我们观测到,2022年西双版纳热带植物园经济推广站果园‘曼赛龙柚的集中开花时间在1月6日前后。据此,从2022年6月至12月,以花后周数标记种子的发育,每两周一次从该果园选择大小、颜色相近的果实,采摘10~15个,去掉果皮果肉以及外种皮,获得近1 300粒种子。在完成千粒重、含水量等基本数据的收集后,其余种子一部分用于高温耐性评价,另一部分用于细胞超显微结构观察和蛋白分析。
1.2 方法
1.2.1 种子基本参数的测定 种子鲜重测定: 随机取出100粒种子称重,重复10次,取平均值。
种子含水量测定: 按照国际种子检验规程(ISTA, 1996),随机取1粒种子,重复8次,放入(103±2) ℃的烘箱中烘(17±1) h。以种子鲜重为基础表示含水量,即含水量(%)=(鲜重-干重)/鲜重×100。
种子生命力测定: 按发芽端朝上的方式,将种子播种在含1%琼脂的培养皿中,每皿25粒种子为1个重复,每个处理6个重复。每周定期观测并记录萌发情况,胚根伸出约0.5 cm为萌发或存活,形成形态正常的幼苗为成苗。萌发期为1个月左右,实验结束时检查未萌发种子是否腐烂。用最终发芽率与成苗率来衡量种子的生命力。
1.2.2 不同发育时期种子的高温耐性评价
前期的研究表明,在30 ℃条件下,‘曼赛龙柚种子萌发率最高、发芽速度最快,是其萌发的最适温度;在40 ℃条件下其萌发受到了严重的抑制(An et al., 2023),而西双版纳地区空旷地地表温度经常达到或超过40 ℃(刘文杰等,2000),因此采用40 ℃的连续性高温处理评价种子的高温耐性,具体做法如下:将种子播种在含有1%琼脂的培养皿中,置于40 ℃的恒温培养箱中高温处理不同时间。高温处理完成后,取出放在30 ℃的恒温培养箱中培养,按前述方法定期观测并记录萌发与成苗情况。在40 ℃高温处理的最长时间依种子的发育阶段不同,从12 h到1 032 h。依据高温处理后种子的存活率和成苗率变化评价不同发育阶段种子的高温耐性。
1.2.3 可溶性和热稳定蛋白的测定
提取: 从上述不同发育时期的‘曼赛龙柚种子中取10~20粒种子,用镊子剥去种皮,切碎,放入冷冻管中,保存在-80 ℃备用。实验前,取约0.1 g(鲜重)的样品,置于研钵中,加入0.5 mL PBS缓冲液,冰浴匀浆后,转移至1.5 mL的离心管中,再用0.5 mL PBS缓冲液冲洗研钵并转移至离心管中。充分混匀后,在4 ℃下15 000 g离心2次,每次15 min。收集上清液约400 μL,一半用作可溶性蛋白测定。另一半在95 ℃恒温水浴锅中加热10 min,冷却后在4 ℃下15 000 g低温离心15 min,收集上清液并用作热稳定蛋白分析(Thierry et al., 1999)。
标准曲线绘制: 根据Bradford(1976)的考马斯亮蓝法,使用酶标仪测定每个样品的蛋白质含量(陈美林等,2018)。称取50 mg牛血清蛋白,加入PBS溶解并定容至50 mL,配制为1 mg·mL-1的标准蛋白溶液,再用PBS溶液稀释成蛋白量浓度分别为0、100、200、400、600、800、1 000 μg·mL-1,然后加入考马斯亮蓝G-250染液在595 nm处测定吸光值并绘制标准曲线。
测定: 可溶性蛋白按25 μL样品加入75 μL提取液进行稀释,再加入0.5 mL考马斯亮蓝染液,混匀后静置5~20 min,用酶标仪在595 nm处测定吸光值,按标准曲线计算种子中的蛋白含量。热稳定蛋白则按50 μL样品加同等的提取液稀释,再加入0.5 mL的考马斯亮蓝染液混匀,静置5~20 min,用酶标仪在595 nm处测定OD值,根据标准曲线计算蛋白含量。
1.2.4 不同发育时期种子胚轴细胞超显微结构观察
种子最重要的使命是萌发和发育成幼苗,而胚轴是种子最重要组成部分,是种子能否发育成为正常幼苗的关键部位。种子在受到逆境胁迫时,胚轴受到伤害最容易导致丧失活力(Priestley, 1986; 程红焱等,1991)。前人关于种子超显微结构的研究也经常是以胚(对胚比较小的种子)或胚轴(对胚比较大的种子)开展的,如玉米(Wen et al., 2009)和蒲葵(Wen,2011)。为此,从上述不同发育时期的‘曼赛龙柚种子中取5粒种子作为样品,用解剖刀和镊子去除种皮并切下种子包含胚轴的尖端。取3 mL电镜固定液对样品进行固定并保存在4 ℃下备用。在电镜观察前需要先制作超薄切片,切取约1 mm的胚根组织,用3.5%戊二醛和1%的锇酸固定,用丙酮逐级脱水后将材料放进环氧树脂中包埋1周。材料处理好后先切成半薄切片,于光学显微镜下筛选出完好的样品制作超薄切片(王若兰等,2014)。将制作好的超薄切片用柠檬酸铅和醋酸铀染色后放电镜下观察。研究细胞形态、结构及细胞器发育变化对种子高温耐性的影响。
1.2.5 数据统计分析
用Microsoft Excel 2010进行数据的统计并计算平均值与标准误,使用Origin 2023制作图表。使用SPSS 22.0在P<0.05水平上进行单因素方差分析。通过Probit analysis计算种子50%致死率时的高温处理时长,以评价种子的高温耐性。
2 结果与分析
2.1 种子发育过程中鲜重、干鲜重比和含水量的变化
花后23~49周的‘曼赛龙柚种子,其鲜重、干鲜重比以及含水量存在显著变化和阶段性特点(图1)。在花后23~35周,种子鲜重显著增加,随后在37周开始降低并保持在一个相对稳定的水平。种子含水量在花后23周、25周和27周维持在一个很高的水平(82%左右),从花后29周到39周含水量显著降低(P<0.05),下降速度迅猛,平均每周降低2.8%,从41周开始维持在相对稳定的水平(约42%)。种子干鲜重比在整个发育过程中呈现出从上升到稳定的变化,花后23~27周种子的干鲜重比保持在17%左右,此后至41周呈逐渐上升的趋势,到花后41周时种子的干鲜重比达57%,增加了近39%,此后趋于稳定。以上结果说明,‘曼赛龙柚种子在花后41周前后达到生理性成熟,并且在此之后种子的含水量趋于稳定,稳定在42%左右。种子成熟时含水量依然很高,说明该种子没有成熟脱水过程。
所有数据为10个或8个重复,以平均值±标准误表示。
All data are expressed as x ±sx of 10 or 8 replicates.
2.2 种子发育过程中高温耐性的变化
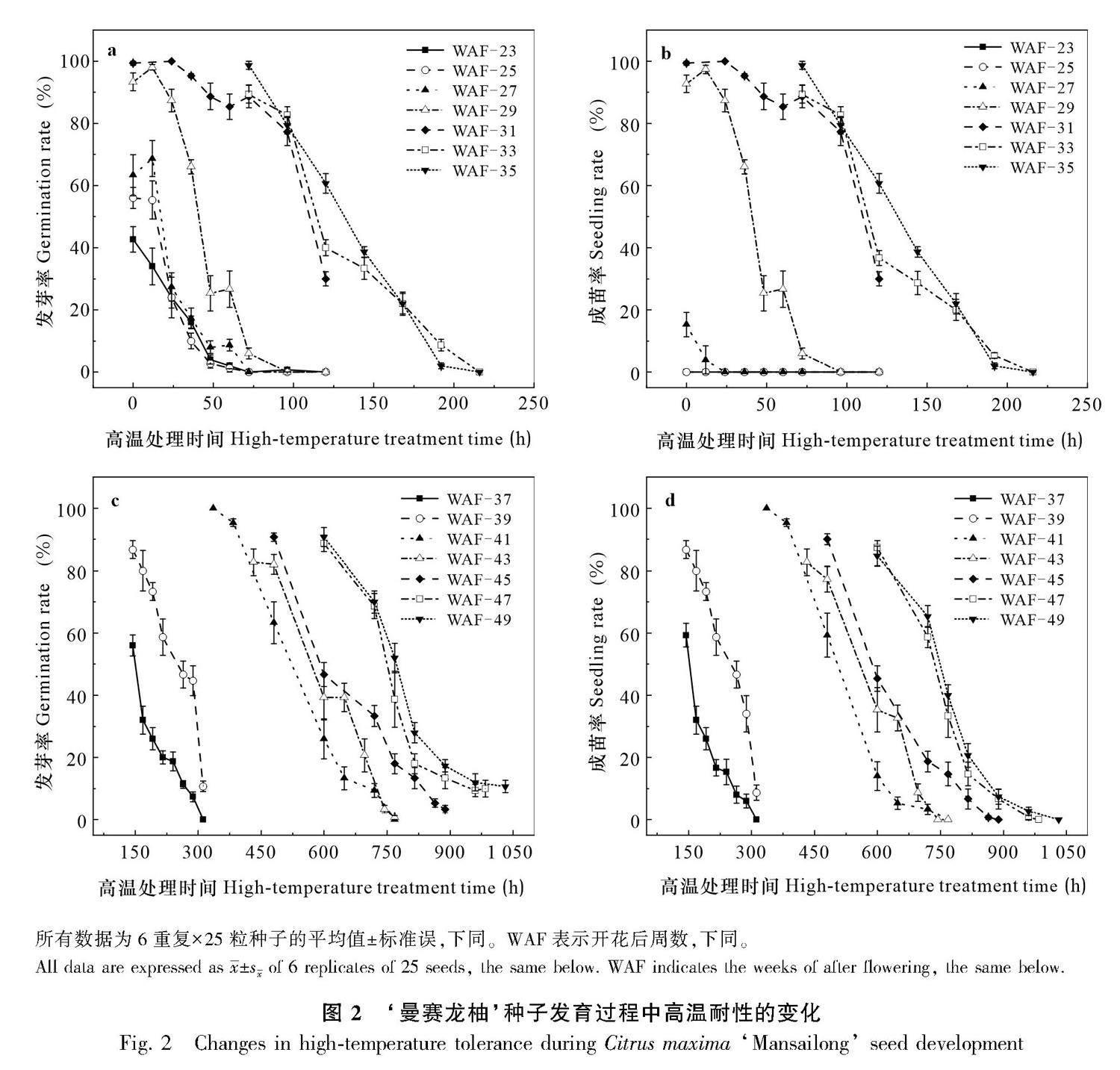
不同发育阶段的种子对40 ℃连续高温的耐受性差异极大。在发育早期,种子的高温耐性极差,如开花后23周时种子已经具有发芽的能力,此时有43%的发芽率,但不能形成幼苗,即使不经过高温处理的种子也不能成苗。直到花后27周才具有成苗的能力,在适宜温度条件下(30 ℃)有15%的种子可以萌发成苗,但经过12 h高温处理后成苗率降低到不足4%,处理24 h后种子全部死亡。花后29周的种子成苗率达到90%,并且在高温处理90 h后种子才完全失去活力,此阶段的种子已经具有初步的高温耐性。之后随着种子的成熟其高温耐性逐渐增强,花后49周的种子经过600 h的高温处理后,成苗率仍高达84%(图2)。
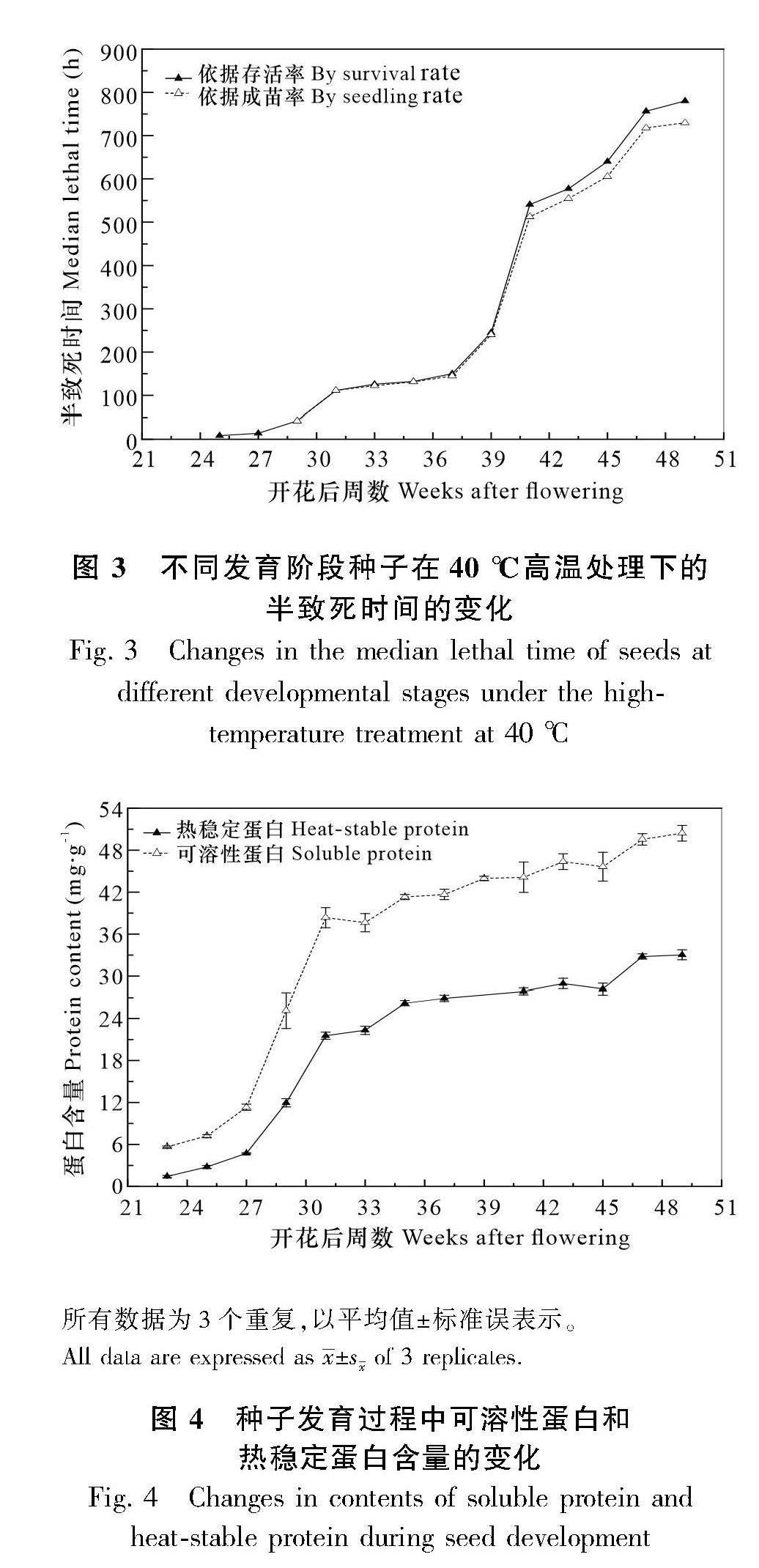
经过高温处理后种子的存活率和成苗率分别在花后25周和29周超过50%。因此,分别以存活率和成苗率为基础,使用概率单位回归分析,分别计算了此后阶段的‘曼赛龙柚种子在40 ℃高温下经历连续高温处理的半致死时间。随着种子的发育,种子耐受高温处理的半致死时间逐渐延长。花后25~31周高温处理半致死时间从8 h增加到111 h,平均每周增加18 h。花后31~37周增长缓慢,平均每周增加6 h。从花后39周到41周是种子高温耐性提高最快的阶段,种子半致死时间直线提升,仅两周时间种子的半致死时间增加296 h。之后高温耐性仍逐渐升高,至最后一个阶段种子的半致死时间增加到近800 h。花后39周及之前,根据存活率和成苗率计算出来的高温处理半致死时间几乎没有差别,花后39周及之后,仅出现较小的差别(图3)。
所有数据为6重复×25粒种子的平均值±标准误,下同。WAF表示开花后周数,下同。
All data are expressed as x ±sx of 6 replicates of 25 seeds, the same below. WAF indicates the weeks of after flowering, the same below.
2.3 种子发育过程中可溶性蛋白和热稳定蛋白含量的变化
由于不同发育阶段的种子含水量差异很大,因此需要以干重为基础来计算发育过程中种子的可溶性蛋白和热稳定蛋白的含量。由图4可知,随着种子的发育,其可溶性蛋白和热稳定蛋白含量呈上升的趋势,其中花后25~31周是可溶性蛋白的快速积累期,在此期间,可溶性蛋白含量从7.21 mg·g-1增加到38.35 mg·g-1,平均每周增加5.19 mg·g-1,差异显著(P<0.05)。之后积累速度变慢,每周仅增加0.67 mg·g-1,相邻各阶段无显著性差异。热稳定蛋白含量变化的总体趋势与可溶性蛋白相似,花后25~31周也是热稳定蛋白的快速积累期,热稳定蛋白含量上升趋势明显,增加了18.77 mg·g-1(P<0.05),花后35~45周热稳定蛋白含量无显著性变化,花后47周增加了4.62 mg·g-1(P<0.05),随后保持不变。因此,花后25~31周是种子可溶性蛋白和热稳定蛋白快速积累的重要阶段。对照种子高温耐性的变化,发现此阶段种子的高温耐性也快速增加,说明种子可溶性蛋白和热稳定蛋白的积累对种子高温耐性的获得起到了重要的作用。
2.4 不同发育时期胚轴细胞超显微结构变化
不同发育阶段的种子,具有不同的细胞结构特点。发育早期以花后23周的种子为例,其胚轴细胞核较大,核膜核仁清晰,细胞中脂质体小而少,在细胞质中不规则分布;线粒体较多,出现大量零散的小液泡,说明早期细胞幼嫩且代谢旺盛(图5:A-C)。到发育中期(花后37周),细胞内发生了明显的变化,如脂质体体积变大,靠细胞壁内侧排列;胞内液泡逐渐变大,液泡中有少量黑色絮状物;线粒体数量多,此时细胞还在进行旺盛的代谢活动并积累储藏物质(图5:D-F)。发育后期(花后47周)的种子,胚轴细胞较小,观察到的线粒体少;液泡中黑色絮状物增加,几乎充斥着整个液泡;本阶段种子成熟度高,细胞内积累了大量的脂质体,在质膜内侧规则排列(图5:G-I)。这些说明,在‘曼赛龙柚种子的发育过程中出现了一定的代谢关闭、贮藏物质积累的过程,这些生理生化变化对种子高温耐性的获得具有重要的贡献。
2.5 ‘曼赛龙柚种子发育相关指标的相关性分析
在种子发育过程中,根据存活率和成苗率计算出来的高温处理半致死时间与种子发育过程中可溶性蛋白、热稳定蛋白以及干鲜重比呈显著的正相关,与种子鲜重和含水量呈负相关。含水量与干鲜重比、热稳定蛋白和可溶性蛋白之间呈极显著负相关。种子干鲜重比与热稳定蛋白和可溶性蛋白之间均呈极显著正相关,可溶性蛋白与热稳定蛋白之间也呈极显著正相关(表1)。
3 讨论与结论
种子的成熟包括生理成熟和形态成熟两个方面,生理成熟主要表现在干物质含量稳定、含水量减低、种子具有萌发能力;形态成熟包括种子的形状、大小和颜色等形态特征不再发生变化(齐永平,2009)。据Hamilton等(2007)报道,柑橘属Citrus garrawayi的种子含水量从未成熟时的(82±1)%下降到(40±1)%时种子即达到成熟状态。本实验中 ‘曼赛龙柚种子的含水量变化与此一致,
花后23周种子的含量为82%左右,到花后41周时下降到42%,之后再无显著变化。此外,种子的鲜重和干鲜重比也在花后41周趋于稳定,进一步说明此时已经达到生理性成熟。但种子鲜重在花后35周以后有些不稳定,在花后47周和49周甚至出现降低,这可能是由于实验后期果园里剩余的可供实验的果实不多,采摘的果实较小所导致。
Bewley等(2013)对正常性种子和顽拗性种子发育的研究表明,正常性种子在成熟脱落前有一个成熟脱水阶段,此时干物质积累停止,种子含水量和鲜重显著下降。顽拗性种子的发育则与此有所不同,其干物质持续积累直至种子成熟脱落,发育过程中种子含水量有所下降,但是种子脱落时仍保持很高的含水量,无明显的成熟脱水。本研究结果表明,‘曼赛龙柚种子在整个发育过程中含水量变化和干物质积累与正常性和顽拗性种子都有所不同,其含水量在发育前期维持在一个较高的水平(81%左右),随后开始逐渐降低,在花后41周以后维持在相对稳定的水平,这与顽拗性种子类似。种子干重在整个发育过程中呈上升趋势,种子的鲜重先增加随后降低并最终保持在一个稳定的水平,这方面则与正常性种子类似。因此,‘曼赛龙柚种子的发育模式是介于正常性种子和顽拗性种子之间的中间型。
种子的脱水耐性是个数量性状,正常性种子的脱水耐性在发育过程中逐渐形成, 并且可能在种子生理成熟后继续加强(Sun & Leoplod, 1993;杨期和等,2002;文彬,2008);顽拗性种子则在生理成熟时最大,之后可能会有轻微下降(彭业芳和傅家瑞,1994)。‘曼赛龙柚种子发育过程中高温耐性的获得也与正常性种子较为相似,花后25~41周种子的高温耐性逐渐上升,并在花后41周即种子生理成熟期直线上升,此后种子的高温耐性持续增加,与中间型葡萄柚种子的脱水耐性发育模式相似(张楠,2014)。在发育过程中,‘曼赛龙柚种子高温耐性的增强与种子可溶性蛋白和热稳定蛋白含量的提高几乎同步,因为花后23~49周种子可溶性蛋白和热稳定蛋白含量均呈连续升高趋势。相关性分析进一步表明在发育过程中这两类蛋白的积累与种子的高温耐性呈显著正相关,说明可溶性蛋白和热稳定蛋白含量的积累降低了高温对种子细胞膜等组织的伤害,从而增加了种子的高温耐性。这与前人关于可溶性蛋白和热稳定蛋白具有保护功能的研究结果相符(黎茵等,2010; 付豪,2019; 秦尧等,2022)。
正常性种子发育早期的胚细胞,细胞体积大、核小,细胞大小不均、排列疏松、间隙大,细胞内液泡大而多,内质网、线粒体等细胞器多;发育后期细胞排列紧密且规则、胞小核大,液泡较小或没
有,此阶段积累了大量的蛋白体和脂质体,内质网和线粒体等细胞器减少(Wen et al., 2009)。而在顽拗性种子发育早期胚细胞排列疏松,胞大核小,含有一个大液泡,几乎占据细胞的大部分空间,线粒体和核糖体等细胞器较多;发育中期细胞排列较紧密,体积小核大,液泡由大液泡转为几个小液泡,胞内细胞器较少,并出现了脂质体;发育后期周边的细胞为成熟细胞,被一个充满黑色颗粒状物质的液泡占据大部分空间,中间位置由幼嫩细胞和成熟细胞组成(Wen, 2011)。本研究通过对‘曼赛龙柚种子胚轴细胞超微结构的观察发现,中间型种子早期和中期的发育与正常性种子相似,即发育早期的‘曼赛龙柚种子胚轴细胞个体大且具有小而少的液泡和脂质体,线粒体多,代谢旺盛的特点;发育中期胚轴细胞较早期小,脂质体较多且靠细胞膜内侧排列,同时液泡变大且里面还出现了黑色絮状物。查阅相关文献发现这种富含黑色物质的液泡为发育中的蛋白体(Klein & Pollock, 1968)。中间型种子后期的发育与正常性种子和顽拗性种子均有所不同,但比较而言,与顽拗性种子更接近。‘曼赛龙柚种子发育后期,其胚轴细胞更小,细胞内的脂质体数量增加,占据细胞大部分空间;液泡中的黑色物质大大增加,但到种子成熟时也没有完全意义上的蛋白体出现,与顽拗性种子发育后期的成熟细胞相似,与正常性种子不同(Wen et al., 2009)。这与王姗(2020)对中间型种子宝华玉兰胚乳细胞发育研究所得到的结果相似。因此,从发育的角度而言,中间型种子的发育也是介于顽拗性和正常性种子之间的类型。
‘曼赛龙柚种子的高温耐性是在发育过程中逐步获得的,并与种子的可溶性蛋白和热稳定蛋白含量及细胞超显微结构的变化相关。发育早期的‘曼赛龙柚种子,其高温耐性差,同时细胞幼嫩且代谢旺盛,细胞内只有少量的脂质体;发育中期的种子具有较高的高温耐性,细胞中脂质体开始大量积累并紧靠细胞膜内侧排列,液泡中也出现了黑色物质;在发育后期,种子的高温耐性达到最大时,细胞中的脂质体大量增加,占据了细胞大部分空间,同时液泡被黑色物质几乎完全占满。因此,‘曼赛龙柚种子逐渐发育直到成熟的过程,也是种子获得并提高高温耐性的过程,同时细胞内的脂质体也在不断增加,液泡中的黑色物质也在增加,对种子高温耐性的获得和提高具有重要的作用。据此,可以认为‘曼赛龙柚种子的高温耐性获得与细胞形态变化、代谢变化和储藏物质的积累密不可分,是其高温耐性的生理基础。
根据贮藏特性,种子可以分为正常性、顽拗性和中间型3种类型,现存物种中以生产正常性种子的植物占优。在Dickie和Pritchard(2002)统计的7 146种物种中,绝大多数(约90%)是正常性的种子,顽拗性的约7%,中间型的仅2%。刘明航等(2019)整理了英国皇家植物园邱园千年种子库的种子信息数据库收录的24 781种植物种子,其中顽拗性种子共620种,占2.5%,中间型种子149种占0.6%。中间型种子在自然界中的占比较少,而且中间型种子这个概念也是相对较晚才提出,因此对这类种子的研究还不够充分,对其特性了解还不够。咖啡和柑橘是生产中间型种子较多的两个类群,也是目前中间型种子中研究得比较多的两个类群。因为咖啡原产于非洲,相对而言,国内对柑橘类,特别是其中的柚种子研究较多。另外,前人的这一类工作通常集中在种子的脱水耐性、低温耐性和贮藏耐性方面,这主要为了与种子的贮藏联系起来,我们关注种子的高温耐性,更多的是为了与种子生态建立联系,如种子在野外的老化、寿命、存活、萌发等。就柚种子而言,我们先前的工作已经对其超低温保存(Zhang et al., 2014;Yan et al., 2014;杨佩儒等,2021)、脱水耐性发育(薛鹏和文彬,2015;Xue & Wen, 2018)、超低温耐性发育(Wen, 2018)、不同品种种子的超低温耐性(Wen et al., 2010)和高温耐性(An et al., 2023)等方面进行了研究。本文对柚种子的高温耐性发育进行研究,检测了种子发育过程中高温耐性的变化,并探究了细胞超显微结构变化及可溶性蛋白和热稳定蛋白积累与种子高温耐性的联系,这一方面让我们对种子高温耐性的生理基础有了一定的认识,另一方面也丰富和加深了我们对中间型种子的了解。
参考文献:
AN XJ, YANG L, WEN B, et al., 2023. Seed high-temperature sensitivity and germination ecology in intermediate seeds of three species from Xishuangbanna, tropical China[J]. Plant Ecol, 224(7): 647-658.
BEWLEY JD, BRADFORD KJ, HILHORST HWM, et al., 2013. Seeds: physiology of development, germination and dormancy[M]. New York: Springer: 86-87.
BRADFORD MM, 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 72(1/2): 248-254.
BURKE JJ, O′MAHONY PJ, 2001. Protective role in acquired thermotolerance of developmentally regulated heat shock proteins in cotton seeds[J]. J Cotton Sci, 5(3): 174-183.
CHEN ML, CHEN Y, ZHANG YT, et al., 2018. Determination of soluble protein in potato by attenvated total reflection mid-infrared spectroscopy[J]. J Chin Cereals Oils Assoc, 33(12): 118-126. [陈美林, 陈业, 张玉婷, 等, 2018. 衰减全反射中红外光谱测定马铃薯中可溶性蛋白含量[J]. 中国粮油学报, 33(12): 118-126.]
CHENG HY, ZHENG GH, TAO JL, 1991. Physiological, biochemical and ultrastructural studies on ultradried seeds of some Brassica species[J]. Plant Physiol J, 17(3): 273-284. [程红焱, 郑光华, 陶嘉龄, 1991. 超干处理对几种芸苔属植物种子生理生化和细胞超微结构的效应[J]. 植物生理学报, 17(3): 273-284.]
DICKIE JB, PRITCHARD HW, 2002. Systemic and evolutionary aspect of desiccation tolerance in seeds [M]// BLACK M, PRITCHARD HW. Desiccation and survival in plants: drying without dying. UK: CABI Publishing: 239-349.
FARRANT JM, BERJAK P, PAMMENTER NW, 1992. Proteins in development and germination of a desiccation sensitive (recalcitrant) seed species[J]. Plant Growth Regul, 11(3): 257-265.
FU H, 2019. Studies on the physiological characteristics effects of Cunninghamia lanceolata seedlings under high temperature stress[D]. Changsha: Central South University of Forestry and Technology: 45. [付豪, 2019. 高温胁迫对红心杉幼苗生理特征的影响[D]. 长沙: 中南林业科技大学: 45.]
GAO GZ, 2015. Studies on identification and molecular mechanism of seed heat tolerance in rapeseed[D]. Wuhan: Chinese Academy of Agricultural Sciences: 10-24. [高桂珍, 2015. 油菜种子耐热性的鉴定及分子机理研究[D]. 武汉: 中国农业科学院: 10-24.]
HAMILTON KN, ASHMORE SE, DREW RA, et al., 2007. Seed morphology and ultrastructure in Citrus garrawayi (Rutaceae) in relation to germinability[J]. Aust J Bot, 55(6): 618-627.
ISTA, 2006. International rules for seed testing[S]. Zurich: International Seed Testing Association.
KLEIN S, POLLOCK MB, 1968. Cell fine structure of developing lima bean seeds related to seed desiccation[J]. Amer J Bot, 55(6): 658-672.
LI Y, LIANG JR, ZHANG YS, 2010. Advances research on seed heat-stable proteins [J]. N Hortic, (5): 221-224. [黎茵, 梁嘉荣, 张以顺, 2010. 种子热稳定蛋白的研究进展[J]. 北方园艺, (5): 221-224.]
LIU MH, CHEN P, LI PP, et al., 2019. Recalcitrant seeds list based on Kew seed bank dataset[J]. J Green Sci Technol, (10): 29-32. [刘明航, 陈萍, 李盼畔, 等, 2019. 基于邱园种子库的顽拗性种子名录 [J]. 绿色科技, (10): 29-32.]
LIU WJ, LI QJ, ZHANG GM, et al., 2000. Microclimatic characteristics of canopy gaps in Shorea chinensis forest in Xishuangbanna[J]. Acta Phytoecol Sin, 24(3): 356-361. [刘文杰, 李庆军, 张光明, 等, 2000. 西双版纳望天树林林窗小气候特征研究[J]. 植物生态学报, 24(3): 356-361.]
MAO PS, HAN JG, WANG P, et al., 2001. Changes on physiology and biochemistry during seed development of smooth bromegrass[J]. Grassl China, 23(1): 26-31. [毛培胜, 韩建国, 王培, 等, 2001. 无芒雀麦种子发育过程中的生理生化变化[J]. 中国草地, 23(1): 26-31.]
PENG YF, FU JR, 1994. Seed germinability and desiccation tolerance of lychee and longan during seed development[J]. Seed, 13(3): 1-5. [彭业芳, 傅家瑞, 1994. 荔枝和龙眼种子发育过程发芽率与脱水忍耐力变化[J]. 种子, 13(3): 1-5.]
PRIESTLEY DA, 1986. Seed aging: implications for seed storage and persistence in the soil[M]. New York: Comstock Associates: 125-195.
PRIETO-DAPENA P, CASTAN~O R, ALMOGUERA C, et al., 2006. Improved resistance to controlled deterioration in transgenic seeds[J]. Plant Physiol, 142(3): 1102-1112.
QI YP, 2009. Dynamic study of physiological and biochemical during the seed developmental stages Schisandra sphenanthera Rehder. et Wils[D]. Xian: Shaanxi Normal University: 4. [齐永平, 2009. 华中五味子种子发育生理生化动态研究[D]. 西安: 陕西师范大学: 4.]
QIN Y, LIU C, LIU DJ, et al., 2022. Exogenous salicylic acid: effects of on seed germination of snap bean under high temperature stress[J]. Chin Agric Sci Bull, 38(18): 79-85. [秦尧, 刘畅, 刘大军, 等, 2022. 外源水杨酸对高温胁迫下菜豆种子萌发的影响[J]. 中国农学通报, 38(18): 79-85.]
RAHMAN SMA, ELLIS RH, 2019. Seed quality in rice is most sensitive to drought and high temperature in early seed development[J]. Seed Sci Res, 29(4): 238-249.
SHEN DX, WANG YY, CHEN LG, et al., 1998. Citrus genetic and breeding [M]. Beijing: Science Press: 1-4. [沈德绪, 王元裕, 陈力耕, 等, 1998. 柑橘遗传育种学[M]. 北京: 科学出版社: 1-4.]
SUN WQ, LEOPLOD AC, 1993. Acquisition of desiccation tolerance in soybeans[J]. Physiol Plant, 87(3): 403-409.
THIERRY C, FLORIN B, PTIARD V, 1999. Changes in protein metabolism during the acquisition of tolerance to cryopreservation of carrot somatic embryos[J]. Plant Physiol Biochem, 37(2): 145-154.
TRK Z, GOLOUBINOFF P, HORVTH I, et al., 2001. Synechocystis HSP17 is an amphitropic protein that stabilizes heat-stressed membranes and binds denatured proteins for subsequent chaperone-mediated refolding[J]. Proc Natl Acad Sci USA, 98(6): 3098-3103.
WANG RL, ZHANG LL, CAO ZS, et al., 2014. Ultra-structural changes in wheat embryo cell and aging mechanism under micro-environment storage conditions[J]. J Chin Cereals Oils Assoc, 29(10): 77-82. [王若兰, 张丽丽, 曹志帅, 等, 2014. 储藏微环境下小麦胚细胞超微结构变化及衰老机制研究[J]. 中国粮油学报, 29(10): 77-82.]
WANG S, 2020. Study on the reproductive biology of the critically endangered plant Magnolia zenii ‘Cheng[D]. Nangjing: Nanjing Forestry University: 54-64.[王姗, 2020. 极危植物宝华玉兰繁殖生物学特性研究[D]. 南京: 南京林业大学: 54-64.]
WEHMEYER N, HERNANDEZ LD, FINKELSTEIN RR, et al., 1996. Synthesis of small heat-shock proteins is part of the developmental program of late seed maturation[J]. Plant Physiol, 112(2): 747-757.
WEN B, 2008. On the compound quantitative characteristic trait of seed recalcitrance[J]. Acta Bot Yunnan, 30(1): 76-88. [文彬, 2008. 试论种子顽拗性的复合数量性状特征[J]. 云南植物研究, 30(1): 76-88.]
WEN B, 2011. Cytological and physiological changes related to cryotolerance in recalcitrant Livistona chinensis embryos during seed development[J]. Protoplasma, 248(3): 483-491.
WEN B, 2018. Changes of cryotolerance during seed development in pomelo and grapefruit[J]. Cryobiology, 85: 186.
WEN B, CAI CT, WANG RL, et al., 2010. Critical moisture content windows differ for the cryopreservation of pomelo (Citrus grandis) seeds and embryonic axes[J]. Cryoletters, 31(1): 29-39.
WEN B, WANG RL, SONG SQ, 2009. Cytological and physiological changes related to cryotolerance in orthodox maize embryos during seed development[J]. Protoplasma, 236(1/2/3/4): 29-37.
XUE P, WEN B, 2015. Effects of drying rates on the desiccation tolerance of Citrus maxima ‘Feizhouyou seeds[J]. Plant Divers Resour, 37(3): 293-300. [薛鹏, 文彬, 2015. 脱水速率对非洲柚种子脱水耐性的影响[J]. 植物分类与资源学报, 37(3): 293-300.]
XUE P, WEN B, 2018. Desiccation Tolerance of intermediate pomelo (Citrus maxima ‘Mansailong) seeds following rapid and slow drying[J]. Seed Sci Technol, 46(3): 511-519.
YAN Q, WEN B, ZHANG N, et al., 2014. Cryopreservation strategies for pomelo seeds from Xishuangbanna, South China[J]. Seed Sci Technol, 42(2): 202-213.
YANG K, 2001. Characteristic and cultivation techniques of Citrus maxima ‘Mansailong [J]. Fujian Fruits, 19(2): 24-25. [杨坤, 2001. 曼赛龙柚特性及其栽培技术[J]. 福建果树, 19(2): 24-25.]
YANG PR, WEN B, ZHAO ZF, 2021. Effects of dehydration rates and freezing rates on cryopreservation of grapefruit seeds[J]. Subtrop Plant Sci, 50(1): 9-14. [杨佩儒, 文彬, 赵烛芳, 2021. 脱水速率和降温速率对葡萄柚种子超低温保存的影响[J]. 亚热带植物科学, 50(1): 9-14.]
YANG QH, YE WH, SONG SQ, et al., 2002. Seed desiccation-tolerance and its relationship to seed types and developmental stages[J]. Acta Bot Boreal-Occident Sin, 22(6): 238-245. [杨期和, 叶万辉, 宋松泉, 等, 2002. 种子脱水耐性及其与种子类型和发育阶段的相关性[J]. 西北植物学报, 22(6): 238-245.]
ZHANG N, 2014. The cryotolerance development and its physiological bases in grapefruit (Citrus paradisi Macfad.) seeds[D]. Beijing: University of Chinese Academy of Sciences: 17-30. [张楠, 2014. 葡萄柚种子超低温耐性的发育及其生理基础[D]. 北京: 中国科学院大学: 17-30.]
ZHANG N, WEN B, JI MY, et al., 2014. Low-temperature storage and cryopreservation of grapefruit (Citrus paradisi Macfad.) seeds[J]. Cryoletters, 35(5): 418-426.
(责任编辑 周翠鸣)
