水稻诱变育种研究进展
2024-06-27杨学智韩云哲朴雪梅徐伟豪白学峰柳洪良
杨学智 韩云哲 朴雪梅 徐伟豪 白学峰 柳洪良
摘 要:诱变育种是一种高效的育种技术,可为水稻新品种选育提供帮助。对水稻诱变育种进行系统性论述,概述了化学诱变、物理诱变、太空诱变、多倍体诱变、诱变剂组合诱导随机突变在水稻育种中的应用,汇总了诱变株的筛选鉴定方法,分析了诱变育种的优缺点,对今后的水稻诱变育种工作进行了展望。
关键词:水稻;诱变育种;育种方法;筛选方法
中图分类号:S511.03 文献标志码:A 文章编号:1673-6737(2024)03-0041-10
Research Progress of Mutation Breeding in Rice
YANG Xue-zhi , HAN Yun-zhe , PIAO Xue-mei , XU Wei-hao , BAI Xue-feng , LIU Hong-liang*
(Yanbian Korean Autonomous Prefecture Academy of Agricultural Sciences, Yanbian Jilin 133400, China)
Abstract: Mutation breeding is an efficient breeding technique which can provide help for the breeding of new rice varieties. The application of random mutation induced by chemical mutation, physical mutation, space mutation, polyploid mutation and mutagen combination in rice breeding was summarized, the screening and identification methods of mutation were summarized, the advantages and disadvantages of mutation breeding were analyzed and the future work of rice mutation breeding was prospected.
Key words: Rice; Mutation breeding; Breeding method; Screening method
水稻(Oryza sativa L.)是世界重要的粮食作物之一,全球约一半人口以大米为主食,随着人口的不断增长,稻米的需求也将进一步扩大[1]。同时,随着生活水平的不断提升,人们对稻米的食味品质和营养质量也提出了更高的要求[2]。日益增长的产量需求和品质要求,使得培育优质、高产、高抗水稻成为水稻育种的主要目标[3]。常规杂交育种是基于基因自由重组原则,以期增加生物的遗传多样性而不产生新的基因。高等植物的自发突变率很低,仅有10-5~10-8[4];而水稻与其他栽培作物相比,基因组相对较小,培育优良水稻品种过程中出现遗传变异的可能更低。诱变是增加突变概率、提供新基因型的重要手段,也是当今植物育种中的一个重要途径[5-6]。诱变育种是一种高效的育种技术,具有特异性较强和诱变后较易稳定遗传特点,可为水稻新品种选育提供帮助(提供新种质资源)。在过去的50年里,诱变育种为全世界开发优质、高产作物基因型作出了重大贡献。
诱变育种是通过人为制造变异,再进行人工选择将有利变异固定下来用于培育新品种的过程。主要通过物理手段或化学试剂破坏目标生物DNA,导致其基因结构变化,从而引起随机突变的发生。诱变育种操作方法简单,短时间可获得更多变异,显著增加变异频率,为突变体资源库提供了丰富的基因材料。因为水稻的基因组小,仅需要少量种质材料即可饱和整个基因组,可提供大量的等位基因用于诱变。同时,水稻也是一种重要的模式植物,大量研究者乐于利用水稻做基础性和应用性研究,有助于全面了解小麦、玉米等其他禾本科植物的基因组[7-8]。因此,对水稻进行诱变育种研究是极其有用的。
1 诱变育种的方法
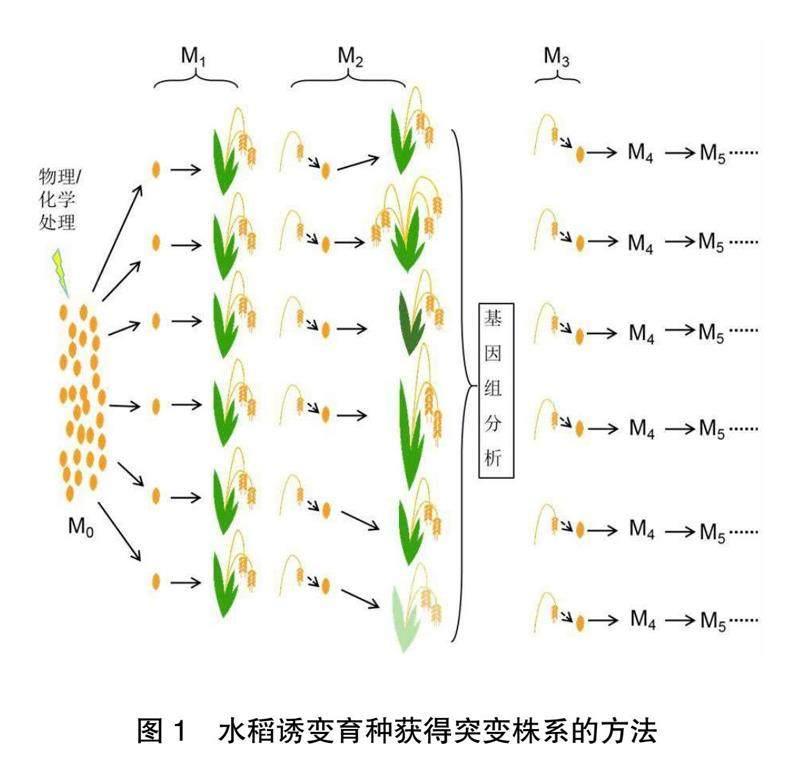
水稻诱变育种通常选用水稻种子作为诱变材料,挑选健康的水稻种子作为M0代种群,利用物理或化学手段进行诱变处理,产生诱变M1代,M1代一般不进行选择。收集M1代种子种植产生诱变M2代,M2代群体是出现变异差异最大的世代,此时是选拔的重要时期,可根据育种目标选择优良单株,也可进行基因组分析判断突变发生位点。诱变M3代由选拔后的M2代产生,此世代性状分离减少,多数突变性状基本稳定。此后,随着世代的增加,可获得稳定的优良突变株系,为进一步培育新品种提供材料(图1)。
1.1 化学诱变
化学诱变育种是利用化学试剂对植株进行处理,引起植株内部结构变化,从而导致遗传物质发生变异,再经过M2代、M3代等多代筛选,最终获得稳定的优势突变株。使用化学试剂诱导突变是以点突变为主,可以仅突变1~2个性状,避免不良突变发生[9-10]。化学诱变主要产生的是沉默突变和错义突变,约占总突变量的50%,只有5%为无义突变[11]。化学诱变剂主要有甲基磺酸乙酯(EMS)、N-甲基-N-亚硝基脲(MNU)、叠氮化钠(NaN3)、乙烯亚胺(EI)等。
1.1.1 甲基磺酸乙酯(EMS) EMS主要是通过鸟嘌呤的烷基化引起突变,导致突变后不与胞嘧啶配对,而与胸腺嘧啶错配,使碱基G:C转变为A:T或T:A[12]。研究表明,考虑到不同基因型和致死曲线的情况下,使用EMS浸泡水稻种子诱导突变,其最适使用浓度为0.2%~2.0%,最佳浸泡时间为10~20 h[13]。
EMS诱变可以改变水稻的农艺性状,陈开等[14]使用1%的EMS诱变武运粳8号(W8)效果显著,对于水稻株高、穗长、粒长、剑叶长等性状都有较好的正向诱导效果,其中有85.7%的突变株株高比W8高、64.3%的突变株剑叶长度超过W8,与Sevanthi等[15]使用EMS诱变陆生水稻Nagina22的结果相似。Huang等[16]在EMS诱导突变体后代中分离得到稳定的半矮秆突变株bgsd-2,分析得出相关基因OsRBAP1在调控水稻高度和幼穗发育方面发挥着重要作用。在抗除草剂方面,陈天子等[17]获得稳定的抗咪唑啉酮类除草剂的水稻突变株,可耐受1 200 mg/L的甲咪唑烟酸,是野生型抗性的100倍。
1.1.2 N-甲基-N-亚硝基脲(MNU) MNU是作物中使用最多且十分高效的一种化学诱变剂。MNU主要与DNA分子中的氧原子反应,向鸟嘌呤或胞嘧啶进行烷基化作用,使G:C配对变为T:A配对。据报道,使用MNU处理水稻受精卵细胞比处理干燥种子更有效,其效率约为处理干种子的两倍[18-19]。
使用MNU进行诱变的应用范围十分广泛,可影响植物一系列生理过程,有助于提高遗传突变,同时探究基因功能的表达。王迪等[20]构建了包含3 562个家系的水稻淮阳5号突变体库,同时定位了2个矮秆突变基因。Zhou等[21]鉴定YSS2为参与叶绿体生物合成相关的基因,YSS2突变可阻碍早期幼苗叶片发育。曹鹏辉等[22]完成水稻低温白化突变体lta1突变基因的精细定位,突变体在20 ℃下叶绿体发育异常,叶绿素含量降低,为克隆lta1基因奠定了基础。MNU诱导突变还可改良稻米品质,李祖胜等[23]使用 0.05%MNU处理湘晚籼13号和明恢63,其稻米品质有明显改良。Long等[24]鉴定FLO8基因为淀粉合成过程中相关基因的调控因子。
1.1.3 叠氮化钠(NaN3) NaN3是一种安全高效的植物诱变剂,对M1代生理损伤小,毒性低,主要作用于复制中的DNA,对染色体致变概率很低[25]。其诱变过程为NaN3被植物吸收,后经植物中O-乙酰丝氨酸硫解酶产生叠氮化物的有机代谢物(如L-叠氮丙氨酸),这种代谢产物进入细胞核中,与复制中的DNA相互作用,使得DNA不能正常合成,导致DNA单链断裂,基因组发生点突变,因此使用NaN3处理萌发的种子效果更好[26]。使用NaN3作诱变剂时,其诱变作用很大程度上取决于浸泡溶液的pH值,当pH=3时,可产生较多的HN3分子,易穿透细胞膜进入细胞内[27]。
NaN3虽然不如EMS和MNU使用广泛,但其价格便宜且使用方法简单,也是较为常用的诱变剂之一,可为水稻功能基因组学研究以及水稻育种提供有利的变异条件。Hussain等[28]发现tms8基因参与了温度诱导的水稻遗传性雄性不育。Lin等[29]筛选得到一株盐超敏突变体shs1,其抗氧化机制的受损以及细胞内Na+稳态的破坏,导致水稻耐盐性降低。Wang等[30]利用NaN3诱变开发的稻瘟病抗性水稻TNG67突变体库包含3 000多个纯突变体系,为抗稻瘟病品种培育以及抗稻瘟病基因定位提供丰富材料。
1.2 物理诱变
物理诱变技术是诱变育种领域使用最多的一种方式,也是植物育种的重要手段之一。根据联合国粮农组织和国际原子能机构的突变品种数据库(FAO/IAEA-MVD)报告,截至2022年9月,使用物理诱变技术研发的新品种占整个突变品种库的91.6%。物理诱变主要通过射线辐射的手段辐照植物,引发植物遗传性状的改变,然后从突变群体中筛选优秀个体,进而培育出新品种[31]。物理诱变常用的诱变源有γ射线、X射线、中子、微波、离子束等。
1.2.1 伽马射线(γ-rays) γ射线在水稻诱变育种中已有十分广泛的应用,最常见的辐射源是60Co-γ射线和137Cs-γ射线。γ射线具有很高的能量和极强的穿透力,当与细胞中的物质碰撞时会发生电离或激发作用,形成的正、负离子或激发态原子与核酸和蛋白质反应,引起分子结构的改变,致使遗传物质结构变化,最终导致生物体结构和功能的改变[32-34]。
γ射线诱导的突变体有助于鉴定水稻生长表型相关基因的鉴定,张一林等[35]利用60Co-γ射线辐射籼稻9311获得茎秆壁增厚突变体st1,其基部第四、五节缩短退化,导致株高变矮,为st1基因的功能分析和解析水稻抗倒伏性机制提供科学依据。余艳欢等[36]在籼稻品种9311辐射诱变后代中分离发现一个窄叶突变体nal7-2(t),由于大维管束和小维管束的数目减少,导致叶片变窄。在叶色表型上,胡彬华等[37]筛选到一份淡黄叶突变体pyl3,整个生育期都表现为淡黄叶表型,pyl3突变体携带的基因是水稻chl9/chli浅黄绿叶基因的新等位基因。陈能刚等[38]获得的短穗小粒突变体sp18,穗长变短,籽粒明显变小,与Li等[39]报道的突变体sp1呈现出相似的短穗小粒突变表型,丰富了水稻穗型相关的调控基因。
1.2.2 离子束辐射(IBR) 离子束辐射(IBR)是一种较为新颖的辐照手段,相较于γ射线具有稳定性强、突变谱广、生物效应高等特点[40-41]。离子束诱变机理较为复杂,在能量传递转移方面不同于γ射线,主要有能量沉积、质量沉积、动量传递和电荷交换等四个反应过程的综合作用[42]。注入生物体的离子束与体内分子或原子产生碰撞,发生能量沉积和质量沉积,直接作用于生物的遗传物质引发突变。能量沉积可使染色发生变异,岳春晖等[43]报告证实了这一点;质量沉积使生物大分子的部分序列被取代或填充,阻碍辐照损伤修复[44]。研究表明,离子束主要诱导DNA单链或双链的断裂,且断裂末端受损,导致修复可能性降低[45]。此外,离子束辐照在细胞膜表面产生蚀刻效应,使细胞膜损伤,有利于外源基因转入,可作为转基因技术的一种手段[46]。
我国科学家余增亮等[44]成功利用离子注入方式诱变水稻,首次提出重离子与植物材料之间的生物学效应假说,至此离子束辐射诱变有了快速发展。离子束诱变可对水稻基因活性产生影响,Ishikawa等[47]利用碳离子辐照成功获得水稻低镉积累突变体,发现参与水稻根系中Cd的转运的基因OsNramp5发生改变,导致水稻籽粒中镉含量的降低。陈慧茹[48]利用碳离子辐照诱变籼稻9311,同样获得一株籽粒低镉积累突变体,但OsNramp5表达水平没有明显改变,而Cd转运调节因子OsHMA3表达水平显著上调,负责Cd向籽粒运输的OsLCT1表达水平显著下调,也导致水稻种子中的镉含量降低。冯莹睿[49]使用低能氮离子束对水稻幼苗辐照处理,筛选得到5个有关脱落酸(ABA)合成酶基因的表达增强。
1.2.3 中子辐照 中子辐照诱变是以高能量中子束作为辐射源的一种诱变方法,能够诱发多种类型的突变。中子不带电荷,与原子核和电子之间没有静电作用,中子束向生物体传递能量主要以反冲核的方式进行。当中子束进入生物体中,中子与体内原子相互碰撞产生氢反冲核,释放大量能量,可对生物体中活性分子造成难以修复的损伤[50]。中子辐照主要影响DNA结构的改变,破坏含氮碱基,使得DNA链断裂。中子辐照诱导的突变主要包括单碱基取代、缺失、插入、倒位、易位和重复[51-52]。中子辐照可产生大量的等位基因突变,包括功能基因的丧失、部分功能基因的缺失以及功能基因的获得,这些等位基因的改变给功能基因组学研究提供了有力的帮助[53]。
尽管中子辐照在生物诱变方面已有广泛的应用,但在水稻相关研究上的使用报道很少。Li等[54]对中子诱变模式水稻品种Kitaake的1 504个突变品系进行全基因组测序,确定了影响32 307个基因(水稻全基因组的58%)的91 513个突变,平均每个品系有61个突变,建立了名为KitBase的共享数据库。Jiang等[55]在利用KitaBase数据库基础上进行研究,鉴定了一个水稻粒形突变株,发现gs9-1基因是参与赤霉素(GA)生物合成的BC12/GDD1/MTD1的新等位基因。李梅[56]通过对中子辐照后稻米籽粒性状分析,在突变品系中检测到直链淀粉含量的变化,而支链淀粉结构没有改变。Ruengphayak等[57]获得对铁毒害耐受的突变株,其中子辐照引发了FRO1基因的变化,从而增强水稻对铁毒害的耐受性,以及籽粒中铁含量增高。Pitaloka等[58]在使用中子诱变水稻Jao Hom Nin(JHN)的基础上,探究到气孔密度和大小的改变可影响水稻对干旱胁迫的响应以及对水分的利用率,低密度、小尺寸气孔能够更好地限制水分蒸发,利于水稻适应干旱条件。
1.3 太空诱变
太空诱变是将生物材料送入太空,在太空微重力环境中接受高能宇宙辐射进行诱变的一种方式。因为致变因素十分复杂,所以太空诱变具有诱变变异频率高、变异幅度大、优良性状稳定快等特点。由于其诱变环境发生了根本性变化,可获得一些迄今在地球上尚未出现的变异材料[59-60]。
利用太空诱变技术进行诱变育种,有助于我们全面探索太空诱变技术的机理、方法和理论,也有助于探寻基因突变规律以及获取优质种质资源[61]。张志勇等[62]通过全基因组测序的方法对突变株和野生型水稻材料基因组中SNPs、InDel、SV变异进行分析,发现基因组诱变作用基本上平均分布,与各对染色体的大小呈正相关。诱变类型是SNPs>InDel>SV,表明太空诱变在水稻基因组中主要是单碱基突变。张兰民等[63]观察到寒地早粳水稻变异存在很大的随机性,有益农艺性状变异如株高变矮、穗变长、穗粒数增多、千粒重增加、结实率升高、分蘖增加等出现比例较高,可见太空诱变育种是创造优质种质资源的有效方法。赵德珠[64]报道的太空诱变品种连粳1号具有高产、稳产的特点,在水稻品种混杂、种植技术水平较低的地区推广应用能够很好地实现增产增收。
1.4 多倍体诱变
秋水仙碱是最常用且最有效的一种多倍体诱变剂,其作用原理是在细胞有丝分裂过程中,抑制纺锤体微管的形成,阻止染色体分离,使细胞中染色体成倍增加,从而形成同源多倍体。多倍体是指染色体数目超过2组,具有完整染色体组的生物体[65]。植物多倍化是驱动物种形成和多样性进化的重要动力之一[66-67]。目前,我们广泛种植的水稻是二倍体作物,与其他多倍体作物(如小麦)相比,水稻的基因组更小,DNA含量更低,二倍体水稻遗传资源有限[68]。因此,多倍体水稻培育有助于丰富遗传性状信息,增加基因重组多样化,增进或改变某些特性的潜能[69]。
秋水仙碱诱导多倍体水稻育种,有助于提高水稻对极端环境的适应性。Tu等[70]发现在盐胁迫下,与二倍体水稻相比,四倍体水稻具有更高的盐胁迫耐受性,根系生长抑制较少,脯氨酸和可溶性糖含量较高,丙二醛含量较低。李德江等[71]研究表明,多倍体水稻中SOD和POD相关基因表达上调使得水稻抗氧化能力增强,也是抵御盐胁迫的原因之一。多倍体水稻还促进籽粒膨大,器官增大等农艺性状。杨祥波等[72]诱变获得同源四倍体植株YB16(4),相比二倍体品系茎秆粗壮、分蘖增多、穗长增加。Zhang等[73]为了探索水稻的杂种优势,培育出两株具有光敏和热敏基因雄性不育性的水稻多倍体品系。这些品系表现出较高的异花授粉能力、育性变化和较高的配合能力。从这些品系获得的杂交种显示出很高的杂种优势,并具有提高水稻产量和品质的潜力。
1.5 诱变剂组合诱导随机突变
除上述仅使用一种化学或物理手段作为诱变源外,还可将两种方法相结合进行诱变,增加诱变频率。罗洪发等[74]使用0.75%的EMS溶液和γ射线双重诱变处理水稻种子,获得了较高的突变频率(1.79%),检测到突变株在茎秆形态、叶形叶色、籽粒大小等农艺性状方面均有变化,可为水稻突变体库构建和功能基因组研究提供实物材料。Gautam等[75]使用EMS和γ射线结合诱变并与单独使用γ-射线诱变进行对比,观察到组合处理中获得理想型早熟突变体的频率更高、存活突变株频率更高、诱变效果更好。Manikandan和Vanniarajan[76]利用电子束和γ射线组合诱变处理,相比于仅使用γ射线反复处理,叶绿素含量突变频率更高。
2 诱变株鉴定方法
随着水稻育种研究的不断深入,目前已有很多方法用于水稻突变株的筛选和鉴定。主要是形态学鉴定,试验检测鉴定,分子生物学鉴定。形态学鉴定和特定物质检测难以判断突变发生的真实性,因此还需要借助分子生物学方法来辨别突变的真假[77]。
2.1 形态学鉴定
在诱变水稻群体中观察农艺性状变化,通过与野生型植株进行比较,挑选存在表型差异的突变株(如茎秆粗细、分蘖多少、叶色深浅等),经过连续多代选择培育,获得具有稳定性状的水稻新品种。水稻性状与产量之间有着密切关系,挑选优良性状,排除不利突变,培育健康水稻品种,目的都是为了提高水稻产量,满足人们对稻米增量的需求[78]。利用诱变育种可对水稻的多种农艺性状产生影响,也为进一步探究水稻分子机理提供基础[42]。
2.2 试验检测鉴定
对于难以通过表型鉴定的可能突变,通常采用试验检测的方式鉴定诱变处理是否发生突变。在稻米品质方面,可以测定突变株稻米中特定物质,如蛋白质、直链淀粉、芳香物质等[79]。筛选具有抗逆性水稻突变株时,可采用抗性鉴定的方法[80-82],鉴定抗生物胁迫和非生物胁迫的有效变异。保证水稻安全生产需要,可进行重金属检测[83-84],淘汰重金属富集的水稻突变株。
2.3 分子生物学鉴定
2.3.1 分子标记辅助育种 分子标记辅助育种在水稻育种研究中有着十分重要的作用,其原理是利用分子标记与目标基因紧密连锁的特点,通过检测杂交后代中的分子标记即可检测到目的基因。水稻中广泛引用的分子标记技术主要有RFLP、RAPD、SSR和AFLP等[85-86]。分子标记技术具有不受环境干扰,准确性好,重复性高等特点。传统的分子育种分析技术主要适用于质量性状位点及主效基因的定位,对于微效基因定位难度相对较大,所需时间较长[87]。目前,对于诱变水稻分子标记基因定位方面的应用,包括籽粒形状[88-89]、叶色叶形[90-92]、水稻抗性[93]等。
2.3.2 突变位点图谱分析(MutMap) MutMap是一种基于可见突变表型的植物分离群体的混合DNA进行全基因组测序的方法,可定位控制重要农艺性状的水稻基因的基因组位置[94]。MutMap原理是利用经诱导后稳定的突变后代与野生型进行杂交,生成的F1代自交,得到具有表型差异的F2代,构建野生型和突变型混合DNA池,进行全基因组测序,利用SNP标记定位突变株同亲本变化的基因组。随着MutMap测序分析方法的建立,MutMap+[95]、MutMap-Gap[96]和QTL-seq[97]等与之相关的技术也孕育而生,有效减少识别水稻基因所用的时间,为水稻育种和基因组分析提供了有力帮助。
2.3.3 定向诱导基因组局部突变技术(TILLING) TILLING是一种反向遗传学研究方法,用于检测目的基因特定位点的突变。该技术起初是以化学诱变为基础,结合PCR检测和高通量测序技术的一种技术体系[98],但随着应用的不断深入,现已被用于EMS[99-100]、MNU[101]、空间诱变和重离子束[102]等多种诱变方式产生突变的检测。随着TILLING技术的广泛使用,许多有关TILLING的延伸技术也不断被开发出来。基于高分辨率熔解曲线技术的HRM-TILLING,在水稻中被用于检测γ射线诱导的DNA变化[103]。对自然群体的点突变进行检测的Eco-TILLING技术,可识别水稻基因组的自然变异[104]。改进和简化了诱变群体种植和取样方式的iTILLING,可用于分析水稻幼苗的基因组DNA[105]。
3 诱变的优缺点
相比于常规育种,诱变育种具有十分明显的优势,可为育种工作者提供丰富的种质资源和遗传变异。诱变育种的优点:① 诱变操作方法简单,便于实施和操作;② 诱变频率显著提高,提供更多变异进行筛选;③ 缩短育种周期,可在较短时间内培育出优势品种;④ 丰富遗传变异范畴,可获得更多在自然变异中难以获取的优良性状,扩大突变体资源库;⑤ 克服远缘杂交的不亲和性,拓宽现有水稻品种遗传背景[106-108]。
利用诱变方法进行育种,其研究的局限性也是不容忽视的。诱变育种的缺点:① 突变随机性大,诱变性状难以确定,需要进行大量筛选工作;② 有益突变频率仍旧很低,致死致畸比率高于有利变异;③ 诱变机理尚不十分明确,难以做到定向诱变;④ 诱变育种遗传稳定性也有待考证,后代培养中存在二次突变的可能[109-110]。
4 展望
诱变育种开创至今已有近百年历史,在此期间科学家通过诱变技术获得了大量的突变材料,同时也对诱变技术进行了诸多的改良和补充。1957年是水稻诱变史上具有里程碑意义的一年,我国科学家利用X射线诱变获得第一株水稻突变体,自此揭开了水稻诱变育种的新篇章。水稻作为重要粮食作物、基因组较小的模式生物,与其他作物具有较高的同线性关系。因此,水稻结构和功能基因组学的诸多研究成果已经延伸到其他作物品种。通过诱变技术增加水稻变异性,为水稻农艺学方面的发展提供了强劲动力,在水稻基因功能的鉴定、突变新品种的开发以及特定基因的编辑修饰上提供了帮助。同时,新技术的开发和应用有助于人们向水稻更深层次进行探索和研究。
水稻育种的真谛是获得优良基因型,以创造更大的经济收益[3]。水稻新品种的选育和利用,可以满足日渐增长的稻米需求。诱变是遗传资源开发的关键工具,可为育种工作提供有效突变,科学使用诱变育种技术可以增加突变频率,提高育种效率,缩短育种时间[111]。在掌握水稻性状遗传变异规律的基础上,根据育种目标,采用适合的育种手段,定向培育水稻新品种,努力提高稻米质量和营养成分,增强稻米加工和外观品质,提高水稻抗逆性和丰产性,以满足确保消费者和种植户的需求,有序推进生物育种产业化应用,推动水稻产业的可持续发展。
参考文献:
[1] YU S B, JAUHAR A, ZHANG C P, et al. Genomic Breeding of Green Super Rice Varieties and Their Deployment in Asia and Africa[J]. Theoretical and Applied Genetics, 2020,133(5):1427-1442.
[2] ZHANG Q F. Strategies for developing Green Super Rice[J].Proceedings of the National Academy of Sciences of the United States of America, 2007,104(42):16402-16409.
[3] 肖国樱,肖友伦,李锦江,等.高效是当前水稻育种的主导目标[J].中国水稻科学,2019,33(4):287-292.
[4] JIANG S Y, SRINIVASAN R. Assigning biological functions to rice genes by genome annotation,expression analysis and mutagenesis[J]. Biotechnology Letters, 2010,32(12):1753-1763.
[5] DA LUZ V K, DA SILVEIRA S F S, DA FONSECA G M, et al. Identification of variability for agronomically important traits in rice mutant families[J]. Bragantia, 2016,75(1):41-50.
[6] 于永英.水稻诱变育种及机理研究[J].民营科技,2012(6):110.
[7] WANG N L, LONG T, YAO W, et al. Mutant resources for the functional analysis of the rice genome[J]. Molecular Plant, 2013,6(3):596-604.
[8] WU J L, WU C J, LEI C L, et al. Chemical- and irradiation-induced mutants of indica rice IR64 for forward and reverse genetics[J]. Plant Molecular Biology, 2005,59(1):85-97.
[9] 彭波,徐庆国,李海林,等.农作物化学诱变育种研究进展[J].作物研究,2007(S1):517-519,524.
[10] JENG T L, Ho P T, SHIH Y J, et al. Comparisons of protein, lipid, phenolics, γ-oryzanol, vitamin E, and mineral contents in bran layer of sodium azide-induced red rice mutants[J].Journal of the Science of Food and Agriculture, 2011,91(8):1459-1465.
[11] NAWAZ Z, SHU Q Y. Molecular nature of chemically and physically induced mutants in plants: A review[J].Plant Genetic Resources,12(S1),S74-S78.
[12] SERRAT X, ESTEBAN R, GUIBOURT N, et al. EMS mutagenesis in mature seed-derived ricecallias a new method for rapidly obtaining TILLING mutant populations[J].Plant Methods,2014,10(1):5.
[13] TALEBI B A,TALEBI B A, SHAHROKHIFAR B. Ethyl Methane Sulphonate (EMS) Induced Mutagenesis in Malaysian Rice (cv. MR219) for Lethal Dose Determination[J].American Journal of Plant Sciences,2012,3(12):1661-1665.
[14] 陈开,陈宇峰,封昱均,等.水稻EMS诱变根系突变体的筛选及其农艺性状分析[J].西南农业学报,2022,35(6):1233-1242.
[15] SEVANTHI A M V, KANDWAL P, KALE P B, et al. Whole Genome Characterization of a Few EMS-Induced Mutants of Upland Rice Variety Nagina22 Reveals a Staggeringly High Frequency of SNPs Which Show High Phenotypic Plasticity Towards the Wild-Type[J]. Frontiers in Plant Science, 2018,9:1179.
[16] HUANG X Z, ZENG X F, CAI M L, et al. The MSI1 member OsRBAP1 gene, identi?ed by a modi?ed MutMap method, is required for rice height and spikelet fertility[J].Plant Science, 2022,320:111201.
[17] 陈天子,余月,凌溪铁,等.EMS诱变水稻创制抗咪唑啉酮除草剂种质[J].核农学报,2021,35(2):253-261.
[18] SANSENYA S, Hua Y L, CHUMANEE S, et al. Effect of Gamma Irradiation on 2-Acetyl-1-pyrroline Content, GABA Content and Volatile Compounds of Germinated Rice (Thai Upland Rice)[J]. Plants, 2017,6(2):18.
[19] SATOH H, MATSUSAKA H, KURMAMARU T. Use of N-methyl-N-nitrosourea treatment of fertilized egg cells for saturation mutagenesis of rice[J]. Breeding Science, 2010,60(5):475-485.
[20] 王迪,牛梅,王健,等.淮稻5号化学诱变突变体库的构建与基因快速定位[J].江苏农业科学,2021,49(4):26-31.
[21] ZHOU K N, Xia J F, WANG Y L, et al. A Young Seedling Stripe2 phenotype in rice is caused by mutation of a chloroplast-localized nucleoside diphosphate kinase 2 required for chloroplast biogenesis[J]. Genetics and Molecular Biology, 2017,40(3):630-642.
[22] 曹鹏辉,郜素,于雅洁,等.水稻低温白化突变体lta1的表型鉴定与基因定位[J].植物遗传资源学报,2023,24(1):275-281.
[23] 李祖胜,徐庆国,彭波,等.3种化学诱变剂对不同水稻品种米质性状的影响[J].湖南农业科学,2015(4):7-9,13.
[24] LONG W H, DONG B N, WANG Y H, et al. FLOURY ENDOSPERM8, encoding the UDP-glucose pyrophosphorylase 1, affects the synthesis and structure of starch in rice endosperm[J]. Journal of Plant Biology, 2017,60(5):513-522.
[25] 蔺豆豆,赵桂琴,柴继宽,等.叠氮化钠诱变燕麦M1代的主要性状分析[J].草地学报,2022,30(3):587-593.
[26] 钱玉源,韩轩,刘祎,等.叠氮化钠(NaN3)诱变在作物性状改良中的应用[J].安徽农业科学,2017,45(35):136-138,141.
[27] 李清国,付晶,钮力亚,等.化学诱变及其突变体筛选在育种中的应用[J].河北农业科学,2010,14(5):68-72.
[28] HUSSAIN A J, Ali J, SIDDIQ E A, et al. Mapping of tms8 gene for temperature-sensitive genic male sterility (TGMS) in rice (Oryza sativa L.)[J]. Plant Breeding, 2012,131(1):42-47.
[29] LIN K C, JWO W S, CHANDRIKA N N P, et al. A rice mutant defective in antioxidant-defense system and sodium homeostasis possesses increased sensitivity to salt stress[J]. Biologia Plantarum, 2016,60(1):86-94.
[30] WANG C S, LO K L, WANG A Z. Sodium azide mutagenesis generated diverse and broad spectrum blast resistance mutants in rice[J]. Euphytica, 2019,215:145.
[31] 张丰收,王青.植物辐射诱变育种的研究进展[J].河南师范大学学报(自然科学版),2020,48(6):39-49.
[32] 黄桂丹.60Co-γ射线辐射育种研究进展[J].林业与环境科学,2016,32(2):107-111.
[33] 范菁.60Co-γ辐射对茭白生长和生理特性的影响[D].杭州:浙江大学,2012.
[34] 史玮.60Co-γ射线辐照创造马铃薯突变株系的研究[D].兰州:甘肃农业大学,2006.
[35] 张一林,杨欧,刘华,等.水稻茎秆壁增厚突变体的表型鉴定与基因定位[J].分子植物育种,2022,20(14):4677-4684.
[36] 余艳欢,仲崇元,李有光,等.水稻窄叶突变体nal7-2(t)的遗传分析和基因定位[J].农村经济与科技,2020,31(10):23-25.
[37] 胡彬华,王平,杜安平,等.水稻淡黄叶突变体pyl3的鉴定和基因定位[J].核农学报,2021,35(12):2696-2703.
[38] 陈能刚,鄢小青,李欢,等.60Co辐射诱导水稻短穗小粒突变体sp18的表型鉴定与基因定位[J].种子,2022,41(10):90-94.
[39] LI S B, QIAN Q, FU Z M, et al. Short panicle1 encodes a putative PTR family transporter and determines rice panicle size[J]. The Plant journal : for cell and molecular biology, 2009,58(4):592-605.
[40] 陈功海,魏霞,徐延浩.离子束诱变在作物育种中的应用[J].宁夏农林科技,2020,61(2):11-13.
[41] 刘瑞媛,金文杰,曲颖,等.重离子束辐射诱变技术在植物育种中的应用[J].广西科学,2020,27(1):20-26.
[42] 温晓婷,张鑫,李景鹏,等.高能重离子束辐射水稻诱变育种研究进展[J].土壤与作物,2022,11(2):179-191.
[43] 岳春晖,袁召,陈鹏,等.离子束辐照水稻变异材料染色体行为观察[C]//河南省细胞生物学学会.河南省细胞生物学学会第二届会员代表大会暨学术研讨会论文摘要集.新乡:河南师范大学生命科学学院,2009:1.
[44] 余增亮,何建军,邓建国,等.离子注入水稻诱变育种机理初探[J].安徽农业科学,1989(1):12-16.
[45] DUDLEY T G. Molecular and cell models of biological effects of heavy ion radiation[J]. Radiat Environ Biophys, 1995,34(2):67-72.
[46] 张晓勇,陈秀霞.低能离子诱变育种作用机理及生物学效应研究进展[J].广东农业科学,2008(6):20-22,26.
[47] ISHIKAWA S, ISHIMARU Y, IGURA M, et al. Ion-beam irradiation, gene identification, and marker-assisted breeding in the development of low-cadmium rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012,109(47):19166-19171.
[48] 陈慧茹.镉在水稻亚种间的吸收转运和积累差异及其低积累突变种质的创建[D].合肥:中国科学技术大学,2019.
[49] 冯莹睿.低能N+辐照水稻对ABA合成通路相关基因表达的影响[D].郑州:郑州大学,2012.
[50] 陈晓明,谭碧生,郑春,等.快中子辐照对枯草芽孢杆菌DNA损伤研究[J].高能物理与核物理,2007,31(10):972-977.
[51] BELFIELD E J, GAN X C, MITHANI A, et al. Genome-wide analysis of mutations in mutant lineages selected following fast-neutron irradiation mutagenesis of Arabidopsis thaliana[J]. Genome research, 2012,22(7):1306-1315.
[52] BOLON Y T, STEC A O, MICHNO J M, et al. Genome resilience and prevalence of segmental duplications following fast neutron irradiation of soybean[J]. Genetics, 2014,198(3):967-981.
[53] LI G T, CHERN M, JAIN R, et al. Genome-Wide Sequencing of 41 Rice (Oryza sativa L.) Mutated Lines Reveals Diverse Mutations Induced by Fast-Neutron Irradiation[J]. Molecular Plant, 2016,9(7):1078-1081.
[54] LI G T, JAIN R, CHERN M, et al. The Sequences of 1504 Mutants in the Model Rice Variety Kitaake Facilitate Rapid Functional Genomic Studies[J]. The Plant Cell, 2017,29(6):1218-1231.
[55] JIANG L R, LI G T, CHREN M, et al. Whole-Genome Sequencing Identifies a Rice Grain Shape Mutant, gs9-1[J]. Rice, 2019,12:52.
[56] 李梅.快中子辐射对泰国水稻品种Jao Hom Nin直链淀粉含量和支链淀粉结构的影响[J].安徽农业科学,2010,38(23):12427-12428,12433.
[57] SIRIPHAT R,VINITCHAN R, CHATREE S, et al. Forward screening for seedling tolerance to Fe toxicity reveals a polymorphic mutation in ferric chelate reductase in rice[J]. Rice (New York), 2015,8:3.
[58] PITALOKA M K, CAINE R S, HEPWORTH C, et al. Induced Genetic Variations in Stomatal Density and Size of Rice Strongly Affects Water Use Efficiency and Responses to Drought Stresses[J]. Frontiers in Plant Science, 2022,13:801706.
[59] 尹琼,吴佳海,陈超.航天诱变黔草1号高羊茅形态多样性研究[J].耕作与栽培,2022,42(4):20-23.
[60] 冷家业.小麦诱变技术综述[J].农业技术与装备,2020(4):145-146.
[61] 徐得泽,吴建平,陈宏伟.水稻航天诱变育种探析[J].现代农业科技,2009(19):66-67.
[62] 张志勇,蒲志刚,王平,等.水稻航天诱变突变体全基因组测序研究[J].西南农业学报,2014,27(2):469-475.
[63] 张兰民,潘国君,杨立英,等.寒地早粳水稻航天育种研究初探[J].中国种业,2014(2):43-46.
[64] 赵德珠.航天诱变水稻连粳1号选育与推广[J].农业与技术,2017,37(9):91-92.
[65] 王利虎,卢彦琦,苏行,等.果树多倍化育种研究进展[J].山西农业大学学报(自然科学版),2022,42(3):14-24.
[66] CHEN J T, COATE J E, MERU G. Editorial: Artificial Polyploidy in Plants[J]. Frontiersin Plant Science, 2020,11:621849.
[67] 虞夏清,陈劲枫.葫芦科作物多倍化研究进展[J].南京农业大学学报,2022,45(5):874-882.
[68] CHEN R R, FENG Z Y, ZHANG X H, et al. A New Way of Rice Breeding: Polyploid Rice Breeding[J]. Plants, 2021,10:422.
[69] 陈金焕.多倍体育种是林木产业化的“芯动力”[J].绿色中国,2022(16):58-61.
[70] TU Y, JIANG A H, GAN L, et al. Genome duplication improves rice root resistance to salt stress[J]. Rice (New York), 2014,7:15.
[71] 李德江,王薇,卢凤丹,等.盐胁迫对不同倍体水稻生理及抗氧化酶相关基因的影响[J].吉林农业大学学报,2022.
[72] 杨祥波,刘湘竹,曾宪伟,等.同源四倍体水稻的诱导研究[J].北方水稻,2019,49(6):27-29.
[73] ZHANG X H, ZUO B, SONG Z J, et al. Breeding and study of two new photoperiod- and thermo-sensitive genic male sterile lines of polyploid rice (Oryza sativa L.)[J]. Scientific reports, 2017,7(1-4):14744.
[74] 罗洪发,查仁明,杨洪海,等.水稻突变体的创制[J].中国农学通报,2011,27(27):45-49.
[75] GAUTAM V, SWAMINATHAN M, AKILAN M, et al. Early flowering, good grain quality mutants through gamma rays and EMS for enhancing per day productivity in rice (Oryza sativa L.)[J]. International journal of radiation biology, 2021,97(12):11-19.
[76] MANIKANDAN V, VANNIARAJAN C. Induced Macromutational Spectrum and Frequency of Viable Mutants in M2 Generation of Rice (Oryza Sativa L.)[J]. International Journal of Current Microbiology and Applied Sciences, 2017,6(7):1825-1834.
[77] 张玉. EMS诱变小麦开花习性突变体的筛选与鉴定[D].泰安:山东农业大学,2022.
[78] LI R H, LI M J, ASHRAF U, et al. Exploring the Relationships Between Yield and Yield-Related Traits for Rice Varieties Released in China From 1978 to 2017[J]. Frontiers Plant Science, 2019,10:543.
[79] 王志玺,吕文俊,崔晶,等.稻米品质的相关性分析[J].天津农学院学报,2018,25(3):9-15,33.
[80] 贺闽,尹俊杰,冯志明,等.水稻稻瘟病和纹枯病抗性鉴定方法[J].植物学报,2020,55(5):577-587.
[81] 唐璇,吕树伟,范芝兰,等.水稻耐冷性鉴定研究进展[J].植物遗传资源学报,2023,24(2):325-331.
[82] 刘佳音,邵晓宇,邹丹丹,等.水稻耐盐碱鉴定方法及评价指标研究进展[J].杂交水稻,2019,34(6):1-6.
[83] 陈怀红.水稻对土壤中重金属的富集作用[J].农技服务,2022,39(8):4-6.
[84] 李广.水稻中常见重金属的检测方法概述[J].北方水稻,2022,52(2):57-60.
[85] 丁健美,刘之熙.杂交水稻品种鉴定方法(综述)[J].南方农业,2022,16(13):139-143.
[86] 吴昊,陈涛,姚姝,等.分子标记辅助选择技术及其在水稻定向改良上的应用研究进展[J].江苏农业科学,2014,42(2):22-27.
[87] 谢鹏.基于全基因组测序的MutMap方法在水稻氮高效育种当中的应用[D].南京:南京农业大学,2020.
[88] 林孝欣,黄明江,韦祎,等.水稻籽粒伸长突变体lgdp的鉴定与基因定位[J].作物学报,2023,49(6):1699-1707.
[89] 邓雪梅,胡鹏,王月影,等.水稻粒宽突变体gw4的鉴定与基因定位[J].中国水稻科学,2021,35(3):259-268.
[90] 郭均瑶,刘斌美,杨惠杰,等.水稻叶脉黄化突变体yml的遗传分析及基因定位[J].作物学报,2022,48(12):3120-3129.
[91] 骆兵兵.水稻黄绿叶突变体ygl205的基因定位及特征特性分析[D].沈阳:沈阳农业大学,2022.
[92] 范鸣谦.水稻白条纹叶突变体wsl179的生理特性分析和基因定位[D].沈阳:沈阳农业大学,2022.
[93] 孙大元,陈冠州,张景欣,等.空间诱变水稻品系T2的稻瘟病抗性分析及抗病基因定位[J].华北农学报,2016,31(2):7-11.
[94] ABE A, KOSUGI S, YOSHIDA K, et al. Genome sequencing reveals agronomically important loci in rice using MutMap[J].Nature biotechnology,2012,30(2):174-178.
[95] FEKIN R, TAKAGI H, TAMIRU M, et al. MutMap+: genetic mapping and mutant identification without crossing in rice[J]. Plos One, 2013,8(7):e68529.
[96] TAKAGI H, UEMURA A, YAEGASHI H, et al. MutMap-Gap: whole-genome resequencing of mutant F2 progeny bulk combined with de novo assembly of gap regions identifies the rice blast resistance gene Pii[J]. New Phytologist, 2013,200(1):276-283.
[97] TAKAGI H, ABE A, YOSHIDA K, et al. QTL-seq: rapid mapping of quantitative trait loci in rice by whole genome resequencing of DNA from two bulked populations[J]. Plant Journal, 2013,74(1):174-183.
[98] MCCALLU C M, COMAI L, GREENE E A, et al. Targeting induced local lesions IN genomes (TILLING) for plant functional genomics[J]. Plant physiology, 2000,123:439-442.
[99] 王彩芬,马晓玲,安永平,等.TILLING技术在水稻耐盐基因SKC1突变体筛选中的应用[J].作物杂志,2013(5):66-70.
[100] SERRAT X, ESTEBAN R, GUIBOURT N, et al. EMS mutagenesis in mature seed-derived rice calli as a new method for rapidly obtaining TILLING mutant populations[J]. Plant Methods, 2014,10:5.
[101] SUZUKI T, EIGUCHI M, KUMAMARU T, et al. MNU-induced mutant pools and high performance TILLING enable finding of any gene mutation in rice[J]. Molecular genetics and genomics, 2008,279(3):213-223.
[102] 严贤诚.水稻空间诱变与重离子诱变效应分析及突变体定向筛选[D].广州:华南农业大学,2018.
[103] LI S, LIU S M, FU H W, et al. High-resolution melting-based TILLING of γ ray-induced mutations in rice[J]. Journal of Zhejiang University-Science B, 2018,19:620-629.
[104] VAUGHN J N, BENNETZEN J L. Natural insertions in rice commonly form tandem duplications indicative of patch-mediated double-strand break induction and repair[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014,111:6684-6689.
[105] KRYSAN P. Ice-cap. A high-throughput method for capturing plant tissue samples for genotype analysis[J]. Plant Physiol, 2004,135:1162-1169.
[106] 张正鹏.甜叶菊物理诱变育种的发展[J].中国糖料,2017,39(5):61-64.
[107] 杨震,彭选明,彭伟正.作物诱变育种研究进展[J].激光生物学报,2016,25(4):302-308.
[108] 罗小忠,郭樱花,叶菊华,等.水稻育种的方法和手段[J].现代农业科技,2020(14):30-31.
[109] 杨端鹏,李仲先,王胜男,等.微藻基因诱变研究及应用进展[J].海洋科学,2021,45(11):165-178.
[110] 李夏.现代玉米育种新技术探析[J].吉林农业,2014,(12):32-33.
[111] 靳鲲鹏,李丹,李小霞,等.大豆诱变育种的研究进展[J].北方农业学报,2020,48(5):30-33.
