芫根多糖的提取及其抗缺氧能力研究
2024-06-17王福清

摘要:为充分利用芫根资源,采用水提醇沉的方法提取芫根多糖,根据单因素试验和正交试验研究并优化芫根多糖提取工艺,并初步探究芫根多糖对急性缺氧小鼠血清中生化指标的影响。研究结果表明,芫根多糖的最佳提取工艺为料液比1∶20、提取温度100 ℃、提取时间4 h和提取次数4次。对于低压低氧环境中的小鼠,在给予芫根多糖干预后,小鼠血清中的氧化应激指标水平有所改善,表明芫根多糖具有一定的抗高原缺氧的作用。该研究结果将有助于深入研究芫根多糖的生物活性,为其在医学和保健食品工业等领域的应用提供科学支持。
关键词:高原缺氧;芫根多糖;抗氧化;生化指标
中图分类号:TS201.23
文献标志码:A
文章编号:1000-9973(2024)06-0195-05
Study on Extraction and Anti-Hypoxia Ability of Polysaccharides
from Brassica rapa L.
WANG Fu-qing
(National and Local Joint Engineering Research Center for Deep Processing of Special Agricultural
and Animal Husbandry Products in Tibet Plateau, Lhasa 850600, China)
Abstract: In order to make full use of Brassica rapa L. resources, polysaccharides are extracted from Brassica rapa L. by water extraction and alcohol precipitation method. The extraction process of polysaccharides from Brassica rapa L. is studied and optimized by single factor test and orthogonal test, and the effects of polysaccharides from Brassica rapa L. on biochemical indexes in the serum of mice with acute hypoxia are explored preliminarily. The results show that the optimal extraction process of polysaccharides from Brassica rapa L. is solid-liquid ratio of 1∶20, extraction temperature of 100 ℃, extraction time of 4 h and extraction times of 4.For mice in low-pressure and low-oxygen environment, the levels of oxidative stress indexes in the serum of mice are improved after the intervention of polysaccharides from Brassica rapa L., which indicates that polysaccharides from Brassica rapa L. have certain anti-hypoxia effect at high altitude. The research results will be helpful to study the bioactivity of polysaccharides from Brassica rapa L. in depth, and provide scientific support for their application in the fields of medicine and health food industry.
Key words: high altitude hypoxia; polysaccharides from Brassica rapa L.; antioxidation; biochemical indexes
收稿日期:2024-01-26
作者简介:王福清(1963—),男,正高级工程师,硕士,研究方向:食品加工技术。
芫根(Brassica rapa L.),又称芜菁根、根头菜、圆根、灰萝卜等,是一种常见的蔬菜,属于十字花科芸苔亚科[1]。目前芫根产地遍及我国青藏高原,被我国高原地区居民普遍种植,并用于缓解人和牲畜的高原反应[1-4]。芫根根部肥大,外形类似萝卜,形状多为圆锥形或长圆柱形,表面光滑,颜色有红、白、紫等多种变异;含有多种矿物质,如钾、钙、磷、镁等,这些矿物质对于维持骨骼健康、神经传导、细胞代谢等具有重要作用[4-6]。芫根含有丰富的维生素,尤其是维生素C,有助于机体免疫系统的正常运转、皮肤健康以及抗氧化作用等[4]。此外,芫根还富含膳食纤维,有助于促进肠道蠕动,维护消化系统的健康,调节血糖水平和降低胆固醇[4-5]。在《甘露本草明镜》、《新编藏医学》中记载芫根具有增强免疫力、调理机体、抗疲劳、抗衰老和抗缺氧等功效[6-7]。
芫根被广泛应用于食品加工中,这得益于芫根独特的口感、味道和风味[8]。芫根具有一定的辛辣味道,因此常被用作调味品或调味酱来增添食物的辛辣度。此外,芫根也被用于制作泡菜,通过腌渍过程,芫根与其他蔬菜混合在一起,被加工成口感丰富的泡菜。目前,关于芫根的生物活性已展开了一系列的探究,其富含的活性物质多糖已被证实具有抗氧化、抗缺氧、提高机体免疫力等保健或药理功效[4-6,8-16]。因此,通过提取和分离芫根多糖中的这些物质,可以进一步鉴定和研究其对人体健康的潜在益处,包括抗氧化、抗炎、抗肿瘤等活性[4-6]。
研究表明,芫根多糖干预后能明显提高缺氧小鼠血液中的红细胞数量和血红蛋白浓度,且能显著延长多种环境下缺氧小鼠的存活时间,表明芫根多糖具有一定的抗缺氧功效[4-6]。此外,芫根多糖还具有较强的清除DPPH自由基、ABTS自由基和羟自由基的能力,具有显著的体内外抗氧化活性[10,17]。因此,通过研究芫根多糖的提取以及对芫根多糖抗缺氧功效的探究,可以深入了解其药理学特性,为其在药物开发中的应用提供理论基础。
1 材料与方法
1.1 试验材料与试剂
自然晾晒的芫根块:购于西藏拉萨市农贸市场;石油醚、苯酚、95%乙醇和无水乙醇。
1.2 试验仪器
HWS-24水浴锅 上海一恒科学仪器有限公司;UV-VIS紫外分光光度计 上海仪电分析仪器有限公司;TG16-WS离心机 上海卢湘仪离心机仪器有限公司;BE-1200旋转混合仪 海门市其林贝尔仪器制造有限公司;4 ℃冰箱 唐山橱加徳不锈钢厨房设备有限公司;SI-0246涡旋振荡器 北京锐志汉兴科技有限公司;BIUGED电热套 标格达精密仪器(广州)有限公司;SMO烘箱 宁波志圣烘箱有限公司;BSA224S-CW电子天平 赛多利斯科学仪器(北京)有限公司;YQ-1019C超声清洗仪 上海易净超声波仪器有限公司。
1.3 试验方法
1.3.1 芫根原料的预处理
将购买的芫根块清洗干净,去除表面泥渍,并置于烘箱内进行低温烘干,温度设置为30 ℃左右。待芫根块的重量稳定后,进行磨粉处理,过50目筛得芫根细粉,装袋备用。为后续多糖的精制、纯化减少了障碍,进而得到纯度更高、更优质的芫根多糖,本文对芫根粉进行脱脂处理,流程:称取芫根粉1 kg→加入2倍的石油醚→回流脱脂处理2 h,重复2~3次。脱脂后,对芫根粉进行烘干直至石油醚完全挥发,待脱脂芫根粉恒重后,将其装入干燥器皿中备用。
1.3.2 芫根多糖提取工艺
本研究采用水提醇沉法对芫根多糖进行提取和纯化,具体工艺见图1。
1.3.3 芫根多糖测定
采用苯酚-硫酸法对芫根多糖进行测定。葡萄糖浓度标准曲线的制作参考谭秀娟[5]的方法。芫根样品多糖含量的测定:先准确称取1.3.2中提取的芫根多糖1 mg,加入蒸馏水制成浓度为1 mg/mL,测定其吸光度值,代入葡萄糖浓度标准曲线的回归方程。芫根多糖提取率公式如下:
芫根多糖提取率(%)=(芫根多糖含量(g)/芫根粉含量(g))×100%。
1.3.4 单因素试验
控制提取温度90 ℃、料液比例1∶20、提取时间4 h和提取次数3次,分别研究不同提取温度40,60,80,100 ℃;不同料液比例1∶10、1∶20、1∶30、1∶40、1∶50;不同提取时间1,2,3,4,5 h和不同提取次数1,2,3,4,5次对芫根多糖含量的影响。
1.3.5 正交试验
以提取温度、料液比例、提取时间和提取次数为变量因子,并以芫根多糖含量作为指标,进行正交试验,见表1。
1.3.6 急性缺氧小鼠模型的建立和芫根多糖干预的方法
急性缺氧小鼠模型的建立参照谭秀娟[5]的方法。建立小鼠模型后,随机分为常压常氧组、低压低氧对照组、芫根多糖低、中、高3个剂量组,每组5只。根据文献报道,本研究确定芫根高剂量组剂量为1 mg/g,中剂量组剂量为0.5 mg/g,低剂量组剂量为0.1 mg/g[18-20]。在试验前5 d,开始对芫根多糖干预组小鼠进行给药,其他两组以生理盐水处理。进入模拟低压低氧舱后,继续对芫根多糖干预组小鼠给药5 d,对低压低氧对照组以生理盐水干预。此外,常压常氧组小鼠一直处于舱外饲养,其饲养条件与其余组一致。
1.3.7 小鼠血清样品采集和血清中生化指标的检测
每天定时观察并记录小鼠的状况。试验结束后,对小鼠进行摘眼球取血,将收集的血液于室温下静置2 h,析出血清后于4 ℃、3 500 r/min离心15 min,收集上层清液,并参照南京建成生物工程研究所提供的相关测试盒方法对小鼠血清中氧化应激(SOD、T-AOC、MDA、GSH-Px)、代谢(LD、LDH)、一氧化氮合酶(NOS)指标水平进行立即测定。
2 结果和讨论
2.1 芫根多糖提取工艺的研究
2.1.1 标准曲线的绘制
根据实验所测结果计算对应的回归方程为Y=8.137 5X+0.042 25(R2=0.999,Y表示吸光度,X表示葡萄糖浓度)。
2.1.2 单因素试验结果
各单因素对芫根多糖提取率的影响见图3。
由图3中a可知,芫根多糖提取率随着温度的升高而逐渐增加,当温度为100 ℃时,芫根多糖提取率高达9%。
由图3中b可知,随着提取时间的延长,芫根多糖提取率不断增加,但是当提取时间超过4 h后,芫根多糖提取率出现下降趋势。
由图3中c可知,料液比例为1∶10时,芫根多糖提取率为5.5%,随着料液比例的增加,芫根多糖提取率出现缓慢增加的趋势,当料液比例从1∶20逐渐增加至1∶50时,芫根多糖提取率仅增加了0.3%~0.5%。
由图3中d可知,提取次数超过2次后,芫根多糖提取率的增幅逐渐趋于平稳,当提取次数为5次时,芫根多糖提取率高达7.4%。
在提取时间上,短时间的提取可能导致未能完全提取芫根中的多糖,而长时间的提取可能导致多糖的降解或损失。在料液比例和提取次数上,芫根多糖提取率分别在1∶20和提取2次后出现增幅趋于平缓的现象,表明一味地增加料液比例或过多增加提取次数并不能理想地提高芫根多糖的提取率。
2.1.3 正交试验及结果分析
由表2可知,最佳提取工艺条件为A2B1C1D2,即提取温度100 ℃、料液比例1∶20、提取时间4 h、提取次数4次。
由表3可知,提取温度和提取次数在所考察的范围内对芫根多糖提取率的影响极显著,而提取时间和料液比例在所考察的范围内对芫根多糖提取率的影响不显著,按照最佳条件进行芫根多糖的提取,重复3次试验,得到芫根多糖提取率最大为8.7%。
2.2 芫根多糖抗急性缺氧作用的研究
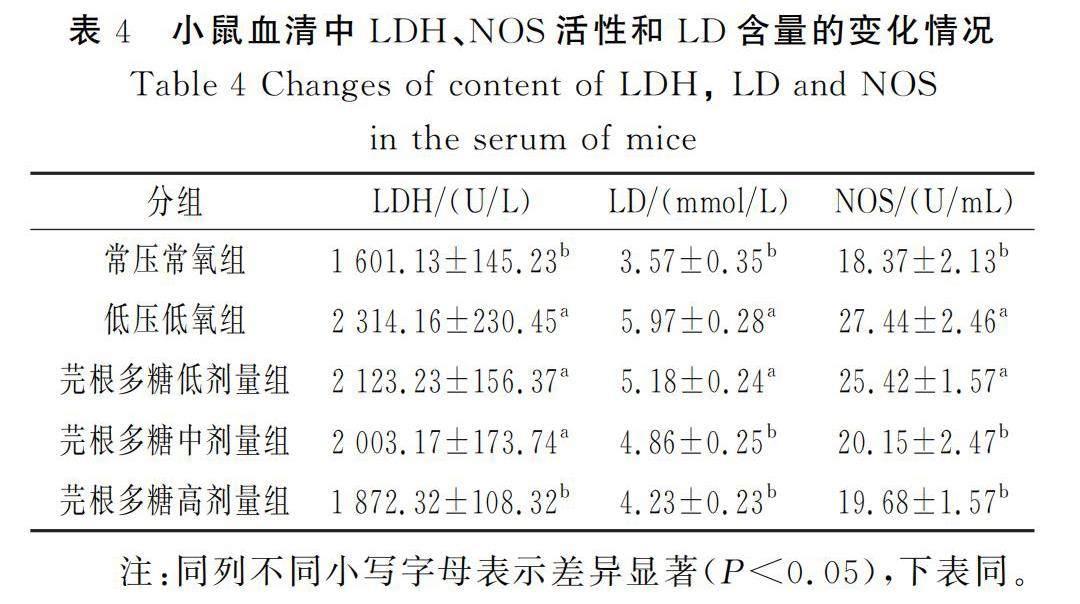
2.2.1 小鼠血清中LDH、NOS活性和LD含量的变化
由表4可知,与常压常氧组比较,低压低氧组小鼠的LDH活性和LD含量更高(P<0.05)。经芫根多糖给药干预后,高剂量组与中剂量组小鼠血清中这两项指标均显著降低(P<0.05),而LDH在低剂量组中与低压低氧组相比无明显变化,LD含量仅稍微降低,无显著差异。与常压常氧组相比,缺氧刺激后小鼠血清中的NOS活性大幅度增强,且差异显著(P<0.05);在芫根多糖给药干预后,小鼠血清中NOS活性有降低趋势,随着芫根多糖剂量的增加,NOS活性也逐渐降低,其效果在高、中剂量组中较显著(P<0.05)。
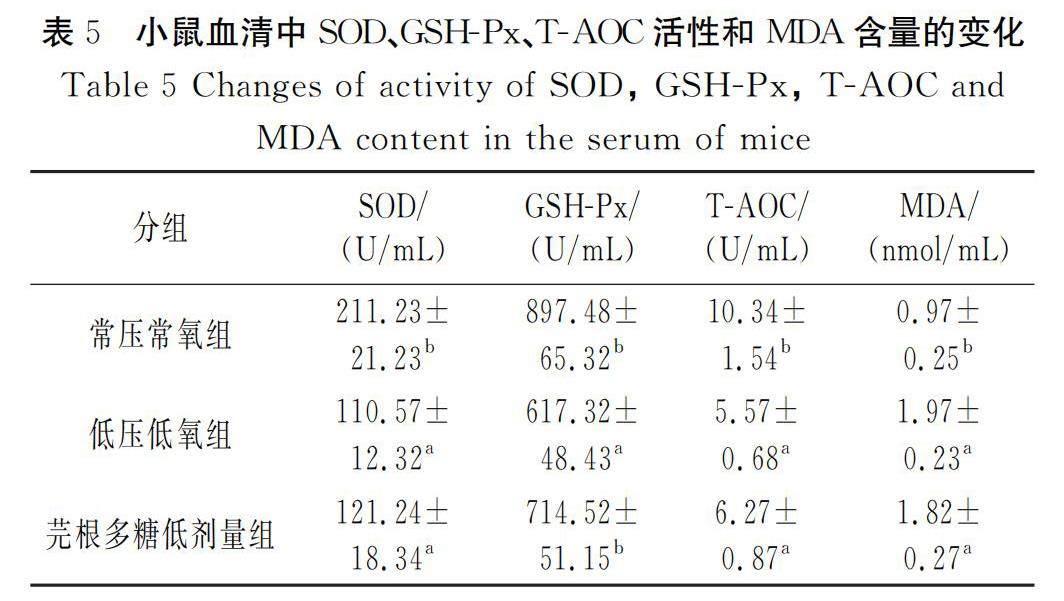
2.2.2 小鼠血清中氧化应激指标的变化情况
本研究测定了不同组小鼠血清的抗氧化指标SOD、GSH-Px、MDA及总抗氧化能力(T-AOC)。由表5可知,与常压常氧组相比,SOD、GSH-Px和T-AOC在低压低氧组中的活性均显著降低(P<0.05),而作为脂质氧化产物的MDA含量则显著升高(P<0.05)。与低压低氧组相比,GSH-Px随着芫根总多糖干预量的增加,其活性增强(P<0.05);T-AOC和SOD的活性在高、中剂量组中升高,差异显著(P<0.05),而在低剂量组中出现了无统计学意义的变化;MDA含量在高剂量组中显著降低(P<0.05),而在中、低剂量组中变化不显著。
3 小结
目前对于芫根多糖的提取方法以热水浸提法居多[1,3-5,10,17]。不少学者针对不同地域、不同设备提出不同的芫根多糖提取工艺,如Wang等[10]优化的工艺条件为温度93 ℃、提取时间4.3 h、液料比75∶1(mL/g);杨永东[17]得到最佳提取条件为温度90 ℃、料液比1∶30、水浴浸提3次,并在每次提取2 h后,加入3%活性炭在60 ℃时进行脱色处理,吸附时间为40 min;赵文瑾[4]提出的最佳工艺参数为超声功率360 W、提取时间55 min、液料比43∶1(mL/g)、温度60 ℃。由此可知,超声波辅助或者添加活性炭等进行脱色处理能不同程度地提高多糖的品质,但此类工艺需多次优化,以达到适用于工厂设备化的工艺参数要求。
高原缺氧的环境会引起人体多种器官的损伤,包括呼吸困难、疲劳等症状。胡贤达等[6]表明芫根水提取物具有一定的抗缺氧能力,经芫根水提取物干预的小鼠在一定时间内在密闭环境中的存活时间显著延长。赵文瑾[4]通过对芫根多糖进行提取、分离,获得占芫根总糖含量78.4%~90.6%的4种多糖级分,即BRP-20、BRP-40、BRP-60 和BRP-80。体外抗氧化活性试验结果表明,这4种芫根多糖均具有良好的体外抗氧化活性,其中以BRP-80的体外抗氧化活性最强,并且能够显著延长小鼠的游泳时长,存在剂量依赖效应。总体而言,芫根多糖具有抗高原缺氧以及抗疲劳的作用[4-6]。本文通过构建小鼠急性缺氧模型以探究给予芫根多糖提取物后小鼠血清中相关生化指标的变化,结果表明小鼠在低压低氧环境中出现氧化应激损伤,因缺氧而产生大量的氧自由基,致使小鼠血清中SOD和GSH-Px活性降低,T-AOC活性也明显降低,而MDA含量显著升高。然而这些应激反应均在芫根多糖干预后得到明显改善,并呈剂量依赖趋势。
高原地区氧气稀薄,机体的供氧不足会导致机体与需氧相关的功能代谢水平降低,这是高原疾病的主要因素之一[21]。本研究通过优化芫根多糖的提取工艺,并以此探究了芫根多糖对应激缺氧环境中小鼠血清中生化指标的影响,结果表明口服一定的芫根或芫根多糖产品能够缓解高原反应症状,这为芫根保健品或药品的开发提供了一定的试验依据。
参考文献:
[1]CHEN Z, WUFUER R, JI J, et al. Structural characterization and immunostimulatory activity of polysaccharides from Brassica rapa L.[J].Journal of Agricultural and Food Chemistry,2017,65(44):9685-9692.
[2]CHU B, CHEN C, LI J, et al. Effects of Tibetan turnip (Brassica rapa L.) on promoting hypoxia-tolerance in healthy humans[J].Journal of Ethnopharmacology,2017,195:246-254.
[3]XIE Y, JIANG S, SU D, et al. Composition analysis and anti-hypoxia activity of polysaccharide from Brassica rapa L.[J].International Journal of Biological Macromolecules,2010,47(4):528-533.
[4]赵文瑾.芫根多糖提取、分离及抗疲劳机理研究[D].无锡:江南大学,2021.
[5]谭秀娟.芫根总多糖提取及抗急性高原缺氧作用研究[D].成都:西南交通大学,2019.
[6]胡贤达,赵华龙,王彪,等.藏药芫根提取物对小鼠抗缺氧能力的研究[J].中国生化药物杂志,2016,36(1):37-39.
[7]国家中医药管理局.中华本草·藏药卷[M].上海:上海科学技术出版社,2002:400-416.
[8]王辞婉,王铖,朱红康,等.青海芫根提取物抗疲劳活性及其风味饮料的研究[J].饮料工业,2022,25(2):8-14.
[9]张旭,张华芳,刘阳,等.川西高原芫根化学成分及抗氧化活性研究[J].食品科技,2019,44(2):104-110.
[10]WANG W, WANG X, YE H, et al. Optimization of extraction, characterization and antioxidant activity of polysaccharides from Brassica rapa L.[J].International Journal of Biological Macromolecules,2016,82:979-988.
[11]陈卓尔,古娜娜·对山别克,乌英,等.新疆芜菁水提物抗肿瘤活性初步研究[J].西北药学杂志,2016,31(3):264-267.
[12]胡贤达,赵华龙,王彪,等.藏药芫根提取物对小鼠抗缺氧能力的研究[J].中国生化药物杂志,2016,36(1):37-39.
[13]李张宇,万波,王张,等.民族药蔓菁对肺炎链球菌和流感病毒感染小鼠的保护作用[J].中国现代中药,2015,17(3):212-217.
[14]陈湘宏,文绍敦,吴萍,等.芜菁不同提取物对糖尿病模型小鼠降血糖作用的研究[J].中国药房,2013,24(7):596-598.
[15]艾克拜尔江·阿巴斯,李冠,王静.新疆芜菁多糖降血糖作用的研究[J].新疆农业科学,2011,48(3):471-479.
[16]刘晖.高原植物(芫根&青稞苗)质量分析方法与初步活性的研究[D].南京:南京中医药大学,2019.
[17]杨永东.藏药蔓菁多糖的制备、组分分析及抗急性低压缺氧损伤作用的研究[D].成都:成都中医药大学,2013.
[18]谭秀娟,李古兵,张淼,等.芫根总多糖对模拟高原缺氧小鼠的作用研究[J].华西药学杂志,2020,35(2):171-175.
[19]王张,张艺,周林,等.蔓菁抗疲劳作用的量效关系初步研究[J].中药药理与临床,2012,28(5):128-130.
[20]邝婷婷,王宇,王张,等.藏药蔓菁膏抗缺氧作用的量-效/毒关系及质量标准研究[J].中国中药杂志,2016,41(4):597-602.
[21]赵明亮,王相阳,李欣欣,等.高原缺氧代谢组学研究进展[J].中草药,2018,49(4):948-954.
