探究高血糖与胰岛素干预对大鼠脑损伤的影响
2024-06-14康旭晖史占华
康旭晖 史占华
基金项目:内蒙古自治区卫生健康科技计划项目(编号:wsjkkj038)
作者简介:康旭晖,硕士研究生,医师,研究方向:颅脑损伤合并糖尿病的诊疗。
通信作者:史占华,博士研究生,主任医师,研究方向:颅脑损伤合并糖尿病的诊疗。E-mail:793361405@qq.com
【摘要】目的 通过大鼠动物实验探讨高血糖与脑损伤的关联性及对后胰岛素干预脑损伤的影响。方法 选取45只健康大鼠,根据随机数字表法分为对照组、糖尿病组、胰岛素恢复组,各15只。对后两组进行相应的建模比较3组大鼠血糖、体质量、学习记忆功能、海马区病理结果、海马小胶质细胞活化情况。结果 实验后,糖尿病组和胰岛素恢复组大鼠血糖浓度均高于对照组,且糖尿病组高于胰岛素恢复组(均P<0.05)。实验后,糖尿病组大鼠平均体质量降低,胰岛素恢复组和对照组大鼠平均体质量均增加,且胰岛素恢复组低于对照组(均P<0.05)。在定位航行实验中,3组大鼠逃避潜伏期具有交互效应、时间差异、组间差异(F时间=91.23,P时间<0.05;F组间=6.89,P组间<0.05;F交互效应=6.89,P交互效应<0.05)。3组大鼠逃避潜伏期均缩短,且糖尿病组和胰岛素恢复组均长于对照组,糖尿病组长于胰岛素恢复组(均P<0.05);在空间探索实验中,糖尿病组大鼠穿台次数少于胰岛素恢复组和对照组(均P<0.05)。糖尿病组大鼠CA3区神经元细胞核固缩、深染,胰岛素恢复组和对照组未见明显异常;糖尿病组大鼠海马CA1区细胞排列相对疏松,部分神经元出现肿胀现象,胰岛素恢复组和对照组未见明显异常;糖尿病组大鼠海马小胶质细胞呈活化态,胰岛素恢复组大鼠和对照组呈静息态。结论 高血糖可导致大鼠学习记忆能力及平均体质量下降,神经元损伤严重,小胶质细胞明显活化。经胰岛素干预后可将糖尿病大鼠血糖控制在正常范围,减轻脑组织损伤,但其对脑组织的保护具有一定限度,但糖代谢对 DM 脑损伤的确切作用机制有待进一步研究。
【关键词】高血糖;胰岛素;脑损伤;脑损伤转归
【中图分类号】R295 【文献标识码】A 【文章编号】2096-2665.2024.08.00.04
DOI:10.3969/j.issn.2096-2665.2024.08.003
糖尿病(diabetes mellitus, DM)是由内分泌系统紊乱导致的代谢性疾病,属于全身性疾病,临床表现为持续的高血糖状态,严重影响患者身体健康、威胁生命安全[1]。DM引发的脑损伤主要表现为认知功能障碍,包括智力、反应速度、注意力、学习记忆和执行能力等功能下降,严重影响患者日常生活和生存质量[2]。胰岛素具有调节营养摄入、调节急性代谢效应、监测能量储存的作用,主要来源为胰岛β细胞,也可在中枢神经系统中的海马体、额叶、下丘脑等部位的神经元中少量合成。胰岛素转运体、胰岛素受体和胰岛素下游信号分子分布在大脑的神经元和神经胶质细胞中,大量的胰岛素受体存在于内侧颞叶、海马区和前额皮质,这些区域与认知功能密切相关[3]。基于此,本研究观察血糖浓度升高和血糖调控后大鼠脑组织的生理改变,分析高血糖与大鼠脑损伤的关联性及胰岛素干预后脑损伤的转归,现报道如下。
1 材料与方法
1.1 实验动物和建模 选取45只健康大鼠,根据随机数字表法分为对照组、糖尿病组、胰岛素恢复组,各15只。本研究采用1型糖尿病(T1DM)动物模型,研究过程遵循国际通行的动物福利和伦理准则。对照组大鼠注射柠檬酸盐缓冲液[赛默飞世尔科技(中国)有限公司,国药准字2291837,规格:100 mL]2 mL/kg,提供正常食物和10%蔗糖溶液,于实验第2天将蔗糖溶液换成饮用水并保持不变。其余两组大鼠一次性腹腔注射链脲佐菌素(北京普利莱基因技术有限公司,规格:100 mg/支),65 mg/kg,注射后第7天进行血糖检测,大鼠空腹血糖值≥16.7 mmol/L为高血糖建模成功。于高血糖模型制作完成后第2天,胰岛素恢复组大鼠每天上午8时、下午4时皮下注射低精蛋白锌胰岛素注射液(江苏万邦生化医药集团有限责任公司,国药准字H20060845,规格:3 mL∶300单位)2~3 单位,保持空腹血糖 <10 mmol/L,对照组、糖尿病组大鼠同时注射等量生理盐水。3组大鼠每天均正常饲养,持续饲养12周。
1.2 观察指标 ⑴血糖浓度。血糖检测前12 h禁食,检测时用75%乙醇溶液擦拭大鼠尾部,用采血针于大鼠尾尖部位采血,第2滴血流出时滴入血糖仪试纸中读取血糖仪显示的数值并记录。⑵平均体质量。每周使用电子天平测量3组大鼠体质量,本组大鼠平均体质量=本组大鼠体质量之和/15。⑶学习记忆功能。于饲养结束后第1,2,3d,利用Morris水迷宫实验检测大鼠学习记忆功能,实验方案由定位航行实验和空间探索实验两部分组成。定位航行实验:先将泳池分为4个象限,实验大鼠面朝泳池内壁,将之分别由4个象限依次放入泳池并开始视频追踪,实验时间为120 s,记录实验大鼠找到水下平台所需时间,2次/d。若实验大鼠在120 s内未找到水下平台,则将逃避潜伏期记为120 s,并将实验大鼠人工引导至水下平台休息10 s,取两次实验的平均值并记录为逃避潜伏期。空间探索实验:开始时去掉水下平台,将实验大鼠面朝池壁放入水迷宫内,实验时间60 s,记录大鼠在60 s内穿过平台标记位置的次数,取两次穿过次数的平均值。⑷海马区病理学变化。3组各取1只实验大鼠,进行麻醉后从心脏灌注生理盐水,取全脑置于甲醛中固定24 h。将固定好的脑组织进行常规石蜡包埋、切片、苏木精-伊红染色(HE染色)。最后在光学显微镜下观察图像并采集分析。⑸海马小胶质细胞活化情况。3组各取1只实验大鼠,组织样品取材、固定方法同⑷,制作封片后使用扫描共聚焦显微镜观察组织切片,并记录海马小胶质细胞活化情况。
1.3 统计学分析 采用SPSS 21.0统计学软件处理数据。计数资料以[例(%)]表示,组间比较采用χ2检验;计量资料以(x)表示,组间比较采用独立样本t检验,组间多时间点比较采用重复测量方差分析,两组间比较采用 LSD-t检验,不符合同质性检验的采用Games-Howell检验。以P<0.05为差异有统计学意义。
2 结果
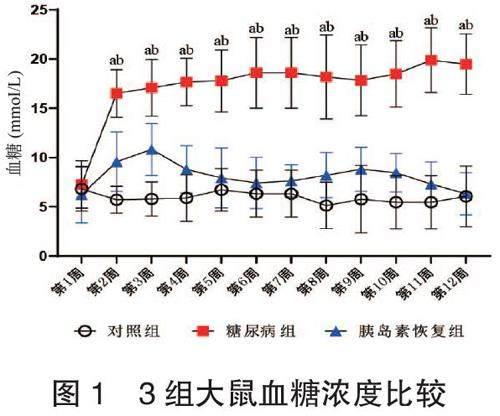
2.1 3组大鼠血糖浓度比较 实验后,糖尿病组和胰岛素恢复组大鼠血糖浓度均高于对照组,且糖尿病组高于胰岛素恢复组,差异均有统计学意义(均P<0.05),见图1。
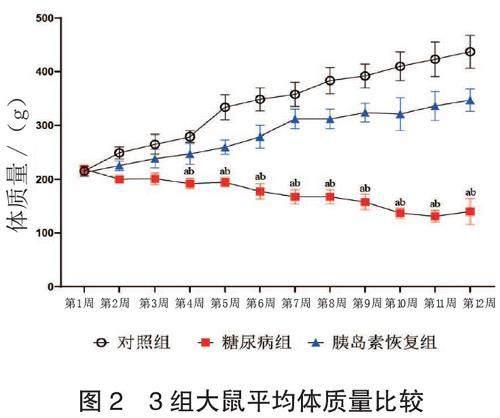
2.2 3组大鼠平均体质量比较 实验后,糖尿病组大鼠平均体质量降低,胰岛素恢复组和对照组平均体质量均增加,且胰岛素恢复组低于对照组,差异均有统计学意义(均P<0.05),见图2。
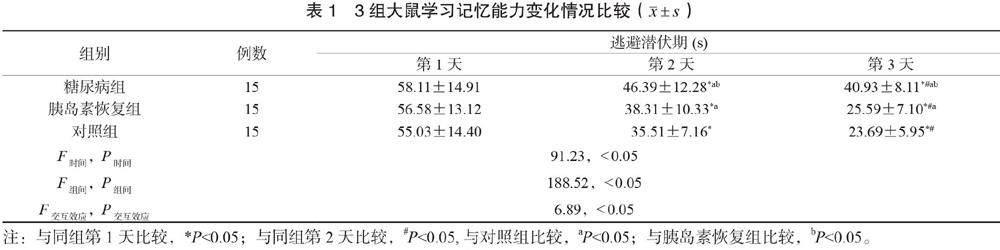
2.3 3组大鼠学习记忆能力变化情况比较 在定位航行实验中,3组大鼠逃避潜伏期具有时间差异、组间差异、交互效应(F时间=91.23,P时间<0.05;F组间=6.89,P组间<0.05;F交互效应=6.89,P交互效应<0.05)。3组大鼠逃避潜伏期均缩短,且糖尿病组和胰岛素恢复组均长于对照组,糖尿病组长于胰岛素恢复组,差异均有统计学意义(均P<0.05)。糖尿病组大鼠穿台次数为(2.38±1.41)次,胰岛素恢复组为(3.63±1.78)次,对照组为(5.07±1.77)次,糖尿病组穿台次数介于胰岛素恢复组和对照组,胰岛素恢复组少于对照组,差异均有统计学意义(均P<0.05),见表1。
2.4 3组大鼠海马病理学变化 糖尿病组大鼠CA3区神经元细胞核固缩、深染;胰岛素恢复组大鼠CA3区神经元均质红染,细胞核较清晰;对照组大鼠CA3区神经元均质红染,细胞核清晰可见,未见明显异常,见图3。糖尿病组大鼠海马CA1区细胞排列相对疏松,部分神经元出现肿胀现象,但并未见神经元细胞质深染、细胞核固缩等情况出现;胰岛素恢复组大鼠海马CA1区神经元排列恢复正常,细胞形态未见异常;对照组大鼠海马CA1区神经元均质红染排列紧密,细胞核清晰可见,未见明显异常,见图4。
2.5 3组大鼠海马小胶质细胞活化情况 糖尿病组大鼠海马小胶质细胞呈明显的阿米巴状,细胞的体积明显增大,小胶质细胞突触变短、变粗乃至巨噬细胞样,呈明显的活化态;胰岛素恢复组大鼠海马小胶质细胞凸起显著变长,胞体变小,细胞由活化态恢复为静息态;对照组大鼠海马小胶质细胞胞体相对较小,突触长且并未出现显著的回缩现象,形态呈静息态,见图5。
3 讨论
本研究通过单次腹腔注射链脲佐菌素破坏大鼠胰岛β细胞,导致胰岛素释放不足,引起持续性血糖浓度升高,使大鼠出现多饮、多尿、体质量减轻的症状。本研究结果显示,实验后,糖尿病组和胰岛素恢复组大鼠血糖浓度均高于对照组,且糖尿病组高于胰岛素恢复组,糖尿病组大鼠平均体质量降低,胰岛素恢复组和对照组平均体质量均增加,且胰岛素恢复组低于对照组。这提示糖尿病可对实验大鼠体质量产生明显的影响,在进行血糖转归后大鼠体质量恢复。由高血糖引起的脑损伤主要表现为记忆力减退、认知能力障碍、逻辑能力混乱,在动物模型的实验中主要表现为Morris水迷宫的逃避潜伏期或转移潜伏期延长,游泳距离延长。海马区是哺乳动物空间学习和记忆的重要结构功能区,也是神经可塑性的主要脑区。本研究结果显示,定位航行实验中,糖尿病组和胰岛素恢复组大鼠逃避潜伏期均长于对照组,且糖尿病组长于胰岛素恢复组;在空间探索实验中,糖尿病组大鼠穿台次数少于对照组和胰岛素恢复组。这提示糖尿病可降低实验大鼠学习记忆能力,且在血糖调控后大鼠学习记忆能力恢复,糖尿病发病可能是实验大鼠学习记忆功能损伤的关键因素,这与Erukainure等[4]研究结果一致。分析原因为,脑组织所消耗的能量主要来源于葡萄糖代谢,糖代谢受损可导致血糖稳态失调,严重影响机体认知功能[5]。有研究表明,DM脑损伤患者常表现出空腹血糖受损、慢性持续性高血糖症、大脑双侧海马区细胞损伤并萎缩、认知功能障碍等症状[6-7]。
本研究结果显示,糖尿病组大鼠CA3区神经元细胞核固缩、深染,胰岛素恢复组和对照组大鼠未见明显异常;糖尿病组大鼠海马CA1区细胞排列相对疏松,部分神经元出现肿胀现象,胰岛素恢复组和对照组大鼠未见明显异常。这提示高血糖可导致海马CA1、CA3区神经细胞变性坏死。分析原因为,高血糖引起的脑损伤的发病机制复杂,包括氧化应激、神经炎症、神经递质变化、脑组织修复过程受损等综合过程[8]。其中,氧化应激产生的毒性物质会导致血脑屏障和大脑微脉管系统出现渗透性破坏,进一步损害神经细胞,是DM 患者脑部出现神经炎症、神经细胞变性和凋亡及进行性认知减退的主要原因[9-10]。
本研究结果显示,糖尿病组大鼠海马小胶质细胞呈明显的活化态,胰岛素恢复组和对照组大鼠呈静息态。这提示血糖浓度升高可导致小胶质细胞活化,而在胰岛素干预后形态异常的神经元数量减少,神经元形态逐渐趋于正常。分析原因为,小胶质细胞作为脑的固有免疫效应细胞,在受到刺激时活性增强,并通过分泌和释放细胞因子、生长因子等维持神经元的正常功能[11]。海马区高血糖状态造成脑细胞损伤、凋亡,进而激发小胶质细胞活化[12]。当胰岛素调控血糖浓度趋于正常后,受损脑细胞逐渐恢复正常形态、功能,小胶质细胞活化程度降低,呈静息态。
综上所述,高血糖可导致大鼠学习记忆能力及平均体质量下降,神经元损伤严重,小胶质细胞明显活化。经胰岛素干预后可将糖尿病大鼠血糖控制在正常范围,减轻脑组织损伤,但其对脑组织的保护具有一定限度,但糖代谢对 DM 脑损伤的确切作用机制有待进一步研究。
参考文献
[1]董雯, 刘美琴, 伦永志, 等. 糖脂代谢参与糖尿病脑损伤的研究进展[J]. 邵阳学院学报(自然科学版), 2020, 17(5): 103-108.
[2]SCHMIDT A M.Highlighting diabetes mellitus: The epidemic continues[J].Arteriosclerosis, Thrombosis, and Vascular Biology, 2018, 38(1): el-e8.
[3]胥智超,李润芝,米东华,中枢胰岛素抵抗与脑血管病的关系[J].中国卒中杂志,2022,17(11):1276-1282.
[4]ERUKAINURE O L, IJOMONE O M, OYEBODE O A, et al.Hyperglycemia-induced oxidative brain injury:Therapeutic effects of Cola nitida infusion against redox imbalance,cerebellar neuronal insults,and upregulated Nrf2 expression in type 2 diabetic rats[J].Food And Chemical Toxicology, 2019, 127:206-217.
[5]LI Y, TENG D,SHI X,et al.Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: National cross sectional study[J]. The British Medical Journal, 2020, 369:m997.
[6]ALSHARIF A A, WEI L, MA T,et al.Prevalence and incidence of dementia in people with diabetesMmellitus[J].Journal of Alzheimers Disease,2020,75(2):607-615.
[7]YU J H, HAN K, PARK S,et al.Incidence and risk factors for dementia in type 2 diabetes mellitus:A nationwide population-based study in Korea[J].Diabetes Metabolism Journal, 2020, 44(1): 113-124.
[8]王琳, 赵娅东. 伴糖尿病或应激性高血糖的重症颅脑外伤患者炎症因子与胰岛素组分的相关性[J].医学临床研究, 2023, 40(11): 1747-1750.
[9]HAMED S A.Brain injury with diabetes mellitus: evidence, mechanisms and treatment implications[J]. Expert Review of Clinical Pharmacology, 2017, 10(4):409-428.
[10]PINTI M V, FINK G K,HATHAWAY Q A, et al.Mitochondrial dysfunction in type 2 diabetes mellitus:an organ-based analysis[J].American Journal of Physiology.Endocrinology and Metabolism, 2019, 316(2): E268-E285.
[11]王冬雪, 蒋玟依, 林萍, 等.rhFGF21调控小胶质细胞/巨噬细胞介导的神经炎症促进2型糖尿病小鼠缺血性脑卒中后神经功能的修复[J]. 中国药理学与毒理学杂志, 2023, 37(7):503.
[12]GUO X Y, SHI Y, DU P,et al.HMGB/TLR4 promotes apoptosis and reduces autophagy of hippocampal neurons in diabetes combined with OSA in diabetes combined with OSA[J].Life sciences, 2019, 239: 117020.
