添加生物炭对烟草连作土壤化学性质及真菌群落的影响
2024-06-03赛子林韩世欣齐虹凌张彦丽郝爱平陈宇
赛子林 韩世欣 齐虹凌 张彦丽 郝爱平 陈宇
赛子林,韩世欣,齐虹凌,等. 添加生物炭对烟草连作土壤化学性质及真菌群落的影响[J]. 江苏农业科学,2024,52(8):242-252.
doi:10.15889/j.issn.1002-1302.2024.08.032
添加生物炭对烟草连作土壤化学性质及真菌群落的影响
赛子林1, 韩世欣2, 齐虹凌1, 3
(1.牡丹江师范学院,黑龙江牡丹江 157011; 2.黑龙江省烟草公司牡丹江烟叶公司,黑龙江牡丹江 157011; 3.牡丹江烟叶公司宁安分公司,黑龙江宁安 157400)
摘要:研究生物炭对烟草土壤化学性质及真菌群落的影响,有助于深入了解烟草连作土壤状况,为土壤改良及消减烟草连作障碍提供新思路。本研究采用田间试验,分别施用5、15、25 t/hm2生物炭,并以不添加生物炭处理为对照,通过高通量测序技术研究生物炭的不同施用量对烟草连作土壤真菌群落结构的影响。随着生物炭施用量的增加,土壤有机质含量显著增加,全钾含量呈现先增加后降低的趋势;施加生物炭后显著增加了土壤交换性钙的含量。同时,随着生物炭施用量的增加真菌群落多样性呈现先增加后降低的趋势,其中施用5 t/hm2生物炭处理的真菌群落多样性最高。OTU Richness和Shannon指數受土壤全氮含量的影响最大,交换性钙含量与真菌群落结构密切相关。此外,在不同生物炭的施用量下土壤真菌群落结构、功能及组装过程差异显著。低施用量生物炭增强了土壤真菌群落之间的相互作用,提高了群落的稳定性。低施用量的生物炭处理真菌网络结构比高施用量的生物炭处理真菌网络结构更稳定。施用适宜量(5 t/hm2)的生物炭在促进烟草连作土壤真菌多样性方面发挥了重要作用。而施加生物炭量过高不仅降低了土壤真菌多样性,而且降低了真菌群落的网络稳定性。
关键词:生物炭;烟草;土壤真菌群落;高通量测序;共现网络
中图分类号:S572.06 文献标志码:A
文章编号:1002-1302(2024)08-0242-11
收稿日期:2023-10-30
基金项目:牡丹江师范学院科研项目(编号:YB2021005);黑龙江省教育厅项目(编号:1451ZD005);黑龙江省烟草行业科技项目(编号:20182300002700081)。
作者简介:赛子林(1999—),男,黑龙江哈尔滨人,硕士研究生,研究方向为土壤生物炭。E-mail:szl990320@163.com。
通信作者:齐虹凌,硕士,副教授,主要从事土壤改良方面的研究。E-mail:swxqhl2021@126.com。
烟草是世界范围内重要的经济作物,我国是世界上烟草第一生产和消费大国。烟草在我国种植历史悠久,然而连作障碍的发生导致植烟土壤质量退化、病害频发、烟叶品质下降,给烟草的生产带来了严重的经济损失[1]。因此,改良植烟土壤,提高土壤肥力成为当务之急。生物炭具有容重小、孔隙度高和比表面积大的特点。施加生物炭还可以降低土壤容重,提高土壤微生物的种类和数量,提高土壤肥力,促进烟草生长进而提高经济效益[2]。因此,通过研究适宜生物炭施用量对改良植烟土壤性质以及烟草产质量的影响具有重要意义。连作障碍导致土壤化学性质恶化,烤烟黑胫病等病虫害增加,烟草产质量以及土壤微生物多样性下降[3]。然而,在连作土壤中添加生物炭,可以有效地缓解连作障碍[4]。已有研究表明,在植烟土壤中加入生物炭不仅能够吸收植物根部释放的有毒物质,还能够提高土壤氮含量,增加土壤微生物多样性以及数量[5]。然而,不同生物炭的施用量所得结果也不尽相同。姚丽茹等研究发现,低浓度生物炭(0~20 t/hm2)可以促进植物生长、提高土壤pH值、有机碳含量、全氮含量以及增加微生物多样性[6]。而Zhang等研究发现,施用高浓度生物炭(10~50 t/hm2)导致微生物多样性指数显著降低[7]。上述结果表明,不同的生物炭施用量会对烟草生长以及微生物多样性产生不同影响,生物炭具有良好的蓬松性和稳定性,前人在生物炭的用量对烟草的生长、烟叶重等方面的影响均有研究,而生物炭的不同施用量对土壤理化性质以及土壤微生物的影响尚不明确。本研究通过比较分析4个不同生物炭浓度处理下烟草土壤化学性质及微生物多样性,确定最佳的生物炭施用浓度,以期为烟田的生物炭施用量提供参考。
1 材料与方法
1.1 试验地概况
试验地位于黑龙江省宾县宾西镇永和乡张家大房屯(黑龙江烟草科学研究所宾西试验场,45°47′55″N,127°7′24″E,海拔165 m)。该地区属中温带大陆性季风气候,年平均气温4.4 ℃。日照平均每天7.2 h,无霜期平均148 d左右。年平均降水量570 mm,降水多集中于7—8月。地形地貌为漫岗地,土壤类型为黑土,质地为沙壤土(沙粒占59%、粉粒占39%和黏粒占2%)。耕层土壤pH值为5.8、有机质含量为30.5 g/kg、速效磷含量为 63.1 mg/kg、速效钾含量为183.7 mg/kg、碱解氮含量为114.1 mg/kg。
1.2 试验设计
本试验为小区定位试验,烟草连作2年茬口。试验共设4个处理:(1)不施生物炭(CK);(2)生物炭施用量为5 t/hm2(B5);(3)生物炭施用量为 15 t/hm2(B15);(4)生物炭施用量为25 t/hm2(B25)。随机区组设计,每个处理3次重复。行长 6 m,行距1.15 m,5行小区,小区面积34.5 m2。所施生物炭均为玉米秸秆生物炭,由沈阳隆泰生物工程有限公司生产,于2021年一次性施入。
生物炭施用方法:在试验小区划分好后,按照各处理生物炭用量将生物炭均匀撒施在供试小区地表,采用人工耕作方式,使其与耕层土壤充分混匀,再通过小型机械翻耕混入耕层土壤。
供试烤烟品种为0110-142。于2022年5月上旬覆膜移栽。种植密度为17 385株/hm2,行株距为1.15 m×0.50 m。化学肥料为烟草专用肥、重过磷酸钙、硝酸钾混合配肥,各处理施纯氮量为 22.5 kg/hm2,距烟株两侧10 cm用施肥器双侧施入,施肥深度10 cm左右。
1.3 土壤样品采集
于2022年7月上旬,采用5点取样法用土钻在每个小区采集0~20 cm的土样。新鲜土样放入密封袋中用冰袋保存带回实验室,过2 mm筛后去除其他杂质备用。一部分土壤样品保存在-80 ℃冰箱中,7 d内完成土壤DNA提取;另一部分土壤样品在室温下风干用于土壤基本化学性质的测定。
1.4 土壤化学性质的测定
土壤化学性质的测定均参照鲍士旦的方法[7]。有机质含量采用重铬酸钾容量法-外加热法测定;全氮含量采用凯氏定氮法测定;土壤总磷含量采用碱溶-钼锑抗比色法测定;土壤pH值采用电位法测定(水土比为2.5 ∶1);土壤速效磷含量用钼锑钪比色法测定;土壤速效钾含量用火焰光度法测定;土壤碱解氮含量采用碱解扩散法测定;氯含量的测定方法参照YC/T 162—2002;用原子吸收分光光度法测定交换性钙和镁的含量。
1.5 土壤DNA提取及高通量测序
使用美国OMEGA公司的Mo Bio Power Soil DNA Isolation Kit(MP Biomedicals,Santa Ana,CA,USA)试剂盒进行DNA提取。从各处理中称取约0.5 g新鲜样品,按照试剂盒提取步骤进行DNA提取。利用1%琼脂糖凝胶进行电泳检测DNA。用核酸定量仪Nano Drop ND-1000(Thermo Fisher Scientific,Waltham,MA,USA)检测DNA浓度同时提纯DNA。合格的DNA样品放于-80 ℃超低温冰箱中冷冻保存。使用真菌引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)扩增真菌ITS序列。PCR反应体系:10× FastPfu Buffer 2 μL、2.5 mmol/L dNTPs 2 μL、引物各0.8 μL(5 μL)、TaKaRa rTaq Polymerase 0.2 μL、BSA 0.2 μL、模板DNA 10 ng,加ddH2O至总反应体积为20 μL,共3个重复。扩增步骤:95 ℃预变性 5 min,1个循环;95 ℃ 变性30 s,62 ℃ 退火30 s,72 ℃延伸1 min(PCR仪器:ABIGeneAmp9700)。将所有样品的PCR产物混合,用2%浓度的琼脂糖凝胶和DNA纯化试剂盒检测并纯化PCR产物。纯化后PCR产物送往上海美吉生物医药科技有限公司进行Illumina MiSeq测序。
1.6 原始数据处理及生物信息分析
运用QIME Pipeline Version去除所有序列中相同连续碱基大于8或平均质量值小于25的低质量原始序列[8]。根据Mothur的Greengene 13.8数据库[9],使用“chimera uchime”命令检测并消除嵌合序列[10]。嵌合体检测后,使用UCLUST方法将剩余的高质量序列以97%的同一性阈值聚类为操作分类单元(OTU)[11]。聚集在同一OTU中的序列数量被计算为分配给特定OTU的丰度。通过选择与OTU中其他序列最相似的最長序列,从每个OTU中选择一个代表性序列。消除相对丰度小于0.001%的OTU以去除低质量序列[12]。所得样本OTU矩阵用于基于OTU的群落分析。细菌的生物信息分析依据Silva数据库(Release 115,https://www.arb-silva.de)[13],真菌的生物信息分析依据UNITF数据库(Release 5.0,https://unite.ut.ee/)[14]。
1.7 数据统计与分析
真菌微生物群落多样性指数采用R中的vegan包计算[15]。根据Bray-Curtis矩阵,利用R语言中的vegan库进行主坐标分析(PCoA)。使用R语言中的随机森林包对土壤化学性质和多样性进行随机森林分析[16]。采用R语言中的ggplot2对真菌微生物群落组成以及微生物群落与土壤化学性质的相关性进行可视化,其中微生物群落组成与土壤化学性质的相关性使用R语言中的psych包计算Spearman相关系数。使用R语言中的igraph包,构建并可视化了低浓度与高浓度生物炭下的真菌网络及其拓扑属性,包括连通性、平均性和模块化等[17-18]。使用FUNGuild数据库预测真菌的功能特征,并用R语言中ggplot 2包进行可视化。使用标准化随机率(NST)方法定量生态过程中的随机性,区分了确定性过程(NST<0.5)和随机性过程(NST>0.5)[19]。
2 结果与分析
2.1 土壤理化性质分析
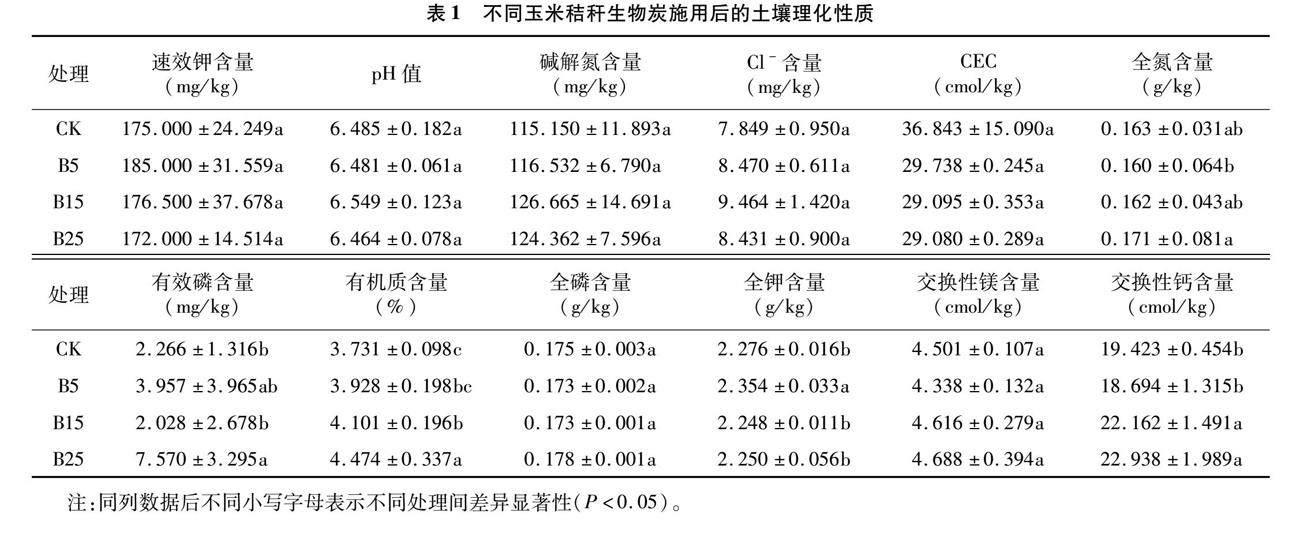
由表1可知,各处理的根际土壤均呈酸性。与未施生物炭相比,施用5 t/hm2(B5)、15 t/hm2(B15)和25 t/hm2(B25)生物炭的土壤速效钾(AK)含量、pH值、碱解氮(AHN)含量、Cl-含量、阳离子交换量(CEC)、全磷(TP)含量和交换性镁含量均无显著差异(P>0.05)。与CK相比,B25处理土壤有效磷(AP)含量增加了234.07%(P<0.05);B15和B25处理土壤有机质(SOM)含量分别提高了9.92%和19.91%(P<0.05);B5处理全钾(TK)含量增加了3.43%(P<0.05)。各处理土壤交换性钙含量表现为B25>B15>CK>B5,与CK相比,B15和B25处理分别显著提高14.10%、18.10%(P<0.05)。与B25处理相比,B5处理土壤全氮(TN)含量降低了6.43%(P<0.05)。
2.2 真菌群落多样性和丰富度
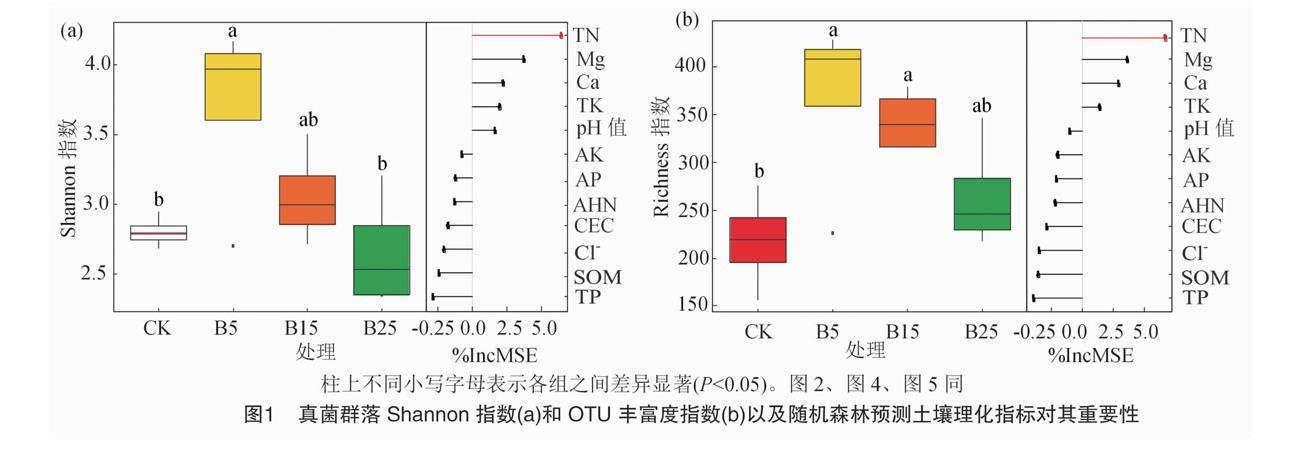
由图1-a可知,Shannon指数表现为B5>B15>CK>B25,B5处理显著高于CK和B25处理(P<0.05),分别增加了0.91和1.05。但OTU Richness指数对添加生物炭的变化不同(图1-b),B5和B15处理的OTU Richness指数显著高于CK,分别增加了151和125,表明施用生物炭对土壤微生物的多样性及丰富度有一定促进作用,以低浓度(B5)处理效果最好。PCoA结果表明,在不同生物炭施用量的土壤中,真菌群落结构存在显著差异(P<0.05)(图2-a),这一点得到了β分散试验的证实(图2-c)。随着生物炭施用量的增加导致β多样性指数显著降低(P<0.05)(图2-b)。随机森林分析结果显示,TN含量是OTU Richness和Shannon指数的主要影响因素(图1)。Mantel试验分析结果表明,交换性钙含量与真菌群落结构显著相关(表2)。
2.3 真菌群落组成
由于在土壤真菌群落已知的门数量较少,进一步分析了属水平上的差异(图3,表3)。各处理土壤真菌属水平(前10)优势菌群如下:篮状菌属(Talaromyces)、镰刀菌属(Fusarium)、木拉克属(Mrakia)、发肤菌属(Piloderma)、棉革菌属(Tomentella)、红菇属(Russula)、古根菌属(Archaeorhizomyces)、被孢霉属(Mortierella)、丝膜菌属(Cortinarius)和一部分未知真菌(图3-a)。其中,B25处理木拉克属(Mrakia)的相对丰度最高,CK中丝膜菌属(Cortinarius)的相对丰度显著高于其他处理(P<0.05),发肤菌属(Piloderma)在CK、B15、B25处理间无显著差异(P>0.05)。B15和B25处理中镰刀菌属(Fusarium)、木拉克属(Mrakia)的相对丰度显著高于CK和B5处理(P<0.05),而红菇属(Russula)的相对丰度与之相反。CK处理中被孢霉属(Mortierella)的相对丰度显著低于其他处理(P<0.05)。CK和B5处理中古根菌属(Archaeorhizomyces)和棉革菌属(Tomentella)的相对丰度高于B15和B25处理。篮状菌属(Talaromyces)的相对丰度在B5处理中最低。利用Spearman相关分析进一步分析土壤化学性质对优势属的影响(图3-b),发现木拉克属(Mrakia)和篮状菌属(Talaromyces)与CEC和TK含量呈显著负相关;木拉克属(Mrakia)、镰刀菌属(Fusarium)和篮状菌属(Talaromyces)与SOM含量和交换性钙含量呈显著正相关;古根菌属(Archaeorhizomyces)、红菇属(Russula)与CEC呈正相关,而篮状菌属(Talaromyces)、镰刀菌属(Fusarium)与CEC呈显著负相关;棉革菌属(Tomentella)、红菇属(Russula)和古根菌属(Archaeorhizomyces)与SOM含量和交换性钙含量呈显著负相关。
2.4 真菌群落功能预测与群落组装过程
为探究不同生物炭处理下真菌群落功能是否存在差异,选取土壤中真菌生态功能进行研究。由图4可知,随着生物炭施用量的逐渐增加,未知(unknown)的类别逐渐减少,B5、B15和B25处理下未知菌的比例分别为80.85%、38.16%和26.44%。共生营养型(symbiotroph)真菌分别占CK、B5、B15和B25处理的39.83%、14.36%、0.10%和0.06%。腐生营养型(saprotroph)真菌分别占比1.31%、4.78%、61.60%和73.48%。因此,随着生物炭施用量的增加腐生营养型真菌比例有所增加。病理营养型(pathotroph)真菌占比分别为0.02%、0.02%、0.15%和0.03%。进一步分析营养模式信息发现:与其他处理相比,B15处理中Fungal Parasite、Plant Pathogen和Leaf Saprotroph的相对丰度明显较高;而施加生物炭处理的Animal Pathogen、Epiphyte、Soil Saprotroph、Ectomycorrhizal和Orchid Mycorrhizal的相對丰度明显低于CK,B25处理Wood Saprotroph的相对丰度明显较高,B5处理Arbuscular Mycorrhizal的相对丰度高于其他处理(图4-e)。综上所述,不同生物炭施用量对真菌群落功能有影响。通过计算NST分析不同生物炭施用量处理下土壤真菌群落的组装过程(图5),土壤真菌群落中B5处理的NST值大于0.5,表明在B5处理中土壤真菌群落的组装过程受随机性过程的主导,而CK、B15和B25处理下土壤真菌群落的组装过程均受确定性过程主导。
2.5 真菌共现网络
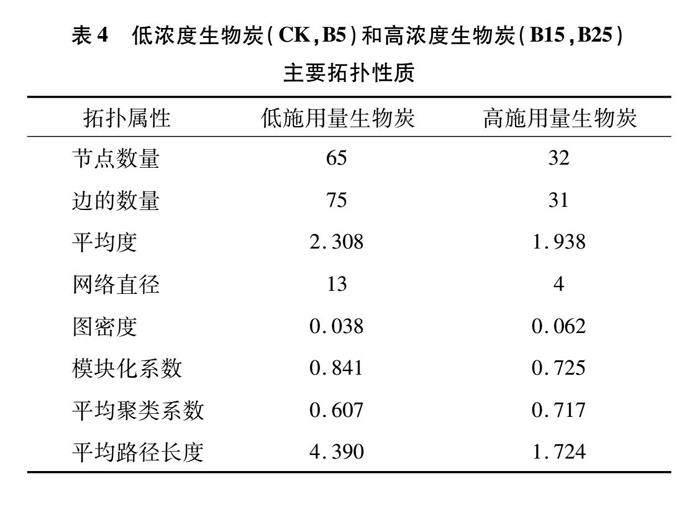
PCoA结果(图2)显示,添加低浓度(CK和B5)和高浓度(B15和B25)生物炭处理是明显分开的,分别分布于PCoA1的负方向和正方向上,说明CK和B5处理以及B15和B25处理真菌群落结构相似。因此,进一步分析了施加低浓度生物炭和高浓度生物炭之间的真菌群落网络和主要拓扑性质的差异(图6和表4)。由节点和边的数量可以看出,施加低浓度生物炭具有更复杂的网络结构(图6和表4)。这些结果也表现在网络拓扑性质,即平均度、模块化系数和网络直径。低浓度生物炭处理的平均度、网络直径、模块化系数均高于高浓度生物炭处理,分别提高了0.37、9、0.116(表4)。
3 讨论与结论
3.1 施加不同浓度生物炭对烟草土壤化学性质的影响
本研究发现,施用5 t/hm2生物炭土壤的全钾含量显著高于未施用生物炭土壤。生物炭的添加已被证实能够促进土壤全钾含量的增加,进而提高土壤肥力[20]。然而,本研究注意到随着生物炭施用量的增加,土壤全钾含量变化并不显著。生物炭在一定程度上增加了土壤的孔隙结构, 增加土壤全钾的总输出负荷,这可能是仅在施用5 t/hm2生物炭处理表现显著促进的原因[21]。此外,这也与王薇薇等的研究结果相似,即高用量的生物炭投入并不一定促进土壤全钾含量的增加[22-23]。钙和镁是烟草种植生长过程中重要且必需的中量元素,植烟土壤交换性钙镁的水平失衡容易导致烤烟的生理性功能障碍[24]。施用15 t/hm2和25 t/hm2生物炭显著增加了土壤交换性钙含量,这表明生物炭施用量的增加对烟草植株具有潜在的促进作用。一般来讲,酸性土壤中吸附于土壤胶体中的交换性钙可直接与土壤中的氢离子进行交换导致在土壤中流失,降低土壤交换性钙含量[25]。本研究土壤的pH值处于6.464~6.549之间,酸性土壤中交换性钙含量的增加可能是由土壤有机质含量的变化所驱动的。在施用15 t/hm2和25 t/hm2生物炭土壤有机质含量的变化中发现了相同的变化趋势,即土壤有机质含量随着生物炭施用量增加而增加。土壤有机质存在着大量带有负电荷的氨基酸和羧酸,能够与交换性钙发生吸附作用形成稳定的络合物,从而增强对交换性钙的吸附能力[26]。有研究表明,生物炭能够提高土壤的养分含量,其中就包括土壤速效磷[27]。Chen等通过添加生物炭改良盐碱地土壤发现,生物炭的添加能够显著提高土壤速效磷含量[28]。Jing等的研究也证实,施加生物炭能够显著促进土壤速效磷含量的增加[29]。
3.2 施加不同浓度生物炭对烟草土壤真菌群落结构的影响
生物炭因具备有效储存碳的能力而被视为一种很好的改良剂,生物炭对土壤真菌群落的积极影响已被广泛报道[30-31]。例如,Zhang等研究发现,施用生物炭对土壤真菌群落的α多样性影响较大,子囊菌的相对丰度在所有菌群中受土壤生物炭的影响最大[32]。Li等通过Illumina MiSeq测序也证实了土壤真菌对生物炭应用的响应存在明显差异,生物炭促进了真菌丰富度和多样性的增加[33]。本研究发现,施用5 t/hm2和15 t/hm2生物炭处理土壤真菌群落丰富度指数显著提高,而多样性指数仅在5 t/hm2生物炭处理表现更优势。这可能是由于土壤生物炭结构稳定,主要成分为芳香烃的惰性碳库,不易分解,对真菌群落多样性的作用较为缓慢[34-35]。全氮是驱动植烟土壤真菌群落多样性和丰富度变化的主要因素。Zeng等通过对黄土高原区森林生态系统土壤的24个样本进行研究,发现真菌群落的Shannon指数与OTU丰富度与土壤全氮含量显著相关[36]。此外,Chen等同样利用随机森林预测发现,土壤真菌群落多样性主要由有机质和全氮含量预测,其次是地上生物量和降水量等其他参数[37],本研究进一步印证了这个结果。
本研究中PCoA图的PCoA1将未施用生物炭和 5 t/hm2 与施用15 t/hm2和25 t/hm2生物炭的处理分割为明显的2个部分,说明生物炭的施用量显著改变了土壤真菌群落结构,这与前人的研究结果[38-39]保持一致。本研究通过Mantel试验分析发现,土壤交换性钙含量是影响土壤真菌群落结构的主要因素。Hou等也通过Mantel试验分析证实了土壤速效磷含量、脲酶活性和土壤交换性钙含量是与真菌群落结构相关的主导因子[40]。相比于未施用和低施用量生物炭的处理(CK和B5),高施用量生物炭显著提高了Fusarium和Mrakia的相对丰度。Elmer等报道了硬木屑炭可以通过增加丛枝菌根的定殖来减少土壤镰刀菌根腐病的发生[41]。生物炭的施用还可以形成特定的微生物种群,形成竞争机制来抑制致病菌的发生与危害[42-43],本研究得到的结果与之相反。有研究报道,生物炭并不是在所有的情况下都能通过提高有益土壤微生物菌群的活动来抑制致病菌丰度的增加[44]。这需要进一步确定土壤微生物群落特征及其对不同地上作物的反应机制,才能明确特定生态系统下添加生物炭能否促进有益菌群落或间接抑制镰刀菌病害的发生[45]。除此之外,Wang等通过玉米和大豆轮作的研究发现,Mrakia的相对丰度与地上作物产量呈显著正相关[46]。烟草的产量已被证实随生物炭量增加而增加[47]。高投入量的生物炭可能会通过促进烟草植株的产量进而影响Mrakia的相对丰度。然而,本研究也发现了施用生物炭导致真菌群落组成相对丰度的降低。相较于未施用生物炭,生物炭的施用降低了Cortinarius和Russula的相对丰度。专门从事有机氮和磷采集的真菌类群Cortinarius的减少,可能是由于生物炭的投入吸收了土壤中一部分的有机氮和磷[48]。Mortierella的相对丰度升高,表明生物炭的施入促进了Mortierella在抵御病害疾病中的积极作用[49]。施用5 t/hm2处理的土壤真菌群落Talaromyces的相对丰度明显降低。潜在的植物有益菌Talaromyces通常在肥力较高的土壤中富集[50]。低用量的生物炭投入并未补给更多的养分支持,并且可能吸附了一部分土壤养分,造成了与未投入生物炭处理相比的土壤养分亏缺。此外,Talaromyces与土壤全钾含量呈显著负相关,施用 5 t/hm2 处理提高了土壤全钾含量造成了Talaromyces相对丰度的降低。Jiang等研究报道,生物炭的施用会导致Russula相对丰度的降低[51]。Cheng等在我国东北地区进行研究发现,土壤有机质含量与Tomentella的相对丰度存在负相关关系,Tomentella的相对丰度可能受到东北黑土区地理位置效应的影响[52]。施用15 t/hm2和25 t/hm2生物炭处理土壤中Archaeorhizoyces相对丰度的降低可能是由于交换性钙浓度的提高而导致的。Spearman相关性分析进一步证实了这一猜测,Archaeorhizoyces的相对丰度与土壤交换性钙含量呈显著负相关。除此之外,本研究还注意到不同优势属水平分类群与土壤性质呈现出一定的相关性,如土壤有机质含量、CEC、全氮含量等。生物炭的施入通过改变土壤环境因子进而影响土壤真菌群落组成,这与前人的研究结果[53-55]一致。
3.3 施加不同浓度生物炭对烟草土壤真菌群落组装和共现网络的影响
在群落生态学中,微生物群落组成的更替由生态学组装过程控制,即确定性和随机性过程[56-58]。确定性过程影响微生物群落的适应度,从而影响微生物群落数量和组成,而随机过程导致群落组成的不可预测变化[59]。确定性和随机性过程都会影响微生物群落的功能[60-61]。本研究发现,仅施用 5 t/hm2 生物炭的处理由随机性过程所主导,而其余处理均由确定性过程所主导。少量生物炭的施用可能促进土壤形成了较15 t/hm2和25 t/hm2生物炭处理更小的微团聚体。这些小的微团聚体与腐生菌产物结合成了稍大的微团聚体,这为真菌提供了保护性的栖息地。许多研究表明,较小团聚体的营养成分受环境变化的影响较小[62-63]。因此,与高施用量的生物炭处理相比,5 t/hm2生物炭处理可能较少受到环境因素的影响,从而使真菌群落组装过程更具有随机性。此外,土壤真菌群落多样性的变化也可能會影响NST值。Xu等的研究表明,土壤真菌多样性与NST值呈极强的正相关,而土壤环境因子仅与NST值密切相关[64]。Zheng等的研究也证实,真菌群落NST值与真菌多样性呈正相关[65]。因此,施用5 t/hm2生物炭处理土壤真菌群落组装的变化也可能是多样性的显著提高所引起的。
基于相关性的网络分析已被广泛用于推测微生物相互作用[66-67]。微生物物种间的合作与竞争相互作用会影响微生物稳定性[68-69]。例如,Li等通过探究种植模式多样性的研究发现,相较于单一种植系统,混作能够提高土壤真菌群落共现网络的稳定性[54]。本研究发现高浓度生物炭的施入抑制了土壤真菌群落的网络稳定性。土壤真菌群落的网络稳定性与网络整体的节点和边密切相关,复杂的微生物网络通常具有更多的节点与边[54]。此外,随着生物炭浓度的增加,网络的平均度降低。Zhang等研究发现,向盐碱地添加秸秆后,网络平均度得到提高,真菌的共现网络复杂性得到显著提高[70]。网络平均度的变化表明,高浓度生物炭的施入造成土壤真菌群落网络复杂性的降低,这也由网络直径进一步证实[71]。同样,平均路径长度和模块化系数的降低也表明高浓度生物炭的施入造成土壤真菌群落共现网络稳定性的降低。Zhang等研究发现,植物入侵降低了土壤真菌群落平均路径长度,从而降低了网络的复杂性[72]。土壤真菌网络较高的模块化表明其拓扑结构和生态位分化更为复杂,高浓度的生物炭施入可能也会降低网络生态位分化的复杂性[73]。前人已有研究报道了生物炭的添加导致土壤真菌群落网络稳定性的降低[74-75]。Zhang等认为在微生物网络生态中,只有适当生物炭的投入才能促进土壤微生物网络的稳定性[76]。由于生物炭的独特性质,生物炭添加入土壤后会影响微生物之间的相互作用[77]。不同生态系统的土壤微生物网络因不同的外界条件而导致网络复杂性的不同[78-79],本研究所关注的是对养分需求强烈的植烟土壤。生物炭可能更多地补给土壤养分供植物吸收,并削弱了土壤微生物之间的关系[80]。
3.4 施加不同浓度生物炭对烟草土壤真菌群落功能类群的影响
本研究发现,施用15 t/hm2和25 t/hm2生物炭显著刺激了土壤真菌群落腐生菌相对丰度的增加。腐生真菌通过释放木质素分解酶分解复杂的有机質,介导陆地生态系统地球化学循环的关键微生物群落[81]。前人研究报道,腐生真菌似乎推动了真菌生物量与土壤碳的强正相关[82],高施用量的生物炭带来了一定的碳投入,这促进了腐生真菌相对丰度的提高。Gao等研究发现,土壤水分抑制了土壤共生真菌的丰度[83]。生物炭作为改良剂施入土壤后,可吸附更多的土壤水分[84]。随着生物炭施入量的增加造成土壤水分的变化可能是导致共生菌相对丰度降低的原因。施用15 t/hm2生物炭后发现,致病菌的相对丰度得到提高。说明施用15 t/hm2生物炭增加了烟草染病的风险,可能会造成一定的经济损失,这与15 t/hm2生物炭显著提高了致病菌Fusarium的相对丰度的结果吻合。
参考文献:
[1] 张纪利,殷全玉,刘慧生,等. 不同配方生物炭基有机肥对百色烟草生长发育和产质量的影响[J]. 安徽农业科学,2022,50(19):147-150.
[2]何聪莲,顾 浩,张锦韬,等. 氮肥配施生物炭对烤烟生长及烤后烟叶化学品质的影响[J]. 云南农业大学学报(自然科学),2022,37(6):1014-1020.
[3]李松伟,王发展,陈 彪,等. 生物炭配施海藻肥对连作植烟土壤理化特性及烤烟生长的影响[J]. 河南农业大学学报,2021,55(5):852-861.
[4]Han G M,Chen Q Q,Zhang S X,et al. Biochar effects on bacterial community and metabolic pathways in continuously cotton-cropped soil[J]. Journal of Soil Science and Plant Nutrition,2019,19(2):249-261.
[5]戴华鑫,梁太波,李彩斌,等. 烟秆生物炭还田对植烟黄棕壤养分、细菌群落结构与功能的影响[J]. 南方农业学报,2023,54(2):476-487.
[6]姚丽茹,李 伟,朱员正,等. 施用生物炭对麦田土壤细菌群落多样性和冬小麦生长的影响[J]. 环境科学,2023,44(6):3396-3407.
[7]鲍士旦. 土壤农化分析[M]. 3版. 北京:中国农业出版社,2000.
[8]Zhang Z,Yang X Y,Shen M H,et al. Sunlight-driven reduction of silver ion to silver nanoparticle by organic matter mitigates the acute toxicity of silver to Daphnia magna[J]. Journal of Environmental Sciences,2015,35:62-68.
[9]FAO/WHO. Expert meeting on the application of nanotechnologies in the Food and Agriculture sectors:potential food safety implications[R/OL]. [2023-09-30]. DOI:/entity/foodsafety/publications/nanotechnology-food-agriculture/.
[10]Fierer N,Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(3):626-631.
[11]Applerot G,Lellouche J,Lipovsky A,et al. Understanding the antibacterial mechanism of CuO nanoparticles:revealing the route of induced oxidative stress[J]. Small,2012,8(21):3326-3337.
[12]Marmiroli M,Pagano L,Rossi R,et al. Copper oxide nanomaterial fate in plant tissue:nanoscale impacts on reproductive tissues[J]. Environmental Science & Technology,2021,55(15):10769-10783.
[13]Liu S Y,Wang Z T,Zhu R H,et al. Three differential expression analysis methods for RNA sequencing:limma,edgeR,DESeq2[J]. Journal of Visualized Experiments,2021(175):e62528.
[14]Arciniegas-Grijalba P A,Patio-Portela M C,Mosquera-Sánchez L P,et al. ZnO-based nanofungicides:synthesis,characterization and their effect on the coffee fungi Mycena citricolor and Colletotrichum sp.[J]. Materials Science and Engineering:C,2019,98:808-825.
[15]Oksanen J,Blanchet F G,Kindt R,et al. vegan:Community ecology package. r package version 2.0-10[CP]. 2013.
[16]Liaw A,Wiener M. Classification and regression by randomForest[J]. R News,2002,2/3:18-22.
[17]Csardi G,Nepusz T. The igraph software package for complex network research[J]. Interjournal Complex Systems,2006,1695(5):1-9.
[18]Guan Y P,Jiang N N,Wu Y X,et al. Disentangling the role of salinity-sodicity in shaping soil microbiome along a natural saline-sodic gradient[J]. Science of the Total Environment,2021,765:142738.
[19]Ning D L,Deng Y,Tiedje J M,et al. A general framework for quantitatively assessing ecological stochasticity[J]. Proceedings of the National Academy of Sciences of the United States of America,2019,116(34):16892-16898.
[20]Wang Y,Dong J X,Zheng X B,et al. Wheat straw and biochar effect on soil carbon fractions,enzyme activities,and nutrients in a tobacco field[J]. Canadian Journal of Soil Science,2021,101(3):353-364.
[21]Fan C H,Yin X A,Fang Q,et al. Effects of surface-underground runoff regulated by biochar on nutrient loss in karst mountainous areas[J]. Journal of Soil Science and Plant Nutrition,2023,23(3):3163-3173.
[22]王薇薇,梅 燚,吳永成,等. 玉米芯生物炭对辣椒连作土壤性质和辣椒生长的影响[J]. 浙江农业学报,2023,35(1):156-163.
[23]李红宇,张巩亮,范名宇,等. 生物炭连续还田对苏打盐碱水稻土养分及真菌群落结构的影响[J]. 水土保持学报,2020,34(6):345-351,360.
[24]刘 杰,谭智勇,周兴华,等. 铜仁市植烟土壤交换性钙镁空间分布特征及其影响因素分析[J]. 核农学报,2022,36(4):812-819.
[25]彭赞文,刘 茜,瞿小杰,等. 茶园土壤交换性钙镁离子含量及其与主要养分相关性[J]. 吉林农业大学学报,2023,45(1):77-82.
[26]郝尚妍,周 嵘,徐 宸,等. 重庆渝东北植烟区土壤交换性钙镁与土壤属性的关联特性研究[J]. 土壤,2023,55(2):288-294.
[27]Pan X Q,Gu Z P,Chen W M,et al. Preparation of biochar and biochar composites and their application in a Fenton-like process for wastewater decontamination:a review[J]. Science of the Total Environment,2021,754:142104.
[28]Chen Y,Qiu Y,Hao X M,et al. Does biochar addition improve soil physicochemical properties,bacterial community and alfalfa growth for saline soils[J]. Land Degradation & Development,2023,34(11):3314-3328.
[29]Jing F,Chen X M,Wen X,et al. Biochar effects on soil chemical properties and mobilization of cadmium (Cd) and lead (Pb) in paddy soil[J]. Soil Use and Management,2020,36(2):320-327.
[30]Zhang M,Liu Y L,Wei Q Q,et al. Biochar application ameliorated the nutrient content and fungal community structure in different yellow soil depths in the karst area of Southwest China[J]. Frontiers in Plant Science,2022,13:1020832.
[31]Xia H,Liu B,Riaz M,et al. 30-Month pot experiment:biochar alters soil potassium forms,soil properties and soil fungal diversity and composition in acidic soil of Southern China[J]. Plants,2022,11(24):3442.
[32]Zhang M Y,Riaz M,Zhang L,et al. Response of fungal communities in different soils to biochar and chemical fertilizers under simulated rainfall conditions[J]. Science of the Total Environment,2019,691:654-663.
[33]Li Y,Yang Y Q,Shen F,et al. Partitioning biochar properties to elucidate their contributions to bacterial and fungal community composition of purple soil[J]. Science of the Total Environment,2019,648:1333-1341.
[34]Lucheta A R,de Souza Cannavan F,Roesch L F W,et al. Fungal community assembly in the Amazonian Dark Earth[J]. Microbial Ecology,2016,71(4):962-973.
[35]Hammes K,Smernik R J,Skjemstad J O,et al. Characterisation and evaluation of reference materials for black carbon analysis using elemental composition,colour,BET surface area and 13C NMR spectroscopy[J]. Applied Geochemistry,2008,23(8):2113-2122.
[36]Zeng Q C,Jia P L,Wang Y,et al. The local environment regulates biogeographic patterns of soil fungal communities on the Loess Plateau[J]. CATENA,2019,183(3):104220.
[37]Chen Y L,Xu T L,Fu W,et al. Soil organic carbon and total nitrogen predict large-scale distribution of soil fungal communities in temperate and alpine shrub ecosystems[J]. European Journal of Soil Biology,2021,102:103270.
[38]Blackwell P,Riethmuller G,Collins M. Biochar for environmental management:science and technology[J]. Environmental Science,2009,14(2):883-892.
[39]Chen J H,Liu X Y,Zheng J W,et al. Biochar soil amendment increased bacterial but decreased fungal gene abundance with shifts in community structure in a slightly acid rice paddy from Southwest China[J]. Applied Soil Ecology,2013,71:33-44.
[40]Hou Y L,Zeng W Z,Hou M L,et al. Responses of the soil microbial community to salinity stress in maize fields[J]. Biology,2021,10(11):1114.
[41]Elmer W H,Pignatello J J. Effect of biochar amendments on mycorrhizal associations and Fusarium crown and root rot of asparagus in replant soils[J]. Plant Disease,2011,95(8):960-966.
[42]Esfehani Y J,Khavazi K,Ghorbani S. Cross interaction of Pseudomonas putida and Glomus intraradices and its effect on wheat root colonization[J]. Pakistan Journal of Biological Sciences,2009,12(20):1365-1370.
[43]Haas D,Défago G. Biological control of soil-borne pathogens by fluorescent pseudomonads[J]. Nature Reviews Microbiology,2005,3:307-319.
[44]Ennis C J,Evans A G,Islam M,et al. Biochar:carbon sequestration,land remediation,and impacts on soil microbiology[J]. Critical Reviews in Environmental Science and Technology,2012,42(22):2311-2364.
[45]王金超,陳利民,金爱武,等. 生物炭防控镰刀菌枯萎病的研究进展[J]. 竹子学报,2021,40(3):49-59.
[46]Wang Y L,Zhang L Q,Meng F A,et al. Responses of soil microbial communities in soybean and ndash;maize rotation to different fertilization treatments[J]. Agronomy,2023,13(6):1590-1599.
[47]李 格,代 快,李江舟,等. 烟秆生物炭与化肥配施对烟草生长及产量的影响[J]. 中国土壤与肥料,2022(3):91-100.
[48]Corrales A,Turner B L,Tedersoo L,et al. Nitrogen addition alters ectomycorrhizal fungal communities and soil enzyme activities in a tropical montane forest[J]. Fungal Ecology,2017,27:14-23.
[49]Ogundeji A O,Li Y,Liu X J,et al. Eggplant by grafting enhanced with biochar recruits specific microbes for disease suppression of Verticillium wilt[J]. Applied Soil Ecology,2021,163:103912.
[50]Sommermann L,Babin D,Behr J H,et al. Long-term fertilization strategy impacts Rhizoctonia solani-microbe interactions in soil and rhizosphere and defense responses in lettuce[J]. Microorganisms,2022,10(9):1717.
[51]Jiang Z W,Yang S H,Pang Q Q,et al. Biochar improved soil health and mitigated greenhouse gas emission from controlled irrigation paddy field:insights into microbial diversity[J]. Journal of Cleaner Production,2021,318:128595.
[52]Cheng Z C,Wu S,Pan H,et al. Cortinarius and Tomentella fungi become dominant taxa in taiga soil after fire disturbance[J]. Journal of Fungi,2023,9(11):1113.
[53]Shen H Y,Yang B S,Wang H,et al. Changes in soil ectomycorrhizal fungi community in oak forests along the urban-rural gradient[J]. Forests,2022,13(5):675.
[54]Li B,Liu X Q,Zhu D,et al. Crop diversity promotes the recovery of fungal communities in saline-alkali areas of the Western Songnen Plain[J]. Frontiers in Microbiology,2023,14:1091117.
[55]Kara O,Bolat I. Influence of soil compaction on microfungal community structure in two soil types in Bartin Province,Turkey[J]. Journal of Basic Microbiology,2007,47(5):394-399.
[56]Ferrenberg S,ONeill S P,Knelman J E,et al. Changes in assembly processes in soil bacterial communities following a wildfire disturbance[J]. The ISME Journal,2013,7(6):1102-1111.
[57]Lammel D R,Feigl B J,Cerri C C,et al. Specific microbial gene abundances and soil parameters contribute to C,N,and greenhouse gas process rates after land use change in Southern Amazonian Soils[J]. Frontiers in Microbiology,2015,6:1057.
[58]Stegen J C,Lin X J,Konopka A E,et al. Stochastic and deterministic assembly processes in subsurface microbial communities[J]. The ISME Journal,2012,6(9):1653-1664.
[59]Gao C,Montoya L,Xu L,et al. Fungal community assembly in drought-stressed sorghum shows stochasticity,selection,and universal ecological dynamics[J]. Nature Communications,2020,11:34.
[60]Tilman D. Niche tradeoffs,neutrality,and community structure:a stochastic theory of resource competition,invasion,and community assembly[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(30):10854-10861.
[61]Zhang W L,Li Y,Wang C,et al. Modeling the biodegradation of bacterial community assembly linked antibiotics in river sediment using a deterministic-stochastic combined model[J]. Environmental Science & Technology,2016,50(16):8788-8798.
[62]Trivedi P,Rochester I J,Trivedi C,et al. Soil aggregate size mediates the impacts of cropping regimes on soil carbon and microbial communities[J]. Soil Biology and Biochemistry,2015,91:169-181.
[63]Neumann D,Heuer A,Hemkemeyer M,et al. Response of microbial communities to long-term fertilization depends on their microhabitat[J]. FEMS Microbiology Ecology,2013,86(1):71-84.
[64]Xu Y C,Chen Y Z,Dang P,et al. Decay of fallen wood and elevation affects soil fungal community assembly and indirectly controls community diversity[J]. Applied Soil Ecology,2023,182:104683.
[65]Zheng W,Zhao Z Y,Lü F L,et al. Fungal alpha diversity influences stochasticity of bacterial and fungal community assemblies in soil aggregates in an apple orchard[J]. Applied Soil Ecology,2021,162:103878.
[66]Faust K,Raes J. Microbial interactions:from networks to models[J]. Nature Reviews Microbiology,2012,10:538-550.
[67]Durán P,Thiergart T,Garrido-Oter R,et al. Microbial interkingdom interactions in roots promote Arabidopsis survival[J]. Cell,2018,175(4):973-983.e14.
[68]Liu J W,Zhu S Q,Liu X Y,et al. Spatiotemporal dynamics of the archaeal community in coastal sediments:assembly process and co-occurrence relationship[J]. The ISME Journal,2020,14(6):1463-1478.
[69]Mundra S,Kjnaas O J,Morgado L N,et al. Soil depth matters:shift in composition and inter-kingdom co-occurrence patterns of microorganisms in forest soils[J]. FEMS Microbiology Ecology,2021,97(3):fiab022.
[70]Zhang L,Tang C,Yang J S,et al. Salinity-dependent potential soil fungal decomposers under straw amendment[J]. Science of the Total Environment,2023,891:164569.
[71]He H R,Huang J R,Zhao Z Z,et al. Clomazone impact on fungal network complexity and stability[J]. Frontiers in Microbiology,2023,14:1124127.
[72]Zhang M,Wang K F,Shi C,et al. Responses of fungal assembly and co-occurrence network of rhizosphere soil to Amaranthus palmeri invasion in northern China[J]. Journal of Fungi,2023,9(5):509.
[73]Liu Z,Li J,Hou R X,et al. Plant rhizospheres harbour specific fungal groups and form a stable co-occurrence pattern in the saline-alkali soil[J]. Agronomy,2023,13(4):1036.
[74]Hu Y,Cong M F,Yan H,et al. Effects of biochar addition on aeolian soil microbial community assembly and structure[J]. Applied Microbiology and Biotechnology,2023,107(11):3829-3845.
[75]Xin Y,Fan Y,Babalola O O,et al. Legacy effects of biochar and compost addition on arbuscular mycorrhizal fungal community and co-occurrence network in black soil[J]. Microorganisms,2022,10(11):2137.
[76]Zhang H J,Wang S J,Zhang J X,et al. Biochar application enhances microbial interactions in mega-aggregates of farmland black soil[J]. Soil and Tillage Research,2021,213:105145.
[77]Yu J L,Deem L M,Crow S E,et al. Biochar application influences microbial assemblage complexity and composition due to soil and bioenergy crop type interactions[J]. Soil Biology and Biochemistry,2018,117:97-107.
[78]Wagg C,Schlaeppi K,Banerjee S,et al. Fungal-bacterial diversity and microbiome complexity predict ecosystem functioning[J]. Nature Communications,2019,10:4841.
[79]武春成,周國彦,曹 霞,等. 连作土壤连续施入生物炭对黄瓜品质及根区微生态的影响[J]. 江苏农业科学,2022,50(9):143-147.
[80]Rodríguez-Vila A,Forján R,Guedes R S,et al. Changes on the phytoavailability of nutrients in a mine soil reclaimed with compost and biochar[J]. Water,Air,& Soil Pollution,2016,227(12):453.
[81]de Corato U,Patruno L,Avella N,et al. Composts from green sources show an increased suppressiveness to soilborne plant pathogenic fungi:relationships between physicochemical properties,disease suppression,and the microbiome[J]. Crop Protection,2019,124:104870.
[82]Whalen E D,Lounsbury N,Geyer K,et al. Root control of fungal communities and soil carbon stocks in a temperate forest[J]. Soil Biology and Biochemistry,2021,161:108390.
[83]Gao S K,He Q,Huang D,et al. Responses of fungal community structure and functional composition to short-term fertilization and dry season irrigation in Eucalyptus urophylla×Eucalyptus grandis plantation soils[J]. Forests,2022,13(6):854.
[84]高海英,何绪生,耿增超,等. 生物炭及炭基氮肥对土壤持水性能影响的研究[J]. 中国农学通报,2011,27(24):207-213.
