UV-B不同剂量辐照下生菜生长和代谢组学分析
2024-06-03刘淑娟刘腾云刘立盘朱安繁黄星瑜欧阳雪灵周华
刘淑娟 刘腾云 刘立盘 朱安繁 黄星瑜 欧阳雪灵 周华
摘要:以奶油生菜为研究材料,在植物工厂人工光源中设置3种紫外线B(UV-B)剂量[0、8.64、17.28 kJ/(m2·d)]处理,利用广靶代谢组学技术,分析不同剂量UV-B辐照下生菜叶片中的差异代谢物质,研究UV-B辐照对生菜生物量、光合参数和次生代谢物的影响。结果表明,与0剂量相比,低剂量UV-B处理对生菜生物量、光合参数均未产生显著影响,代谢组检测到30种差异代谢产物,主要为生物碱、酚类、萜类等物质,其中9种上调表达,21种下调表达;高剂量UV-B处理显著降低了生菜地上部干重、地下部干重、气孔导度和蒸腾速率,但地上部鲜重、净光合速率均未呈现显著差异,共检测到35个差异表达代谢物,其中21种上调表达,14种下调表达,上调表达的代谢物主要为黄酮类、单萜等,生菜叶片槲皮素含量在低剂量、高剂量UV-B处理下均显著增加。研究结果可为利用UV-B辐照提高设施生菜营养品质提供理论依据和参考。
关键词:UV-B辐照;生菜;劑量;生长;代谢产物
中图分类号:S636.204 文献标志码:A
文章编号:1002-1302(2024)08-0131-07
收稿日期:2023-04-28
基金项目:国家自然科学基金(编号:31960623);江西省科学院重大产业技术攻关专项(编号:2023YSBG10005)。
作者简介:刘淑娟(1982—),女,安徽宿州人,博士,副研究员,主要从事植物遗传育种研究。E-mail:liushujuan@126.com。
通信作者:周 华,博士,研究员,主要从事设施园艺研究。E-mail:yuerhua116@126.com。
UV-B(ultraviolet-B)是太阳辐射中波长为280~315 nm的紫外线,具有高能量日光光谱。随着人类的发展和地球臭氧层的减少,到达地面的UV-B辐射增加,引起了研究人员的关注[1]。最初的研究认为,UV-B是一种环境胁迫因子,增加的UV-B作用于植物,会抑制植物的光合作用,减少植株高度、叶片长度,增加叶片厚度和分枝,影响作物产量、生长发育和代谢过程[2]。随着研究的深入,人们发现利用作物对UV-B辐照的适应性,可以控制作物的形态建成,调控作物生长,生产有利于人类饮食健康的次生代谢产物[3]。研究发现,药用植物菥蓂在增补UV-B辐射下,通过增加体内总黄酮和总酚含量、可溶性蛋白和可溶性糖含量,抵抗UV-B紫外胁迫对其造成的影响,增强对逆境环境的适应性[4]。在白光中增加1.14 kJ/(m2·d) UV-B辐照,甜椒中苯丙氨酸解氨酶、查耳酮合成酶基因表达显著上调,绿原酸等类黄酮物质显著积累[5]。南非醉茄在温室环境[UV-B剂量为 9.6 kJ/(m2·d)] 的基础上增加3.6 kJ/(m2·d)UV-B辐照剂量,其体内尤其是根部的生物碱、花青素、类胡萝卜素、类黄酮、番茄红素次生代谢产物含量普遍呈现增加的变化趋势[6]。与不能透过紫外线的大棚相比,生长在可以透过紫外线大棚中的生菜的花青素含量显著提高[7]。UV-B辐照可以显著提高水稻、玉米、黄瓜等作物的叶片及水果中的维生素C含量[8]。因此,调控栽培环境中的 UV-B 辐照,已经成为提高作物营养品质的一种有效方法[9]。
UV-B对作物的影响是与波长、剂量相关的[10]。例如,当用波长为300~320 nm的UV-B照射荞麦芽时,可以增加花青素、芸香苷含量,而当用波长为280~300 nm的UV-B照射时,荞麦芽会发黄或枯萎,不利于芽的生长[11]。黄瓜在1.44 kJ/(m2·d) UV-B辐照下,植株高度降低,株型更为紧凑,有利于叶片净光合能力、水分利用效率的提高,而在6.92 kJ/(m2·d) UV-B辐照下,黄瓜地上部、地下部干重显著下降,根系活力、光合速率和叶绿素含量均受到抑制[12]。24 kJ/(m2·d) UV-B紫外灯处理对芒果树体产量、果实品质无显著影响,而高剂量96 kJ/(m2·d) UV-B会破坏芒果叶肉光合组织结构,抑制叶片光合作用,加厚叶表角质层,从而阻碍叶片吸收二氧化碳,抑制蒸腾作用,引起树体减产[13]。用 1.845 kJ/m2 UV-B辐照2.5 h可以诱导绿豆芽体内维生素C、酚类和类黄酮含量的增加,提高其营养品质[14]。作物在低剂量、高剂量UV-B辐射下会引发特异性或非特异性反应,通过调控植物光形态建成、激发植物抗氧化系统、产生次生代谢产物来应对胁迫[15]。
叶用莴苣(Lactuca sativa L.)俗称生菜,是国际上一种重要的蔬菜作物种类,随着生食蔬菜人口的增加,叶用莴苣以营养丰富、生食口感好的特点,在近年来市场需求量加大,世界栽培面积也迅速扩大。其中LED完全人工光源植物工厂所生产的叶用莴苣可实现按计划生产,且无病虫害或重金属污染,作物产量高,已经成为高端叶用莴苣供应的一类重要生产形式[16]。然而,栽培在温室或植物工厂中的作物由于覆盖材料、水培方式的影响,营养品质明显下降[17]。研究发现,随着UV-B辐射的增强,生菜叶片中类黄酮含量逐渐增加,抗坏血酸、可溶性糖和可溶性蛋白含量则先增加后减小[18]。截至目前,人类对UV-B辐照剂量对生菜代谢产物的影响还缺乏全面理解。本研究通过代谢组学的方法,研究不同剂量UV-B辐照对生菜生长、代谢产物的影响,以期为设施栽培调控生菜品质提供基础数据和技术支持。
1 材料与方法
1.1 材料
本研究中的生菜品种为奶油生菜,于2022年1月20日生菜的3叶1心期开始在植物工厂中栽培,栽培的基础光源为红光-蓝光(光照度之比为 2 ∶1),其中红光波长为(660±10) nm,蓝光波长为(450±10) nm。采用UV-B光源(Phillips TL 100W/01)作为补充光源,植物工厂室内设置:光照度为 200 μmol/(m2·s),每天光照16 h,白天温度为 22 ℃,晚上温度为20 ℃,水培营养液为Hoagland营养液,CO2浓度为400 mg/L。当生菜生长10 d后,开始增加UV-B辐照处理,试验设置3个不同剂量的UV-B辐照:0 (CK)、8.64 kJ/(m2·d) (U1)、17.28 kJ/(m2·d) (U2),每个处理10株,重复3次,UV-B辐照剂量通过调整UV-B灯管与植物之间的距离获得,UV-B剂量采用林上光电科技有限公司的紫外光计(LS 125 UV)进行测量。
生菜在植物工厂中用不同剂量UV-B照射4 d后,用Li-6400XT光合仪进行光合参数的测定,选取生菜从上往下第3张叶片进行测定,光合仪叶室参数:流量为500 μmol/s,光合有效辐射为 1 000 μmol/s,CO2浓度为400 μmol/s,相对湿度为50%~60%,叶温为25 ℃,重复测量3次。同时进行生物量的测定,从水培系统中取出生菜后,分别称取地上部、地下部鲜重,随后在105 ℃烘箱中杀青5 min,再调节温度至70 ℃直到烘干。取中部新鲜叶片,去除叶脉后放入液氮中处理10 min后保存至-80 ℃冰箱中,用于后续广靶代谢组学的测定和分析。
1.2 样品的制备及代谢组测定方法
采用超高效液相色谱-质谱系统(UPLC-MS/MS)进行代谢组学的测定。称取0.5 g样品,加入20 mL甲醇-Mcllvaine-Na2EDTA溶液,通过超声和离心进行3次提取,蒸发至20 mL后过聚苯乙烯-二乙烯基苯(HLB)固相萃取柱,用6 mL甲醇洗脱,收集洗脱液,用氮吹至近干,再用乙腈-水(体积比2 ∶8)混合溶液复溶,4 ℃、12 000 g离心,收集上清液过滤后,用UPLC-MS/MS进行检测,具体参数参照陈乾等的研究[19]进行设置。
1.3 数据处理
生物量数据和光合数据用SPSS 20.0进行单因素方差分析,采用新复极差法分析差异。对质谱检测的数据进行定性、相对定量分析,定性分析参照公共数据库,相对定量分析采用多反应监测模式,得到所有样本的代谢物定性与相对定量的结果。用SIMCA软件(v16.0.2,Sartorius Stedim Data Analytics AB,Umea,Sweden)对数据进行对数转换加中心化格式化处理,进行主成分模型分析。采用正交偏最小二乘法-判别分析(orthogonal projections to latent structures-discriminant analysis,OPLS-DA)的统计方法对结果进行分析。各处理间选取P<0.05的代谢物为差异代谢物,并将差异代谢物比对到KEGG数据库中进行富集性分析。
2 结果与分析
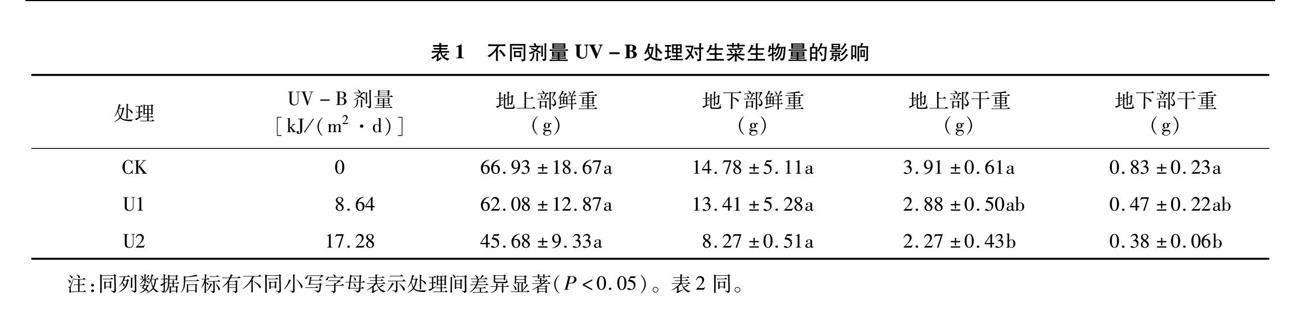
2.1 不同剂量UV-B辐照处理对生菜生长的影响
由表1可以看出,与对照相比,在低剂量UV-B辐照处理下,生菜的地上部鲜重、地下部鲜重、地上部干重和地下部干重逐渐减少,但地上部鲜重、地下部鲜重在3个处理间未呈现显著差异。在高剂量UV-B辐照处理下,生菜的地上部干重和地下部干重显著低于对照,但在低剂量UV-B辐照处理下,生菜的地上部干重和地下部干重与其他2种处理间无显著差异。
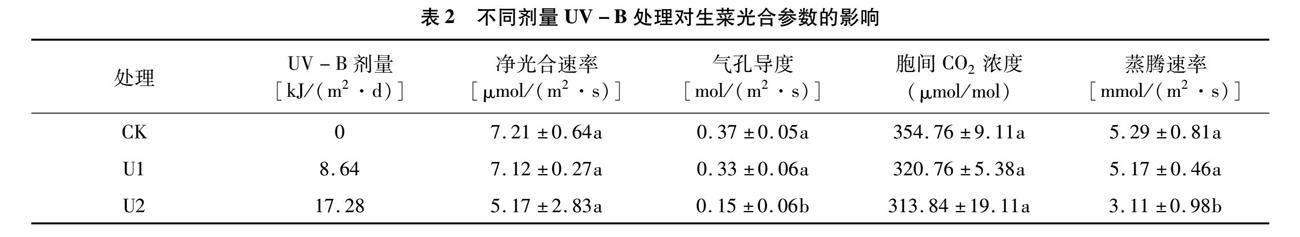
由表2可以看出,生菜叶片的光合参数变化趋势与生物量基本相同,与对照相比,生菜叶片的光合参数随着UV-B剂量的增加而逐渐下降,其中净光合速率、胞间CO2浓度在3个处理间未呈现显著差异,而气孔导度、蒸腾速率在高剂量UV-B处理下显著低于对照、低剂量处理,而对照与低剂量处理间无显著差异。
2.2 代谢组多元统计分析
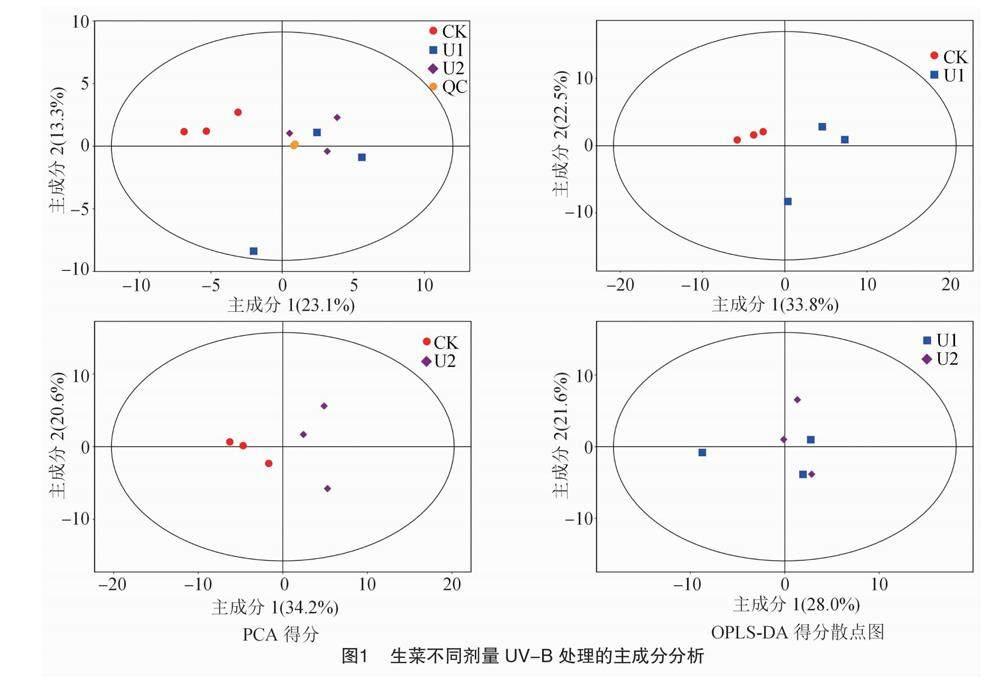
用SIMCA软件对数据进行对数(LOG)转换加UV格式化处理,首先对第1主成分进行OPLS-DA建模分析,模型的质量用7折交叉验证进行检验;用交叉验证后得到的RY(模型对分类变量Y的可解释性)和Q(模型的可预测性)对模型的有效性進行评判;最后通过置换检验,随机多次改变分类变量Y的排列顺序,得到不同的随机Q 值,对模型有效性作进一步的检验。全部样本(包括QC样本)的PCA得分散点图如图1所示, 可见样本全部位于95%置
信区间内。样本间对比分析的PCA得分散点图如图1所示,可见所有样本的两两对比区分非常显著。OPLS-DA模型结果中的R2Y均为1,Q2分别为0.628、0.632、0.746,表明模型预测性良好。置换检验结果表明,模型具有良好的稳健性,不存在过拟合现象。
2.3 差异代谢物筛选
为了检测不同剂量UV-B辐照对生菜代谢产物的影响,利用广泛靶标代谢组测定生菜叶片中的代谢产物,每组设3次生物学重复,并对其进行定性、定量分析。由表3可知,CK组对U1组共筛选到30个差异代谢物,其中属于生物碱类的有5种,4种在U1中上调表达,属于萜类有2种,均在U1 中下调表达,U1组中共有9种上调表达的差异代谢物,分别是1-甲基腺嘌呤、3-羟基-4-甲氧基肉桂酸、别欧前胡素、甜菜碱醛、胆绿素、松柏苷、表雄酮、槲皮素-3-O-新橙皮苷、乙酰托品醇,其中 3-羟基-4-甲氧基肉桂酸、槲皮素-3-O-新橙皮苷上调表达达2倍以上。
CK组对U2组共筛选到35种差异代谢物,其中黄酮类物质占差异代谢物的9/35,均在U2中上调表达,萜类物质有6种,其中单萜在U2中上调表达,而其余多萜在U2中均下调表达,生物碱类有3种,在U2组中总共有21种上调表达的差异代谢物,其中芹菜苷、甜菜碱醛、去甲氧基茵陈色原酮、维生素A 上调表达2倍以上,紫云英苷上调表达7倍以上。U1组对U2组共筛选到26个差异代谢物,其中萜类物质有3种,2种单萜、1种三萜均在U2中上调表达,3种黄酮类物质均在U2中上调表达,在U2组中总共有16种上调表达的差异代谢物。
2.4 差异代谢通路分析
由图2可知,CK与U1比较,富集在烟酸盐、烟酰胺代谢通路中共有12个代谢物,在该通路中的差异代谢物为烟酰胺核糖酸,在泛醌和其他萜类化合物的生物合成通路中共检测出23个代谢物,差异代谢物为维生素E, 油菜素内酯生物合成通路中检测到25个代谢物,其中菜油甾醇是差异代谢物,此外,还有卟啉和叶绿素代谢,甘氨酸、丝氨酸和苏氨酸代谢,类固醇生物合成,嘧啶代谢,精氨酸和脯氨酸代谢和苯丙酸生物合成上均存在差异代谢物,分别为胆绿素、甜菜碱醛、菜油甾醇、脱氧尿苷和n-乙酰-l-谷氨酸5-半醛(图2)。在CK与U2的比较中,黄酮和黄酮醇的生物合成、类黄酮生物合成、乙醛酸盐和二羧酸盐代谢、柠檬酸循环(TCA循环)、甘氨酸、丝氨酸和苏氨酸代谢、类胡萝卜素生物合成和嘧啶代谢是主要的差异代谢通路,其中差异代谢物分别为芹黄素、槲皮素、花青色素、芹黄素、顺式乌头酸、顺式乌头酸、甜菜碱醛、脱落酸、脱氧尿苷。在U1和U2的比较中,代谢通路集中在果糖和甘露糖代谢、乙醛酸盐和二羧酸盐代谢、柠檬酸循环(TCA循环)、泛醌等萜类化合物的生物合成、糖酵解或糖异生、半乳糖代谢、淀粉和蔗糖代谢、半胱氨酸和蛋氨酸代谢、精氨酸和脯氨酸代谢、氨基糖和核苷酸糖代谢、不饱和脂肪酸的生物合成、类黄酮生物合成、苯丙酸生物合成、脂肪酸生物
合成共14個代谢通路上。
3 结论与讨论
植物为了防御UV-B辐射带来的伤害,会改变植物光合作用、基因表达、酶活性及次生代谢。在本研究中,生菜在高剂量UV-B辐照处理下地上部干重和地下部干重显著减少,但在低剂量 UV-B 辐照处理下的生物量无显著差异。在自然条件下,增强UV-B辐射后,山楂叶片、下表皮厚度增加,净光合速率下降,气孔导度、蒸腾速度上升,叶片和果实中的总酚、总黄酮和总花青素含量均出现不同程度的增加[20]。有研究表明,UV-B辐照对大部分植物的产量、叶面积、胚轴长度都起到抑制作用[21-22]。也有少数研究表明,在UV-B辐照下,一些作物(如生菜)的净光合速率和产量均增加[23-24]。这种差异除了与植物的遗传特性、地区适应性有关,还与UV-B辐照剂量、植物生长阶段及光合有效辐射强度有关[10]。在本研究中,在地上部鲜重(产量)方面,3种UV-B处理间并没有呈现显著差异,表明UV-B辐照在生菜生产中的应用可以不影响产量。
在本研究中,与对照相比,在2种剂量UV-B辐射处理下,生菜叶片中最主要的差异代谢产物是酚类物质,尤其是类黄酮类物质。在高剂量UV-B辐照下,主要差异代谢物为黄酮类物质,包括芹菜素、芹菜苷、紫云英苷、矢车菊素、去甲氧基茵陈色原酮、高良姜素、槲皮素、槲皮苷,均在高剂量UV-B辐照处理下显著上调,在低剂量UV-B辐照处理下, 黄酮类物质槲皮素-3-O-新橙皮苷也显著上调表达,表明黄酮类物质在UV-B辐照处理下显著积累,且随着辐照剂量提高而逐渐积累,这与多数研究结果一致。如在温室中比较UV-B、无UV-B处理生菜种苗,类黄酮物质呈现显著差异[25]。UV-B辐射可以显著提高辣椒叶片中绿原酸、芹菜素8-c-己苷等黄酮类物质的含量[5]。在花菜中,随着UV-B剂量[0、2.2、8.8、16.4 kJ/(m2·d)]的增加,产量逐渐降低,体内总酚、金莲葡糖硫苷含量先增后减,总类黄酮含量逐渐增加[26]。类黄酮类物质具有抗氧化和吸收紫外线的功能,在UV-B辐射下高度羟基化,有利于去除植物细胞中的ROS,从而对氧化胁迫造成的机体损伤进行有效修复[27-28]。
除黄酮类外,萜类物质也是UV-B辐照下重要的差异代谢物。萜类化合物是指具有(C5H8)n通式、含氧、具有不同饱和程度的衍生物,具有抗肿瘤、抗病毒、抗菌、抗炎等药理作用。萜类化合物能够保护植株避免受到氧化损伤,当植株面临UV-B胁迫时,植物的自我保护机制开启,诱导萜类化合物合成量增加[29]。在本研究中,受到UV-B辐照后,生菜体内萜类化合物发生了显著变化,与对照相比,高剂量UV-B辐照处理主要积累单萜2,6-二甲基-7-辛烯-2,3,6-三醇,而倍半萜(脱落酸)、三萜(灵芝酸F、羽扇豆醇)、二萜(12-O-十四烷酰佛波醋酸酯-13)表达量显著下调;在低剂量UV-B处理下,生菜的二萜(12-O-十四烷酰佛波醋酸酯-13)、倍半萜(柳杉二醇)显著下调表达。相似的研究结果也在其他植物中发现,如在UV-B辐射下,神农香菊叶片分泌物中的单萜桉树脑含量随着辐照时间不断增加[30]。相比无UV-B辐照处理,不同强度的UV-B均可以增加葡萄采后桉油精、芳樟醇等单萜的浓度[31]。相对于正常UV-B较低的环境,高海拔、较强UV-B环境下的葡萄浆果中的α-金合欢烯、β-金合欢烯、瓦伦烯、α-人参烯和橙花叔醇等倍半萜含量均增加,但总挥发性有机化合物排放量没有受到明显影响[32]。上述研究结果表明,在不同物种中,萜类物质对UV-B胁迫的响应机制不同。
植物产生各种次级代谢产物是应对UV-B辐射的防御策略之一,这些代谢物不仅涉及对UV-B影响下的植物提供保护,而且可以对植物细胞在UV-B诱导免疫防御系统不充分时提供保护[33-34],同时这些物质也是人类可利用的饮食营养及药用物质,已经被用于制药、营养保健并逐渐成为常规饮食的一部分。槲皮素作为一种天然的黄酮类多酚化合物,具有抗氧化、抗炎、抗肿瘤等作用,在本研究的高、低剂量UV-B辐射处理下,槲皮素表达量均显著提升。在高剂量UV-B辐射处理下,香豆素、芹菜苷、紫云英苷、矢车菊素、枸橘苷等黄酮类物质表达量显著提高,维生素A表达量显著提升,但生菜的产量(地上部鲜重)并没有受到显著影响。因此可见,较高剂量UV-B辐照可以成为生菜设施栽培中提高有利于人类健康的营养品质的一种有效措施[35]。关于不同UV-B剂量下生菜叶片的转录组学研究,尤其是黄酮类、萜类物质合成机制及合成途径中涉及的关键酶的基因表达是否发生上调还有待进一步研究。
本研究开展不同剂量UV-B辐照对生菜生长和代谢组学的影响研究,随着UV-B剂量增加,生菜地上部鲜重和净光合速率均呈现下降趋势,但并未呈现出显著差异,2种剂量UV-B辐照下生菜叶片中最主要的差异代谢物质为黄酮类物质,其中槲皮素含量在UV-B辐照下均显著增加,本研究结果可为利用UV-B辐照提高设施生菜营养品质提供技术支持。
参考文献:
[1]Caldwell M M,Bornman J F,Ballaré C L,et al. Terrestrial ecosystems,increased solar ultraviolet radiation,and interactions with other climate change factors[J]. Photochem Photobiol Sci,2007,6(3):252-266.
[2]Hideg E,Jansen M A K,Strid . UV-B exposure,ROS,and stress:inseparable companions or loosely linked associates?[J]. Trends Plant Sci,2013,18(2):107-115.
[3]王修蘋,李 想,李祖然,等. 植物对UV-B辐射增强响应的跨代可塑性特征及机制研究进展[J]. 植物生理学报,2022,58(5):797-805.
[4]黄志慧,张一宁,李娜娜,等. 增补UV-B辐射对菥蓂生理特性及次生代谢产物的影响[J]. 植物研究,2022,42(6):1079-1087.
[5]Rodríguez-Calzada T,Qian M,Strid ,et al. Effect of UV-B radiation on morphology,phenolic compound production,gene expression,and subsequent drought stress responses in chili pepper (Capsicum annuum L.)[J]. Plant Physiology and Biochemistry,2019,134:94-102.
[6]Takshak S,Agrawal S B. Secondary metabolites and phenylpropanoid pathway enzymes as influenced under supplemental ultraviolet-B radiation in Withania somnifera Dunal,an indigenous medicinal plant[J]. J Photoch Photobio B,2014,140:332-343.
[7]Quintero-Arias D G,Acua-Caita J F,Asensio C,et al. Ultraviolet transparency of plastic films determines the quality of lettuce (Lactuca sativa L.) grown in a greenhouse[J]. Agronomy,2021,11(2):358.
[8]Dai Q J,Yan B,Huang S B,et al. Response of oxidative stress defense systems in rice (Oryza sativa) leaves with supplemental UV-B radiation[J]. Physiol Plantarum,1997,101(2):301-308.
[9]Loconsole D,Santamaria P. UV lighting in horticulture:a sustainable tool for improving production quality and food safety[J]. Horticulturae,2021,7(1):9.
[10]Jenkins G I. Signal transduction in responses to UV-B radiation[J]. Annu Rev Plant Biol,2009,60(1):407.
[11]Tsurunaga Y,Takahashi T,Katsube T,et al. Effects of UV-B irradiation on the levels of anthocyanin,rutin and radical scavenging activity of buckwheat sprouts[J]. Food Chemistry,2013,141(1):552-556.
[12]孙令强,李召虎,段留生,等. UV-B辐射对黄瓜幼苗生长和光合作用的影响[J]. 华北农学报,2006,21(6):79-82.
[13]岳 堃,王 红,郭钰柬,等. 增强UV-B辐射对芒果叶片光合组织结构的损伤[J]. 热带生物学报,2019,10(4):324-330.
[14]Wang H B,Gui M Y,Tian X,et al. Effects of UV-B on vitamin C,phenolics,flavonoids and their related enzyme activities in mung bean sprouts (Vigna radiata)[J]. Int J Food Sci Tech,2017,52(3):827-833.
[15]Lee J H. UV-B signal transduction pathway in Arabidopsis[J]. J Integr Plant Biol,2016,59(3):223-230.
[16]Bergstrand K J,Schüssler H K. Recent progresses on the application of LEDs in the horticultural production[J]. Acta Hortic,2012,927:529-534.
[17]Massot C,Génard M,Stevens R,et al. Fluctuations in sugar content are not determinant in explaining variations in vitamin C in tomato fruit[J]. Plant Physiol Bioch,2010,48(9):751-757.
[18]趙晓莉,胡正华,徐建强,等. UV-B辐射与酸雨胁迫对生菜生理特性及品质的影响[J]. 生态环境,2006,15(6):1170-1175.
[19]陈 乾,刘 洋,肖丽君,等. 超高效液相色谱串联质谱法同时测定叶菜中13种抗生素[J]. 环境科学,2020,41(2):952-961.
[20]劉榕晨. UV-B辐射对‘大金星山楂生理特性及次生代谢产物的影响[D]. 太谷:山西农业大学,2019.
[21]陈慧泽,韩 榕. 植物响应UV-B辐射的研究进展[J]. 植物学报,2015,50(6):790-801.
[22]Huché-Thélier L,Crespel L,Le Gourrierec J,et al. Light signaling and plant responses to blue and UV radiations perspectives for applications in horticulture[J]. Environ Exp Bot,2016,121:22-38.
[23]Yao Y,Xuan Z,He Y,et al. Principal component analysis of intraspecific responses of tartary buckwheat to UV-B radiation under field conditions[J]. Environ Exp Bot,2007,61(3):237-245.
[24]Wargent J J,Elfadly E M,Moore J P,et al. Increased exposure to UV-B radiation during early development leads to enhanced photoprotection and improved long-term performance in Lactuca sativa[J]. Plant Cell Environ,2011,34(8):1401-1413.
[25]Wargent J J,Nelson B C,McGhie T K,et al. Acclimation to UV-B radiation and visible light in Lactuca sativa involves up-regulation of photosynthetic performance and orchestration of metabolome-wide responses[J]. Plant Cell Environ,2015,38(5):929-940.
[26]Topcu Y,Dogan A,Sahin-Nadeem H,et al. Morphological and biochemical responses of broccoli florets to supplemental ultraviolet-B illumination[J]. Agr Ecosyst Environ,2018,259:1-10.
[27]Agati G,Tattini M. Multiple functional roles of flavonoids in photoprotection[J]. New Phytol,2010,186(4):786-793.
[28]Agati G,Azzarello E,Pollastri S,et al. Flavonoids as antioxidants in plants:location and functional significance[J]. Plant Sci,2012,196:67-76.
[29]刘佳钰,王 蓉,张 弛,等. UV-B辐射与植物次级代谢产物变化的研究进展[J]. 基因组学与应用生物学,2017,36(8):3157-3166.
[30]何 淼,王霁佳,高文杰,等. UV-B辐射对神农香菊萜类物质合成及其相关基因表达的影响[J]. 广西植物,2019,39(7):933-939.
[31]Eichholz I,Huyskens-Keil S,Keller A,et al. UV-B-induced changes of volatile metabolites and phenolic compounds in blueberries (VacciniumcorymbosumL.)[J].FoodChem,2011,
126(11):60-64.
[32]Gil M,Bottini R,Pontin M,et al. Solar UV-B radiation modifies the proportion of volatile organic compounds in flowers of field-grown grapevine (Vitis vinifera L.) cv. Malbec[J]. Plant Growth Regul,2014,74(2):193-197.
[33]Schreiner M,Martínez-Abaigar J,Glaab J,et al. UV‐B induced secondary plant metabolites:potential benefits for plant and human health[J]. Optik & Photonik,2014,9(2):34-37.
[34]Takshak S,Agrawal S B. Defense potential of secondary metabolites in medicinal plants under UV-B stress[J]. J Photoch Photobio B,2019,193:51-88.
[35]Meyer P,van de Poel B,de Coninck B. UV-B light and its application potential to reduce disease and pest incidence in crops[J]. Hortic Res,2021,8(1):194.
