2株溶磷真菌的筛选、鉴定、耐盐及促生效果
2024-06-03王向向陈静宇樊川曹旭孟利强刘志庭赵晓宇张颂宋瑜
王向向 陈静宇 樊川 曹旭 孟利强 刘志庭 赵晓宇 张颂 宋瑜
摘要:溶磷真菌能够溶解土壤中被固化的磷元素,在提高磷肥利用率和改善土壤环境方面具有重要意义。利用无机磷固体培养基从磷矿植物根际土壤中筛选得到2株高效溶磷真菌W10和W12,在液体培养基中检测菌株对不同难溶磷的溶解能力以及耐盐能力。结合形态学特征与ITS rDNA序列分析,W10与W12分别被鉴定为篮状菌(Talaromyces sp.)和黑曲霉(Aspergillus niger)。菌株W10和W12溶解Ca3(PO4)2的最高溶解量分別为843.05 mg/L和1 187.09 mg/L,对AlPO4和FePO4的溶解量远远低于对Ca3(PO4)2的溶解量;W10最高可耐受4%的盐浓度,W12在10%的盐浓度下对Ca3(PO4)2仍有较强的溶解能力,没有达到耐盐极限,有开发为盐碱地微生物肥料的潜力;玉米盆栽试验结果显示,与CK2相比,10~40 d的W10处理土壤有效磷含量提高了44.74%~56.62%,植株鲜重、干重、株高、叶面积以及植物全磷含量分别提高了23.21%、27.08%、9.62%、21.59%、20.07%,土壤脲酶活性和蔗糖酶活性分别增强了28.43%和38.20%。表明菌株W10能够显著提高土壤有效磷含量(P<0.05),促进植物生长和增强土壤酶活性,具有开发为微生物肥料和农业生产应用的潜力。
关键词:溶磷真菌;篮状菌,黑曲霉,耐盐,促生
中图分类号:S144;S182 文献标志码:A
文章编号:1002-1302(2024)08-0219-07
收稿日期:2023-06-26
基金项目:黑龙江省科学院青年创新基金项目(编号:CXM2022SW02);黑龙江省重大科技成果转化项目(编号:CG23014)。
作者简介:王向向(1994—),男,甘肃定西人,硕士,助理研究员,主要从事微生物肥料相关研究。E-mail:1447185318@qq.com
通信作者:陈静宇,实验师,主要从事生物技术、农业微生物学研究。E-mail:49673522@qq.com。
磷是植物生长必不可少的营养元素之一,土壤中磷素含量直接影响植物的生长发育与品质,在农业生产中具有举足若轻的地位,磷肥的施用是保障粮食产量的重要举措[1]。然而,磷肥施加到土壤中通常很快被Ca2+、Mg2+、Al3+、Fe3+等离子固化,以难溶性的金属螯合物存在于土壤中,致使磷肥的有效利用率不超过20%[2]。长此以往,不仅造成磷素资源的严重浪费,使本就稀少的高品位磷矿资源面临挑战,另一方面,磷肥的过量使用造成地下水污染和水体富营养化[3]。因此,合理使用磷肥,提高磷肥当季的利用率,延长磷矿资源使用年限,对我国农业可持续发展具有重要的意义。
研究表明,土壤中存在一种微生物,能够将难溶性的磷转化为植物可以吸收的有效磷,许多学者希望得到高效的溶磷微生物能够提高磷肥在农业生产中的利用。溶磷微生物主要包括细菌和真菌,有研究表明,真菌的溶磷性能要远大于细菌,而真菌在实际农业生产中的应用较少,所以近些年来溶磷真菌也逐渐成为研究热点[4]。目前,已经分离得到的溶磷真菌包含数10个属,其中,研究较多的集中于青霉菌属和曲霉菌属[5]。Sang等从杨树根际土壤中分离得到的4株溶磷真菌均属于被孢霉属,其中溶磷效果最好的为L4,最大溶磷量为 180 mg/L[6]。Wang等从磷尾矿渣场土壤中得到1株淡紫拟青霉菌PSF7,在经过培养基优化后,该菌株最大溶磷量能达到122.17 mg/L[7]。Bononi等从亚马逊雨林土壤中分离得到木霉属的真菌中有19.5%的菌株具有溶磷效果,盆栽试验中大豆对磷的吸收提升了2.1%~41.1%[8]。Wang等研究黑曲霉属溶磷真菌对小麦秸秆的降解效能与磷的释放,结果表明,黑曲霉属溶磷真菌释放的葡聚糖酶和葡萄糖苷酶有助于秸秆降解与有机磷释放,分泌的草酸促进了无机磷的释放[9]。Vessey等在实验室和大田试验中将1株拜莱青霉(Penicillium bilaii)接种于豌豆上,接菌处理植株的根长、根质量和茎部磷含量等均显著增加,能够有效促进豌豆的生长,目前,该菌株已在加拿大实现商品化生产[10]。尚晓静等从蓝莓内生真菌中筛选出具有溶磷、耐盐功能的烟管菌G14与阿达青霉FG54,实验室条件下最高有效磷含量于5 d后分别达到587.315 μg/mL和523.730 μg/mL[11]。李静等从小麦田土壤中分离得到一株具有溶磷效果的产红青霉(Penicillium rubens),该菌株对 Ca3(PO4)2、AlPO4、FePO4均有一定的溶解能力,最大溶磷量分别为382.79、95.99、75.39 mg/L,且对小麦有明显的促生特性,小麦株高、根长、鲜重和叶绿素含量最高可分别提升35.65%、50.44%、50.94%和19.57%[12]。
目前,关于溶磷真菌的研究报道较多,但大多数真菌的筛选主要来源于各种农作物根际土壤,对磷矿及其附近植被根际土壤中溶磷真菌的研究较少。因此,本研究以磷矿土壤为来源,筛选具有高效溶磷效果的真菌,通过IST rDNA序列测序比对分析确定其种属关系,利用钼锑抗比色法检测其溶磷特性,并通过盆栽试验验证菌株对玉米幼苗的促生效果,以期为我国黑土可持续利用发展提供优良的菌种资源。
1 材料与方法
1.1 土样采集
土样于2021年7月采集于辽宁省朝阳市建平县磷矿山区(119°37′50″E,41°29′59″N)的植物根际土壤,采用5点采样法进行取样,用铁铲深入植物根际 10 cm 处取样,装入自封袋拿回实验室放4 ℃冰箱备用。
1.2 培养基
马铃薯葡萄糖琼脂(PDA)培养基:葡糖糖 20 g,K2HPO4 2 g,MgSO4 1 g,琼脂 20 g,马铃薯汁 1 000 mL,pH值自然,115 ℃灭菌30 min。
无机磷培养基:葡糖糖 10 g,FeSO4·7H2O 0.03 g,MgSO4·7H2O 0.3 g,NaCl 0.3 g,KCl 0.3 g,(NH4)2SO4 0.5 g,MnSO4·7H2O 0.03 g,Ca3(PO4)2 5 g,琼脂 20 g,蒸馏水1 000 mL,pH值7.2~7.4,115 ℃灭菌30 min。
1.3 溶磷真菌的分离纯化
取10 g土样置于含90 mL无菌水的250 mL锥形瓶中,锥形瓶中放置少量玻璃珠用于充分搅拌,170 r/min培养30 min制备土壤菌悬液,用无菌水将土壤菌悬液梯度稀释至10-2、10-3、10-4,分别取 100 μL 菌悬液均匀涂布于含链霉素(100 mg/mL,千分之一比例加入)的无机磷培养基上,每个梯度设置3个平板,28 ℃恒温培养3~4 d,挑选有明显溶磷圈的菌株转接到PDA培养基上进行纯化,获得纯化的单一菌株后接种到PDA试管,于4 ℃冰箱保藏备用。
1.4 溶磷特性研究
1.4.1 固体培养基上溶磷能力测定
将纯化后的菌株接种到无机磷培养基上,28 ℃恒温培养5 d后,检测其溶磷圈直径(D)与菌落直径(d),计算D/d值。
1.4.2 液体培养基上溶磷能力测定
将纯化后的菌株接种到PDA培养基上,28 ℃恒温培养,待孢子长满整个培养皿,加入10 mL无菌水,用涂布棒轻轻刮取孢子,再用灭菌的脱脂棉球过滤获得孢子悬液,重复冲洗1次滤渣,通过血球计数板检测孢子数量,用无菌水稀释至1 000万CFU/mL备用。
向装有100 mL无机磷液体培养基的锥形瓶中加入1 mL制备好的孢子悬液,置于28 ℃摇床中培养,分别于2、4、6、8、10、12、14 d吸取上清液,利用钼锑抗比色法检测上清液有效磷含量,使用pH计检测上清液pH值。
1.4.3 对不同磷源的溶解能力
分别以Ca3(PO4)2、AlPO4、FePO4作为无机磷液体培养基中的唯一无机磷源,检测菌株对不同难溶磷的溶解能力。向装有100 mL不同难溶磷源的液体培养基中加入1 mL制备好的孢子悬液(1 000万CFU/mL),置于28 ℃摇床中培养,8 d时吸取上清液,利用钼锑抗比色法检测其有效磷含量。
1.5 溶磷真菌的鉴定
将目标菌株接种到PDA液体培养基中,于 28 ℃、170 r/min摇床中培养2 d,收集菌丝,利用真菌提取试剂盒提取菌株总DNA,通过ITS1与ITS4引物扩增ITS片段,随后送生工生物工程(上海)股份有限公司测序,测序结果提交到NCBI进行BLAST比对,选取同源性98%以上的序列,运用MAGA 11.0软件构建系统发育树。
1.6 菌株耐盐能力及生物量的测定
分别向含0.5%、1%、2%、4%、6%、8%、10% NaCl的无机磷液体培养基中加入1 mL制备好的孢子悬液(1 000万CFU/mL),置于28 ℃恒温摇床中,170 r/min培养8 d,菌液经10 000 r/min、25 ℃离心10 min,吸取上清液,利用钼锑抗比色法检测有效磷含量,弃掉剩余上清液,菌体经65 ℃烘干至恒重,称量菌株生物量。
1.7 盆栽试验
供试土壤为普通东北田间黑土,采集土壤后分装至育苗盆中(上口17 cm,高14 cm),每盆2 kg黑土。供试种子为辽源市泉源种业有限公司购得的黄金糯一号,供试磷源为Ca3(PO4)2,添加量为1 g/kg(土壤)。将供试溶磷真菌接入PDA液体培养基中(放置少许玻璃珠),28 ℃、170 r/min振荡培养,3 d后开始取样,采用血球计数板计数,直到孢子数达 1亿CFU/mL。
试验分组:(1)CK1:不接菌,不加Ca3(PO4)2;(2)CK2:不接菌,加Ca3(PO4)2;(3)W10:加 Ca3(PO4)2,接种溶磷真菌W10;(4)W12:加 Ca3(PO4)2,接种溶磷真菌W12。
真菌培养液以10亿CFU/kg接种到土壤中,每盆播种4粒相对饱满的玉米种子,每组4个处理。播种后每隔3 d浇1次水,每10 d取1次土样检测有效磷含量,40 d后检测玉米幼苗的株高、叶面积、植株鲜重、干重、根部总鲜重与干重以及土壤含水量等指标。
1.8 土壤酶活性检测
土壤脲酶活性:采用土壤脲酶(S-UE)试剂盒[上海晶抗生物工程有限公司(货号:ml076937)]测定脲酶活性。土壤蔗糖酶活性:采用土壤蔗糖酶(S-SC)试剂盒[上海晶抗生物工程有限公司(货号:ml076925)]测定蔗糖酶活性。
1.9 数据分析
运用软件Graphpad Prism 5.0进行统计分析与作图。
2 结果与分析
2.1 溶磷真菌的筛选与鉴定
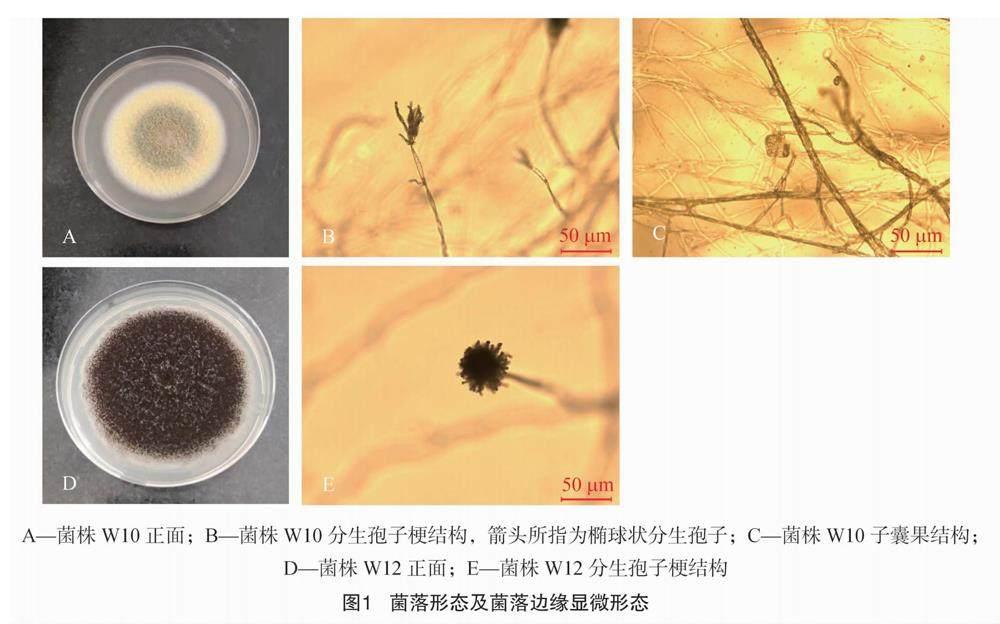
通过梯度稀释法从磷矿植物根际土壤中筛选得到具有溶解Ca3(PO4)2能力的溶磷真菌W10与W12。菌株W10于28 ℃培养箱中培养7 d后,菌落直径6.6 cm,生长速度较快,菌落表面平坦,边缘整齐,形成同心环绒状菌落,菌丝体在边缘为白色,中心呈黄绿色,同心圆中间部分呈玉米黄色,菌落背面呈浅黄色。由图1可知,W10有性繁殖期内产生类似“篮网”的子囊果結构,子囊果由1层紧密交织的菌丝组成,上面挂满了成熟的“果实”,为子囊孢子。菌丝表面产生扫帚状分生孢子梗,产椭球状分生孢子,符合篮状菌属真菌的形态学特征。菌株W12于28 ℃培养箱中培养7 d后,菌落直径 7.5 cm,生长速度快,形成黑色绒状菌落,菌丝体边缘为白色,菌落背面中心形成放射状褶皱。W12菌丝形成黑色球形的分生孢子梗结构,分生孢子顶部形似“菊花”,符合黑曲霉的形态学特征。
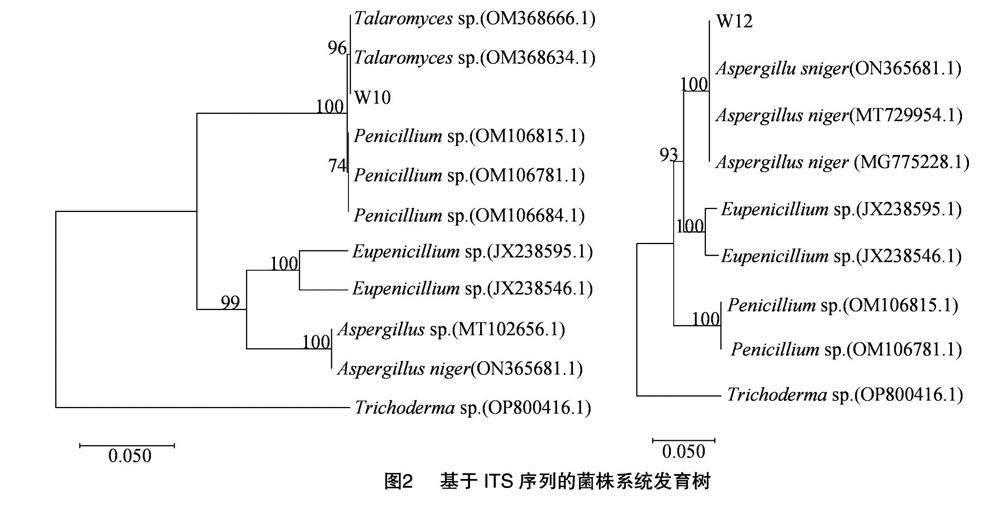
利用ITS rDNA特殊引物扩增得到560 bp左右的目的片段,通过BLAST软件进行序列比对,由图2结果显示,菌株W10与篮状菌属Talaromyces sp.的序列同源性高达99.94%,W12与黑曲霉Aspergillus niger的序列同源性高达99.82%。利用MEGA 11中的Neighbor-Joining方法构建系统发育树,结果表明,菌株W10与同属一个分支,菌株W12与同属一个分支,可信度均达到100%。结合形态学与ITS序列鉴定结果,菌株W10属于篮状菌属,菌株W12为曲霉属中的黑曲霉。
2.2 溶磷性能的研究
2.2.1 溶磷能力的测定
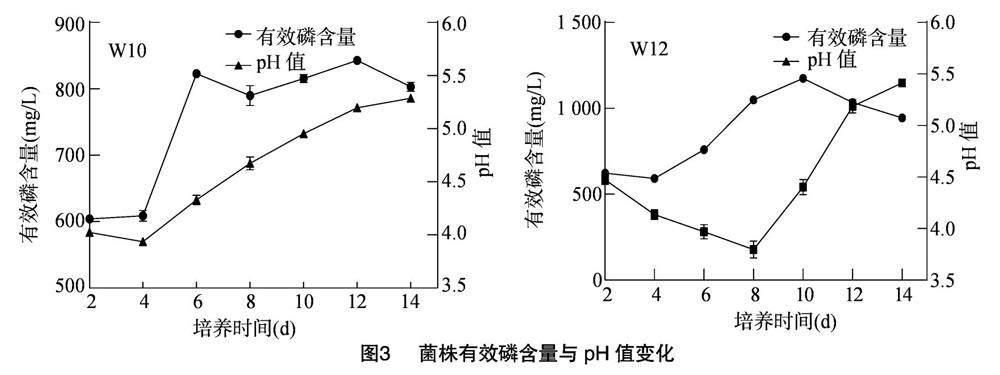
菌株接种到以Ca3(PO4)2为唯一磷源的无机磷固体培养基中,检测其溶磷圈直径(D)与菌落直径(d)比,W10的D/d为1.65,W12的D/d为1.4,具有明显的溶磷效果。菌株接种到以Ca3(PO4)2为唯一磷源的无机磷液体培养基中,每隔2 d检测一次培养基有效磷含量与pH值变化。由图3可知,菌株W10有效磷含量在6 d时达到第1个峰值(823.15 mg/L)后稍微有所下降,并在12 d时达到最高值(843.05 mg/L),呈现先升高后降低再升高最后降低的趋势,而pH值在4 d时达到最低值3.92后持续缓慢升高至5.30;菌株W12有效磷含量呈现先上升后降低的趋势,在10 d时达到最高值(1 187.09 mg/L),而pH值变化由8 d时达到最低值3.71后持续缓慢升高至5.44,呈现先降低后升高的趋势。
2.2.2 菌株对不同难溶磷的溶解能力
由图4结果显示,2株溶磷真菌均对Ca3(PO4)2的溶解力最强,菌株W10对Ca3(PO4)2的溶解量为789.22 mg/L,对AlPO4和FePO4的溶解量分别为105.25 mg/L与78.35 mg/L;菌株W12对Ca3(PO4)2的溶解量为 1 049.81 mg/L,对AlPO4和FePO4的溶解量分别为138.85 mg/L与278.35 mg/L。
2.3 菌株耐盐能力及生物量的测定
由图5可知,2株溶磷真菌溶磷能力和生物量均随NaCl含量的升高而降低,菌株W10在NaCl含量为2%和4%时仍有较强的溶解能力,有效磷含量
分别为684.22 mg/L和 645.52 mg/L,而生物量快速下降,由0.36 g下降至0.11 g,在NaCl含量超过4%时,W10对Ca3(PO4)2仅有轻微的溶解能力,几乎没有菌丝形成。菌株W12在NaCl含量为10%时仍有较强的溶解能力,有效磷含量为542.85 mg/L,生物量下降幅度缓慢,没有达到菌株的耐盐极限。
2.4 溶磷真菌盆栽试验研究
2.4.1 溶磷真菌对玉米幼苗促生效果的研究
由表1可见,施加溶磷菌株W10的玉米幼苗待生长至40 d时,其植株鲜重、干重以及叶面积均显著高于CK1和CK2(P<0.05),土壤含水率显著低于CK1和CK2;CK2的鲜重、干重以及叶面积均高于CK1,但两者间差异不显著。W10处理植株鲜重、干重、叶面积以及植物全磷含量与CK1相比分别增长0.86 g/株、0.21 g/株、11.25 cm2、0.93 mg/株,增幅达45.26%、52.50%、28.94%和36.61%;与CK2相比分别增长0.52 g/株、0.13 g/株、8.9 cm2、0.58 mg/株,增幅达23.21%、27.08%、21.59%、20.07%;W10处理土壤含水率与CK1和CK2相比分别降低26.00%和17.89%,W10处理株高与CK1、CK2差异不显著。对玉米幼苗施加菌株W12后,植株鲜重、干重、株高、叶面积、全磷含量均显著低于CK1和CK2,土壤含水率显著高于2个对照。
2.4.2 溶磷真菌对玉米幼苗根际土壤有效磷含量的影响
玉米幼苗根际土壤有效磷含量检测结果见表2。以Ca3(PO4)2为磷源的条件下,所有处理根际土壤有效磷含量均随着时间增长而增长,接种溶磷真菌的处理相比2个对照,土壤有效磷含量均显著增加。W10处理土壤有效磷含量相比CK1增长了61.66%~97.66%,相比CK2增长了 44.74%~56.62%,W12处理土壤有效磷含量相比CK1增长了29.90%~65.46%,相比CK2增长了16.29%~30.54%。
2.4.3 溶磷真菌对玉米幼苗根际土壤酶活性的影响
溶磷真菌对玉米幼苗根际土壤脲酶与蔗糖酶活性的影响见图6。可以看出,CK1、CK2、W10、W12处理的土壤脲酶活性分别为314.26、359.65、461.91、340.52 μg/g,菌株W10的土壤脲酶活性均显著高于CK1、CK2,增幅分别为46.98%和28.43%。CK1、CK2、W10、W12处理的土壤蔗糖酶活性分别为197.53、220.08、304.16、120.91 mg/g,菌株W10的蔗糖酶活性均显著高于CK1、CK2,增幅分别为53.98%和38.20%。由图6可知,菌株W12对脲酶活性无明显影响,对蔗糖酶活性甚至有抑制作用。
3 讨论与结论
溶磷微生物在植物生长过程中扮演着比较重要的角色,目前国内外关于溶磷微生物的研究在细菌方向占比较多,关于溶磷真菌的研究相对较少,而溶磷真菌的研究主要集中于青霉属和曲霉属,因此,寻找更多种类的溶磷真菌可以为微生物肥料的发展提供优质的菌种资源[5]。篮状菌(Talaromyces islandicus)是一类广泛分布于自然界的腐生真菌,除少数具有条件致病性外,大多数有益于人类的生产活动,已发现篮状菌有产抗菌物质、植物抗病抗逆、降解木质纤维素以及生产天然着色剂等功能[13]。Li等从海洋红藻组织中分离得到篮状菌EN-501,从该菌株培养提取物中分离出5种具有抗菌、抗氧化活性的蒽醌衍生物[14]。Madi等研究发现,黄篮状菌(T. flavus)可以减少葡萄球菌引起的豆茎腐病,并分泌抗大丽黄萎病的抗真菌物质[15]。篮状菌中有许多产纤维素酶的菌,如嗜松篮状菌(T. pinophilus)、绳状篮状菌(T. funiculosus)、产紫篮状菌(T. purpureogenus)、小疣篮状菌(T. verruculosus)等可以分泌大量纤维素酶降解植物残体中的木质纤维素,从而增强土壤肥力[16-17]。篮状菌大多产黄色和红色色素,其中,暗玫瑰篮状菌(T. atroroseus)和白双轮篮状菌(T. bobiverticillius)的某些菌株能够在产生色素的同时不产生任何真菌毒素,有可能应用到食用色素行业[18]。篮状菌的溶磷性能早有报道,尹小嫚等从杨树根部土壤中分离得到1株具有溶磷效果的黄篮状菌(T. flavus),其最大溶磷量为660.9 mg/L[19],本研究从磷矿土壤中分离得到1株篮状菌属的溶磷真菌W10,其最大溶磷量为 843.05 mg/L,溶磷效果对比同属的黄篮状菌较高。黑曲霉作为重要的工业发酵菌株,也是微生物肥料中的常用菌株,多用于土壤修复邻域[20]。本研究得到1株溶磷效果较好的黑曲霉W12,其最大溶磷量为1 187.09 mg/L。菌株W10与W12均对AlPO4和FePO4有一定的溶解量,虽较Ca3(PO4)2偏低,但對不同难溶磷均有溶解效果,且菌株W12对AlPO4和FePO4的溶解水平高于一般的溶磷真菌,如产红青霉的溶解量分别为95.99 mg/L和 75.39 mg/L,菌株W10与产红青霉的溶解效果相似[12]。菌株W10与W12在无机磷液体培养基中pH值均呈现先降低后升高的趋势,且在降低到最低值2 d后有效磷含量到达一个峰值,表明2株溶磷真菌的溶解机制为有机酸的酸解作用[21],而W10处理有效磷含量在6 d时达到峰值后呈现先降低又升高再降低的趋势,推测有可能为W10吸收部分有机酸后再次增殖溶解的效果。
土壤速效磷是植物可以直接吸收利用的磷,也是土壤肥力的体现。然而由于土壤环境的复杂性,很多溶磷菌在实验室环境下有较好的溶磷效果,接种到土壤后效果并不理想[22]。由此本研究设立盆栽试验,验证2株溶磷真菌对玉米幼苗的促生效果以及对土壤有效磷含量的作用,结果表明,相比CK1和CK2,菌株W10处理对玉米幼苗鲜重、干重、株高、叶面积以及植物全磷含量均有促进作用,也能显著促进植物对水分的吸收,土壤有效磷含量较CK2增长了55.95%。土壤酶是反映土壤肥力和微生物活动的重要指标,参与到土壤生态系统各种物质循环和生化过程中。土壤脲酶活性与土壤中微生物数量和氮素供应关系密切,蔗糖酶是有机碳转换过程的一种重要的水解酶,其活性与土壤中有机质含量、微生物数量及土壤呼吸强度密切相关,是评价土壤肥力的重要指标[23]。菌株W10处理相比CK2能够显著提升土壤脲酶与蔗糖酶的活性,从而增强土壤肥力,促进植物生长。篮状菌作为土壤中常见的腐生真菌,在环境、农业和医药等方面扮演着重要的角色,到目前为止国内已知报道的有57种,且主要分布在热带与亚热带地区,占比达90%,在东北等寒温带地区分布较少,本研究从东北地区磷矿土壤中分离得到1株篮状菌属的真菌,具有良好的溶磷特性,适度耐盐性,对玉米幼苗有明显的促生效果,且能有效提高土壤蔗糖酶与脲酶的活性,改善土壤肥力,有应用于农业微生物肥料的潜质,另一方面,也填补了东北寒温带地区关于篮状菌属的研究空白,具有较好的研究意义[13]。
目前,我国沿海地区土壤盐碱化问题比较严重,而关于高效耐盐的溶磷真菌研究较少。范延辉等从黄河三角洲地区盐生植物根部分离得到2株溶磷真菌Penicillium oxalicum F2和Aspergillus niger F19,其最高可耐受7%與9%的盐浓度[24]。本研究中菌株W10最高可承受4%的盐浓度,属中度耐盐菌,而菌株W12在盐浓度为10%的环境下仍有较好的溶磷效果,有效磷含量为542.85 mg/L,没有达到耐盐极限,有开发为盐碱地微生物肥料的潜力。
本研究从磷矿植物根部土壤中分离得到2株具有高效溶磷效果的真菌,经鉴定为篮状菌(Talaromyces sp.)W10和黑曲霉(Aspergillus niger)W12。2株真菌均对Ca3(PO4)2有很强的溶解能力,最高有效磷含量分别为843.05 mg/L和 1 187.09 mg/L,对AlPO4和FePO4的溶解能力低于Ca3(PO4)2,但菌株W12对AlPO4和FePO4的溶解能力强于一般溶磷菌株和W10。2株溶磷真菌均具有耐盐特性,W10最高可耐受4%的盐浓度,属中度耐盐菌,W12在10%的盐浓度下仍有很强的溶磷效果,没有达到耐盐极限,有开发为盐碱地微生物肥料的潜力。玉米盆栽试验表明,菌株W10能够显著提高土壤有效磷含量,促进玉米幼苗生长和增强土壤酶活性,改善土壤肥力,具有开发为溶磷微生物肥料的潜力。
参考文献:
[1]Kouas S,Labidi N,Debez A,et al. Effect of P on nodule formation and N fixation in bean[J]. Agronomy for Sustainable Development,2005,25(3):389-393.
[2]秦利均,杨永柱,杨星勇. 土壤溶磷微生物溶磷、解磷机制研究进展[J]. 生命科学研究,2019,23(1):59-64,86.
[3]Wen W J,Zhuang Y H,Zhang L,et al. Preferred hierarchical control strategy of phosphorus from non-point source pollution at regional scale[J]. Environmental Science and Pollution Research,2021,28(42):60111-60121.
[4]Chang C H,Yang S S. Thermo-tolerant phosphate-solubilizing microbes for multi-functional biofertilizer preparation[J]. Bioresource Technology,2009,100(4):1648-1658.
[5]许昌超,张俊涛,叶少萍,等. 土壤中一株溶磷青霉菌的分离鉴定及其应用效果研究[J]. 中国土壤与肥料,2020(6):272-278.
[6]Sang Y,Jin L,Zhu R,et al. Phosphorus-solubilizing capacity of Mortierella species isolated from rhizosphere soil of a poplar plantation[J]. Microorganisms,2022,10(12):2361.
[7]Wang X L,Qiu S Y,Zhou S Q,et al. Phosphate-solubilizing capacity of Paecilomyces lilacinus PSF7 and optimization using response surface methodology [J]. Microorganisms,2023,11(2):454.
[8]Bononi L,Chiaramonte J B,Pansa C C,et al. Phosphorus-solubilizing Trichoderma spp.from Amazon soils improve soybean plant growth[J]. Scientific Reports,2020,10:2858.
[9]Wang L Y,Guan H,Hu J,et al. Aspergillus niger enhances organic and inorganic phosphorus release from wheat straw by secretion of degrading enzymes and oxalic acid[J]. Journal of Agricultural and Food Chemistry,2022,70(35):10738-10746.
[10]Vessey J K,Heisinger K G. Effect of Penicillium bilaii inoculation and phosphorus fertilisation on root and shoot parameters of field-grown pea[J]. Canadian Journal of Plant Science,2001,81(3):361-366.
[11]尚晓静,侯 瑞,徐芳玲,等. 2株蓝莓溶磷内生真菌的筛选、鉴定及溶磷效果评价 [J]. 江苏农业科学,2022,50(20):246-252.
[12]李 静,艾加敏,余天飞,等. 一株溶磷真菌的鉴定及其促生特性研究[J]. 福建农业学报,2021,36(10):1224-1230.
[13]孙剑秋,阮永明,金世宇,等. 篮状菌属的重要性及其分类学研究概况[J]. 菌物研究,2021,19(2):83-93.
[14]Li H L,Li X M,Li X,et al. Antioxidant hydroanthraquinones from the marine algal-derived endophytic fungus Talaromyces islandicus EN-501[J]. Journal of Natural Products,2017,80(1):162-168.
[15]Madi L,Katan T,Katan J,et al. Biological control of Sclerotium rolfsii and Verticillium dahliae by Talaromyces flavus is mediated by different mechanisms[J]. Phytopathology,1997,87(10):1054-1060.
[16]Fujii T,Hoshino T,Inoue H,et al. Taxonomic revision of the cellulose-degrading fungus Acremonium cellulolyticus nomen nudum to Talaromyces based on phylogenetic analysis[J]. FEMS Microbiology Letters,2014,351(1):32-41.
[17]Morozova V V,Gusakov A V,Andrianov R M,et al. Cellulases of Penicillium verruculosum[J]. Biotechnology Journal,2010,5(8):871-880.
[18]Frisvad J C,Yilmaz N,Thrane U,et al. Talaromyces atroroseus,a new species efficiently producing industrially relevant red pigments[J]. PLoS One,2013,8(12):e84102.
[19]尹小嫚,談家金,方爱琴. 1株黄蓝状菌(Talaromyces flavus)SH16解磷特性的测定 [J]. 南京林业大学学报(自然科学版),2017,41(5):169-174.
[20]隋雨菲,欧阳立明,鲁洪中,等. 黑曲霉组学研究进展[J]. 生物工程学报,2016,32(8):1010-1025.
[21]刘胜亮,朱舒亮,祁先慧,等. 四株解磷菌分泌有机酸与溶解磷酸三钙能力的研究[J]. 新疆农业科学,2017,54(6):1114-1121.
[22]Gyaneshwar P,Naresh Kumar G,Parekh L J,et al. Role of soil microorganisms in improving P nutrition of plants[J]. Plant and Soil,2002,245(1):83-93.
[23]丁少男,薛 萐,刘国彬. 施肥处理对黄土丘陵区农田土壤酶活性和水溶性有机碳、氮的影响[J]. 农业环境科学学报,2015,34(11):2146-2154.
[24]范延辉,王 君,尚 帅,等. 两株根际真菌的耐盐、溶磷、促生效果及其分类鉴定 [J]. 土壤通报,2022,53(1):127-134.
