丁酸梭菌对钝吻黄盖鲽幼鱼生长性能、肠道结构和肠道菌群的影响
2024-06-03徐晓莹史文凯张宁卢波李秀梅张晓明刘蓬
徐晓莹 史文凯 张宁 卢波 李秀梅 张晓明 刘蓬

摘 要:为研究丁酸梭菌对钝吻黄盖鲽(Pseudopleuronectes yokohamae)幼鱼生长和肠道健康的影响,选取体长(10.28±0.08)cm、体质量(13.72±0.90)g的钝吻黄盖鲽幼鱼共180尾,随机分为试验组(饲料中添加丁酸梭菌菌液)和对照组,开展了为期42 d的饲养对比试验,采用体尺性状测量、肠道组织切片观察和高通量测序等方法,分析了饲料中添加丁酸梭菌菌液对钝吻黄盖鲽生长性能、肠道结构和肠道菌群的影响。试验结果显示,与对照组相比,试验组幼鱼的增重率、特定生长率和肥满度均显著提高(P<0.05),饲料系数显著降低(P<0.05);肠道组织的绒毛长度极显著增加(P<0.01),绒毛宽度显著增加(P<0.05)。高通量测序结果显示,在门和属水平上,试验组和对照组均表现出不同程度的差异;饲料中添加丁酸梭菌可以增加钝吻黄盖鲽幼鱼肠道中潜在有益菌的数量,促进肠道分解、代谢饲料的功能。结果表明,饲料中添加丁酸梭菌能提高钝吻黄盖鲽幼鱼的生长性能,改善其肠道结构,调节肠道菌群的比例,促进肠道健康。
关键词:丁酸梭菌;钝吻黄盖鲽;生长性能;肠道结构;肠道菌群
益生菌是一种绿色、健康的微生态制剂,可作为饲料添加剂应用于水产养殖中,有助于改善水产动物生长性能,提高饲料利用率,抑制病原微生物,减少抗生素的使用,现已成为水产病害防控的重要手段[1]。丁酸梭菌(Clostridium butyricum)又名酪酸菌,是一种芽孢杆菌科的革兰氏阳性厌氧菌[2],其代谢产物丁酸是肠道上皮组织细胞再生和修复的主要能量来源,可修复肠道结构,调节肠道微生态环境[3-4]。研究表明,丁酸梭菌可促进凡纳滨对虾(Litopenaeus vannamei)[5]、鲤(Cyprinus carpio)[6]、虹鳟(Oncorhynchus mykiss)[7]等多种水产动物的生长和肠道健康[8]。
钝吻黄盖鲽(Pseudopleuronectes yokohamae)隶属于鲽形目、鲽科、黄盖鲽属[9],是我国黄、渤海海域鲆鲽类主要经济品种之一[10]。该鱼肉质细嫩,营养价值高,为传统名贵鱼类[11]。近年来,随着钝吻黄盖鲽集约化养殖的发展,养殖规模不断扩大,对生物饲料的需求量也日益增加,但有关益生菌在钝吻黄盖鲽养殖中的应用研究还相对较少。本研究通过开展饲养对比试验,采用性状测量、肠道组织切片观察和高通量测序等方法,分析饲料中添加丁酸梭菌对钝吻黄盖鲽生长性能、肠道组织结构、肠道菌群等的影响,以期为钝吻黄盖鲽养殖过程中新型饲料的开发提供数据支撑。
1 材料和方法
1.1 试验材料
试验用钝吻黄盖鲽为烟台宗哲海洋科技有限公司自繁自育的健康鱼种,平均体长为(10.28±0.08)cm,平均体质量为(13.72±0.90)g。配合饲料为仔稚鱼育苗专用饲料,购自青岛赛格林生物工程有限公司,其常规营养成分(按质量分数)为:粗蛋白质52%、粗脂肪8%、粗灰分17%、粗纤维8%和水分12%。丁酸梭菌为“优肠健”牌,购自青岛海芙特生态科技有限公司,丁酸梭菌含量为1×109 CFU/g。
1.2 试验设计
选取健康且规格整齐的钝吻黄盖鲽180尾,随机分为两组:配合饲料组(CF组,即对照组),丁酸梭菌组(PF组,即试验组)。每组设3个重复,每个重复30尾鱼。将各组鱼分别放入120 L的塑料水族箱中饲养。试验水温为15 ℃,盐度为24~30,每天吸污并更换30%的水以保证水质。
试验期间,每日投饲2次,上午7:30和下午16:30各投1次,其中CF组仅投喂配合饲料,PF组则投喂添加了丁酸梭菌的配合饲料,每次投饲量为鱼体质量的1%。PF组饲料的配制方法是:将丁酸梭菌溶解于蒸馏水中,然后均匀喷洒在配合饲料上,完成后于4 ℃冰箱中保存备用。丁酸梭菌添加量为配合饲料量的0.3%(质量分数,实际含量为3×109 CFU/kg)[12]。
试验开始时称取每尾鱼的体质量,试验期间每半个月测量1次试验鱼的体质量,并根据鱼体质量调整投饲量,记录每组鱼的摄食量。养殖试验周期为42 d。
1.3 测定指标及方法
1.3.1 生长性能
试验结束后,称量前停食24 h,分别从各组随机抽取10尾试验鱼进行体尺性状测量,并根据以下公式计算各项生长性能指标。
RWG=100%×(Wt-W0)/W0(1)
RSG=100%×(lnWt-lnW0)/t(2)
RFC=F/(Wt-W0) (3)
CF=100×Wt/L3 (4)
式(1)~(4)中:RWG為增重率(%),Wt为终末体质量(g),W0为初始体质量(g),RSG为特定生长率(%/d),t为试验天数(d),RFC为饲料系数,F为试验期内的摄食量(g),CF为肥满度,L为试验结束时鱼的体长(cm)。
1.3.2 肠道结构
试验结束后停食24 h,从各组随机抽取3尾鱼,解剖取出肠道并于体积分数为4%的多聚甲醛溶液中固定。固定的肠道组织样品交由生工生物工程(上海)股份有限公司进行浸蜡包埋、冷冻切片和HE染色。对染色后的组织切片进行显微镜观察和图像采集,并利用Image-Pro Plus 6.0软件测量肠道组织的绒毛长度、绒毛宽度和肌层厚度。
1.3.3 肠道菌群
1.3.3.1 肠道菌群DNA提取与PCR扩增
饲养试验结束后,分别从各组随机取9尾鱼,解剖取出完整鱼肠道,并将肠道内容物挤出,将3尾鱼的肠道内容物作为1个混合样品放入冻存管中,用液氮速冻保存待测。肠道样品基因组DNA的提取和测序由生工生物工程(上海)股份有限公司完成。以提取的肠道样品基因组DNA为模板,以特异引物341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)扩增16S rDNA的V3+V4区,构建测序文库后在Illumina平台PE250上机测序。
1.3.3.2 肠道菌群生物信息分析
下机数据使用FLASH 1.2.7软件对样品的数据(reads)进行拼接、过滤,得到高质量的标签数据(clean tags),参照QIIME流程对clean tags进行质控,得到有效数据(effective tags)[13]。用Uparse 7.0.1001软件对所有样品的全部effective tags进行聚类分析,以97%的一致性将序列聚类成为可操作分类单元(OTUs),并对OTUs进行Chao1、ACE、Shannon和Simpson等多种多样性指数分析以及Alpha多样性和Beta多样性指数组间差异分析[14]。
1.3.4 数据统计与分析
试验数据以平均值±标准差表示。采用SPSS 19.0软件对数据进行样本t检验。设显著性水平為0.05,极显著水平为0.01。
2 结果和分析
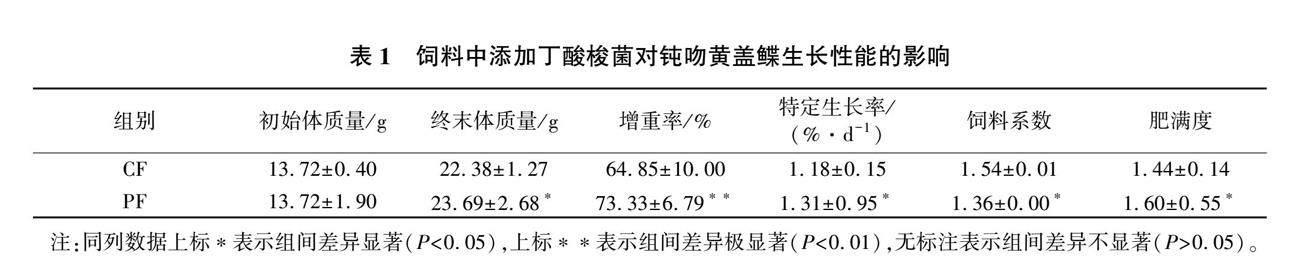
2.1 添加丁酸梭菌对钝吻黄盖鲽幼鱼生长性能的影响
由表1可见,在配合饲料中添加丁酸梭菌有效促进了钝吻黄盖鲽的生长,降低了饲料系数。PF组鱼的终末体质量、增重率、特定生长率、肥满度均显著高于CF组(P<0.05),其中增重率达到极显著水平(P<0.01),PF组的饲料系数也显著低于CF组(P<0.05)。
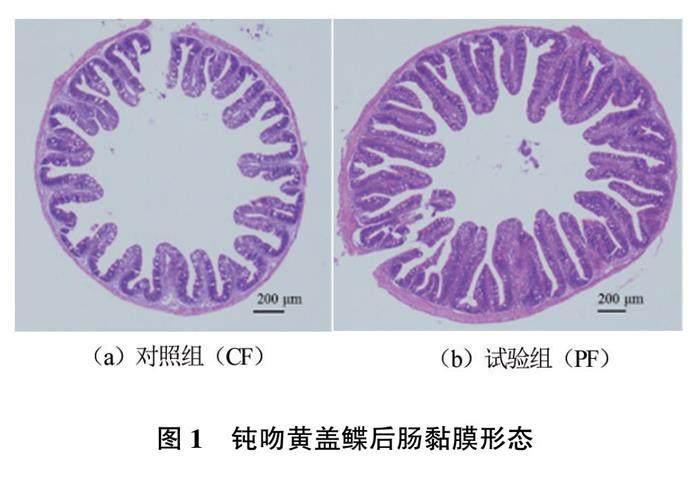
2.2 添加丁酸梭菌对钝吻黄盖鲽幼鱼肠道结构的影响
试验组和对照组钝吻黄盖鲽幼鱼的后肠切片显微观察见图1。由图1可见,试验组(PF组)鱼的肠道绒毛致密且较长,而对照组(CF组)鱼的肠道绒毛稀疏且长度较短。结合肠道黏膜形态数据(见表2)可以看出,饲料中添加丁酸梭菌后,显著提高了钝吻黄盖鲽肠道绒毛长度和绒毛宽度(P<0.05),且两个组的肠道绒毛长度差异达到极显著水平(P<0.01)。
2.3 钝吻黄盖鲽肠道菌群多样性分析
由图2样本间物种分布韦恩(Venn)图可知,3组钝吻黄盖鲽肠道样品产生的OTUs数目在418~445,对照组和试验组共有OUTs为161个,对照组特有OUTs为284个,试验组特有OUTs为257个。结合Alpha多样性分析结果(见表3),对照组钝吻黄盖鲽肠道菌群的Chao1、Ace、Shannon指数均高于试验组,Simpson指数低于试验组,说明试验组钝吻黄盖鲽肠道菌群多样性降低了。
2.4 钝吻黄盖鲽肠道菌群结构组成分析
钝吻黄盖鲽肠道菌群物种丰富度见图3所示。在门水平上,PF组钝吻黄盖鲽肠道中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和异常球菌-栖热菌门(Deinococcus-Thermus)的丰度高于CF组,而厚壁菌门(Firmicutes)丰度低于CF组。在属水平上,PF组钝吻黄盖鲽肠道中微杆菌属(Microbacterium)、异常球菌属(Deinococcus)、紫色杆菌属(Janthinobacterium)等的丰度高于CF组,CF组特有的菌群为乳球菌属(Lactococcus)。
3 讨论
3.1 丁酸梭菌对钝吻黄盖鲽生长性能的影响
丁酸梭菌作为有益菌添加于水产饲料中可提高水产动物的生长性能[8]。樊英等[7]在虹鳟(Oncorhynchus mykiss)幼鱼饲料中添加丁酸梭菌,经40 d的饲喂试验后,虹鳟幼鱼的特定生长率显著提高,饲料系数显著降低。Zhang等[13]在罗非鱼(Oreochromis niloticus)饲料中添加不同浓度的丁酸梭菌,结果发现,添加量为1.5×1011 CFU/kg时,罗非鱼生长性能最佳。本研究中,42 d的饲养对比试验结果表明,添加丁酸梭菌组钝吻黄盖鲽的增重率、特定生长率显著高于未添加的对照组,而饲料系数显著低于对照组。本研究中丁酸梭菌的促生长作用可能与其代谢产物丁酸有关,丁酸可为结肠黏膜细胞提供主要能量,并为肠道细胞的增殖与成熟提供重要保障[7]。
3.2 丁酸梭菌对钝吻黄盖鲽肠道结构的影响
健康的肠道结构是营养物质消化和吸收的保障。研究表明,丁酸梭菌代谢产物丁酸对肠道黏膜损伤具有修复作用[14]。丁酸是肠道上皮组织细胞再生的主要营养物质,可增加肠上皮细胞的数量,使绒毛长度增加,从而改善肠道形态结构[15]。潘晓东等[16]研究表明,在饲料中添加丁酸梭菌后,鱼免鱼(Miichthysmiiuy)肠绒毛明显增长、致密,且肠绒毛上出现了大量的横向分叉。本研究中,试验组钝吻黄盖鲽肠道绒毛的长度和宽度比对照组分别增加了59.26%和48.47%,进一步说明丁酸梭菌可促进肠道发育,使肠绒毛增长,增加肠道吸收表面积,从而促进钝吻黄盖鲽对饲料营养的吸收。
3.3 丁酸梭菌对钝吻黄盖鲽肠道菌群变化的影响
益生菌常用于添加到基础日粮中以改善养殖动物肠道的微生态平衡。吴杨等[17]研究表明,在卵形鲳鲹(Trachinotus ovatus)饲料中添加适量丁酸梭菌能显著提高卵形鲳鲹肠道菌群的多样性。类似的结论也在樊英等[7]对虹鳟(Oncorhynchus mykiss)的研究中得到验证。另有研究表明,丁酸梭菌能够抑制不耐酸致病菌在鱼肠道上皮的黏附[18]。在体外试验中,丁酸梭菌也表现出对致病菌的抑制作用[19]。本研究中,添加丁酸梭菌试验组的OUTs数量相对较少,结合Chao1、Ace、Simpson、Shannon指数变化,丁酸梭菌降低了钝吻黄盖鲽肠道菌群的多样性,究其原因,可能是高浓度丁酸梭菌通过竞争作用在一定程度上抑制了一些细菌的生长繁殖。另有研究表明,丁酸梭菌能够显著提高养殖动物肠道内溶菌酶的活性[20-21],高活性的溶菌酶也可能是导致肠道菌群多样性降低的原因之一。
本试验通过测序结果发现,钝吻黄盖鲽肠道中的优势菌门为变形菌门和放线菌门。变形菌门是中国沿海地区养殖水体的优势菌门[22],能分解代谢饲料中的营养成分[23]。本试验中,PF组变形菌门丰度增加可能有利于钝吻黄盖鲽对饲料中营养成分的吸收。放线菌门中的许多种类属于潜在的益生菌[24],可产生次级代谢产物,通过干扰病原菌的代谢对病原菌产生直接的抑制和致死作用[25]。本试验中,PF组钝吻黄盖鲽肠道中放线菌门丰度高于CF组,可能与丁酸梭菌能够有效增加水产动物肠道中潜在的有益菌有关[26]。在属水平上,钝吻黄盖鲽肠道优势菌属为微杆菌属和巨型球菌属。微杆菌是潜在的有益菌,能参与多种碳水化合物的代谢,提供能量[27]。CF组中微杆菌属比例增加,说明添加外源丁酸梭菌增加了钝吻黄盖鲽肠道中有益菌的数量。投喂丁酸梭菌的PF组试验鱼肠道菌群中未检测到梭菌属的分布,这可能是由于养殖周期短,导致丁酸梭菌在钝吻黄盖鲽肠道菌群中占比较低或并未在肠道内定植。但也有研究表明,丁酸梭菌是否在水产动物肠道内定植不影响其有益作用的发挥[28],即使是死亡或失去活性的丁酸梭菌也能在水产动物肠道内发挥益生作用,维持肠道健康[29]。本研究中,乳球菌属为CF组特有的菌群。有研究表明,乳球菌可提高日本牙鲆的生长速度以及溶菌酶、抗蛋白酶、血清过氧化物酶及血液的呼吸暴发活性[30]。本研究中PF组未检测到乳球菌属的分布,可能与投喂丁酸梭菌后,丁酸梭菌浓度过高抑制了特定有益菌的生长有关[31]。因此,丁酸梭菌在钝吻黄盖鲽中饲料中的最佳添加浓度还有待进一步研究试验。
4 结论
饲料中添加丁酸梭菌可显著提高钝吻黄盖鲽的生长性能,改善其肠道组织结构。丁酸梭菌可调节钝吻黄盖鲽肠道中菌群的比例和结构,进而促进肠道健康。
参考文献
[1]吴豪益,林晨,傅玲琳,等.益生菌在现代水产养殖中的应用研究进展[J].饲料工业,2020,41(22):48-51.
[2]LIU L,ZENG D,YANG M Y,et al.Probiotic Clostridium butyricum improves the growth performance,immune function,and gut microbiota of weaning rex rabbits[J].Probiotics and Antimicro-bial Proteins,2019,11(4):1278-1292.
[3]余榮,徐小芳,王雯熙.丁酸对动物肠道影响的研究进展[J].中国畜牧杂志,2012,48(16):64-68.
[4]于卓腾,杭苏琴,姚文,等.肠道产丁酸细菌及其丁酸产生机制的研究进展[J].世界华人消化杂志,2006,14(25):2531-2534.
[5]DUAN Y F,ZHANG Y,DONG H B,et al.Effect of dietary Clostridium butyricum on growth,intestine health status and resistance to ammonia stress in Pacific white shrimp Litopenaeus vannamei[J].Fish & Shellfish Immunology,2017,65:25-33.
[6]MENG X L,WU S K,HU W P,et al.Clostridium butyricum improves immune responses and remodels the intestinal microbiota of common carp (Cyprinus carpio L.)[J].Aquaculture,2021,530:735753.
[7]樊英,叶海斌,王晓璐,等.丁酸梭菌和凝结芽孢杆菌对虹鳟生长性能、肝功能及肠道菌群的影响[J].大连海洋大学学报,2019,34(2):198-203.
[8]徐亚飞,钱希逸.复合丁酸梭菌发酵饲料及其在水产养殖中的应用前景[J].当代水产,2022,47(2):70-71.
[9]李思忠,王惠民.中国动物志:硬骨鱼纲 鲽形目[M].北京:科学出版社,1995.
[10]李秀梅,张宁,李丁军,等.黄盖鲽活体种质资源保存关键技术研究[J].中国水产,2021(7):66-69.
[11]代文汇,李秀梅,张宁.黄盖鲽速生新品系选育[J].养殖与饲料,2018(4):14-16.
[12]王海瑞,莫文艳,赵红霞,等.饲料添加丁酸梭菌对黄颡鱼生长性能及血清生化指标、免疫功能和抗氧化能力的影响[J].动物营养学报,2022,34(8):5295-5303.
[13]ZHANG M Q,DONG B,LAI X X,et al.Effects of Clostridium butyricum on growth,digestive enzyme activity,antioxidant capacity and gut microbiota in farmed tilapia(Oreochromis niloticus)[J].Aquaculture Research,2021,52(4):1573-1584.
[14]POOLSAWAT L,LI X Q,HE M,et al.Clostridium butyricumas probiotic for promoting growth performance,feed utilization,gut health and microbiota community of tilapia(Oreochromis niloticus× O.aureus) [J].Aquaculture Nutrition,2020,26(3):657-670.
[15]胡文攀,朱振祥,李克克.丁酸梭菌的生物学功能及在水产养殖中的应用[J].当代水产,2022,47(1):76-77.
[16]潘晓东,吴天星,宋增幅,等.丁酸梭菌对鮸鱼肠粘膜结构及肠内短链脂肪酸的影响[D]//第四届第十次全国学术研讨会暨动物微生态企业发展战略论坛论文集(上册).2010:147-151.
[17]吴杨,杨铿,黄小林,等.饲料中添加丁酸梭菌对卵形鲳鲹幼鱼生长性能和肠道菌群的影响[J].南方水产科学,2022,18(3):155-162.
[18]GAO Q X,XIAO Y P,SUN P,et al.In vitro protective efficacy of Clostridium butyricum against fish pathogen infections[J].Indian Journal of Microbiology,2013,53(4):453-459.
[19]WOO T D H,OKA K,TAKAHASHI M,et al.Inhibition of the cytotoxic effect of Clostridium difficile in vitro by Clostridium butyricum MIYAIRI 588 strain[J].Journal of Medical Microbiology,2011,60(11):1617-1625.
[20]FOYSAL M J,NGUYEN T T T,CHAKLADER M R,et al.Marked variations in gut microbiota and some innate immune responses of fresh water crayfish,marron(Cherax cainii,Austin 2002) fed dietary supplementation of Clostridium butyricum[J].PeerJ,2019,7:7553.
[21]JAMI M J,ABEDIAN KENARI A,PAKNEJAD H,et al.Effects of dietary b-glucan,mannan oligosaccharide,Lactobacillus plantarum and their combinations on growth performance,immunity and immune related gene expression of Caspian trout,Salmo trutta caspius (Kessler,1877)[J].Fish & Shellfish Immunology,2019,91:202-208.
[22]LIU M,DONG Y,ZHANG W C,et al.Diversity of bacterial community during spring phytoplankton blooms in the central Yellow Sea[J].Canadian Journal of Microbiology,2013,59(5):324-332.
[23]ROESELERS G,MITTGE E K,STEPHENS W Z,et al.Evidence for a core gut microbiota in the zebrafish[J].The ISME Journal,2011,5(10):1595-1608.
[24]杜瑞,王梦歌,彭金金,等.环境未培养微生物中新型抗生素的发掘研究进展[J].生物加工过程,2022,20(2):172-181.
[25]汪夕芳.动植物来源内生菌次级代谢产物成分及抗菌活性研究[D].广州:中山大学,2007.
[26]TIAN L,ZHOU X Q,JIANG W D,et al.Sodium butyrate improved intestinal immune function associated with NF-κB and p38MAPK signalling pathways in young grass carp (Ctenopharyngodon idella)[J].Fish & Shellfish Immunology,2017,66:548-563.
[27]CHEN M,CHEN X Q,TIAN L X,et al.Improvement of growth,intestinal short-chain fatty acids,non-specific immunity and ammonia resistance in Pacific white shrimp(Litopenaeus vannamei) fed dietary water-soluble chitosan and mixed probiotics[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2020,236:108791.
[28]DUAN Y F,WANG Y,DONG H B,et al.Changes in the intestine microbial,digestive,and immune-related genes of Litopenaeus vannamei in response to dietary probiotic Clostridium butyricum supplementation[J].Frontiers in Microbiology,2018,9:2191.
[29]IRIANTO A,AUSTIN B.Use of dead probiotic cells to control furunculosis in rainbow trout,Oncorhynchus mykiss(Walbaum)[J].Journal of Fish Diseases,2003,26(1):59-62.
[30]HEO W S,KIM Y R,KIM E Y,et al.Effects of dietary probiotic,Lactococcus lactis subsp.lactis I2,supplementation on the growth and immune response of olive flounder(Paralichthys olivaceus)[J].Aquaculture,2013,376/377/378/379:20-24.
[31]茹媛媛.乳酸乳球菌影響红螯螯虾生长和免疫性能及其肠道菌群的研究[D].泰安:山东农业大学,2021.
Effects of Clostridium butyricum on growth performance, intestinal morphology and bacterial diversity of Pseudopleuronectes yokohamae
XU Xiaoying1, SHI Wenkai1, ZHANG Ning2, LU Bo1, LI Xiumei2, ZHANG Xiaoming1,LIU Peng1
(1. Yantai Marine Economic Research Institute,Yantai 264003,China; 2. Yantai Zongzhe Ocean Technology Co.,LTD,Yantai 265617,China)
Abstract: In order to study the effects of dietary Clostridium butyricum supplementation on the growth and intestinal health of juvenile Pseudopleuronectes yokohamae,a total of 180 juveniles of P. yokohamae with the average body length of (10.28±0.08)cm and average body weight of (13.72±0.90)g were randomly divided into the experimental group(dietary C. butyricum liquid supplemented treatment) and the control group,and a 42-day culture experiment was carried out.Body size measurement, intestinal tissue section observation and high-throughput sequencing were used to study the effects of C. butyricum solution on the growth performance,intestinal structure and intestinal flora of P. yokohamae.The results showed that the weight gain rate(P<0.01),specific growth rate(P<0.05) and fullness(P<0.05) of juveniles in the experimental group were significantly increased,and the feed coefficient ratio(P<0.05) was significantly decreased,when compared to the control group.The length(P<0.01) and width(P<0.05) of villi were also significantly increased in the intestinal tissue of experimental group.The results of Illumina MiSeq sequencing showed that the experimental group and the control group showed different degrees of differences at the phylum and genus levels.C. butyricum can increase the number of potentially beneficial bacteria in the intestinal tract of P. yokohamae,and promote the function of intestinal breakdown and metabolism of feed.The results showed that the addition of C. butyricum to the feed could improve the growth performance,improve the intestinal structure,regulate the proportion of intestinal flora,and promote intestinal health of juveniles P. yokohamae.
Key words: Clostridium butyricum; Pseudopleuronectes yokohamae; growth performance; intestinal morphology; bacterial diversity
