甘薯耐盐性研究进展
2024-06-03郭慧慧潘祥华蒋元斌林丛发徐绍翔
郭慧慧 潘祥华 蒋元斌 林丛发 徐绍翔

摘要:甘薯是世界上重要的粮食、饲料及工业原料作物,具有适应性强、产量高等优良特性。了解甘薯在盐胁迫条件下的耐盐机制,筛选耐盐种质资源,培育耐盐品种,对提高盐碱地利用率具有重要的实践意义。本文主要从甘薯耐盐种质资源筛选与鉴定、耐盐性评价指标、耐盐性相关基因挖掘以及提高耐盐性的途径等4个方面,综述了近年来甘薯耐盐相关的研究进展。在甘薯耐盐种质资源筛选与鉴定方面,总结了目前已报道的强耐盐、中度耐盐、弱耐盐及盐敏感甘薯种质资源。在耐盐性评价上,将众多指标归结为形态学指标和生理生化指标两大类。在耐盐性相关基因挖掘上,总结了参与盐胁迫响应的基因,如C2结构域脱落酸相关基因IbCAR1、磷脂酰丝氨酸合成酶基因IbPSS1、蔗糖非发酵-1-相关蛋白激酶-1基因IbSnRK1、甘薯R2R3-MYB基因IbMYB308、海藻糖-6-磷酸合成酶(TPS)基因IbTPS等。在提高耐盐性的途径上,总结了现阶段常采用的2种方法,即施用外源物质及培育耐盐品种。目前甘薯的耐盐性在生理代谢、耐盐基因挖掘等研究中取得诸多成果,但在提高甘薯耐盐性途径上研究较少。针对这个问题,本文提出了相应的解决方法,以期为今后开展甘薯耐盐性研究、培育耐盐性强及综合性状优的甘薯品种提供理论参考。
关键词:甘薯;种质资源;耐盐基因;盐胁迫;耐盐品种
中图分类号:S531.01 文献标志码:A
文章编号:1002-1302(2024)08-0023-08
收稿日期:2023-07-07
基金项目:福建省科技计划(编号:2020N0077)。
作者简介:郭慧慧(1989—),女,福建福安人,硕士,助理研究员,主要从事甘薯遗传育种研究。E-mail:pansyg12@163.com。
通信作者:潘祥华,研究员,主要从事作物遗传育种研究。E-mail:pxh6681@126.com。
盐胁迫是一种重要的非生物胁迫类型,可同时对植物细胞造成离子毒害及渗透胁迫,严重影响作物的生长和产量[1]。据联合国教科文组织和联合国粮农组织不完全统计,盐碱地面积占世界陆地总面积的5.9%以上[2]。除现有盐碱地外,气候变化、过度灌溉等因素导致耕地二次盐碱化持续进行[3]。据推测,到2050年世界上大约50%的可耕地将面临盐渍化问题[4]。我国盐渍地面积99万km2,其中,约12.3万km2具有农业利用潜力且尚未开发而处于荒芜状态[5]。目前盐碱地改良措施有建立盐渍排水工程、使用生物炭等改良剂、接种根际促生菌、种植耐盐适生作物等[6-10]。其中,种植耐盐适生作物是最经济最有效的措施。甘薯[Ipomoea batatas (L.) Lam.]根系发达,茎蔓不定根的再生能力强,表现出很强的抗逆境能力。我国已筛选出许多强耐盐的甘薯品种,如济薯26、济徐23、苏薯15号、宁薯192、南薯1号等。本文从甘薯耐盐种质资源筛选、耐盐评价指标、耐盐基因挖掘及提高耐盐性的途径等方面综述了甘薯耐盐性研究进展,旨在为今后甘薯耐盐研究和新品种选育提供参考。
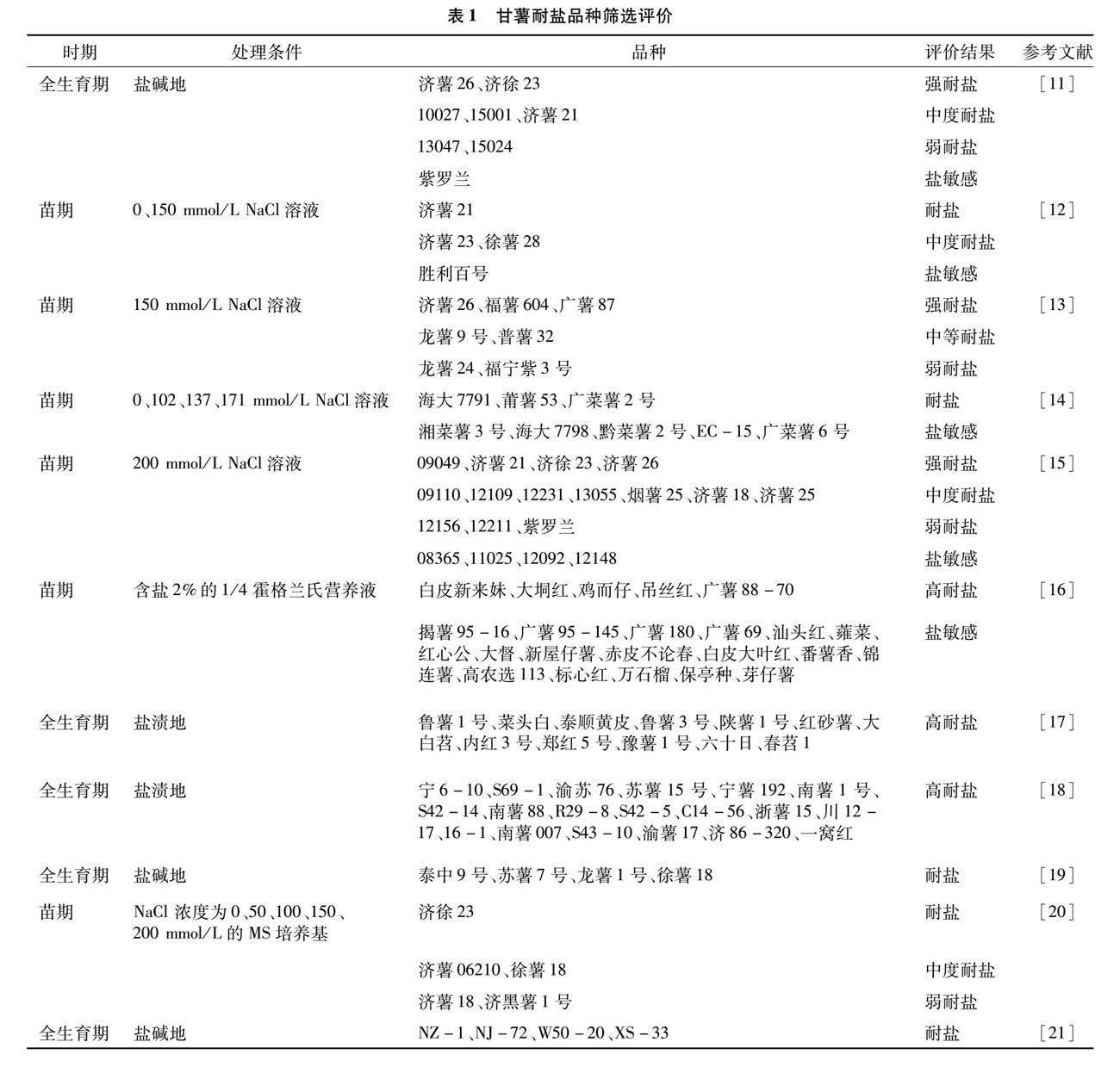
1 甘薯耐盐种质资源筛选与鉴定
近年来,国内外研究者先后筛选得到一些甘薯耐盐和盐敏感种质(表1)。其中,段文学等对8个甘薯品种(系)进行田间耐盐性比较研究,测定了块根产量、叶片K+含量/Na+含量、块根干重等指标,筛选出强耐盐种质2份[11]。王灵燕等通过比较4个甘薯品种的幼苗黄叶率、植株死亡率、盐害率等指标,筛选出1份耐盐种质[12]。崔纪超等运用盆栽试验法比较7个甘薯品种苗期耐盐性,鉴定出济薯26、福薯604和广薯87为强耐盐种质[13]。黄婷用137 mmol/L NaCl溶液胁迫检测8个菜用甘薯品种的耐盐性,鉴定出3个耐盐种质[14]。段文学等通过苗期盐土栽培胁迫方式,将18个甘薯品种(系)划分为4种耐盐类型[15]。李育军等对109个甘薯品种资源进行耐盐筛选,鉴定出5个高耐盐品种和18个盐敏感品种[16]。郭小丁等对240个甘薯品種进行了耐盐性鉴定,筛选出12个高耐盐品种[17]。马佩勇等通过比较200份甘薯材料的苗期成活率、单株结薯数、单株产量、商品薯率等产量与品质指标,筛选出19份耐盐性较强的甘薯种质[18]。刘桂玲等在黄河三角州盐碱地开展9个甘薯种质的种植试验,筛选出4个耐盐碱种质[19]。王文婷等以5个甘薯品种的无菌试管苗为试材,筛选得到1份耐盐种质[20]。董静等对9个不同类型甘薯品种(系)在盐碱地条件下的生长状况等进行了系统分析,筛选得到4份耐盐种质[21]。
2 甘薯耐盐性评价
植物的耐盐性是由多种基因调控、多种外界因素共同作用的综合性状,植物不同生长发育时期的耐盐能力可能也有所差别[22]。甘薯耐盐性评价指标分为形态学指标和生理生化指标2类。常用的数据分析方法有相关性分析法、主成分分析法、聚类分析法、隶属函数法、逐步回归法等。
2.1 形态学指标
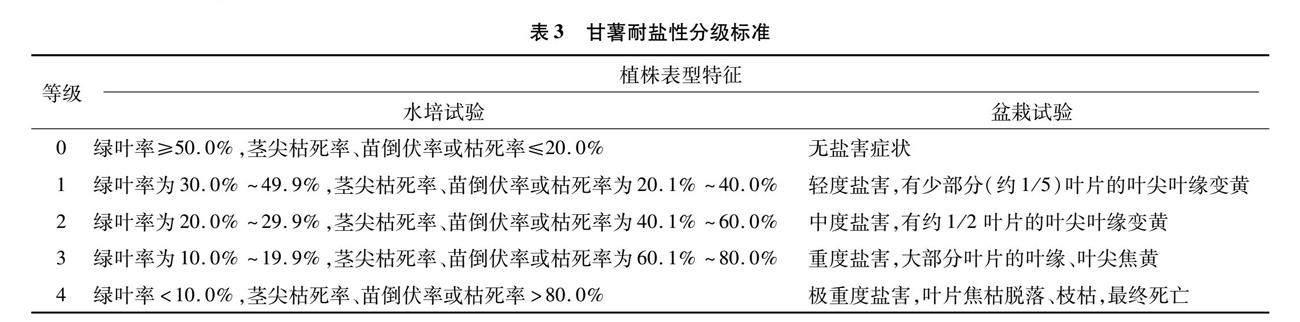
盐胁迫对植物生长的影响体现在植物生长势下降、衰老甚至死亡,即生长量和生物量受到抑制[23-24]。在甘薯耐盐性上,前人研究分为苗期试验和全生育期试验,考察的形态指标有幼苗黄叶率、植株死亡率、植株干(鲜)重、叶面积、鲜薯产量、薯块干率、薯干产量等,详见表2。苗期试验分为水培试验、盆栽试验和组培苗试验[11-13,15-16,20]。李育军等的研究表明,甘薯茎段苗的不同组织器官对盐胁迫的反应不一致,用单一指标来说明品种间的不同耐盐性是相对的、不全面的,必须用与耐盐性有关的多项指标来综合定量评价[16,26]。常用的形态指标有茎叶干(鲜)重、根系干(鲜)重、总干(鲜)重等。同时,学者们根据植株受害程度及盐害症状将甘薯耐盐性划分为5个等级(表3),并计算盐害指数(公式1)[12-13,16]。全生育期试验为田间试验,前人研究认为甘薯以膨大的块根为收获产物,甘薯品种的耐盐性最终要体现在块根产量上[18]。段文学等研究表示,田间条件下鲜薯、薯干产量较高且地上部分薯秧生长旺盛,则可认为是耐盐碱品种[11,19,21]。但郭小丁等表示该法容易丢失本身产量低但含有耐盐基因的材料,应采用耐盐指数(公式2)来评价参试品种的耐盐性[17-18,25]。耐盐指数可兼顾品种自身的产量潜力和耐盐能力,客观地反映品种的耐盐性[18]。
公式1:盐害指数(SSI)=∑(代表级数×该级株数)/(总株数×最高级数)×100。
公式2:耐盐指数(STI)=(某品种盐渍地薯块平均单株产量/所有参试品种盐渍地薯块平均单株产量)×(某品种盐渍地薯块平均产量/某品种培肥地薯块平均产量)。
2.2 生理生化指标
盐胁迫除了对植物生长产生影响外,还会引发植物体内多种生理变化,如离子紊乱、光合速率下降、氧化胁迫等[27]。因此研究植物耐盐性除了调查形态学指标外,还需测定分析相关生理生化指标。在甘薯耐盐性上测定的生理生化指标有超氧化物歧化酶(SOD)活性、叶片相对电导率、Fv/Fm、SPAD值、丙二醛(MDA)含量、脯氨酸含量、K+和Na+含量等,详见表2。其中,SOD是细胞内最有效的透明质酸抗氧化剂,主要功能是降低体内O-2含量,广泛存在于所有易受活性氧侵害的细胞中[28]。叶片相对电导率表征植物细胞膜受损伤的大小。Fv/Fm和SPAD值反映了植物的光合作用状况。MDA含量是衡量细胞膜稳定性的重要指标,与植物的耐盐性呈负相关关系,与细胞膜的伤害程度呈正相关关系[29]。脯氨酸是一种重要的渗透调节物质,盐胁迫下,它可以保护光合系统、维持离子稳态、增强抗氧化系统[30]。段文学等的研究表明,与盐敏感型品种相比,耐盐性强的品种叶片SOD活性和脯氨酸含量升幅大,MDA含量升幅小;SOD活性、脯氨酸及MDA含量可作为甘薯苗期耐盐性的鉴定指标[11]。Shafeiee等的研究表明,维持Na+、K+和Ca2+的稳态是植物耐盐性的重要组成部分[31]。在生理盐水条件下,Ca2+可能影响根离子通道的选择性,抑制叶片中Na+的积累,提高叶片中K+和Ca2+的含量,导致叶片中Na+/K+和Na+/Ca2+显著降低[32]。刘桂玲等则表示,不同甘薯品种Ca2+含量在不同器官差异非常大[19]。Mondal等表示,在非盐渍水平下,甘薯组织钾含量高则产量高;在临界根区盐度(75 mmol/L NaCl溶液)下,钾含量差异小,则表明具有耐盐性[33]。
3 甘薯耐盐性相关基因的挖掘
植物耐盐性是受多基因控制的数量性状[34]。近年来,甘薯中已经鉴定出大量参与盐胁迫响应的基因。Zhao等从甘薯突变系JS6-5中克隆并鉴定了IbMYB48,该基因在拟南芥中异位表达导致脱落酸(ABA)、茉莉酸(JA)、脯氨酸含量和SOD活性升高,表明IbMYB48可正向调节耐盐和干旱胁迫[35]。Xie等的研究表明,甘薯IbSAP16基因参与了盐胁迫响应,将其转入拟南芥中,拟南芥具有耐盐性[36]。Zhang等诱导甘薯IbCCD4基因在拟南芥中异源表达,结果表明在200 mmol/L NaCl处理下,与野生型植物相比,过表达IbCCD4的拟南芥丙二醛(MDA)水平升高,抗性相关基因表达降低,过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)3种抗氧化酶活性降低,降低了拟南芥的耐盐性[37]。You等从徐紫薯8号转录组数据中克隆出IbCAR1基因,发现过表达IbCAR1株系在盐胁迫中具有独特的根细胞膜完整性,且ABA生物合成、胁迫响应和活性氧清除系统相关基因表达上调,在甘薯耐盐性中发挥积极的作用[38]。Wang等从甘薯中分离出MYB转录因子基因IbMYB308,该基因具有组织特异性;经200 mmol/L NaCl处理后,转基因烟草中CAT活性、POD活性、脯氨酸含量及蛋白质含量升高,MDA含量降低,说明该基因提高了烟草对盐胁迫的耐受性[39]。Meng等表示,IbNAC7是一个可提高甘薯耐盐性的候选基因,转基因拟南芥在盐胁迫下表现出比野生拟南芥更强的耐盐性,过氧化氢酶活性、叶绿素和脯氨酸含量均高于野生拟南芥,MDA和活性氧(ROS)积累均低于野生拟南芥[40]。Yu等的研究表明,IbPSS1通过促进根内Na+平衡和Na+排斥来促进甘薯的耐盐性,过表达IbPSS1增强了盐诱导的Na+/H+反端口活性,增加了质膜(PM) Ca2+渗透通道对NaCl和H2O2的敏感性[41]。Ren等表示,IbSnRK1基因通过激活活性氧清除系统并通过ABA信号通路控制气孔关闭来增强甘薯的耐盐、耐旱和耐寒性[42]。Liu等从耐盐甘薯中分离得到铁硫簇支架蛋白基因IbNFU1,将其转入盐敏感甘薯品种中,发现转基因植株脯氨酸和还原性抗坏血酸含量显著增加,超氧化物歧化酶(SOD)活性和光合作用显著增强,丙二醛(MDA)含量及H2O2的积累量显著降低;盐胁迫下,IbNFU1过表达上调吡咯-5-羧酸合成酶(P5CS)和吡咯-5-羧酸还原酶(P5CR)基因,且植株的活性氧(ROS)清除基因出现系统性上调[43]。Yan等把CuZnSOD和APX转入甘薯,提高了转基因植物的耐盐性[44]。Zhai等表示,肌醇-1-磷酸合成酶基因IbMIPS1增强了转基因甘薯的耐盐、耐旱能力和对茎线虫的抗性[45]。Liu等的研究表明,IbSIMT1基因通过调节渗透平衡、保护膜完整性和光合作用以及增加活性氧清除能力来提高转基因甘薯植株的耐盐性[46]。Zhu等的研究表明,IbGATA24与IbCOP9-5a相互作用,可正向调控干旱和耐盐性[47]。Cheng等的研究表明,甘薯R2C3-MYB基因IbMYB1可提高转基因马铃薯的耐盐性[48]。Du等表示,IbATL38的过表达显著提高了拟南芥的耐盐性,该基因定位于细胞核和质膜,具有E3泛素连接酶活性[49]。Zhu等从甘薯中克隆了1个WRKY基因IbWRKY2,该基因定位于细胞核,全长蛋白具有转录激活活性,其活性区域位于N端[50]。过表达IbWRKY2的拟南芥抗旱耐盐能力增强。Kang等从甘薯中克隆了1个bZIP转录因子基因IbbZIP1,在酵母中具有转录激活活性,可使转基因拟南芥具有耐盐、耐旱的特性[51]。Li等从甘薯中克隆了1个AP2/ERF基因IbRAP2-12,该基因在酵母中具有转录激活活性,其蛋白在烟草表皮细胞中瞬时表达,可提高转基因拟南芥的耐盐性和耐旱性[52]。Kang等将甘薯品系HVB-3的IbARF5基因转入拟南芥中,发现转基因拟南芥ABA、脯氨酸含量和超氧化物歧化酶(SOD)活性增加,H2O2含量降低,同时其可正向调控类胡萝卜素的生物合成[53]。Wang等从甘薯品系ND98中分离并鉴定得到1个液泡Na+/H+反转运蛋白基因IbNHX2,过表达该基因可显著提高转基因甘薯的耐盐性和耐旱性,其由542个氨基酸残基组成,具有1个保守的阿米洛酰结合结构域FFIYLLPPI和1个阳离子/H+交换结构域,与其他植物中鉴定的液泡Na+/H+反转运体具有高度的氨基酸同源性(73.72%~96.13%)[54]。甘薯Cys 2/His 2锌指蛋白基因IbZFP1通过调控ABA信号通路、脯氨酸生物合成、胁迫响应和ROS清除来增强转基因拟南芥的耐盐性和耐旱性[55]。Liu等表示,吡咯-5-羧酸还原酶(P5CR)位于谷氨酸和鸟氨酸通路的交汇点,是脯氨酸生物合成过程中最后一个也是最关键的酶,其从甘薯中分离得到1个P5CR基因IbP5CR,过表达IbP5CR的转基因甘薯耐盐性显著高于野生型[56]。Jiang等表示,海藻糖在多种生物的代谢调节和非生物胁迫耐受中起着重要作用,其从甘薯中分离得到1个海藻糖-6-磷酸合成酶(TPS)基因IbTPS,转基因烟草的耐盐性显著高于对照植株[57]。Kim等表示,在甘薯中下调番茄红素ε-环化酶基因可促进类胡萝卜素的合成,增强转基因甘薯愈伤组织的盐胁迫耐受性[58]。以上这些研究结果(表4)只确定了甘薯中某功能基因的过度表达可显著提高或降低其对非生物胁迫的耐受性,但更深入的调控网络和调控通路等分子机制仍不清楚,还需进一步解析獲悉。
4 提高甘薯耐盐性的途径
4.1 施用化学物质或外源激素
施用化学物质是一种较为常用的提高植物耐盐性的方法。研究表明,适当喷施外源脱落酸(ABA)能够显著缓解NaCl(300 mmol/L)胁迫对徐薯25造成的伤害作用,以ABA浓度为70 μmol/L时缓解效果最好[66]。1.0 mmol/L水杨酸(SA)和0.5 mmol/L苯并噻二唑(BTH)诱导处理的徐薯18薯苗盐胁迫下根系活力分别提高90.16%和29.51%,丙二醛含量分别降低30.65% 和11.24%[67]。
4.2 培育耐盐品种
甘薯的耐盐能力因品种而异,研究人员通过多种手段培育耐盐性较强的品种。主要有:(1)杂交育种。济薯26、济徐23、济薯21、泰中9号、苏薯7号、龙薯1号、徐薯18等皆为通过杂交育种选育的具有一定耐盐性的甘薯品种。(2)物理诱变育种。张聪等利用60COγ射线80 Gy、1.09 Gy/min辐照处理甘薯品种西成007的悬浮细胞,获得3株耐盐突变株[68]。刘春月等通过相同的方法获得甘薯品种红心王、栗子香、徐薯18的耐盐突变株[69-70]。孙榕的研究表明,甘薯茎段的适宜辐射剂量为 30 Gy,致死剂量为80 Gy[71]。(3)化学诱变育种。采用的诱变剂为烷化剂甲基磺酸乙酯(EMS)。对甘薯茎段而言,EMS适宜浓度和时间组合为0.3% 1 h 或0.2% 2~3 h,致死剂量为0.4% 3 h[71-72]。(4)生物诱变育种。Kim等的研究表明,沉默LCY-ε及CHY-β基因能增强甘薯盐胁迫耐性[58,63]。周桦楠等利用根癌农杆菌介导法将磷脂酰丝氨酸合成酶基因、几丁质酶基因导入甘薯品种中,发现转基因甘薯植株的耐盐性显著提高[41,60]。
5 展望
植物应对盐碱环境是个复杂的过程,会通过形态结构、生理生化变化以及基因型来适应[73]。目前甘薯的耐盐性在生理代谢、耐盐基因挖掘等研究中取得诸多成果,但在提高甘薯耐盐性途径上研究较少。未来在甘薯耐盐性研究上可从以下3个方面入手。
(1)培育耐鹽甘薯种质。种质资源的深入研究是育种利用的基础,目前已报道的耐盐甘薯种质较少。精准鉴定甘薯种质在各时期的耐盐性,充分筛选并利用耐盐种质,为甘薯耐盐育种提供丰富的种质资源亦是未来探索的方向。同时甘薯耐盐基因丰富,需进一步利用基因工程技术将优异基因资源导入优良甘薯品种中,以加速耐盐甘薯品种的培育进程。并且有必要设置不同盐碱地试点,以便于培养和推广耐盐性强的甘薯品种。
(2)施用外源物质。诸多学者的研究表明,施用外源物质可以改变植物体内基因表达水平,影响植物的生理代谢过程,从而缓解盐胁迫对植物造成的伤害。如刘丽萍等的研究表明,施加外源甜菜碱和脯氨酸均可有效缓解盐胁迫对大麦种子萌发及幼苗生长的抑制作用,甜菜碱最适浓度为1.0 mmol/L,脯氨酸最适浓度为15.0~30.0 mmol/L[74];陈瑶等的研究表明,当氯化钠溶液浓度≤300 mmol/L时,添加柠檬酸可以有效缓解高羊茅受到的盐害[75];李嘉文等的研究表明,添加150 μmol/L外源褪黑素能使盐胁迫下燕麦抗氧化系统活性显著提高,渗透平衡得到有效缓解[76];刘行行等的研究表明,外源NaHS(H2S供体)能有效缓解盐胁迫对红砂幼苗氮代谢功能的抑制作用,最适缓解浓度为0.025 mmol/L[77];腾元旭等的研究表明,喷施0.010 mmol/L高铁血红素(CO供体)会提高渗透性调节物质的含量,缓解渗透胁迫,促进干物质的积累,降低盐胁迫对加工番茄的伤害[78];李世玉的研究表明,外源NO能显著缓解盐胁迫对甜瓜生长的抑制,有效提高甜瓜体内抗氧化酶活性及调节甜瓜植株矿质元素的平衡,最佳浓度为100 μmol/L SNP(NO供体)[79]。如何利用这些外源物质提高甘薯的耐盐性亦是今后探索的一个方向。
(3)筛选开发耐盐植物根际促生菌,制作适合盐碱地使用的有效微生物肥料。这在其他作物上有相关的研究,甘薯上还尚未见报道。凌宇等的研究表明,根际促生菌X8(Bacillus aquimaris)、X11(Photobacterium halotolerans)、X12(Enterobacter ludwigii)、Z2(Aspergillus niger)、Z7(Fusarium equiseti)、Z9(Mucor racemosus)均能不同程度地促进狗牙根在盐胁迫下的生长[80];王丹等的研究表明,菌株wp-8(Nesterenkonia rhizosphaerae)可缓解小麦盐胁迫并促进小麦幼苗生长,尤其促进其根系的发育[81];张银翠等的研究表明,菌株LrM2(Bacillus sp.)有高耐盐性,能够促进盐胁迫下燕麦的生长[82];王艳宇等的研究表明,菌株DQSA1可以在盐碱环境下定殖并促进根瘤菌和鞘氨醇杆菌等有益菌的生长,且增加了绿豆中可溶性糖、可溶性蛋白和脯氨酸含量,渗透调节物的增加提高了绿豆的耐盐碱能力[83]。这些研究表明,植物根际促生菌能够直接或间接地协助植物减轻盐胁迫带来的损伤,基于植物根际促生菌的作物改良方略在未来有巨大的潜力。
参考文献:
[1]Yu W C,Wu W W,Zhang N,et al. Research advances on molecular mechanism of salt tolerance in Suaeda[J]. Biology,2022,11(9):1273.
[2]Duan Q X,Zhu Z H,Wang B S,et al. Recent progress on the salt tolerance mechanisms and application of tamarisk[J]. International Journal of Molecular Sciences,2022,23(6):3325.
[3]Wang Y Y,Liu Z Y,Wang P L,et al. A 2-Cys peroxiredoxin gene from Tamarix hispida improved salt stress tolerance in plants[J]. BMC Plant Biology,2020,20(1):360.
[4]Shrivastava P,Kumar R. Soil salinity:a serious environmental issue and plant growth promoting bacteria as one of the tools for its alleviation[J]. Saudi Journal of Biological Sciences,2015,22(2):123-131.
[5]杨劲松,姚荣江. 我国盐碱地的治理与农业高效利用[J]. 中国科学院院刊,2015,30(增刊1):162-170.
[6]Liu C X,Li K S,Ma D P.Construction and engineering application of salt-discharging model for local saline-alkali soil with compact structure in the Yellow River Delta[J]. Applied and Environmental Soil Science,2020,2020:2906747.
[7]Yuan P,Wang J Q,Pan Y J,et al. Review of biochar for the management of contaminated soil:preparation,application and prospect[J]. The Science of the Total Environment,2019,659:473-490.
[8]吴 丹,孙 萍,路鹏展,等. 浒苔生物炭对滨海盐碱土壤改良的效果及途径[J]. 环境科学,2020,41(4):1941-1949.
[9]梁洪榜,趙 丽,周云鹏,等. 盐碱地应用根际促生菌对土壤改良、作物产量与品质的影响——基于Meta分析[J]. 土壤,2022,54(6):1257-1264.
[10]杨莉琳,谢志霞,朱向梅,等. 生物炭与土壤调理剂对滨海荒芜重盐碱地的改良效应[J]. 环境科学,2023,44(10):5641-5648.
[11]段文学,张海燕,解备涛,等. 不同甘薯品种(系)田间耐盐性比较研究[J]. 山东农业科学,2018,50(8):42-46.
[12]王灵燕,贾文娟,鲍 敬,等. 不同甘薯品种苗期耐盐性比较[J]. 山东农业科学,2012,44(1):54-57.
[13]崔纪超,中 奕,钟玉扬,等. 不同甘薯品种苗期耐盐性试验[J]. 广东农业科学,2020,47(4):1-7.
[14]黄 婷. 菜用甘薯耐盐品种筛选及耐盐生理响应[D]. 海口:海南大学,2020:39.
[15]段文学,张海燕,解备涛,等. 甘薯苗期耐盐性鉴定及其指标筛选[J]. 作物学报,2018,44(8):1237-1247.
[16]李育军,龚明权,陈新亮,等. 甘薯品种资源室内耐盐性快速筛选试验初报[J]. 广东农业科学,2012,39(9):14-16.
[17]郭小丁,邬景禹,钮福祥,等. 甘薯品种资源耐盐性鉴定研究[J]. 盐碱地利用,1993(2):36-41.
[18]马佩勇,边小峰,郭小丁,等. 甘薯全生育期耐盐种质筛选与耐盐性评价[J]. 植物遗传资源学报,2018,19(3):546-553.
[19]刘桂玲,郑建利,范维娟,等. 黄河三角洲盐碱地条件下不同甘薯品种耐盐性[J]. 植物生理学报,2011,47(8):777-784.
[20]王文婷,侯夫云,王庆美,等. 耐盐性甘薯品种的初步筛选[J]. 山东农业科学,2012,44(11):35-37.
[21]董 静,邢锦城,朱小梅,等. 苏北沿海滩涂盐碱地上不同类型甘薯品种耐盐性比较[J]. 江苏农业科学,2017,45(18):85-88.
[22]秦 娟,罗光香,李 亭,等. 2种线椒的种子萌发和幼苗生长对NaCl的耐受性分析[J]. 种子,2016,35(9):24-28,31.
[23]Jaarsma R,de Vries R S M,de Boer A H. Effect of salt stress on growth,Na+accumulation and proline metabolism in potato (Solanum tuberosum) cultivars[J]. PLoS One,2013,8(3):e60183.
[24]余叔文,汤章城. 植物生理与分子生物学[M]. 2版.北京:科学出版社,1998:752-769.
[25]郭小丁,邬景禹,唐 君,等. 甘薯品种资源田间耐盐性鉴定研究[J]. 作物品种资源,1994(3):34-36.
[26]武 辉,侯丽丽,周艳飞,等. 不同棉花基因型幼苗耐寒性分析及其鉴定指标筛选[J]. 中国农业科学,2012,45(9):1703-1713.
[27]Li J J,Ma J J,Guo H L,et al. Growth and physiological responses of two phenotypically distinct accessions of centipedegrass[Eremochloa ophiuroides (Munro) Hack.]to salt stress[J]. Plant Physiology and Biochemistry,2018,126:1-10.
[28]王瀚祥,李广存,徐建飞,等. 植物耐盐机理研究进展[J]. 作物杂志,2022(5):1-12.
[29]王彬彬,李秋果,于景金,等. 3种外源物对匍匐剪股颖耐盐性的影响[J]. 草业科学,2022,39(3):474-484.
[30]Butt M,Sattar A,Abbas T,et al. Foliage applied proline induces salt tolerance in chili genotypes by regulating photosynthetic attributes,ionic homeostasis,and antioxidant defense mechanisms[J]. Horticulture,Environment,and Biotechnology,2020,61(4):693-702.
[31]Shafeiee M,Ehsanzadeh P. Physiological and biochemical mechanisms of salinity tolerance in several fennel genotypes:existence of clearly-expressed genotypic variations[J]. Industrial Crops and Products,2019,132:311-318.
[32]Vafadar F,Amooaghaie R,Ehsanzadeh P,et al. Crosstalk between melatonin and Ca2+/CaM evokes systemic salt tolerance in Dracocephalum kotschyi[J]. Journal of Plant Physiology,2020,252:153237.
[33]Mondal S,Rahaman E H M S,Asch F. Potassium content is the main driver for salinity tolerance in sweet potato before tuber formation[J]. Journal of Agronomy and Crop Science,2022,208(5):645-661.
[34]劉东让,董邵云,苗 晗,等. 黄瓜耐盐胁迫遗传育种研究进展[J]. 中国蔬菜,2021(7):14-23.
[35]Zhao H Y,Zhao H Q,Hu Y F,et al. Expression of the sweet potato MYB transcription factor IbMYB48 confers salt and drought tolerance in Arabidopsis[J]. Genes,2022,13(10):1883.
[36]Xie H,Yang Q Q,Wang X X,et al. Genome-wide identification of the A20/AN1 zinc finger protein family genes in Ipomoea batatas and its two relatives and function analysis of IbSAP16 in salinity tolerance[J]. International Journal of Molecular Sciences,2022,23(19):11551.
[37]Zhang J,He L H,Dong J J,et al. Overexpression of sweet potato carotenoid cleavage dioxygenase 4 (IbCCD4) decreased salt tolerance in Arabidopsis thaliana[J]. International Journal of Molecular Sciences,2022,23(17):9963.
[38]You C,Li C,Ma M,et al. A C2-domain abscisic acid-related gene,IbCAR1,positively enhances salt tolerance in sweet potato[Ipomoea batatas (L.) Lam.][J]. International Journal of Molecular Sciences,2022,23(17):9680.
[39]Wang C,Wang L J,Lei J,et al. IbMYB308,a sweet potato R2R3-MYB gene,improves salt stress tolerance in transgenic tobacco[J]. Genes,2022,13(8):1476.
[40]Meng X Q,Liu S Y,Dong T T,et al. Comparative transcriptome and proteome analysis of salt-tolerant and salt-sensitive sweet potato and overexpression of IbNAC7 confers salt tolerance in Arabidopsis[J]. Frontiers in Plant Science,2020,11:572540.
[41]Yu Y C,Xuan Y,Bian X F,et al. Overexpression of phosphatidylserine synthase IbPSS1 affords cellular Na+ homeostasis and salt tolerance by activating plasma membrane Na+/H+antiport activity in sweet potato roots[J]. Horticulture Research,2020,7:131.
[42]Ren Z T,He S Z,Zhou Y Y,et al. A sucrose non-fermenting-1-related protein kinase-1 gene,IbSnRK1,confers salt,drought and cold tolerance in sweet potato[J]. The Crop Journal,2020,8(6):905-917.
[43]Liu D G,Wang L J,Liu C L,et al. An Ipomoea batatas iron-sulfur cluster scaffold protein gene,IbNFU1,is involved in salt tolerance[J]. PLoS One,2014,9(4):e93935.
[44]Yan H,Li Q,Park S C,et al. Overexpression of CuZnSOD and APX enhance salt stress tolerance in sweet potato[J]. Plant Physiology and Biochemistry,2016,109:20-27.
[45]Zhai H,Wang F B,Si Z Z,et al. A myo-inositol-1-phosphate synthase gene,IbMIPS1,enhances salt and drought tolerance and stem nematode resistance in transgenic sweet potato[J]. Plant Biotechnology Journal,2016,14(2):592-602.
[46]Liu D G,He S Z,Song X J,et al. IbSIMT1,a novel salt-induced methyltransferase gene from Ipomoea batatas,is involved in salt tolerance[J]. Plant Cell,Tissue and Organ Culture,2015,120(2):701-715.
[47]Zhu H,Zhai H,He S Z,et al. A novel sweetpotato GATA transcription factor,IbGATA24,interacting with IbCOP9-5a positively regulates drought and salt tolerance[J]. Environmental and Experimental Botany,2021,194:104735.
[48]Cheng Y J,Kim M D,Deng X P,et al. Enhanced salt stress tolerance in transgenic potato plants expressing IbMYB1,a sweet potato transcription factor[J]. Journal of Microbiology and Biotechnology,2013,23(12):1737-1746.
[49]Du B,Nie N,Sun S F,et al. A novel sweetpotato RING-H2 type E3 ubiquitin ligase gene IbATL38 enhances salt tolerance in transgenic Arabidopsis[J]. Plant Science,2021,304:110802.
[50]Zhu H,Zhou Y Y,Zhai H,et al. A novel sweetpotato WRKY transcription factor,IbWRKY2,positively regulates drought and salt tolerance in transgenic Arabidopsis[J]. Biomolecules,2020,10(4):506.
[51]Kang C,Zhai H,He S Z,et al. A novel sweetpotato bZIP transcription factor gene,IbbZIP1,is involved in salt and drought tolerance in transgenic Arabidopsis[J]. Plant Cell Reports,2019,38(11):1373-1382.
[52]Li Y,Zhang H,Zhang Q,et al. An AP2/ERF gene,IbRAP2-12,from sweetpotato is involved in salt and drought tolerance in transgenic Arabidopsis[J]. Plant Science,2019,281:19-30.
[53]Kang C,He S Z,Zhai H,et al. A sweetpotato auxin response factor gene (IbARF5) is involved in carotenoid biosynthesis and salt and drought tolerance in transgenic Arabidopsis[J]. Frontiers in Plant Science,2018,9:1307.
[54]Wang B,Zhai H,He S Z,et al. A vacuolar Na+/H+antiporter gene,IbNHX2,enhances salt and drought tolerance in transgenic sweetpotato[J]. Scientia Horticulturae,2016,201:153-166.
[55]Wang F B,Tong W J,Zhu H,et al. A novel Cys2/His2 zinc finger protein gene from sweetpotato,IbZFP1,is involved in salt and drought tolerance in transgenic Arabidopsis[J]. Planta,2016,243(3):783-797.
[56]Liu D G,He S Z,Zhai H,et al. Overexpression of IbP5CR enhances salt tolerance in transgenic sweetpotato[J]. Plant Cell,Tissue and Organ Culture,2014,117(1):1-16.
[57]Jiang T,Zhai H,Wang F B,et al. Cloning and characterization of a salt tolerance-associated gene encoding trehalose-6-phosphate synthase in sweetpotato[J]. Journal of Integrative Agriculture,2014,13(8):1651-1661.
[58]Kim S H,Kim Y H,Ahn Y O,et al. Downregulation of the lycopene ε-cyclase gene increases carotenoid synthesis via the β-branch-specific pathway and enhances salt-stress tolerance in sweetpotato transgenic calli[J]. Physiologia Plantarum,2013,147(4):432-442.
[59]边小峰,谢一芝,郭小丁,等. 甘薯中一个含有EAR元件的乙烯不敏感基因IbERF3负调控植株耐盐和耐旱性[C]//江苏省遗传学会第九次会员代表大会暨学术研讨会论文集.南京,2015:21-22.
[60]周桦楠,孙思凡,杨颖慧,等. 甘薯几丁质酶基因IbChi的克隆及其耐盐性分析[J]. 分子植物育种,2022,20(9):2812-2820.
[61]张 欢. 甘薯耐盐转录组分析及抗逆相关基因IbBBX24和IbCPK28的克隆与功能验证[D]. 北京:中国农业大学,2017:147.
[62]刘德高. 过表达IbP5CR、IbERD3、IbELT、IbNFU1基因的甘薯植株的获得及耐盐性鉴定[D]. 北京:中国农业大学,2014:98-99.
[63]Kim S H,Ahn Y O,Ahn M J,et al. Down-regulation of β-carotene hydroxylase increases β-carotene and total carotenoids enhancing salt stress tolerance in transgenic cultured cells of sweetpotato[J]. Phytochemistry,2012,74:69-78.
[64]陈杉彬,孙思凡,聂 楠,等. 甘薯IbCAF1基因的克隆及耐盐性、抗旱性鉴定[J]. 作物学报,2020,46(12):1862-1869.
[65]何绍贞,刘德高,王连军,等. 甘薯耐盐基因克隆与功能分析[C]//2012年中国作物学会学术年会论文摘要集.南昌,2012:25.
[66]肖 强,王 刚,衣艳君,等. 外源脱落酸增强甘薯幼苗耐盐性的作用[J]. 植物营养与肥料学报,2016,22(1):201-208.
[67]赵永强,徐 振,张成玲,等. 水杨酸(SA)和苯并噻二唑(BTH)对甘薯耐盐性的影响[J]. 西南农业学报,2014,27(4):1791-1793.
[68]张 聪,李 明,冯俊彦,等. 辐射诱变甘薯悬浮细胞筛选耐盐植株[J]. 分子植物育种,2016,14(12):3496-3500.
[69]刘春月.甘薯高频再生体系建立及离体诱变筛选耐盐突变体的初步研究[D]. 大连:辽宁师范大学,2009:41.
[70]韩元凤.甘薯耐盐突变体的离体筛选及鉴定[D]. 北京:中国农业大学,2004:40.
[71]孙 榕.甘薯的组织培养及耐盐诱变育种研究[D]. 大连:辽宁师范大学,2010:24-25.
[72]孙 榕,马晓梅,王关林.EMS处理甘薯茎段的耐盐性研究[J]. 安徽农学通报,2010,16(1):63-64.
[73]贾文飞,马靖恒,裴 彤,等. 植物耐盐碱性研究进展及外源褪黑素应用研究[J]. 特产研究,2023,45(3):157-162.
[74]刘丽苹,汪军成,司二静,等. 外源甜菜碱和脯氨酸对盐胁迫下大麦种子萌发及幼苗生长的影响[J]. 麦类作物学报,2023,43(6):766-774.
[75]陈 瑶,凌 宇,龙江宇,等. 外源柠檬酸缓解高羊茅盐胁迫的机制[J]. 草业科学,2023,40(2):511-520.
[76]李嘉文,麻冬梅,苏立娜,等. 外源褪黑素对盐胁迫下燕麦幼苗生长及抗氧化系统的影响[J]. 草地学报,2023,31(2):396-403.
[77]刘行行,种培芳,马志强,等. 外源H2S对盐胁迫下红砂幼苗叶片和根系氮代谢的影响[J]. 核农学报,2023,37(2):405-413.
[78]滕元旭,骆 霞,张雪蒙,等. 外源CO对盐胁迫下加工番茄幼苗光合荧光的影响[J]. 干旱地区农业研究,2023,41(1):86-93.
[79]李世玉.26份甜瓜材料耐盐性评价及外源NO对甜瓜盐胁迫的缓解效应[D]. 杨凌:西北农林科技大学,2022:48.
[80]凌 宇,冯启佳,孙小艳,等. 耐盐促生菌的筛选及其对狗牙根耐盐性的影响[J]. 草业科学,2022,39(11):2297-2306.
[81]王 丹,趙亚光,张凤华.耐盐促生菌筛选、鉴定及对盐胁迫小麦的效应[J]. 麦类作物学报,2020,40(1):110-117.
[82]张银翠,姚 拓,赵桂琴,等. 耐盐促生菌筛选鉴定及对盐胁迫燕麦生长的影响[J]. 草地学报,2021,29(12):2645-2652.
[83]王艳宇,向君亮,周 妍,等. 耐盐碱细菌DQSA1的分离鉴定及盐碱胁迫下对绿豆的促生作用[J]. 微生物学通报,2021,48(8):2653-2664.
