血清ICAM-1、IL-10、TNF-α检测对烧伤患者预后的评估价值研究
2024-05-30高学坡贾鸿飞李茂清
高学坡,贾鸿飞,李茂清
烧伤可造成机体组织损伤,主要由高温、腐蚀或电流等导致,根据烧伤面积及深度可分为轻度、中度、重度及特重度烧伤,其中轻度烧伤可于短期内痊愈,而重度及以上烧伤可伤及皮肤表皮层、生发层,甚至累及真皮层[1-2]。由于皮肤是机体首层防御屏障,一旦烧伤则会失去屏障及其功能,出现体液丢失、易感染等问题,严重影响患者预后。因此,寻找一个实用、简易的监测指标对烧伤患者的病情、预后进行评估及预测具有重要意义。细胞间黏附分子-1(ICAM-1)是一种常见的免疫球蛋白,主要通过与血管内皮细胞表面上的特异性受体结合而发挥生物学活性,可介导中性粒细胞黏附与渗出,进而诱发炎症反应[3]。肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)也是机体炎症反应中重要的炎性介质[4],其中TNF-α可以促进T细胞产生炎性因子,促进中性粒细胞的活化;而IL-10作为抗炎细胞因子,可以抑制TNF-α等促炎因子合成与释放,从而缓解炎症反应。基于此,本研究旨在分析血清ICAM-1、IL-10、TNF-α联合检测对烧伤患者预后的评估价值,具体报告如下。
1 资料与方法
1.1 一般资料
选择2019年6月—2022年3月张家口市第一医院收治的179例烧伤患者,其中男93例(51.96%)、女86例(48.04%);年龄18~63(41.81±10.13)岁;烧伤至入院时间0.5~24.0(4.85±1.33)h;烧伤原因:火焰烧伤143例(79.89%),热液烫伤25例(13.97%),化学烧伤7例(3.91%),电击伤4例(2.23%);烧伤等级:Ⅱ度烧伤123例(68.72%),Ⅲ度烧伤 56例(31.28%);烧伤面积:25%~65%(41.75±7.59)%体表总面积;烧伤部位:面颈部26例(14.53%),上肢61例(34.08%),下肢40例(22.35%),躯干42例(23.46%),其他10例(5.59%);62例(34.64%)合并吸入伤;急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分11~30(17.53±2.65)分。本研究获张家口市第一医院医学伦理委员会批准(2022-KY-45),且患者已签署知情同意书。
1.2 入选标准
纳入标准:1)符合《实用烧伤学》[5]中相关诊断标准;2)年龄18~63岁;3)烧伤后24 h内到院就诊;4)入院前未采取其他处理措施;5)认知功能良好,无营养不良。
排除标准:1)伤后超过24 h入院就诊;2)放射线导致的烧伤;3)会阴或呼吸道等特殊部位烧伤;4)合并其他严重创伤;5)合并严重脏器功能障碍;6)有出血倾向;7)免疫功能低下;8)合并全身感染;9)合并精神疾病;10)入院后24 h内死亡;11)临床资料欠缺;12)妊娠或哺乳期女性;13)患者依从性差。
1.3 方法
1)治疗方法:入院后及时评估患者伤情,并予清创、纠正休克、抗感染及营养支持等常规对症治疗。其中轻度吸入性损伤者采用氧疗、雾化等治疗;中、重度吸入性损伤者酌情进行气管切开、机械通气等呼吸支持治疗;广泛深度烧伤者,可在必要时行早期切开减张,待病情稳定于伤后1周左右行削痂植皮手术治疗,同时术后注意抗感染治疗。
2)血清ICAM-1、IL-10、TNF-α检测:入院后第1、3、5、7天采集患者清晨空腹静脉血3 mL,用WG-XXB-FLJ-I血液成分分离机,以1 500 r/min、半径10 cm条件离心15 min取上清液,置于-20 ℃冰箱中保存待检。采用酶联免疫吸附试验检测血清ICAM-1、IL-10、TNF-α水平,试剂盒购自江西艾博因生物科技有限公司、上海化邦生物科技有限公司、武汉伊莱瑞特生物科技股份有限公司,严格按照试剂盒说明书内容进行操作。检测工作均在血样采集后2 h内进行。
3)预后评估:患者从入院开始观察90 d,以病死为终点,表示死亡,其余为生存(包括病情好转稳定出院患者、在院观察的患者、病情未稳定仍需在院治疗患者)。
1.4 观察指标
1)根据患者的预后情况分为生存组和死亡组,对比2组患者不同时间点的血清ICAM-1、IL-10、TNF-α水平。
2)采用Pearson相关性分析烧伤患者血清ICAM-1、IL-10、TNF-α间的相关性,采用受试者工作特征(ROC)曲线评估血清ICAM-1、IL-10、TNF-α对烧伤患者预后的预测价值。
1.5 统计学方法
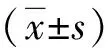
2 结果
2.1 2组患者基线资料比较
根据患者的预后情况分为生存组150例和死亡组29例。2组基线资料比较差异无统计学意义(P>0.05),见表1。

表1 2组烧伤患者基线资料比较
2.2 2组不同时间点血清ICAM-1水平比较
生存组患者血清ICAM-1水平呈先升高后下降趋势,在入院后第5天达到峰值(P<0.01),而死亡组血清ICAM-1水平呈逐渐升高趋势(P<0.01)。2组间血清ICAM-1水平比较差异有统计学意义(P<0.01);不同时间点血清ICAM-1水平比较差异有统计学意义(P<0.01);组别和时间点之间存在交互作用,差异有统计学意义(P<0.01)。见表2。

表2 2组烧伤患者不同时间点血清ICAM-1水平比较
2.3 2组不同时间点血清IL-10水平比较
采用重复测量方差分析,生存组患者血清IL-10水平呈先升高后下降趋势,在入院后第3天达到峰值(P<0.01),死亡组血清IL-10水平呈逐渐升高趋势(P<0.01)。2组间血清IL-10水平比较差异有统计学意义(P<0.01);不同时间点血清IL-10水平比较差异有统计学意义(P<0.01);组别和时间点之间存在交互作用,差异有统计学意义(P<0.01)。见表3。

表3 2组烧伤患者不同时间点血清IL-10水平比较
2.4 2组不同时间点血清TNF-α水平比较
采用重复测量方差分析,生存组血清TNF-α水平呈先升高后下降趋势,在入院后第3天达到峰值(P<0.01),而死亡组呈逐渐升高趋势(P<0.01)。2组间血清TNF-α水平比较差异有统计学意义(P<0.01);不同时间点血清TNF-α水平比较差异有统计学意义(P<0.01);组别和时间点之间存在交互作用,差异有统计学意义(P<0.01)。见表4。

表4 2组烧伤患者不同时间点血清TNF-α水平比较
2.5 血清ICAM-1、IL-10、TNF-α相关性
烧伤患者血清ICAM-1与血清IL-10呈正相关(r=0.864,P<0.05),与血清TNF-α呈正相关(r=0.769,P<0.05),且血清IL-10、TNF-α呈正相关(r=0.817,P<0.05)。
2.6 血清ICAM-1、IL-10、TNF-α对烧伤患者预后的预测价值
以血清ICAM-1、IL-10、TNF-α为因变量,生存状态为变量(赋值=1),绘制ROC曲线。结果显示,ICAM-1预测烧伤患者预后的曲线下面积为0.758,IL-10预测烧伤患者预后的曲线下面积为0.765,TNF-α预测烧伤患者预后的曲线下面积为0.775,三者联合预测烧伤患者预后的曲线下面积为0.824。见图1,表5。

ICAM-1为细胞间黏附分子-1,IL-10为白细胞介素-10,TNF-α为肿瘤坏死因子-α,ROC为受试者工作特征。

表5 ICAM-1、IL-10、TNF-α对烧伤患者预后的预测价值
3 讨论
烧伤是一种由热力、化学物质、电能等因素引起的皮肤黏膜损伤,甚至深部组织损伤,以皮肤热力烧伤较为多见,容易出现组织缺氧坏死、机体炎症反应、皮肤屏障功能受损和免疫功能下降等问题,严重影响患者的预后,而且其发生率和病死率居高不下[6-10]。据统计,全球范围内,每年严重烧伤的人数超过1 100万,而且随着医疗技术的不断发展,仍有3%~8%的病死率[11-12]。相关研究指出,炎性因子的产生和释放在全身免疫、炎症反应中发挥主导作用,因为炎症反应参与烧伤患者创面愈合过程,而且烧伤会损伤局部组织,刺激中枢神经释放大量炎性因子进入血液和组织间液,诱发炎症反应;而过度、失控的炎症反应会损伤烧伤患者脏器功能,大幅度增加血液中促炎因子水平,进而引发全身炎症反应,甚至发展为多脏器功能障碍综合征[13-16]。因此抑制炎症反应并且减少炎性因子释放是改善烧伤患者预后的关键。
炎症和渗出是烧伤皮肤修复时经历的首个阶段。血清ICAM-1作为一种炎性因子,可刺激创面炎性细胞浸润,介导黏附反应,并增强炎性细胞与内皮细胞之间的黏附作用,参与组织纤维化,促进炎性细胞渗出,造成瘢痕新生细胞损伤,从而减缓烧伤创面愈合速度,与烧伤患者的创面愈合率及创面愈合时间有关[17-18]。汪涟等[19]研究也表示,相比正常皮肤,烧伤创面ICAM-1的mRNA表达明显升高。另外,血清ICAM-1作为一种介导细胞间黏附和细胞外基质的膜表面糖蛋白[20],可介导中性粒细胞渗出、黏附,还可参与局部炎症反应、免疫反应、凝血等,在静息状态下的血管内皮细胞上呈现低表达。本研究中,生存组患者血清ICAM-1水平在住院期间趋于平稳并逐渐降低,而死亡组患者血清ICAM-1水平呈增高趋势,提示血清ICAM-1在不同预后烧伤患者中呈现出不同的表达水平。这可能是因血清ICAM-1高表达会影响烧伤患者创面愈合,而抑制其表达对创面血液循环及新生肉芽组织损伤的影响较小,从而促进皮肤创面恢复。动物研究也证实,雄性比格犬烧伤模型血清ICAM-1高表达,而持续注射丙泊酚可降低血清ICAM-1,有利于改善其免疫功能和炎症反应[21]。
有研究报道,IL-10作为机体重要的抗炎细胞因子,在免疫细胞及炎性细胞的生物调节中起重要作用,可调节细胞外基质[22],抑制B细胞分化,减少体内细胞因子释放,在烧伤后发挥减轻炎症反应、拮抗炎性介质作用,且烧伤患者血清IL-10显著升高可能与全身重度感染有关,预后多不良。
另有研究也指出,正常情况下,人体血清中IL-10水平较低,其可防止机体炎症反应导致的组织损伤,但在抗炎介质过度的情况下,大量IL-10可造成持续的免疫抑制,降低清除病原体能力,从而增加感染风险[23]。本研究生存组患者住院后第1、3、5、7天血清IL-10水平低于死亡组,而死亡组患者的血清IL-10水平呈增高趋势,提示血清IL-10在不同预后烧伤患者中呈现出不同的表达水平,其会随着病情加重而持续升高,分析原因可能是烧伤导致机体免疫功能紊乱,免疫应答低下、过度炎症反应,从而使炎性因子分泌异常,引起血管内皮损伤,破坏炎症-抗炎因子动态平衡。
TNF-α是巨噬细胞/单核细胞活化而合成分泌的促炎因子,可以促进细胞因子级联反应,激活淋巴细胞、中性粒细胞等,释放弹性蛋白酶等溶菌酶,促使炎性因子的合成及释放,产生活性氧并破坏机体重要器官的结构细胞和血管内皮细胞,诱导烧伤创面发生炎症反应[24-25]。相关研究也表明,TNF-α的分泌可以影响创面的愈合[26-27]。本研究中,生存组患者住院后第1、3、5、7天的血清TNF-α水平低于死亡组患者,而死亡组患者的血清TNF-α水平呈增高趋势,提示血清TNF-α在不同预后烧伤患者中呈现出不同的表达水平,其会随着病情加重而持续升高。胡强等[28]研究也指出,TNF-α在烧伤创面组织和创面液体中的表达很高,其能与中性粒细胞相互作用而加强组织破坏程度,是造成烧伤创面组织破坏的关键因子。另外,TNF-α水平的升高还会引发角质细胞坏死,使创面愈合过程停止。此外,进一步经Pearson相关性分析及ROC曲线分析显示,烧伤患者的血清ICAM-1、IL-10、TNF-α互呈正相关,且三者联合检测预测烧伤患者预后的曲线下面积高于单一指标预测,表明三者联合检测可以作为预测烧伤患者预后的有效指标。但是本研究纳入样本量偏小,后续还需大样本、多中心的数据对烧伤患者的血清ICAM-1、IL-10、TNF-α水平进行深入研究。在未来研究中,可以进一步结合复发感染情况及预后的影响进行分析,也可以考虑结合其他相关指标进行综合分析,以更全面地评估效果和患者的预后情况。
综上,血清ICAM-1、IL-10、TNF-α联合检测对评估烧伤患者预后具有较高的临床应用价值,有利于早期采取干预措施。
