LncRNA FEZF1-AS1调控特发性肺间质纤维化的机制研究*
2024-05-27满君宋龙飞刘永全
满君, 宋龙飞, 刘永全
(潍坊医学院附属医院 1.呼吸内科, 2.康复医学科, 山东 潍坊 261035)
特发性肺间质纤维化(idiopathic pulmonary fibrosis, IPF)是指慢性、进行性、纤维化性及原因不明的肺间质性病变,表现弥漫性肺泡炎、肺泡结构紊乱、上皮-间充质相互作用(epithelial interstitial transition, EMT)、成纤维细胞过度增生及细胞基质过度沉积,最终导致弥漫性间质纤维化[1]。IPF 是肺系疑难重症疾病,确诊后平均生存期为3 年左右,5 年生存率为30%~50%。近年来国内外学者认为,IPF 发病机制主要与EMT 有关,EMT 指上皮细胞在形态学上发生成纤维细胞或间充质细胞表型转变、细胞极性消失、迁移运动能力提高的现象[2-3]。长链非编码RNA(long non-coding RNA, LncRNA)是一类转录本长度>200 nt、不编码蛋白的RNA,其大量存在于真核生物和哺乳动物细胞中,广泛参与生物体内各种重要的生理过程[4]。研究发现,FEZ 家族锌指1-反义RNA 1(LncRNA FEZF1-AS1)在多种肿瘤细胞的增殖、迁移、侵袭及EMT 中发挥重要作用,调控肿瘤细胞EMT 过程相关的多种关键分子和信号通路。MicroRNA(miRNA)是一种重要的非编码小RNA,广泛参与多种生物学功能的调控。MicroRNA-200c-3p(miR-200c-3p)在多种疾病EMT过程中的作用逐渐被揭示,研究发现,miR-200c-3p在心肌梗死及乳腺癌、胃癌、胆囊癌等EMT 转化过程中发挥重要作用[5-7]。然而,LncRNA FEZF1-AS1在IPF 中的作用尚无研究,且LncRNA FEZF1-AS1 是否通过miR-200c-3p 发挥作用尚不清楚。本研究分析LncRNA FEZF1-AS1 在IPF 中的表达模式和生物学功能,探讨IPF 的发病机制,为寻找IPF 有价值的治疗靶点提供理论依据。
1 材料与方法
1.1 细胞及培养
A549 细胞购自上海富衡生物科技有限公司,A549 细胞培养于含10%胎牛血清、100 u/mL 青霉素、100 u/mL 链霉素的DMEM/F12 培养基中,在恒温培养箱中以5% CO2、37 ℃及饱和湿度条件下松盖培养,当细胞长至80%铺满时再进行后续实验。
1.2 主要试剂及仪器
转化生长因子-β1(transforming growth factor-β1,TGF-β1)(上海近岸生物科技有限公司),DMEM/F12 液体培养基(美国HyClone 公司),胎牛血清(美国GIBCO 公司),CCK-8 检测试剂盒(日本DoJinDo公司);Transwell 嵌套小室(美国Corning 公司),TRIzol(北京全式金生物技术有限公司),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)试剂盒(北京全式金生物技术有限公司),引物合成(上海捷瑞生物工程有限公司),FastKing cDNA 第一链合成试剂盒、Bulge-LoopTMmiRNA qRT-PCR Starter Kit 试剂盒(苏州锐博生物科技有限公司),Lipofectamine 6000™ 转染试剂(上海碧云天生物技术有限公司),Si LncRNA FEZF1-AS1 转染质粒(广州市锐博生物科技有限公司),Si LncRNA FEZF1-AS1 NC(对照)转染质粒(广州市锐博生物科技有限公司),miR-200c-3p 引物序列(广州市锐博生物科技有限公司),BCA 蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)及GAPDH 抗体(美国Proteintech公司),辣根过氧化物酶(HRP)偶联的二抗(上海碧云天生物技术有限公司)。二氧化碳培养箱(日本SANYO),酶标仪(美国Thermo 公司)。
1.3 方法
1.3.1 细胞转染及分组 将原始浓度为10 μg/mL的TGF-β1稀释500 倍后建立TGF-β1(20 ng/mL)作用于A549 细胞48 h 诱导肺间质纤维化细胞模型,将细胞分为空白对照组和模型组。细胞接种于6 孔板内进行培养,当细胞生长至融合度达到70%~90%时进行转染,构建LncRNA FEZF1-AS1 突变质粒及空白质粒,依据Lipofectamine 6000™试剂盒说明书进行转染,将模型组细胞分为TGF-β1+ Si LncRNA FEZF1-AS1 组(转染质粒)及TGF-β1+ Si LncRNA FEZF1-AS1 NC 组(转染空白质粒),Blank 组(不做任何处理的A549 细胞)。A549 细胞转染48 h 后采用qRT-PCR 检测细胞转染效率,用于后续实验。将A549 细胞分组为Blank 组、Si LncRNA FEZF1-AS1 NC组、Si LncRNA FEZF1-AS1 组。为保证结果的准确性,本研究又将Si LncRNA FEZF1-AS1 组设置3 组重复实验,即Si LncRNA FEZF1-AS1-1 组、Si LncRNA FEZF1-AS1-2 组、Si LncRNA FEZF1-AS1-3 组,共分为5 组观察转染效率。
1.3.2 qRT-PCR 检测LncRNA FEZF1-AS1 和miR-200c-3p 表达 采用TRIzol 试剂从细胞中提取总RNA,分别应用FastKing cDNA 第一链合成试剂盒及miRNA cDNA 第一链合成试剂盒说明书操作逆转录成cDNA,根据PCR 试剂盒说明书进行qRT-PCR反应,反应条件为95 ℃预变性10 min,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,40 个循环。记录Ct值,采用2-ΔΔCt进行相对定量分析,分别以GAPDH 和U6 作为内参计算LncRNA FEZF1-AS1 mRNA 和miR-200c-3p mRNA 相对表达量,实验重复3 次。引物序列如表1 所示。

表1 引物序列
1.3.3 CCK-8 法检测细胞增殖 将细胞分组为Blank 组、TGF- β1+ Si LncRNA FEZF1-AS1 组及TGF-β1+ Si LncRNA FEZF1-AS1 NC 组。A549 细胞转染24 h 后,胰酶消化细胞数调整至4×104个/mL,100 μ L/well 接种于96 孔板同时加入TGF- β120 ng/mL,分别在培养0、24 和48 h 时每孔加入10 μL CCK-8 溶液,4 h 后使用酶标仪测定450 nm波长处各孔吸光度(OD 值)。
1.3.4 细胞划痕检测细胞迁移实验 将细胞分组为Blank 组、TGF-β1+ Si LncRNA FEZF1-AS1 组及TGF-β1+ Si LncRNA FEZF1-AS1 NC 组。A549 细胞转染24 h 后,将细胞悬液接种到6 孔板中,加入TGF-β120 ng/mL,细胞生长至铺满孔底后,用10 μL的无菌微量移液器吸头垂直在消毒后在细胞板上划痕,并将细胞洗涤3 遍,加入无血清培养基,二氧化碳培养箱中继续培养。倒置显微镜下观察0、48 h各组细胞的变化。划痕愈合率(%)=(0 h 划痕面积- 48 h 划痕面积)/0 h 划痕面积。
1.3.5 Transwell 实验检测细胞迁移 将细胞浓度调整为2×105个/mL,每组细胞数量为1×105个/孔。配制Transwell 上室液和下室液:上室加无血清培养基,下室是TGF-β120 ng/mL 含血清完全培养基,上室液每孔200 μL,下室液每孔800 μL。将上层小室放入下层小室,细胞计数后将细胞铺在上层小室中。在细胞培养箱中培养48 h 后,取出上室,用棉签擦去上室底部膜表面上的细胞,800 μL 甲醇中固定10 min,采用吉姆萨染色液染色细胞,荧光倒置显微镜下计数、拍照。
1.3.6 Western blotting检测E-cadherin、N-cadherin、Vimentin 蛋白相对表达量 细胞分组后,采用裂解液裂解每组细胞,裂解完后,于4 ℃下12 000 r/min离心15 min,提取各组细胞蛋白,采BCA 蛋白浓度测定试剂盒测定蛋白浓度。SDS-PAGE 电泳分离后,采用湿转法转到PVDF 膜,用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF 膜,室温摇床封闭2 h,加入一抗4 ℃孵育过夜,TBST 充分洗涤PVDF 膜后加入二抗37 ℃摇床孵育2 h。TBST 洗涤后加入ECL 显影,采用Image J 软件进行灰度值分析,GAPDH 作为内参蛋白,计算目的蛋白相对表达量。目的蛋白相对表达量=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.4 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用t检验或单因素方差分析或析因设计的方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 空白对照组与模型组细胞E-cadherin、Ncadherin、Vimentin蛋白表达的比较
Western blotting 检测结果显示,空白对照组与模型组细胞E-cadherin、N-cadherin 和Vimentin 蛋白相对表达量比较,经t检验,差异均有统计学意义(P<0.05)。模型组细胞N-cadherin、Vimentin 蛋白相对表达量高于空白对照组(P<0.05);模型组细胞E-cadherin 蛋白相对表达量低于空白对照组(P<0.05)。见表2 和图1。
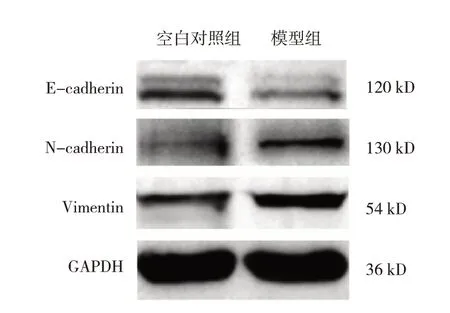
图1 空白对照组与模型组细胞E-cadherin、N-cadherin、Vimentin蛋白表达
表2 空白对照组与模型组细胞E-cadherin、N-cadherin和Vimentin蛋白相对表达量的比较 (±s)
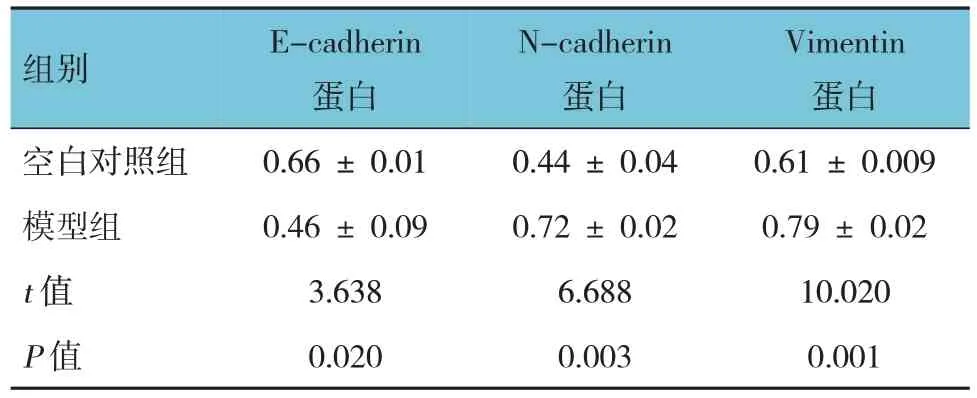
表2 空白对照组与模型组细胞E-cadherin、N-cadherin和Vimentin蛋白相对表达量的比较 (±s)
组别空白对照组模型组t 值P 值E-cadherin蛋白0.66 ± 0.01 0.46 ± 0.09 3.638 0.020 N-cadherin蛋白0.44 ± 0.04 0.72 ± 0.02 6.688 0.003 Vimentin蛋白0.61 ± 0.009 0.79 ± 0.02 10.020 0.001
2.2 空白对照组与模型组细胞LncRNA FEZF1-AS1、miR-200c-3p基因表达的比较
qRT-PCR 实验结果显示,空白对照组与模型组细胞LncRNA FEZF1-AS1 和miR-200c-3p mRNA 相对表达量比较,经t检验,差异均有统计学意义(P<0.05)。模型组细胞LncRNA FEZF1-AS1 mRNA 相对表达量高于空白对照组(P<0.05);模型组细胞miR-200c-3p mRNA 相对表达量低于空白对照组(P<0.05)。见表3。
表3 空白对照组与模型组细胞LncRNA FEZF1-AS1、miR-200c-3p mRNA相对表达量的比较 (±s)
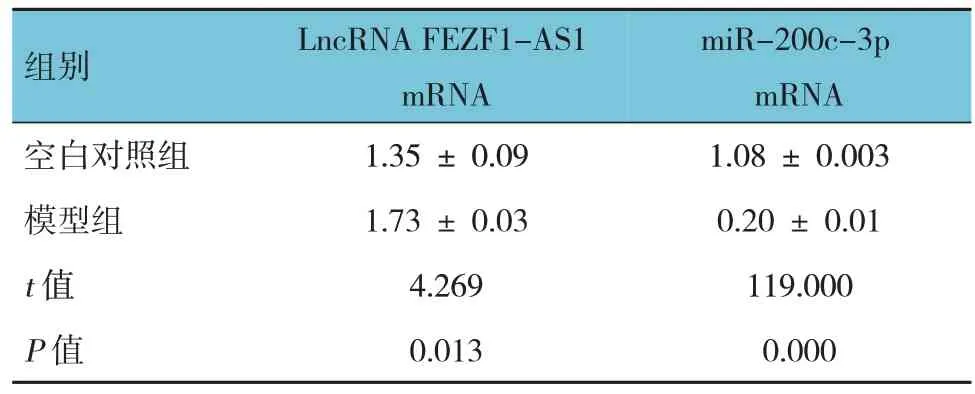
表3 空白对照组与模型组细胞LncRNA FEZF1-AS1、miR-200c-3p mRNA相对表达量的比较 (±s)
组别空白对照组模型组t 值P 值LncRNA FEZF1-AS1 mRNA 1.35 ± 0.09 1.73 ± 0.03 4.269 0.013 miR-200c-3p mRNA 1.08 ± 0.003 0.20 ± 0.01 119.000 0.000
2.3 各组LncRNA FEZF1-AS1转染效率的比较
5 组转染效率比较,经方差分析,差异有统计学意义(P<0.05)。两两比较结果示,Si LncRNA FEZF1-AS1-1 组、Si LncRNA FEZF1-AS1-2 组、Si LncRNA FEZF1-AS1-3 组的LncRNA FEZF1-AS1 mRNA 相对表达量低于Blank 组(P<0.05);且Si LncRNA FEZF1-AS1-1 组、Si LncRNA FEZF1-AS1-2组、Si LncRNA FEZF1-AS1-3 组的LncRNA FEZF1-AS1 mRNA 相对表达量也低于Si LncRNA FEZF1-AS1 NC 组(P<0.05)。见表4
表4 各组细胞LncRNA FEZF1-AS1 mRNA相对表达量的比较 (±s)
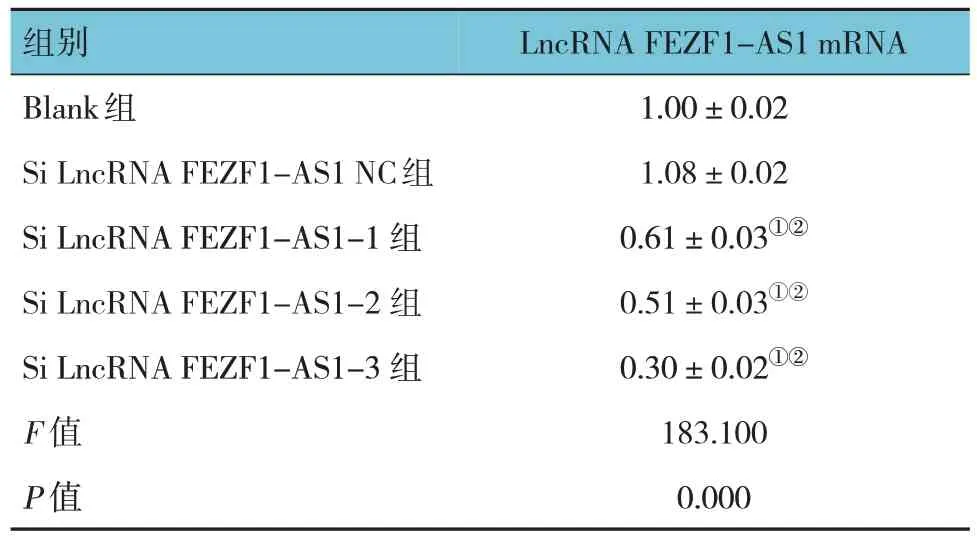
表4 各组细胞LncRNA FEZF1-AS1 mRNA相对表达量的比较 (±s)
注 : ①与Blank 组比较,P <0.05;②与Si LncRNA FEZF1-AS1 NC组比较,P <0.05。
组别Blank组Si LncRNA FEZF1-AS1 NC组Si LncRNA FEZF1-AS1-1 组Si LncRNA FEZF1-AS1-2 组Si LncRNA FEZF1-AS1-3 组F 值P 值LncRNA FEZF1-AS1 mRNA 1.00±0.02 1.08±0.02 0.61±0.03①②0.51±0.03①②0.30±0.02①②183.100 0.000
2.4 沉默LncRNA FEZF1-AS1对细胞增殖的影响
CCK-8 实验结果显示,经析因设计的方差分析,结果显示,Blank 组不同时间点细胞增殖数(OD450)值比较,差异有统计学意义(F=1 733.000,P=0.000);TGF-β1+Si LncRNA FEZF1-AS1 NC 组不同时间点OD450值比较,差异有统计学意义(F=895.400,P=0.000);TGF-β1+Si LncRNA FEZF1-AS1组不同时间点OD450值比较,差异有统计学意义(F=1 383.000,P=0.000)。Blank 组、TGF-β1+Si LncRNA FEZF1-AS1 NC 组及TGF-β1+Si LncRNA FEZF1-AS1组随时间的变化趋势有差别(F=221.250,P=0.000)。见表5。
表5 各组不同时间点细胞增殖的比较 (±s)
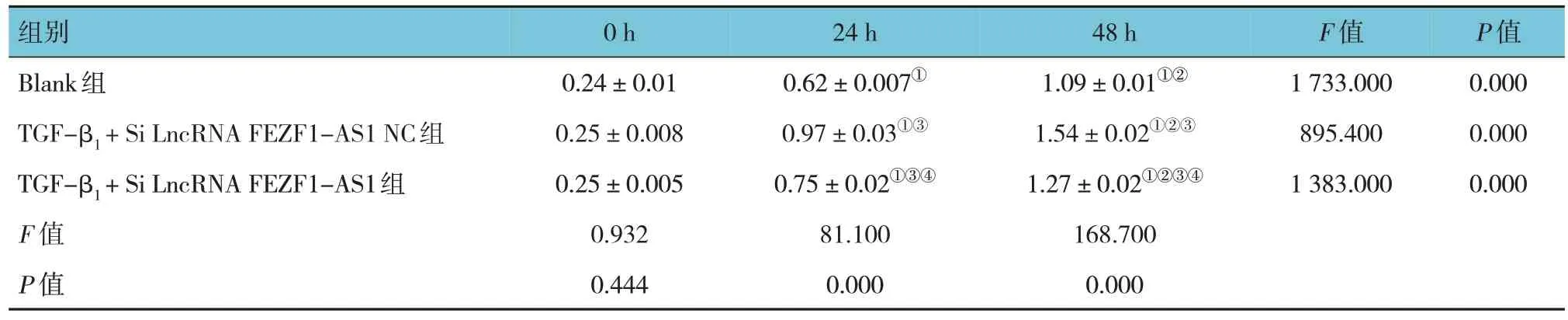
表5 各组不同时间点细胞增殖的比较 (±s)
注 : ①与0 h 比较,P <0.05; ②与24 h 比较,P <0.05; ③与Blank 组比较,P <0.05; ④与TGF-β1 + Si LncRNA FEZF1-AS1 NC 组比较,P <0.05。
组别Blank组TGF-β1 + Si LncRNA FEZF1-AS1 NC组TGF-β1 + Si LncRNA FEZF1-AS1组F 值P 值0 h 0.24±0.01 0.25±0.008 0.25±0.005 0.932 0.444 24 h 0.62±0.007①0.97±0.03①③0.75±0.02①③④81.100 0.000 48 h 1.09±0.01①②1.54±0.02①②③1.27±0.02①②③④168.700 0.000 F 值1 733.000 895.400 1 383.000 P 值0.000 0.000 0.000
2.5 沉默LncRNA FEZF1-AS1 对细胞迁移的影响
细胞迁移实验结果显示,Blank 组、TGF-β1+Si LncRNA FEZF1-AS1 NC 组和TGF- β1+Si LncRNA FEZF1-AS1 组细胞划痕愈合率分别为(27.06±1.64)%、(48.09±1.36)%、(34.31±0.65)%,经方差分析,差异有统计学意义(F=69.110,P=0.000)。两两比较结果显示,与Blank 组比较,TGF-β1+ Si LncRNA FEZF1-AS1 NC 组细胞划痕愈合率升高(P<0.05);与TGF-β1+ Si LncRNA FEZF1-AS1 NC组比较,TGF-β1+Si LncRNA FEZF1-AS1组中细胞划痕愈合率降低(P<0.05)。见图2。
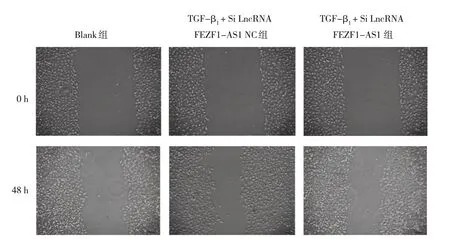
图2 各组细胞划痕愈合的检测 (×100)
2.6 沉默LncRNA FEZF1-AS1 对细胞迁移的影响
Transwell 实验结果显示,Blank 组、TGF-β1+ Si LncRNA FEZF1-AS1 NC 组和TGF-β1+ Si LncRNA FEZF1-AS1 组迁移细胞数分别为(223.00±3.06)、(325.30±2.91)、(272.70±5.78)个,经方差分析,差异有统计学意义(F=153.400,P=0.000)。两两比较结果示,TGF-β1+ Si LncRNA FEZF1-AS1 NC 组迁移细胞数大于Blank 组(P<0.05);TGF-β1+ Si LncRNA FEZF1-AS1 组迁移细胞数小于TGF-β1+ Si LncRNA FEZF1-AS1 NC 组(P<0.05)。见图3。
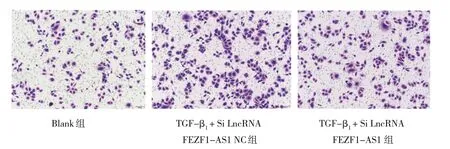
图3 各组细胞迁移的检测 (×100)
2.7 LncRNA FEZF1-AS1基因抑制miR-200c-3p的表达
qRT-PCR 实验结果显示,Blank 组、TGF-β1+Si LncRNA FEZF1-AS1 NC 组和TGF-β1+Si LncRNA FEZF1-AS1 组细胞LncRNA FEZF1-AS1 mRNA 与miR-200c-3p mRNA 相对表达量比较,经方差分析,差异均有统计学意义(P<0.05)。TGF-β1+ Si LncRNA FEZF1-AS1 组LncRNA FEZF1-AS1 mRNA相对表达量低于TGF-β1+ Si LncRNA FEZF1-AS1 NC 组(P<0.05);而TGF-β1+ Si LncRNA FEZF1-AS1 NC 组miR-200c-3p mRNA 相对表达量低于Blank 组(P<0.05);TGF-β1+Si LncRNA FEZF1-AS1组miR-200c-3p mRNA 相对表达量高于TGF-β1+Si LncRNA FEZF1-AS1 NC 组(P<0.05)。见表6。
表6 各组细胞LncRNA FEZF1-AS1 mRNA、miR-200c-3p mRNA相对表达量比较 (±s)
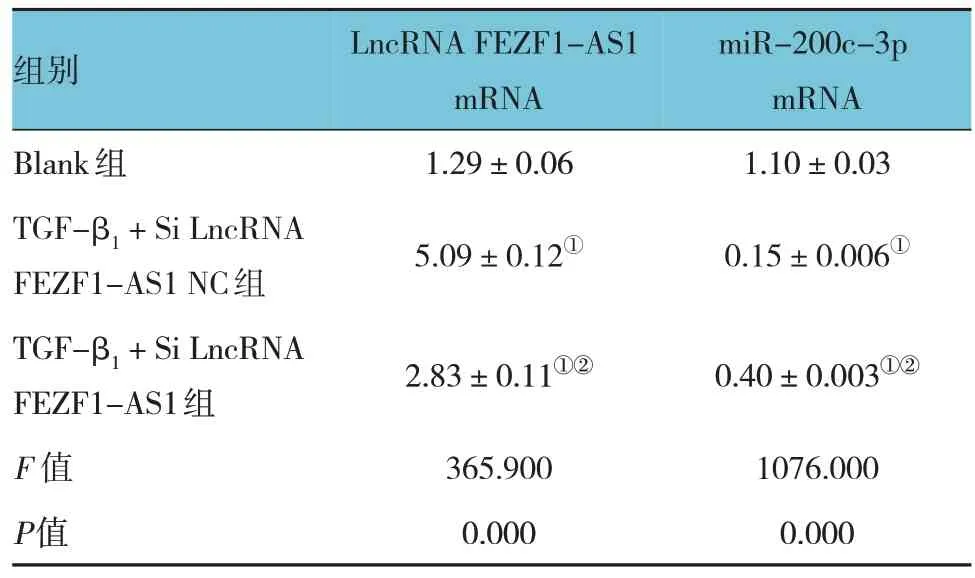
表6 各组细胞LncRNA FEZF1-AS1 mRNA、miR-200c-3p mRNA相对表达量比较 (±s)
注 : ①与Blank 组比较,P <0.05; ②与TGF-β1 + Si LncRNA FEZF1-AS1 NC组比较,P <0.05。
组别Blank组TGF-β1 + Si LncRNA FEZF1-AS1 NC组TGF-β1 + Si LncRNA FEZF1-AS1组F 值P值LncRNA FEZF1-AS1 mRNA 1.29±0.06 5.09±0.12①2.83±0.11①②365.900 0.000 miR-200c-3p mRNA 1.10±0.03 0.15±0.006①0.40±0.003①②1076.000 0.000
2.8 LncRNA FEZF1-AS1 促进肺间质纤维化相关蛋白的表达
Western blotting 检测结果显示,Blank 组、TGFβ1+ Si LncRNA FEZF1-AS1 NC 组和TGF-β1+ Si LncRNA FEZF1-AS1 组细胞E-cadherin、N-cadherin、Vimentin 蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05)。TGF- β1+ Si LncRNA FEZF1-AS1 组E-cadherin 蛋白相对表达量高于TGF-β1+ Si LncRNA FEZF1-AS1 NC 组(P<0.05);TGF-β1+ Si LncRNA FEZF1-AS1 组N-cadherin 蛋白相对表达量低于TGF-β1+ Si LncRNA FEZF1-AS1 NC 组(P<0.05);TGF-β1+ Si LncRNA FEZF1-AS1 组Vimentin 蛋白相对表达量低于TGF-β1+ Si LncRNA FEZF1-AS1 NC 组(P<0.05)。见图4 和表7。
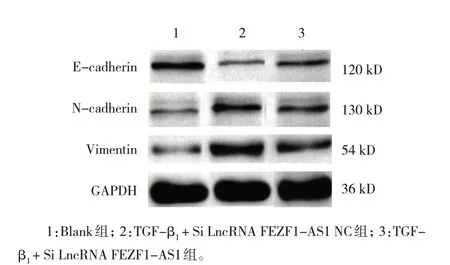
图4 LncRNA FEZF1-AS1促进肺间质纤维化相关蛋白的表达
表7 各组细胞E-cadherin、N-cadherin、Vimentin蛋白相对表达量比较 (±s)
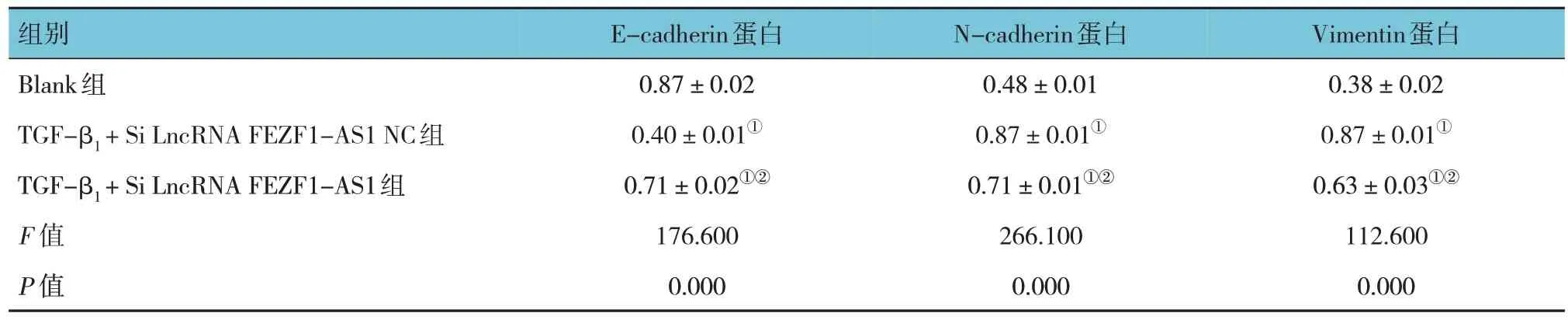
表7 各组细胞E-cadherin、N-cadherin、Vimentin蛋白相对表达量比较 (±s)
注 : ①与Blank组比较,P <0.05; ②与TGF-β1 + Si LncRNA FEZF1-AS1 NC组比较,P <0.05。
组别Blank组TGF-β1 + Si LncRNA FEZF1-AS1 NC组TGF-β1 + Si LncRNA FEZF1-AS1组F 值P 值E-cadherin蛋白0.87±0.02 0.40±0.01①0.71±0.02①②176.600 0.000 N-cadherin蛋白0.48±0.01 0.87±0.01①0.71±0.01①②266.100 0.000 Vimentin蛋白0.38±0.02 0.87±0.01①0.63±0.03①②112.600 0.000
3 讨论
目前国内外研究认为IPF 发病机制主要与EMT有关,认为肺泡上皮细胞间质转化机制,肺成纤维细胞的活化及胶原沉积等在IPF 发病中具有关键的作用[8]。TGF-β1诱导因子可通过多种不同的信号通路调节EMT,是目前IPF 细胞模型复制中较为成熟的方法。LncRNA 作为人类基因组中重要调节因子,在表观遗传、转录及转录后水平、翻译或翻译后水平调控基因表达,与人类疾病的发生、发展密切相关[4]。研究发现,LncRNA FEZF1-AS1 不仅在各种肿瘤细胞的增殖、迁移、侵袭及Warburg 效应中起着至关重要的作用,还参与调节EMT[9]。研究表明抑制LncRNA FEZF1-AS1 可抑制前列腺癌细胞的增殖、侵袭、转移和EMT,发现LncRNA FEZF1-AS1 通过调控前列腺癌中的miR-25-3p/ITGB8 轴促进自噬和EMT[10]。沉默LncRNA FEZF1-AS1 还可抑制非小细胞肺癌NSCLC 的细胞增殖和侵袭,LncRNA FEZF1-AS1 可通过增加E-cadherin 的表达,降低Slug、Twist 和Vimentin 的表达,抑制NSCLC 细胞EMT[11]。研究显示,LncRNA FEZF1-AS1 是肝癌发生、发展中的关键调控因子,沉默LncRNA FEZF1-AS1 基因可通过抑制JAK2/STAT3 信号通路抑制EMT,从而抑制肝癌细胞的侵袭、转移[12]。故目前研究发现LncRNA FEZF1-AS1 在多种肿瘤的EMT 过程中均起着关键作用,但LncRNA FEZF1-AS1 在特发性肺间质纤维化中的作用尚未有报道。本研究首次证实,LncRNA FEZF1-AS1 在特发性肺间质纤维化中明显高表达,LncRNA FEZF1-AS1 在IPF 中促进细胞增殖、迁移、侵袭和EMT 过程,且进一步证实在IPF 中LncRNA FEZF1-AS1 可靶向抑制miR-200c-3p的表达。
本研究EMT 过程中的关键分子选用Ecadherin、N-cadherin 和Vimentin,E-cadherin 是一种Ca2+依赖的、与细胞间黏附密切相关的跨膜糖蛋白,是典型的上皮细胞标志物,E-cadherin 是介导细胞与细胞间黏附的最重要的分子之一,当E-cadherin的表达减少时,细胞间的黏附作用减弱,细胞极性发生改变,导致上皮样细胞进一步向间质样细胞转化。本研究结果也显示,IPF 模型组细胞E-cadherin明显低于对照组细胞,且沉默LncRNA FEZF1-AS1可促进E-cadherin 的表达。而N-cadherin 和Vimentin是间质细胞的重要标志物,N-cadherin 和Vimentin 对维持细胞形态稳定,促进细胞黏附、浸润转移及信号传导均发挥重要作用。本研究结果证实,模型组细胞N-cadherin、Vimentin 表达明显高于空白对照组细胞,敲除LncRNA FEZF1-AS1 基因可抑制Ncadherin、Vimentin 的表达,因此本研究证实LncRNA FEZF1-AS1 在IPF 中促进EMT 的发生。
miR-200c-3p 是目前研究已证实的在IPF 的EMT 发病机制中发挥重要作用调控因子,研究发现miR-200c-3p 在肺间质纤维化患者及动物模型中均显著下调,miR-200c-3p 可抑制肺间质纤维化EMT转化,逆转肺成纤维细胞的纤维原活性[13]。miR-200c-3p 抑制肺泡Ⅱ型上皮细胞异常的EMT,抑制肺泡Ⅱ型上皮细胞向肺泡I 型细胞的转化,进而抑制肺间质纤维化的发生[14]。本研究结果也显示,肺间质纤维化细胞模型中miR-200c-3p 的表达明显低于空白对照组细胞。沉默LncRNA FEZF1-AS1 组细胞中miR-200c-3p 的表达明显高于TGF-β1+ Si LncRNA FEZF1-AS1 NC 组细胞,表明肺间质纤维化中LncRNA FEZF1-AS1 通过靶向抑制miR-200c-3p途径介导疾病EMT 的发生与进展。这也是本研究的创新之处,首次发现IPF 发病机制中LncRNA FEZF1-AS1 对miR-200c-3p 的靶向作用关系。
综上所述,本研究证明LncRNA FEZF1-AS1 通过靶向抑制miR-200c-3p 促进肺间质纤维化细胞增殖、迁移、侵袭和EMT 过程,从而促进肺间质纤维化的发生与进展。本研究对IPF 进展的分子机制有了新的认识,为其治疗提供了潜在的靶点。
