钩吻总碱对肺腺癌细胞增殖和凋亡作用的研究*
2024-05-27金明静李艳萍周欢思杨梅赵昱倩卢春花
金明静, 李艳萍, 周欢思, 杨梅, 赵昱倩, 卢春花
(1.广西中医药大学附属国际壮医医院, 广西 南宁 530200; 2.广西国际壮医医院壮瑶医药研究实验室, 广西 南宁 530200; 3.南宁市第一人民医院 医学实验中心, 广西 南宁 530021)
肺癌作为癌症死亡最主要的原因,是癌症发病的第2 大原因[1],已成为严重危害人类健康的疾病,2020 年肺癌发病率和病死率均随着年龄和人类发展指数等级的升高而逐渐升高[2],由于肺癌早期临床症状及体征隐匿,被确诊时多数已错过最佳治疗时机,其传统手术治疗有限,且对正常组织器官损伤较大,因此寻找新的治疗药物,完善抗肿瘤药物数据显得格外重要。
钩吻(GelsemiumelegansBenth.)为马钱科胡蔓藤属植物全草,有剧毒,以根、叶及全草入药。其别名较多,如断肠草、大茶药、猪人参、葛根、大炮叶、山砒霜等,主要分布在我国广西、云南、福建等长江以南的地区。《千金翼方》中载:钩吻味辛,温,有大毒。主金疮乳痓,中恶风,咳逆上气,水肿,杀鬼疰蛊毒,破瘕积,除脚膝痹痛,四肢拘挛,恶疮疥虫,杀鸟兽[3]。吲哚类生物碱是钩吻的主要有效成分,其中含量最多的是钩吻素子(koumine),其次包括钩吻绿碱(gelsevirine)、钩吻素甲(gelsemine)、胡蔓藤碱乙(humantenine)和钩吻素己(gelsenicine)等[4]。钩吻具有明显的抗肿瘤及镇痛作用,同时具有抗焦虑、修复放射损伤及放射增敏、造血保护、抗炎、抗曲霉菌等作用[5]。早在1984 年,就有学者将钩吻碱注射液应用于临床,观察到其对内脏平滑肌痉挛引起的绞痛和癌性疼痛均有较强的镇痛作用,总有效率高达90%,推测钩吻止痛效果较为可靠,且不具有成瘾性,可作为吗啡、盐酸哌替啶的替代品[6],钩吻醇提物具有一定的抗肿瘤作用,其促进Hela 细胞凋亡,并使Hela 细胞周期阻滞在G2/M 期,G0/G1期也有一定阻滞作用[7],将其与玉叶金花混合提取,既可保持钩吻抗肿瘤的疗效,又降低毒性[8]。有实验发现钩吻总碱(total alkaloids ofGelsemiumelegansBenth., TAG)能抑制人结肠癌细胞HT-29 和人脐静脉内皮细胞的增殖,促进凋亡,并且TAG 对人脐静脉内皮细胞的迁移、侵袭和管腔形成均有抑制作用,从而推测TAG 抗肿瘤作用的机制可能与抑制肿瘤血管新生有关[9-11]。TAG 呈剂量依赖性抑制人舌癌细胞Tca8113增殖、促进凋亡,推测与调控JAK2/STAT3/Survivin 通路有关[12]。对TAG 进行分离纯化得到的9 种吲哚类生物碱对人肝癌细胞HepG2、人肺癌细胞A549、人慢性髓系白血病细胞K562、小鼠胚胎成纤维细胞NIH3T3 均具有抑制作用[13]。MTT 法观察到钩吻生物碱化合物对人肝癌细胞HepG2、人胃癌细胞MGC80-3、人食管癌细胞TE-11 和人结肠癌细胞SW480 增殖有抑制作用,并且发现钩吻生物碱化合物具有抗消化系统肿瘤活性,并具有构效关系[14]。基于此,本文从细胞增殖和凋亡的角度采用形态学、细胞生物学、分子生物学等方法研究TAG 对肺腺癌A549、SPCA1 细胞的作用。
1 材料与方法
1.1 细胞系、药品及试剂
肺腺癌细胞系(A549、SPCA1)由广西国际壮医医院壮瑶医药研究实验室保存。钩吻生药材购自玉林市银丰国际中药港,经广西国际壮医医院壮瑶医药研究实验室陈少峰副主任药师鉴定确认。钩吻素子对照品(纯度:99.45%,编号:T5S0661),钩吻碱甲对照品(纯度:98%,编号:T5S0662)均购自上海陶术生物科技有限公司。DMEM 培养基(美国Gibco 公司,编号:C11995500BT),胎牛血清[依科赛生物科技(太仓)有限公司,编号:FSP500],PBS 缓冲液(编号:P1020)、胰蛋白酶(编号:T1300)均购自北京索莱宝科技有限公司,青霉素-链霉素溶液(编号:C0222)、ECL 化学发光试剂盒(编号:P0018FS)、增强型CCK-8 试剂盒(编号:C0042)、细胞周期与细胞凋亡检测试剂盒(编号:C1052)、Hoechst 33258 染色液(编号:C1018)、Rhodamine 123(编号:C2007)均购自上海碧云天生物技术有限公司,二甲基亚砜(dimethyl sulfoxide, DMSO)[安倍医疗器械贸易(上海)有限公司,编号:196055],Caspase-3(编号:19677-1-AP)、Bcl-2(编号:12789-1-AP)、Bax(编号:50599-2-Ig)、GAPDH 抗体(编号:60004-1-Ig)均购自武汉三鹰生物技术有限公司。
1.2 仪器设备
活细胞动态功能分析系统(美国Sartorius 公司,型号:Incucyte S3),全自动激光四色流式细胞仪(美国BD 公司,型号:BD FACSVia),荧光倒置显微镜(日本Olympus 公司,型号:CKX53),细胞计数器(美国Beckman Coulter 公司,型号:ZⅠ型),多功能酶标仪(美国BioTek 公司,型号:SYNERGY H1M),二氧化碳培养箱(新加坡Esco 公司,型号:CCL-240B-8),高速台式离心机(德国Eppendorf 公司,型号:5424R),置入-80 ℃超低温冰箱冷冻(中国海尔公司,DW-86L626),近红外双色荧光成像系统(德国耶拿公司,型号:UVP Chem Studio 815)。
1.3 方法
1.3.1 TAG 的提取及配制 将钩吻生药材用氢氧化钠NaOH 水溶液浸湿,采取加热回流、减压旋蒸、萃取及蒸干的实验方法提取TAG,配制前溶解于浓度为4 g/mL 的DMSO 储存液,于4 ℃下避光保存。
1.3.2 薄层色谱法 ①对照品溶液的制备:分别称取0.5 mg 钩吻碱甲、钩吻素子对照品,加甲醇溶解制成浓度均为1 mg/mL 的对照品溶液;②供试品溶液的制备:称取0.5 mg TAG,加甲醇溶解制成浓度分别为1 mg/mL 的供试品溶液。吸取制备的供试品和钩吻素子、钩吻碱甲对照品溶液各6 μL 分别点于以羧甲基纤维素钠为黏合剂的硅胶G 板上,以三氯甲烷-甲醇(9∶1)为展开剂,将薄层板饱和10 min,展开、取出、晾干、喷以碘化铋钾试液,可见光下检视。溶质移动距离与流动相前沿移动距离之比值(Rf值)=原点到斑点中心的距离/原点到溶剂前沿的距离。
1.3.3 细胞培养 A549、SPCA1 细胞用含10%胎牛血清、1%青链霉素的DMEM 培养基培养,于37 ℃、5%二氧化碳培养箱中培养。
1.3.4 Incucyte S3 活细胞动态分析系统拟合细胞融合度、EC50 值及观察细胞形态 将处于对数生长期的A549、SPCA1 细胞以4 000 个/孔的细胞密度接种于96 孔板,置于培养箱中培养至细胞贴壁生长,以不加TAG 为对照组,不同浓度的TAG 作为实验组处理细胞,每组设置3 个重复孔,将96 孔板置于活细胞动态分析系统中动态检测48 h,系统根据细胞融合度拟合EC50 值及观察细胞凋亡形态,实验重复3 次。
1.3.5 CCK-8 法检测细胞增殖 将处于对数生长期的A549、SPCA1 细胞消化后,重悬计数调整细胞密度以4 000 个/孔接种于96 孔板,置于细胞培养箱中过夜培养。以不加TAG 为对照组,不同浓度的TAG(50、100 和150 μg/mL)作为实验组处理细胞,每组设置3 个复孔,分别培养24 和48 h,移除各孔中原有的培养基,每孔加入含有10 μL CCK-8 的溶液,将96 孔板重新放回37 ℃、5%二氧化碳培养箱中避光孵育2 h,酶标仪测定450 nm 波长处吸光度,计算细胞生长抑制率,细胞生长抑制率(%)=1-(实验组平均吸光值-背景值)/(对照组平均吸光值-背景值)。实验重复3 次。
1.3.6 集落形成实验检测细胞增殖 选择处于对数生长时期的A549、SPCA1 细胞,重悬计数调整细胞密度以2 500 个/孔接种于12 孔板中,于37 ℃、5%二氧化碳培养箱培养至合适克隆团时,以不加TAG为对照组,不同浓度的TAG(50、100 和150 μg/mL)作为实验组处理细胞48 h,每组设置3个复孔,结晶紫染色。扫描仪扫描12 孔板,用Image J 软件对克隆团进行分析。实验重复3 次。
1.3.7 Hoechst 33258 染色检测细胞凋亡 取对数生长期A549、SPCA1 细胞,重悬计数调整细胞密度以5 000 个/孔接种于12 孔板中,置于细胞培养箱中培养,细胞贴壁后以不加TAG 为对照组,不同浓度的TAG(50、100 和150 μg/mL)作为实验组处理细胞48 h,染色时各孔加入500 μL Hoechst 33258 染色液,充分覆盖住待染色的样品,放置细胞培养箱中避光培养30 min 后弃染色液,用无菌PBS 洗3 次,荧光倒置显微镜观察细胞凋亡情况。
1.3.8 Rhodamine123 染色检测细胞凋亡 取对数生长期A549、SPCA1 细胞,重悬计数调整细胞密度为1×105/mL 接种于6 孔板中,置于细胞培养箱中培养,细胞贴壁后以不加TAG 为对照组,不同浓度的TAG(50、100 和150 μ g/mL)作为实验组处理细胞48 h,染色时吸除旧培养基,用无菌PBS 洗涤2 次,在37 ℃黑暗环境下用2 μmol Rhodamine 123染色30 min,用无菌PBS 洗涤2 次收集细胞,流式细胞仪检测细胞凋亡。
1.3.9 Western blotting 检测Caspase-3、Bcl-2、Bax 蛋白表达 以不加TAG 为对照组,不同浓度的TAG(50、100 和150 μg/mL)作为实验组处理细胞48 h,胰酶消化细胞,PBS 清洗2 次,组织裂解液(RIPA)提取蛋白。蛋白样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)并转至聚偏二氟乙烯膜(PVDF)上,封闭液封闭,加入Caspase-3、Bcl-2、Bax及内参蛋白GAPDH 抗体孵育,ECL 显色液在PVDF膜上显色,在近红外双色荧光成像系统中测定各组蛋白条带。
1.3.10 PI染色法检测细胞周期 选取对数生长期的A549、SPCA1 细胞,细胞密度以1×105/mL 接种于6孔板中,细胞贴壁后以不加TAG为对照组,不同浓度的TAG(50、100 和150 μg/mL)作为实验组处理细胞48 h,胰酶消化后使用PBS 洗涤2 次,加入经预冷后的乙醇,4 ℃固定过夜,PI 染色液37 ℃避光温浴30 min。染色后使用流式细胞仪检测细胞周期的分布。
1.4 统计学方法
数据分析采用GraphPad Prism 9.5 统计软件,数据分析以均数±标准差(±s)表示,比较用方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 薄层色谱法鉴定结果
在TAG 供试品薄层色谱中(见图1),与钩吻素子、钩吻碱甲对照品相应位置显现相同橙色斑点,对照品的斑点的Rf 值分别为0.63 和0.45,斑点清晰,Rf 值适中,因此可鉴别TAG 中含有钩吻素子、钩吻碱甲。

图1 TAG薄层色谱图
2.2 Incucyte S3活细胞动态分析系统拟合细胞融合度、EC50值及观察细胞形态
根据不同浓度的TAG 作用细胞48 h 的细胞融合度改变,Incucyte S3 活细胞动态分析系统拟合出A549、SPCA1 细胞的EC50 值分别是99.2、82.0 μg/mL(见图2),因此确定后续TAG 对A549、SPCA1 细胞增殖、凋亡等实验中的低、中、高浓度,依次为50、100、150 μg/mL。随着TAG 浓度的增加,细胞数量逐渐减少,细胞融合度降低,生长状态逐渐变差,部分细胞形态变小变圆,大小不一,药物作用呈浓度依赖性(见图3)。

图2 TAG作用A549、SPCA1细胞48 h细胞融合度的改变及EC50值

图3 各组A549、SPCA1细胞48 h的细胞形态 (×10)
2.3 TAG抑制A549、SPCA1细胞的增殖
采用CCK-8 法检测TAG 对A549、SPCA1 细胞增殖的影响,结果显示,与对照组比较,TAG100、150 μg/mL 组干预A549、SPCA1 细胞后能明显抑制细胞的增殖,随着TAG 作用浓度增加和时间的延长,A549、SPCA1 细胞抑制率逐渐升高(P<0.05)(见表1)。集落形成实验结果显示,100 和150 μg/mL 浓度的TAG 处理A549 细胞48 h 后,TAG 细胞克隆形成显著减少(见图4 和表2)。
表1 各组A549、SPCA1细胞24和48 h细胞抑制率的比较 (±s)
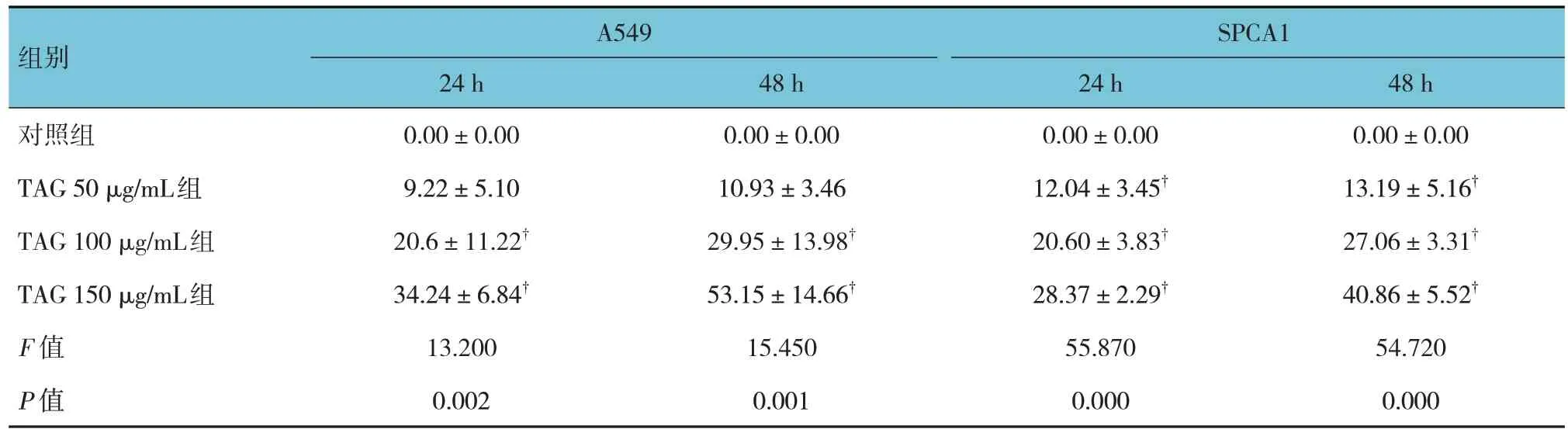
表1 各组A549、SPCA1细胞24和48 h细胞抑制率的比较 (±s)
注 : †与对照组比较,P <0.05。
组别对照组TAG 50 μg/mL组TAG 100 μg/mL组TAG 150 μg/mL组F 值P 值A549 24 h 0.00±0.00 9.22±5.10 20.6±11.22†34.24±6.84†13.200 0.002 48 h 0.00±0.00 10.93±3.46 29.95±13.98†53.15±14.66†15.450 0.001 SPCA1 24 h 0.00±0.00 12.04±3.45†20.60±3.83†28.37±2.29†55.870 0.000 48 h 0.00±0.00 13.19±5.16†27.06±3.31†40.86±5.52†54.720 0.000
表2 各组A549、SPCA1细胞集落面积的比较 (±s)
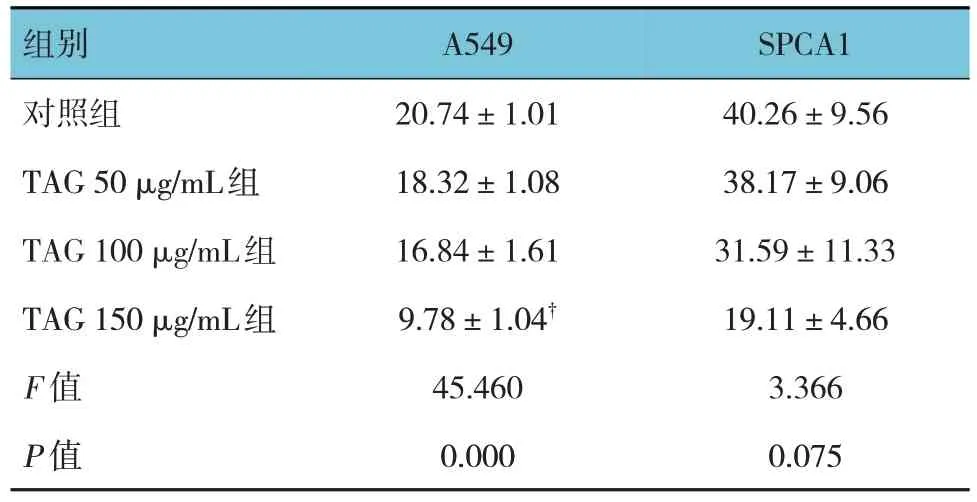
表2 各组A549、SPCA1细胞集落面积的比较 (±s)
注 : † 与对照组比较,P <0.05。
组别对照组TAG 50 μg/mL组TAG 100 μg/mL组TAG 150 μg/mL组F 值P 值A549 20.74±1.01 18.32±1.08 16.84±1.61 9.78±1.04†45.460 0.000 SPCA1 40.26±9.56 38.17±9.06 31.59±11.33 19.11±4.66 3.366 0.075
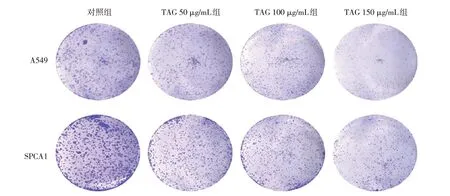
图4 TAG抑制A549、SPCA1细胞集落形成
2.4 TAG促进A549、SPCA1细胞凋亡
与对照组比较,50、100 和150 μg/mL 浓度的TAG 处理A549、SPCA1 细胞48 h,经Hoechst 33258染色发现对照组A549、SPCA1 细胞着色均匀,呈规则的圆形,TAG 50、100 和150 μg/mL 组均出现细胞核碎裂、边缘不规则,大小不一,细胞数量减少(见图5)。采用流式细胞术检测Rhodamine123 探针染色荧光强度,发现TAG 50、100 和150 μg/mL 组均出现荧光信号强度增强(见图6)。Western blotting 检测结果显示,给药组Bcl-2 表达下调,Bax 表达上调,Bcl-2/Bax 的比率降低,Caspase-3 的切割活化增加,其中以浓度为150 μg/mL 的TAG 作用最显著(P<0.05),见图7 和表3。以上结果提示TAG 促进A549、SPCA1 细胞凋亡的发生。
表3 TAG对A549、SPCA1细胞相关蛋白表达的影响 (±s)

表3 TAG对A549、SPCA1细胞相关蛋白表达的影响 (±s)
注 : †与对照组比较,P <0.05。
组别对照组TAG 50 μg/mL组TAG 100 μg/mL组TAG 150 μg/mL组F 值P 值A549细胞Bcl-2 1.23±0.22 1.03±0.12 0.61±0.05†0.41±0.02†17.110 0.010 Bax 0.52±0.08 0.84±0.15†0.88±0.07†1.11±0.08†12.180 0.018 Cleaved Caspase-3 0.36±0.09 0.82±0.12†0.84±0.09†1.13±0.06†22.120 0.006 Bcl-2/Bax 2.36±0.05 1.23±0.08†0.70±0.11†0.37±0.00†299.900 0.000 SPCA1细胞Bcl-2 1.73±0.20 0.85±0.17†0.72±0.08†0.54±0.08†27.210 0.004 Bax 0.63±0.06 0.77±0.10 1.32±0.59 2.70±0.47†12.250 0.018 Cleaved Caspase-3 0.51±0.13 0.51±0.11 0.74±0.15 1.78±0.41†13.140 0.015 Bcl-2/Bax 2.76±0.57 1.09±0.09†0.59±0.20†0.20±0.00†27.170 0.004

图5 TAG作用A549、SPCA1 48 h染色后细胞核形态

图6 TAG对A549、SPCA1细胞染色荧光强度变化

图7 TAG对A549、SPCA1细胞相关蛋白表达的影响
2.5 TAG对A549、SPCA1细胞周期的影响
用不同浓度的TAG 处理细胞48 h 后,与对照组比较,细胞周期各个时相的占比发生相应的变化,处于G2/M 期的细胞比例随着TAG 作用浓度的升高而增加,这在A549 细胞中表现得更明显,当TAG 浓度为150 μg/mL 时,G2/M 期的比例达15.55%,而对照组G2/M 期的比例仅8.02%。这表明TAG 使A549、SPCA1 细胞周期阻滞在G2/M 期,诱导细胞凋亡。见图8。
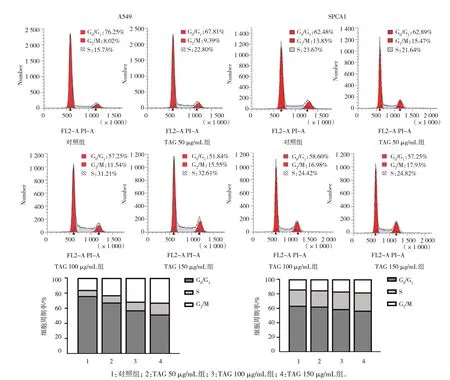
图8 TAG对A549、SPCA1细胞周期的影响
3 讨论
自20 世纪后半叶起,全球科学家们从天然药物中研发小分子抗肿瘤药物,如长春碱(类)、喜树碱(类)、秋水仙碱和高三尖杉酯碱等生物碱在全球范围内批准使用,且至今为临床上常用化疗药物[15]。钩吻作为中国传统瑶药,其化学成分丰富,药理作用广泛,钩吻注射液与放射疗法相结合,可提高肿瘤细胞的放射敏感性,提升治疗肿瘤的疗效[16],有研究发现,钩吻素子依赖ROS 通过NF-κB 和ERK/p38 MAPK 信号通路抑制肝细胞癌的增殖并促进凋亡[17],也能够显著减轻神经损伤后的神经性疼痛,并同时保留对神经性疼痛的抗炎反应[18]。
本课题组前期研究表明,TAG 对人结肠癌细胞HT29、HCT116、人肝癌细胞SMMC7721、HepG2、人舌鳞癌细胞CAL27、人乳腺癌细胞MCF7 等均具有较明显的生长抑制作用,在此基础上本研究进一步探究TAG 对人肺腺癌细胞A549、SPCA1 的作用。首先从钩吻植物中提取TAG,采用薄层色谱法鉴定TAG中含有的化合物钩吻素子、钩吻碱甲,然后从TAG 抑制肺腺癌细胞增殖、促进其凋亡的角度分别采取实验验证。从抑制肺腺癌细胞增殖的角度使用了Incucyte S3 活细胞动态分析系统、CCK-8 法和集落形成实验:Incucyte S3 活细胞动态分析系统拟合出A549、SPCA1细胞的EC50值分别是99.2和82.0 μg/mL,并且观察到给药组细胞融合度降低,细胞数量逐渐减少,生长状态逐渐变差,部分细胞出现凋亡;CCK-8 法观察到TAG 干预A549、SPCA1 细胞后能明显抑制细胞的增殖,且具有浓度和时间依赖性;集落形成实验结果显示TAG 作用A549、SPCA1 细胞后,细胞形成克隆团数下降。从促进肺腺癌细胞凋亡的角度采用Hoechst 33258 细胞核染色、Rhodamine123 线粒体染色、Western blotting 及PI 染色法等实验:Hoechst 33258 细胞核染色后发现给药组出现细胞核碎裂、核固缩,且细胞数目下降;流式细胞术检测Rhodamine123 探针染色荧光强度发现给药组荧光信号强度增强;Western blotting 结果显示Bcl-2/Bax 的比率降低,Caspase-3 的切割活化明显增加;流式细胞术检测到TAG 使A549、SPCA1 细胞周期阻滞在G2/M 期,诱导细胞凋亡。以上研究结果证实TAG 具有抑制肺腺癌细胞增殖、促进凋亡的作用。
细胞凋亡涉及一系列基因的激活、表达及调控,也是评价抗癌药物有效性的指标之一。恶性肿瘤的特征之一是细胞凋亡程序性失控导致的细胞增殖,因此凋亡相关通路可能作为TAG 抗肿瘤研究的重点。Bcl-2 蛋白家族属于线粒体凋亡通路,又被称为内源性凋亡通路,通过调节线粒体功能来调节凋亡,属于凋亡通路中最经典的通路,其中Bcl-2 和Bax 分别作为抗凋亡和促凋亡蛋白。细胞凋亡的线粒体途径表现为线粒体外膜透化作用和细胞色素C的活化,Bcl-2 蛋白家族成员之间通过蛋白-蛋白相互作用来调控线粒体凋亡通路。当细胞受到刺激时Bcl-2/Bax 的比率发生改变,细胞会发生凋亡[19-20]。当凋亡发生时Bax 作用于线粒体外膜,使线粒体通透性发生改变,导致细胞色素C 释放,以诱导Caspase 通路级联反应,放大死亡信号,最终引发凋亡。本研究TAG 作用肺腺癌细胞后Bcl-2/Bax 的比率下降,Caspase-3 切割活化增加,推测TAG 促进肺腺癌细胞凋亡与此相关。Rhodamine123 染色经流式细胞术检测后发现线粒体跨膜电位的增加,可能与Bcl-2/Bax 的比率下降、线粒体通透性改变有关。由此推测TAG 通过降低Bcl-2/Bax 的比率引起线粒体跨膜电位的改变从而激活Caspase-3 发生凋亡。
综上所述,本研究发现TAG 抑制A549、SPCA1增殖并促进凋亡,TAG 具有显著的抗肿瘤作用,是前景广阔的抗肿瘤药物,后续也将进一步研究TAG抗肿瘤作用的分子机制。
