人脐带间充质干细胞对糖尿病肾病大鼠肾脏HIF-1α表达的影响*
2024-05-27高和平米焱王彩丽吴雅茹张丁予魏凯悦
高和平, 米焱, 王彩丽, 吴雅茹, 张丁予, 魏凯悦
(内蒙古科技大学包头医学院第一附属医院 肾内科, 内蒙古 包头 014010)
糖尿病肾病是糖尿病最常见的微血管并发症之一,已经成为终末期肾功能衰竭的重要原因,严重威胁人们的身体健康[1]。由于糖尿病肾病诱发终末期肾脏疾病的发病率高,需要进行肾脏替代治疗的糖尿病肾病患者数量急剧增加,造成巨大的医疗负担和社会经济负担。糖尿病肾病的发病机制十分复杂,有包括炎症因子释放、氧化应激、糖脂代谢紊乱、血流动力学异常及遗传等多因素参与,目前并未完全阐明。近年来,对低氧反应引起糖尿病肾病患者肾功能损伤防治方法的探索成为了关注焦点。缺氧诱导因子(hypoxia-inducible factor-1, HIF-1)是代谢缺氧的主要介质,其异常激活在肾脏疾病的发病中起重要作用。在缺氧条件下,HIF-1 的降解受到抑制,导致HIF-1α 积累。有研究表明,HIF-1α 在慢性缺氧条件下的积累会诱发足细胞上皮间质转化、细胞骨架紊乱、足突消失和裂隙隔膜功能障碍[2]。此外,HIF-1α 也是参与肾脏纤维化的重要因素。HIGGINS 等[3]早在2007年发现,体外低氧环境中HIF-1α 基因过表达小鼠的肾脏小管上皮细胞更易发生细胞上皮间质转化,体内通过沉默HIF-1α 基因减轻肾纤维化模型小鼠的小管间质纤维化;并且,糖尿病肾病患者肾穿刺的肾组织纤维化区域中HIF-1α 基因高表达。同样,HIF-1α 参与慢性肾脏病患者肾小管损伤[4]。近年来,以低氧诱导为治疗靶点开展的临床或基础研究越来越多,基因治疗或新开发的药物均有一定的治疗效果,但现有的治疗药物和方案均不能有效逆转糖尿病肾病的低氧诱导损伤。目前,人脐带间充质干细胞(human umbilical cord mesenchymal stem cell, HUMSC)在糖尿病肾病的损伤修复中发挥了一定作用,HUMSCs 可促进糖尿病肾病大鼠肾脏纤维化的修复和延缓炎症反应[5],但是关于HUMSCs 影响低氧诱导基因表达的研究尚未见报道。
本研究通过复制糖尿病肾病大鼠模型,移植HUMSCs 到其体内,观察糖尿病肾病模型大鼠的肾功能和病理改变、血清HIF-1α 的变化及肾组织HIF-1α 在肾小球和肾小管中分布和表达特点,进一步探讨HUMSCs 对糖尿病肾病低氧诱导的肾损伤的修复作用,以及HIF-1α 表达对糖尿病肾病大鼠肾功能改变的影响。
1 材料与方法
1.1 HUMSCs的体外培养及鉴定
HUMSCs 原代细胞购自北京清大赛尔有限公司。HUMSCs 原代细胞在含10%胎牛血清的DF-12培养基、37 ℃和5%二氧化碳细胞培养箱中培养。当细胞融合度接近80%~90%时传代,并按1∶3 传代接种至细胞皿中,24 h 后换液,每48 h 更换培养液一次,直到细胞贴壁,并观察细胞形态。
在HUMSCs 细胞悬液中加入鼠抗人CD90、CD105、CD44、CD29、CD34 抗体及同型鼠IgG 抗体[贝克曼库尔特商贸(中国)有限公司],避光环境下孵育30 min,随后加入磷酸盐缓冲液(PBS)吹打均匀,1 000 r/min 离心4 min,弃去上清液,重复2 次,再次加入PBS 制成HUMSCs 悬液,留一管做空白对照,采用流式细胞仪进行HUMSCs 活性和免疫表型检测。
1.2 复制糖尿病肾病大鼠模型
50 只健康清洁级8 周龄雄性SD 大鼠[北京维通利华实验动物技术有限公司,实验动物生产许可证号SCXK:(京)2019-0010,实验动物使用许可证号SYXK:(蒙)2020-0003]进行分笼饲养,给予标准大鼠饲料,自由进食及饮水,定期更换垫料,环境温度恒定于25 ℃,每12 h 昼夜交替,适应性饲养1 周。随机选取20 只为健康对照组,其余30 只为模型组进行模型复制。30 只大鼠按35 mg/kg 的剂量腹腔注射链脲佐菌素(Streptozotocin, STZ),连续注射3 d。第4 天每只大鼠尾尖采血测血糖,血糖>16.8 mmol/L 为达标,否则继续补打STZ,直至达到标准。之后继续饲养12 周,直至镜下观察肾脏组织出现损伤为糖尿病肾病大鼠模型复制成功。观察两组大鼠的血糖和体重变化。
1.3 肾脏组织病理检测
第8 周时,随机选取两组大鼠各3 只进行病理检测,模型组肾脏病理损伤不明显;第12 周时,随机选取两组大鼠各5 只进行病理检测,模型组肾脏病理损伤,证明糖尿病肾病大鼠模型复制成功。具体操作:去掉右肾包膜后,沿横轴切开,每一半肾脏再沿横轴切一下,使肾脏薄片变成厚度为原来的1/2,然后固定于4%多聚甲醛,石蜡包埋,4 μm 厚切片进行PAS 和Masson 染色。
1.4 DiR 染料标记HUMSCs 及免疫组织化学检测大鼠肾脏组织CD90、CD44蛋白表达
新鲜配制的近红外荧光(DiR)染料加入计数的HUMSCs 中,37 ℃下避光孵育5 min 后PBS 轻柔清洗细胞2 次,移植备用,避光保存。第12 周,随机选取两组大鼠各3 只分别尾静脉注射DiRHUMSCs,代谢12~16 h 后在小动物活体光学3D 成像系统下观察DiR-HUMSCs 在大鼠体内的分布。为进一步观察移植入健康对照组大鼠和模型组大鼠体内DiR-HUMSCs 在大鼠肾脏的定位分布,本研究采用人源性和鼠源性间充质干细胞特异性抗体CD90、CD44 染色大鼠肾组织。采用颈椎脱臼法处死大鼠,迅速剪开腹部取出肾脏,去掉肾脏外包膜,沿着横轴切开,在每一半肾脏上再沿着横轴切一下,使肾脏薄片变成厚度成为原来的1/2,然后固定于4%的多聚甲醛溶液中,石蜡包埋,4 μm厚切片,依次放入二甲苯Ⅰ(10 min),二甲苯Ⅱ(10 min),无水乙醇Ⅰ(5 min),无水乙醇Ⅱ(5 min),95%酒精(3 min),90%酒精(3 min),80%酒精(2 min),70%酒精(2 min),然后蒸馏水浸洗2 min。将脱蜡水化后的组织加适量的修复液(0.01 mol 枸橼酸缓冲液,pH 6.0),使用微波炉加热至沸腾进行抗原修复,10~15 min 后放入冷水中冷却,PBS 冲洗3 遍。将配制好的3%过氧化氢滴加于模型组大鼠切片组织上以阻断内源性过氧化物酶,室温孵育15 min。用油性笔在组织周围画圈,然后滴加稀释好的一抗;在健康对照组大鼠切片组织上滴加PBS 做阴性对照。加完一抗后于4 ℃冰箱孵育过夜。第2 天,加入聚合物辅助剂,室温或37 ℃孵育20 min。PBS 冲洗后加入辣根过氧化物酶标记的二抗IgG,室温或37 ℃孵育20 ~30 min。切片滴加新鲜配制的DAB 显色液,显微镜下观察,呈棕黄色或棕褐色为阳性。苏木精复染30 s~1 min。水洗后用1%盐酸酒精分化,再用自来水冲洗返蓝。将切片再次自来水冲洗后依次放入70%酒精、80%酒精、90%酒精、95%酒精、无水乙醇Ⅰ、无水乙醇Ⅱ、二甲苯Ⅰ、二甲苯Ⅱ中脱水透明,并风干切片。中性树胶封盖玻片和切片。最后,切片在显微镜下观察或者采集图像。
1.5 HUMSCs移植
以上实验完成后,模型组大鼠剩余19 只,随机选取9 只进行HUMSCs 移植(HUMSCs 移植组)。HUMSCs 移植采用尾静脉注射方式,移植浓度为1×106个/mL 的HUMSCs 500 μ L 至大鼠体内,1 次/周,连续4 周,共28 d。健康对照组9 只大鼠和模型组其他10 只大鼠不做任何治疗。
为进一步观察HUMSCs 在大鼠肾脏的分布,用10% 水合氯醛(300 mg/kg)麻醉剂注射入HUMSCs 移植组大鼠腹腔,待大鼠彻底麻醉后,打开腹腔,快速摘取大鼠肾脏,利用Luminaivis Ⅱ成像仪记录成像。曝光5 min 后,采用小动物活体光学3D 成像系统Living Image®4.5.2 分析、成像。
1.6 大鼠血糖及肾功能指标的检测
移植HUMSCs 治疗后,每周通过断尾尖试纸检测3 组大鼠的血糖,连续检测4 周。移植HUMSCs 治疗4 周后,采用Chemray 800 全自动生化分析仪(深圳雷杜生命科学股份有限公司)检测3 组大鼠的血尿素氮(blood urea nitrogen, BUN)、血清肌酐(serum creatinine, Scr)、尿白蛋白与肌酐比值(urinary protein-creatinine ratio, UACR)水平;采用BCA 蛋白定量法检测3 组大鼠的尿液24 h 尿蛋白定量(24-hour urinary protein quantity, 24 h UPro)水平(试剂盒购自美国赛默飞世尔科技有限公司,货号:23227);采用酶联免疫吸附试验检测3 组大鼠的尿肌酐(urine creatinine, Ucr)水平(试剂盒购自美国赛默飞世尔科技有限公司,货号:EIACUN)。
1.7 酶联免疫吸附试验检测大鼠血清HIF-1α水平
移植HUMSCs 治疗4 周后,采用酶联免疫吸附试验(试剂盒购自武汉伊莱瑞特生物科技股份有限公司,货号:E-EL-R0513c)检测大鼠血清HIF-1α 水平。用蒸馏水按1∶20 稀释洗涤缓冲液;手工洗板,每孔加满洗涤液,静置1 min 后甩尽孔内液体,在吸水纸上拍干,反复洗板5 次;从室温下平衡20 min 后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4 ℃冰箱;设置阴、阳性对照孔和样本孔,阴、阳对照孔中加入阴性对照、阳性对照各50 μL;待测样本孔先加待测样本10 μL,再加样本稀释液40 μL;随后阴、阳性对照孔及样本孔中各加入辣根过氧化物酶(HRP)标记的检测抗原100 μL,用封板膜封住反应孔,37 ℃恒温箱温育60 min;弃去液体,吸水纸上拍干,重复手工洗板5 次;每孔加入底物A、B 各50 μL,37 ℃避光孵育15 min;每孔加入终止液50 μL,15 min 内,测定450 nm 波长处各孔的光密度值。采用Excel 表,以标准品浓度作横坐标,对应光密度值作纵坐标,绘制标准品线性回归曲线,按曲线方程计算各样本浓度。
1.8 3 组大鼠肾脏组织病理检测及免疫荧光染色检测HIF-1α、Aquaporin1、Slc12A3的表达
移植HUMSCs 治疗4 周后,第29 天,采用颈椎脱臼法处死3 组大鼠,迅速剪开腹部取出肾脏,去掉肾脏包膜,沿着横轴切开,在每一半肾脏上再沿着横轴切一下,使肾脏薄片厚度成为原来的1/2,然后固定于4%的多聚甲醛溶液中,石蜡包埋,4 μm 厚切片。一部分采用PAS 和Masson 染色进行肾脏组织病理检测,一部分进行免疫荧光染色检测HIF-1α、Aquaporin1、Slc12A3 的表达:PBS 洗3 次,弃去PBS 后加入0.5% Triton X-100 室温通透20 min,PBS洗2 次并弃去;加入5% BSA,37 ℃封闭1 h,弃去封闭液;加一抗(HIF-1α、Aquaporin 1、SLC12A3),4 ℃孵育过夜;PBS 洗2 次后加二抗抗体,37 ℃孵育1 h;PBS 洗2 次后弃去并加入抗荧光淬灭封片液(含DAPI)。荧光显微镜下观察并拍照。用Image J 1.49软件量化分析荧光图片,结果用平均荧光强度相对值表示。
1.9 统计学方法
数据分析采用SPSS 24.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用单因素方差分析或重复测量设计的方差分析,进一步两两比较用Tukey 法。P<0.05 为差异有统计学意义。
2 结果
2.1 HUMSCs的生化特征和特征性表面标志物
原代HUMSCs 培养贴壁生长,48 ~72 h 传代1 次,传至第3 代时,光镜下观察细胞呈梭状排列,即HUMSCs 外观为成纤维细胞状(见图1A)。流式细胞仪实验证实HUMSCs 的干性标志物CD29、CD44、CD90、CD105 的阳性率分别为99.4%、100%、100%和99.8%,而CD34、CD45、HLA-DR 的阳性率分别为1.3%、1.6%和1.0%(见图1B)。确认本实验中使用的HUMSCs 纯度较高,免疫原性较低。
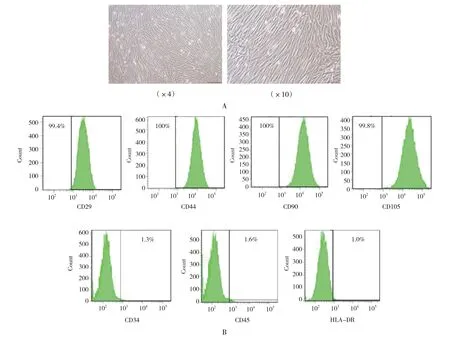
图1 HUMSCs的特征性表面标志物
2.2 健康对照组与模型组大鼠模型复制过程中的一般情况比较
健康对照组与模型组大鼠第0 天的体重和血糖比较,差异无统计学意义(P>0.05)。健康对照组与模型组大鼠第6 天的体重比较,差异无统计学意义(P>0.05);第6 天的血糖比较,差异有统计学意义(P<0.05)。第2、4、6、8、10 和12 周的体重和血糖比较,差异均有统计学意义(P<0.05);模型组较健康对照组体重轻,血糖水平高。见表1 和图2。
表1 健康对照组与模型组模型复制过程中的体重和血糖比较 (±s)
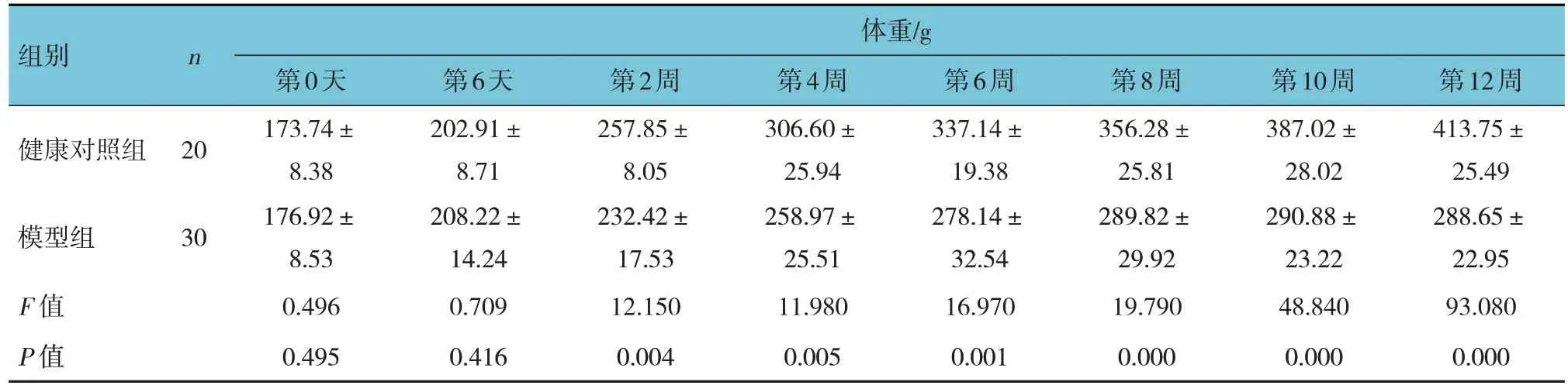
表1 健康对照组与模型组模型复制过程中的体重和血糖比较 (±s)
组别健康对照组模型组F 值P 值n 20 30体重/g第0天173.74±8.38 176.92±8.53 0.496 0.495第6天202.91±8.71 208.22±14.24 0.709 0.416第2周257.85±8.05 232.42±17.53 12.150 0.004第4周306.60±25.94 258.97±25.51 11.980 0.005第6周337.14±19.38 278.14±32.54 16.970 0.001第8周356.28±25.81 289.82±29.92 19.790 0.000第10周387.02±28.02 290.88±23.22 48.840 0.000第12周413.75±25.49 288.65±22.95 93.080 0.000
续表1
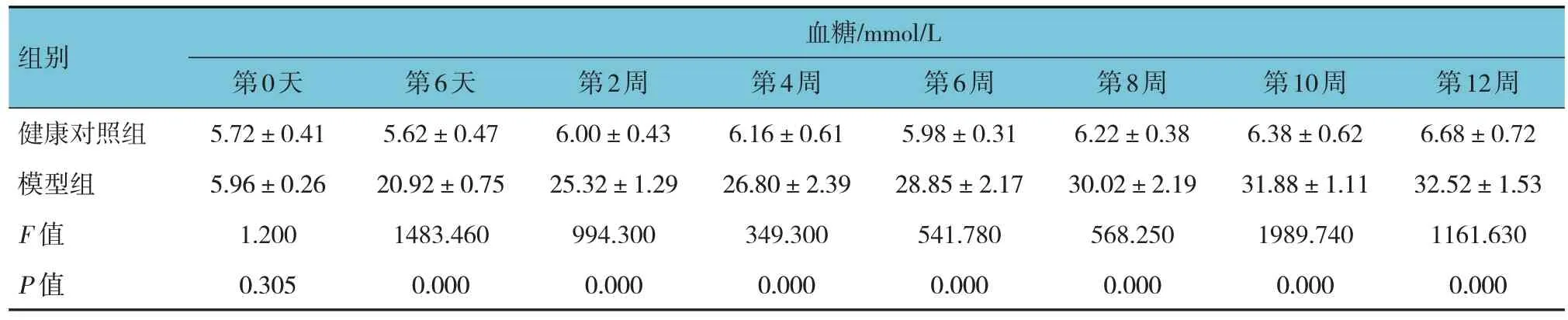
表1 健康对照组与模型组模型复制过程中的体重和血糖比较 (±s)
组别健康对照组模型组F 值P 值血糖/mmol/L第0天5.72±0.41 5.96±0.26 1.200 0.305第6天5.62±0.47 20.92±0.75 1483.460 0.000第2周6.00±0.43 25.32±1.29 994.300 0.000第4周6.16±0.61 26.80±2.39 349.300 0.000第6周5.98±0.31 28.85±2.17 541.780 0.000第8周6.22±0.38 30.02±2.19 568.250 0.000第10周6.38±0.62 31.88±1.11 1989.740 0.000第12周6.68±0.72 32.52±1.53 1161.630 0.000
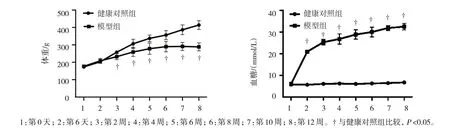
图2 健康对照组与模型组大鼠体重生长曲线和血糖浓度曲线
第12 周时,PAS 染色结果显示模型组大鼠肾脏组织中肾小球基底膜增厚(红色箭头),系膜基质增多(黄色箭头);Masson 染色结果显示胶原纤维蛋白的沉积增加(见图3)。说明糖尿病肾病大鼠模型复制成功。
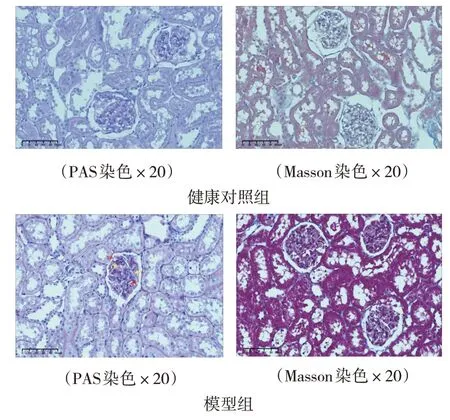
图3 两组大鼠肾脏组织病理图
2.3 HUMSCs在大鼠肾脏的分布
DiR 染料标记的HUMSCs 经尾静脉注射到健康对照组和模型组大鼠体内后,均可在腹部观察到DiR 染料的荧光分布。模型组大鼠体内荧光主要分布在脾胃与胰腺区,而健康对照组大鼠体内主要分布在肝脏区(见图4)。免疫组织化学检测CD90 和CD44 蛋白的表达发现,CD44 蛋白在模型组大鼠肾小球和肾小管区中均表达(见图5,蓝色箭头),CD90 蛋白主要在肾小球中表达(见图5,红色箭头),证明HUMSCs 在模型组大鼠肾脏中定植。
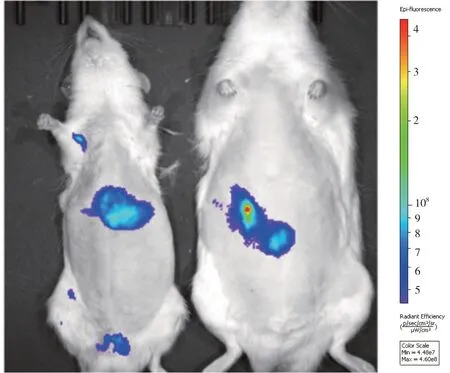
图4 DiR-HUMSCs在大鼠活体内的分布荧光显示图
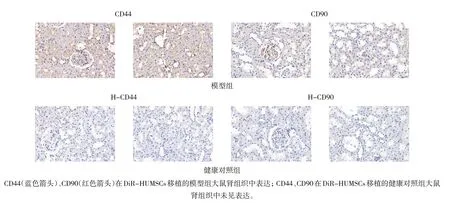
图5 大鼠肾脏组织CD90和CD44蛋白的表达 (免疫组织化学×40)
2.4 HUMSCs对糖尿病肾病大鼠肾脏功能的影响
移植HUMSCs 治疗后,HUMSCs 移植组第1 周注射干细胞后死亡3 只,第2 周注射后死亡1 只,剩余5 只直到实验结束。模型组在与HUMSCs 移植组平行时间的第1 周无死亡,第2 周死亡2 只,第3 周无死亡,第4 周死亡3 只,剩余5 只;健康对照组大鼠对照实验后剩余9 只,到实验结束时大鼠无死亡。
健康对照组、模型组、HUMSCs 移植组大鼠移植HUMSCs 治疗第1、2、3、4 周的血糖比较,经方差分析,差异均有统计学意义(P<0.05)。进一步两两比较,模型组和HUMSCs 移植组血糖高于健康对照组(P<0.05);模型组与HUMSCs 移植组血糖比较,差异无统计学意义(P>0.05)。见表2。
表2 3组大鼠移植HUMSCs治疗期间的血糖比较 (mmol/L, ±s)
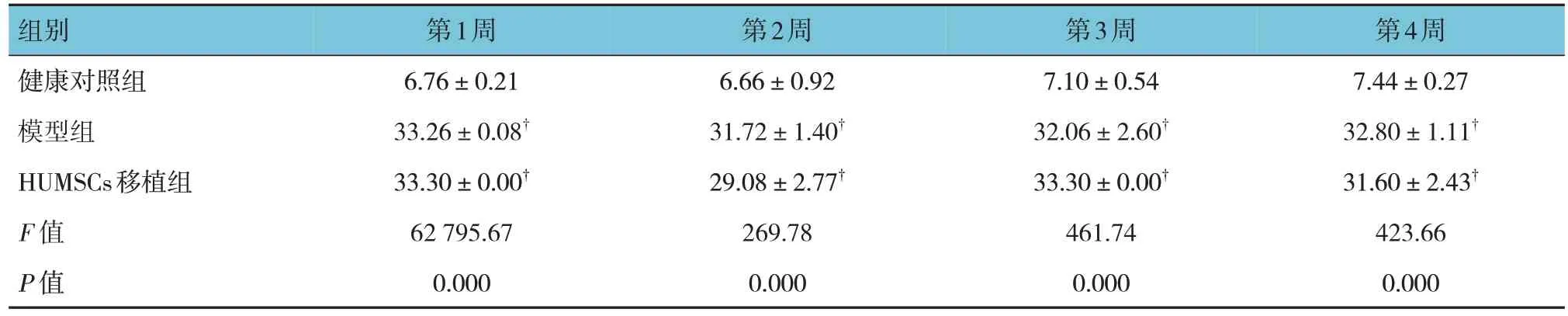
表2 3组大鼠移植HUMSCs治疗期间的血糖比较 (mmol/L, ±s)
注 : † 与健康对照组比较,P <0.05。
组别健康对照组模型组HUMSCs移植组F 值P 值第1周6.76±0.21 33.26±0.08†33.30±0.00†62 795.67 0.000第2周6.66±0.92 31.72±1.40†29.08±2.77†269.78 0.000第3周7.10±0.54 32.06±2.60†33.30±0.00†461.74 0.000第4周7.44±0.27 32.80±1.11†31.60±2.43†423.66 0.000
移植HUMSCs 治疗4 周后,健康对照组、模型组、HUMSCs 移植组大鼠的肾功能指标Ucr、Scr、24 h UPro、BUN、UCAR 比较,差异均有统计学意义(P<0.05)。进一步两两比较,与健康对照组比较,模型组和HUMSCs 移植组大鼠Ucr 水平降低(P<0.05),Scr、24 h UPro、BUN、UCAR 均升高(P<0.05);与模型组比较,HUMSCs 移植组大鼠Ucr 水平差异无统计学意义(P>0.05),Scr、24 h UPro、BUN、UCAR 均降低(P<0.05)(见表3)。相较于模型组,HUMSCs 移植组大鼠的肾脏组织增厚的基底膜被改善,小管空泡变性数量减少,间质纤维化减轻(见图6)。
表3 3组大鼠移植HUMSCs治疗后肾功能指标比较 (±s)
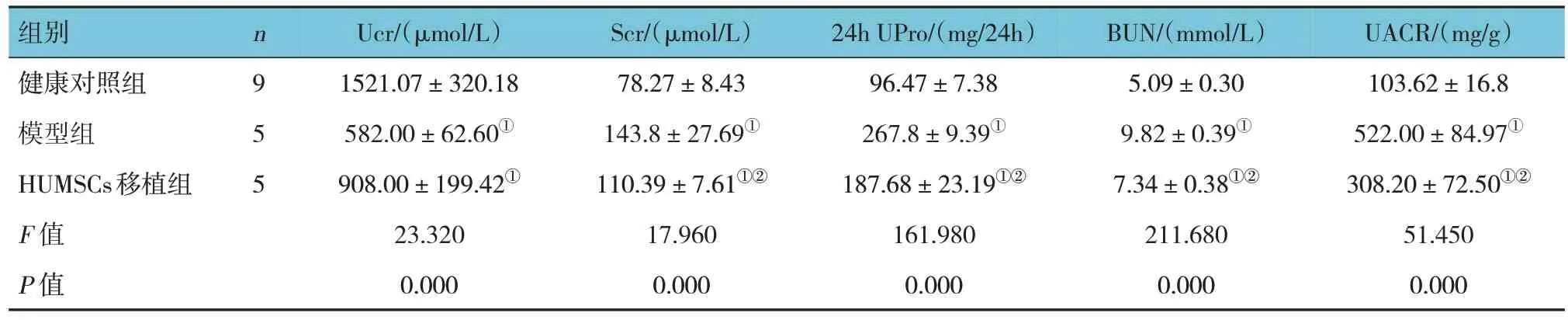
表3 3组大鼠移植HUMSCs治疗后肾功能指标比较 (±s)
注 : ①与健康对照组比较,P <0.05;②与模型组比较,P <0.05。
组别健康对照组模型组HUMSCs移植组F 值P 值n9 5 5 Ucr/(μmol/L)1521.07±320.18 582.00±62.60①908.00±199.42①23.320 0.000 Scr/(μmol/L)78.27±8.43 143.8±27.69①110.39±7.61①②17.960 0.000 24h UPro/(mg/24h)96.47±7.38 267.8±9.39①187.68±23.19①②161.980 0.000 BUN/(mmol/L)5.09±0.30 9.82±0.39①7.34±0.38①②211.680 0.000 UACR/(mg/g)103.62±16.8 522.00±84.97①308.20±72.50①②51.450 0.000
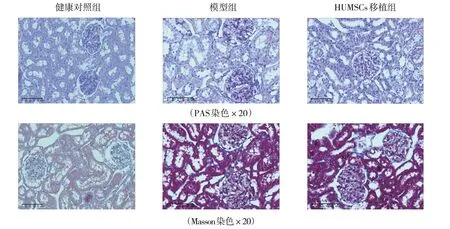
图6 3组大鼠肾脏组织病理切片
2.5 3组大鼠血清HIF-1α水平比较
移植HUMSCs 治疗4 周后,酶联免疫吸附试验检测健康对照组、模型组、HUMSCs 移植组大鼠的血清HIF-1α 水平分别为(42.69±2.76)、(62.15±3.00)、(50.40±3.20) ng/L,3 组比较,差异有统计学意义(F=53.470,P=0.000)。模型组大鼠血清HIF-1α 水平较健康对照组升高(P<0.05),HUMSCs 移植组血清HIF-1α 水平较模型组降低(P<0.05)。见图7。
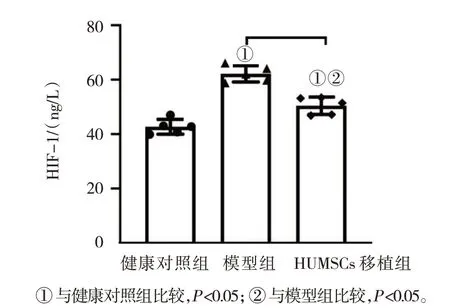
图7 大鼠血清HIF-1α的水平比较
2.6 3 组小鼠HUMSCs 移植治疗后肾脏组织的HIF-1α、Slc12A3、Aquaporin1水平比较
HUMSCs 移植治疗后,免疫荧光染色检测健康对照组、模型组、HUMSCs 移植组大鼠肾脏组织的HIF-1α、Slc12A3、Aquaporin1 水平,3 组比较,差异均有统计学意义(P<0.05)。进一步两两比较,与健康对照组比较,模型组大鼠肾脏远端小管中HIF-1α 蛋白水平升高(P<0.05);HUMSCs 移植组的HIF-1α 蛋白水平较模型组降低(P<0.05)。模型组远端小管标记蛋白Slc12A3 水平低于健康对照组(P<0.05),HUMSCs 移植组Slc12A3 水平较模型组升高(P<0.05)。HUMSCs 移植组的Aquaporin1 蛋白水平较模型组和健康对照组均降低(P<0.05)。见表4。
表4 3组小鼠HUMSCs移植治疗后肾脏组织的HIF-1α、Slc12A3、Aquaporin1蛋白水平比较 (±s)
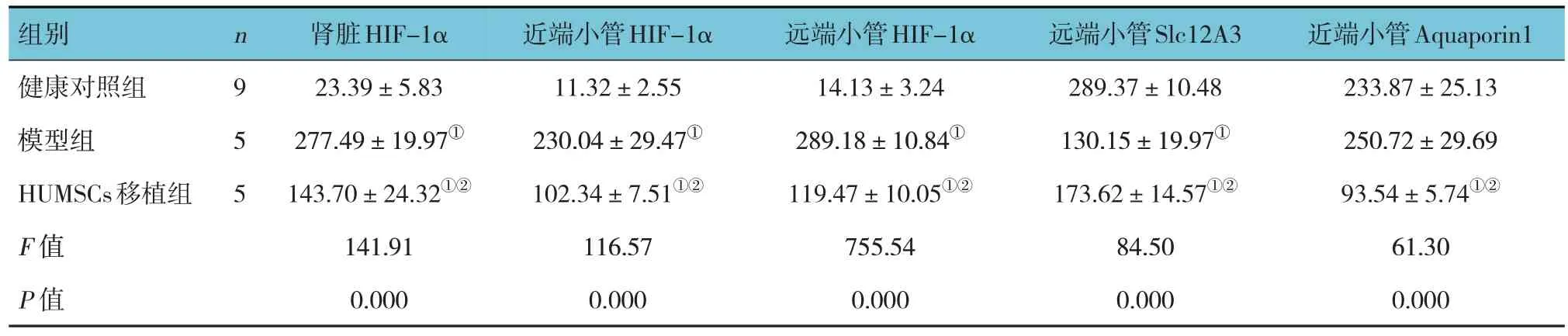
表4 3组小鼠HUMSCs移植治疗后肾脏组织的HIF-1α、Slc12A3、Aquaporin1蛋白水平比较 (±s)
注 : ① 与健康对照组比较,P <0.05; ②与模型组比较,P <0.05。
组别健康对照组模型组HUMSCs移植组F 值P 值n9 5 5肾脏HIF-1α 23.39±5.83 277.49±19.97①143.70±24.32①②141.91 0.000近端小管HIF-1α 11.32±2.55 230.04±29.47①102.34±7.51①②116.57 0.000远端小管HIF-1α 14.13±3.24 289.18±10.84①119.47±10.05①②755.54 0.000远端小管Slc12A3 289.37±10.48 130.15±19.97①173.62±14.57①②84.50 0.000近端小管Aquaporin1 233.87±25.13 250.72±29.69 93.54±5.74①②61.30 0.000
免疫荧光染色显示,HIF-1α 主要在肾小管中大量表达,肾小球中微量表达,说明低氧诱导主要发生在肾小管(见图8A)。3 组小鼠远端小管标记蛋白Slc12A3 表达见图8B,肾脏远端小管发生低氧诱导反应,同时远端小管上皮细胞受损。模型组的HIF-1α 蛋白绿色荧光强度明显强于健康对照组。同时模型组与健康对照组大鼠的HIF-1α 和Aquaporin1 蛋白在近端小管中无共定位,说明HIF-1α 蛋白主要在远端小管中表达和分布。HUMSCs 移植组的HIF-1a 蛋白的绿色荧光信号明显减弱,Aquaporin1 蛋白的表达也显著降低,这进一步说明近端小管的损伤并不是由低氧反应引起(见图8C)。
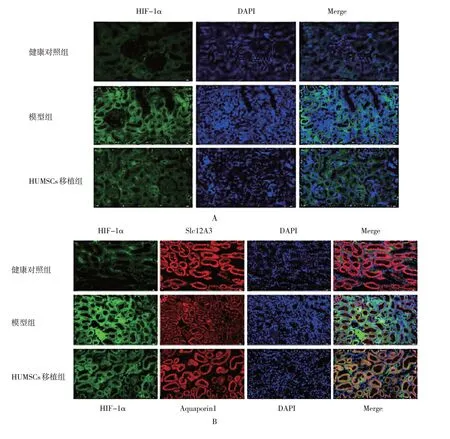
图8 HUMSCs对糖尿病肾病大鼠低氧诱导因子表达变化的影响
3 讨论
本研究发现,HUMSCs 明显改善糖尿病肾病大鼠的生存状态,糖尿病肾病大鼠在移植HUMSCs 后肾功能指标明显好转,此外,HUMSCs 显著延缓了糖尿病肾病大鼠肾脏的病理进展,增厚的肾小球基底膜和增生的系膜基质在移植HUMSCs 后被改善。更重要的是,HUMSCs 抑制糖尿病肾病大鼠体内低氧诱导的损伤,移植后糖尿病肾病大鼠血清HIF-1α 水平明显降低,特别是在治疗后糖尿病肾病大鼠肾脏远端小管中HIF-1α 的表达被显著抑制,这说明HUMSCs 具有调控糖尿病肾病低氧的作用,且可通过抑制HIF-1α 的表达修复肾小管的损伤。
大量的证据表明,间充质干细胞可有效保护和促修复糖尿病肾病肾脏组织[6-7]。LI 等[8]探讨骨髓源间充质干细胞(bone marrow-derived mesenchymal stem cells, BMD-MSCs)对糖尿病大鼠肾功能的保护作用,研究显示,通过尾静脉5 次注射BMD-MSCs 到糖尿病肾病大鼠体内,血清BUN 和Scr 水平,尿液样本中的糖尿、微量白蛋白、UACR,肾脏病理学及动物的生存均被显著改善,但是并未观察到对高血糖的显著影响;BMD-MSCs 移植48 h 后,在肾脏损伤区域发现MSCs 的定位。此外,脐带源间充质质干细胞(umbilical cord-derived mesenchymal stem cells,UCMSCs)也被证实具有延缓STZ 诱导的糖尿病大鼠肾脏疾病进展的作用。CHEN 等[9]的研究发现,对糖尿病肾病大鼠每周输注一次UCMSCs,连续2 周,大鼠的24 h UPro、UCAR、Scr 和BUN 的增加受到抑制,同时,UCMSCs 改善了糖尿病肾病大鼠肾脏的病理损伤,并发现这种改善作用可能是通过UCMSCs 抑制肾脏细胞凋亡,减轻糖尿病肾病大鼠肾细胞损伤和蛋白尿而实现的。本研究发现,HUMSCs 在移植到糖尿病肾病大鼠体内24 h 后会内化到肾脏,可显著降低糖尿病肾病大鼠增加的BUN、Scr、24 h UPro、UACR 水平,明显地改善肾小球的系膜增生和基底膜增厚,减少小管空泡变性,减轻间质纤维化,这表明HUMSCs 有效改善了糖尿病肾病大鼠的肾功能。且在第2 次移植HUMSCs 后,糖尿病肾病大鼠的血糖开始下降,这表明HUMSCs 具有调节糖尿病肾病大鼠血糖的作用。
缺氧反应是肾脏适应缺氧和在不同病理条件下生存的机制。近年来,人们认识到内皮和毛细血管损伤后可以影响肾组织中供氧与耗氧间的平衡,这在糖尿病肾病的进展中发挥重要作用。因此,缺氧被认为是糖尿病肾病发生和发展的重要因素[10]。HIF-1 是代谢缺氧的主要介质,其异常激活在肾脏疾病的发病机制中起重要作用。在缺氧条件下,HIF-1 的降解受到抑制,导致HIF-α 积累。肾脏组织中,HIF-1 在于大多数肾细胞中表达,大部分表达在近端小管、远端小管、连接小管和集合管的细胞中,并在缺氧性肾病中发挥调节炎症、纤维化、细胞凋亡和糖酵解等多种功能[4]。
研究发现,糖尿病肾病患者肾穿刺组织中HIF-1表达紊乱,HIF-1 体系在肾小管间质损伤之前被激活,从而提出高血糖-HIF 通路学说[11]。在正常或缺氧条件下,高血糖可以不同方式激活HIF-1 的表达,如晚期糖基化终产物的合成、蛋白激酶C 激活、促炎细胞因子、线粒体活性氧等[12]。本研究发现,糖尿病肾病大鼠血清HIF-1α 异常升高,其在肾小球和远端小管中均表达增强,并且远端小管中HIF-1α 的表达高于肾小球和近端小管。因此,本研究推测高糖环境下,HIF-1α 是引起糖尿病肾病肾小管损伤的重要基因。
已有研究证明,糖尿病肾病缺氧环境中,HIF-1α 过度活化促进了肾脏间质纤维化,与尿蛋白增多、肾功能减退及肾脏病理形态学的变化密切相关,是糖尿病肾病治疗的靶蛋白[13]。DEBRA 等[3]研究者发现,通过沉默HIF-1α 基因可减轻肾纤维化小鼠模型中的间质纤维化。近年来研究表明HIF-1 是糖尿病肾病的药物钠/葡萄糖协同转运蛋白2(Sodium/glucose cotransporter 2, SGLT2)抑制剂的作用靶点[13-15]。SGLT2 抑制剂可降低体外培养的肾小管上皮细胞中缺氧诱导的HIF-1α 蛋白及其靶基因的表达[13,15],其机制是线粒体耗氧量减少。SGLT2 抑制剂治疗糖尿病db/db 小鼠可减少HIF-1α 在肾小球中表达、减轻小管损伤和间质纤维化[13]。本研究进一步探讨了HUMSCs 对糖尿病肾病大鼠HIF-1α 表达的影响,结果表明,HUMSCs 可显著减少HIF-1α 在糖尿病肾病大鼠肾小球和肾小管中的表达,特别是远端小管细胞中HIF-1α 的表达被明显减弱,同时标记蛋白Slc12A3 蛋白的表达增强。有趣的是,HIF-1α 并不会引起近端肾小管低氧诱导损伤。这些实验结果有力地证明糖尿病肾病肾脏远端小管HIF-1α 因子表达增强可能是诱发肾脏损伤的重要原因。
综上所述,本研究表明HUMSCs 可改善糖尿病肾病大鼠缺氧反应,其能够通过调控HIF-1α 在肾脏远端小管的表达而减缓肾脏损伤。因此,HIF-1α 基因是HUMSCs 治疗糖尿病肾病的重要作用靶点。这可能为糖尿病肾病的治疗提供新的见解和思路。
