饲料中间隔添加壳寡糖对仿刺参生长、非特异性免疫和消化的影响
2024-05-20李肖凡王荣月汤金伟黎睿君
李肖凡, 王荣月, 黄 冲, 汤金伟, 刘 娟, 黎睿君
(大连海洋大学水产与生命学院,辽宁 大连 116023)
仿刺参(Apostichopus japonicus)在分类学上隶属于楯手目(Aspidochirotida)刺参科(Stichopodidae)仿刺参属(Apostichopus),其经济价值和保健价值很高[1]。随着养殖规模和密度的不断增大,水产养殖病害频发[2]。免疫增强剂可以提高水产动物免疫力[3],其中壳寡糖(chitosan oligosaccharide,COS)被证实是一种安全有效的免疫增强剂。COS 是由几丁质脱乙酰基后得到的产物,广泛存在于虾、蟹、昆虫等的外壳及真菌细胞壁中,其代谢产物不具有毒性,具有可生物降解,抗病原微生物等活性,同时,因其优良性质,被广泛应用于医疗[4]、植物抗病[5]和动物养殖中[6]。COS 在水产动物中的作用及对生长性能的研究已被广泛开展。饲料中添加COS,可提高锦鲤(Cyprinuscarpio)和卵圆鲳鲹(Trachinotus ovatus)的生长、免疫力和对病原菌的抗病能力[7-8]。饲料中添加0%~1%不同含量的COS 饲喂8 周,均能改善杂交石斑鱼的生长、肠道健康和对哈维氏弧菌(Vibrio harveyi)的抗病性[9]。Wang 等[10]研究表明,COS具有触发草鱼(Ctenopharyngodon idella)体液免疫的潜在作用,同时也可促进天然IgM 的分泌。刘美思等[11]研究表明,COS 可有效提高仿刺参幼参的生长性能和免疫酶活性。然而长期饲喂免疫增强剂,可能会使机体产生免疫疲劳或免疫抑制现象[12]。有研究表明,在连续饲喂仿刺参壳寡糖28 d后,各免疫指标呈先升高后降低的趋势[13]。进行间隔饲喂的情况下,仿刺参的免疫指标和对照组相比显著增强[14]。
因此免疫增强剂在水产养殖中饲喂频率的探索非常重要。有许多研究通过荧光定位方式,探究壳寡糖在机体内的吸收动力学[15-16]。张朋朋等[17]通过高效液相色谱-质谱联用(LC-MS/MS)检测方法,检测到48 h 后壳三糖在Sprague Dawley(SD)大鼠尿液、粪便中的排泄率分别为7.15%和72.80%。Ouyang 等[18]研究表明,12 h 内,主要集中在团头鲂(Megalobrama amblycephala)肠道中的COS 逐渐被吸收和代谢。因此,不同物种吸收分布时间有一定差异性。关于壳寡糖在仿刺参体内的吸收动力学研究较少。
本实验室前期通过荧光定位实验研究,明确添加0.5%壳寡糖饲喂仿刺参3 d 后,绝大多数COS 能够被吸收代谢。因此,本实验以仿刺参为研究对象,验证3 天1 次的壳寡糖饲喂频率对仿刺参生长、非特异性免疫力、抗病力以及肠道和呼吸树组织学的影响,以期为壳寡糖在仿刺参的健康养殖中的应用提供科学依据。
1 材料与方法
1.1 实验饲料及养殖管理
壳寡糖标准品,脱乙酰度> 95%,聚合度2~10,平均相对分子质量<1 500 u,由中国科学院大连化学物理研究所提供。基础饲料由海泥与配合饲料以2∶1 (质量比)的比例混合过筛,壳寡糖饲料由基础饲料添加0.5%的壳寡糖混合均匀,两种饲料分别制粒,晾晒完成后,-20 °C 保存备用。
养殖实验在大连海洋大学黄海校区进行。健康仿刺参购自大连宝发海珍品有限公司,暂养1 周,养殖期间水温16~18 °C,pH 值为8.00±0.15,盐度为30,水体24 h 充氧,每日18 时饱食投喂体重4%的基础饲料,早上9 时吸除残饵和粪便,并换总水量1/3 的海水。本研究获得了大连海洋大学实验动物伦理委员会批准,实验过程中操作人员严格遵守大连海洋大学伦理规范,并按照大连海洋大学伦理委员会制定的规章制度执行。
1.2 实验方法与样品采集
将204 头仿刺参[平均体重(18.51±0.28) g] 随机分为2 组,每组设3 个平行,每个平行34 头。对照组每日饱食饲喂基础饲料,实验组每3 天饱食投喂1 次壳寡糖饲料,其余时间饱食投喂基础饲料,持续8 周。
养殖实验结束后,禁食24 h,每个平行随机抽取3 头仿刺参作为混合样本,进行免疫指标测定。收集体腔液,以体积比1∶1 加入抗凝剂(0.48 mol/L NaCl、0.019 mol/L KCl、0.02 mol/L EGTA、0.068 mol/L Tris-HCl,pH 7.6),一部分将体腔细胞浓度稀释至2×106个/mL 后,直接用于吞噬活性和呼吸爆发测定。另一部分用超声破碎仪(22 kHz,25×6 s,0 °C)破碎后,4 000 r/min,4 °C,离心10 min,所得上清液-80 °C 保存,用于免疫酶和抗氧化酶的测定。收集肠道和呼吸树,分别称重,以质量比1∶9 的比例加入预冷PBS(磷酸盐缓冲液,pH 7.6)进行匀浆。随后将匀浆液移入1.5 mL 离心管中,4 °C,7 000 r/min,离心20 min,所得上清液于-80 °C 保存,用于免疫酶、抗氧化酶和消化酶活性测定。同时,每个平行随机抽取3 头海参,收集肠道和呼吸树,用4%多聚甲醛固定液固定48 h,用于组织切片制作。每个平行另随机抽取3 头海参,迅速取肠道组织置于无酶离心管中,放入液氮速冻,-80 °C 保存,用于RNA 提取及相关基因测定。
1.3 生长性能
相关生长指标计算公式:
式中,N0为初始头数,Nt为终末头数,W0为初始体重(g),Wt为终末体重(g),t为实验天数(d),Wv为内脏重(g),Wi为肠道重(g),Wb为体壁重(g)。
1.4 体腔细胞吞噬活性和呼吸爆发
吞噬活性和呼吸爆发参考文献,分别采用中性红方法和氮蓝四唑(NBT)还原法测定[19]。
1.5 酶活性测定
采用考马斯亮蓝法测定组织匀浆液蛋白质浓度[20],用于后续肠道和呼吸树组织酶活性计算。体腔细胞、肠道和呼吸树的非特异性免疫酶和抗氧化酶指标均采用南京建成生物工程研究所生产的检测试剂盒和酶标仪(Molecular Devices,美国)测定。非特异性免疫指标包括酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)和总一氧化氮合酶(T-NOS)的活性。抗氧化指标包括超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性、总抗氧化能力(T-AOC)和丙二醛(MDA)含量。严格按照试剂盒提供的说明书进行试验操作,参照试剂盒说明书中的计算公式换算成相应含量或酶活性。其次,测定肠道的消化酶。采用福林酚法[21]、3,5-二硝基水杨酸显色法[21]和橄榄油乳化液法[22],分别检测肠道蛋白酶、淀粉酶和脂肪酶活性。
1.6 肠道、呼吸树组织学切片
固定后的样品经梯度酒精脱水、透明、浸蜡和包埋,在室温下切成5 μm 切片。经脱蜡,苏木精-伊红(H.E)染色后,中性树脂封片。肠道每组选取5 张不连续的切片,每张切片随机选取8 个位点,测量各组织层的厚度。呼吸树随机选择有代表性的切片进行观察并拍照。利用Image Pro Plus 6.0 软件进行肠道切片定量。
1.7 实时荧光定量PCR
仿刺参肠道总RNA 提取参照莫纳试剂盒说明书(Monad)。使用酶标仪测定提取的RNA 浓度,用1%琼脂糖凝胶检测RNA 质量。提取的总RNA 用Prime ScriptTM反转录试剂盒(TaKaRa)将上述提取到的RNA 样品反转录成cDNA。实时荧光定量PCR 实验使用实时定量PCR 仪(Eppendorf)对仿刺参肠道免疫相关基因Aj-tlr3、Aj-c3、Aj-lyz、Aj-sod、Aj-relmRNA 的相对表达水平进行检测(表1),引物均于生工生物工程(上海)股份有限公司合成,本实验中所选用的定量引物参考文 献[23-24]。实 验 体 系 为SYBR®Premix ExTaqTM(Monad) 10 μL,cDNA (100 ng/μL) 2 μL,ddH2O 7.2 μL,引 物F (10 μmol/L) 0.4 μL;引 物R (10 μmol/L) 0.4 μL。基本反应程序为95 °C 预变性10 min;95 °C变性10 s,60 °C 退火10 s,72 °C 延伸20 s,40 个循环。采用2-ΔΔCt法计算目的基因的相对表达量。

表1 内参和目的基因定量引物Tab. 1 Primers of internal reference and target genes
1.8 攻毒实验
养殖实验结束后,实验组和对照组分别随机选取15 头仿刺参,进行病原菌攻毒实验。病原菌为灿烂弧菌(Vibrio splendidus) (登录号:AM422807),来自大连市海珍品疾病防控重点实验室。攻毒前经过活化和复壮,测定LD50为108CFU/mL。将菌液密度调至2×108CFU/mL,采用腹腔注射法,向仿刺参体内注射菌液0.1 mL。于水槽中养殖,观察14 d 内的死亡情况。攻毒期间两组仿刺参分别以养殖实验时的饲喂方式进行投喂。
1.9 数据分析
实验数据采用平均数±标准差(mean±SD)表示,分别通过Excel 2019、SPSS 22.0 和Origin 2019 软件进行统计分析与绘图。采用独立样本T检验比较组间差异性,以P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果
2.1 间隔投喂壳寡糖对仿刺参生长性能的影响
经过8 周的养殖实验,仿刺参的初始体重、终末体重、增重率、特定生长率、脏壁比、肠壁比、存活率见表2。3 天1 次的壳寡糖饲喂频率对仿刺参增重率、特定生长率、存活率无显著影响(P>0.05)。与对照组相比,间隔投喂壳寡糖可极显著提高仿刺参的脏壁比和肠壁比(P<0.01)。
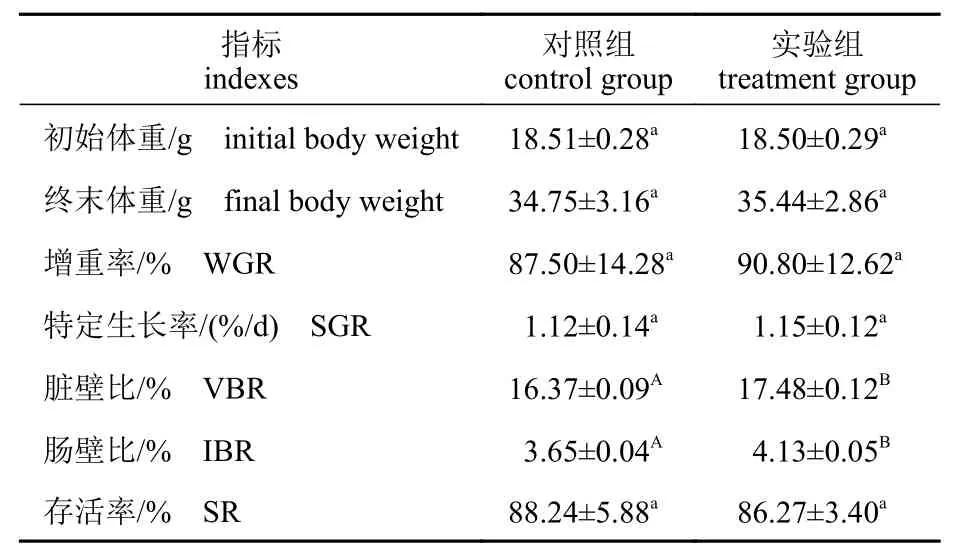
表2 间隔投喂壳寡糖对仿刺参生长性能的影响Tab. 2 Effects of COS feeding frequency once every 3 days on growth performance of A. japonicus
2.2 间隔投喂壳寡糖对仿刺参体腔细胞吞噬活性和呼吸爆发的影响
间隔投喂壳寡糖对仿刺参体腔细胞吞噬活性和呼吸爆发的影响见表3。与对照组相比,3 天1次的壳寡糖饲喂频率可显著提高仿刺参体腔细胞的吞噬活性和呼吸爆发能力(P<0.05)。
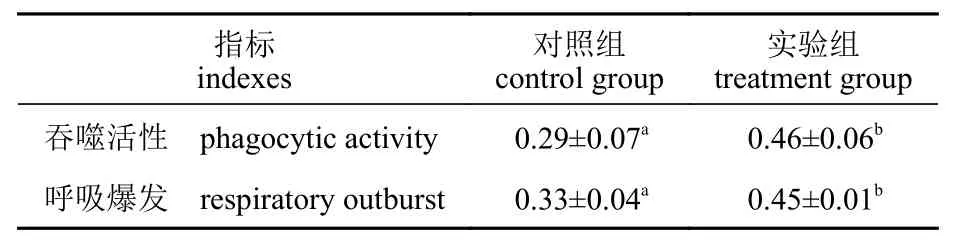
表3 间隔投喂壳寡糖对仿刺参体腔细胞吞噬活性和呼吸爆发的影响Tab. 3 Effects of COS feeding frequency once every 3 days on phagocytic activity and respiratory outburst of coelomocytes of A. japonicus
2.3 间隔投喂壳寡糖对仿刺参非特异性免疫酶活性的影响
间隔投喂壳寡糖对仿刺参体腔细胞、肠道、呼吸树非特异性免疫酶活性的影响见表4。3 天1次的壳寡糖饲喂频率对仿刺参体腔细胞、肠道、呼吸树ACP、AKP、LZM、T-NOS 活性有不同程度的影响。与对照组相比,该方式饲喂壳寡糖显著提高了体腔细胞的ACP 活性(P<0.05),极显著提高了肠道的ACP 活性(P<0.01),较对照组分别提高62.83%和42.12%,但对呼吸树的ACP 活性无显著影响(P>0.05)。3 天1 次的壳寡糖饲喂频率极显著提高了体腔细胞和肠道的AKP 活性(P<0.01),显著提高了呼吸树的AKP 活性(P<0.05),分别提高了20.88%、70.06%和50.05%。同时,该饲喂方式能显著提高体腔细胞的LZM 活性(P<0.05),极显著提高了肠道和呼吸树的LZM 活性(P<0.01),分别提高58.27%、156.00%和30.84%。该方式能显著提高体腔细胞的T-NOS 活性(P<0.05),极显著提高肠道的T-NOS 活性(P<0.01),较对照组分别提高24.27%和43.65%。
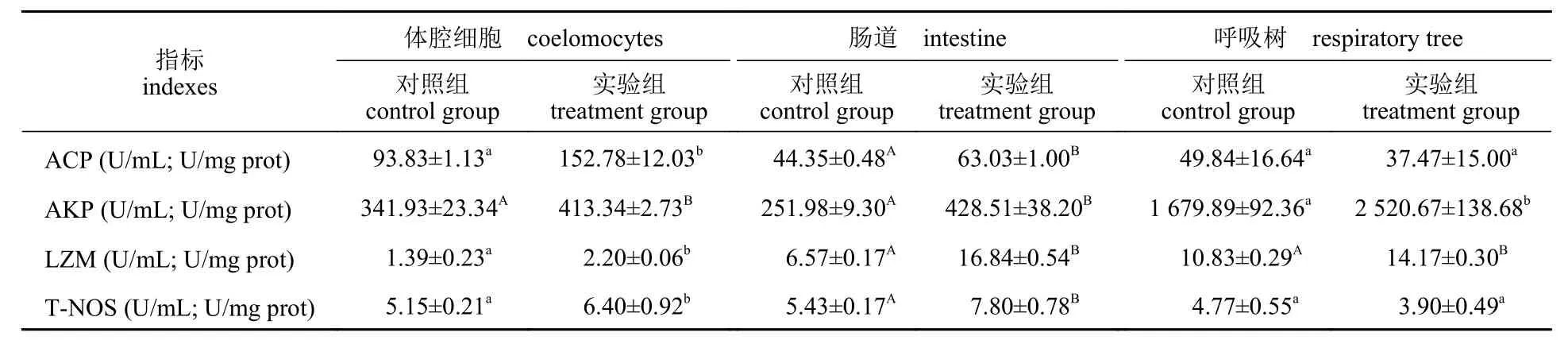
表4 间隔投喂壳寡糖对仿刺参体腔细胞、肠道、呼吸树非特异性免疫酶的影响Tab. 4 Effects of COS feeding frequency once every 3 days on non-specific immunoenzyme activities in coelomocytes,intestine and respiratory tree of A. japonicus
2.4 间隔投喂壳寡糖对仿刺参抗氧化酶的影响
间隔投喂壳寡糖对仿刺参体腔细胞、肠道、呼吸树抗氧化酶活性的影响见表5。3 天1 次的壳寡糖饲喂频率对仿刺参体腔细胞、肠道、呼吸树的SOD、CAT、T-AOC 活性和MDA 含量有不同程度的影响。与对照组相比,间隔饲喂壳寡糖极显著提高了仿刺参体腔细胞CAT 活性(P<0.01),较对照组提高了208%,而对SOD 和T-AOC 活性、MDA 含量无显著影响(P>0.05)。
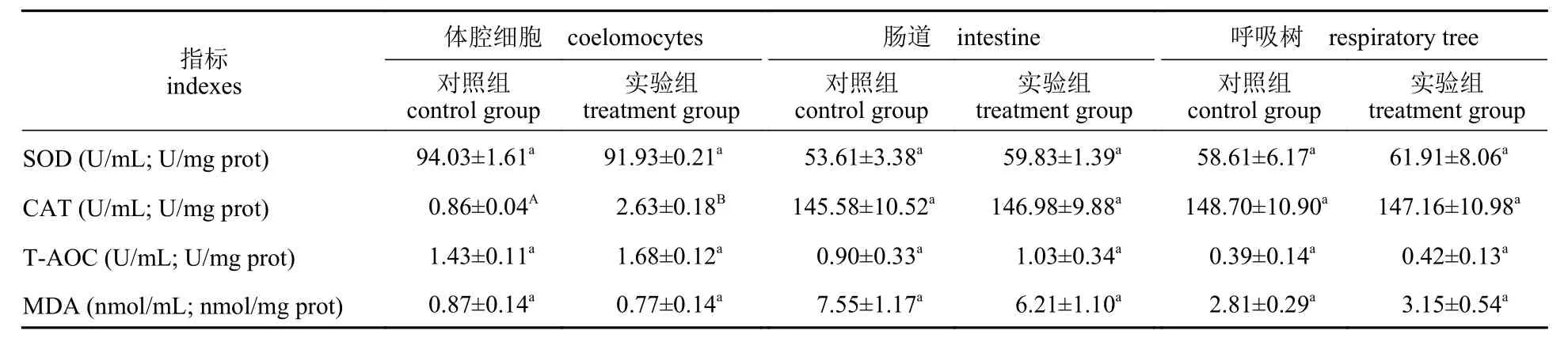
表5 间隔投喂壳寡糖对仿刺参体腔细胞、肠道、呼吸树抗氧化酶的影响Tab. 5 Effects of COS feeding frequency once every 3 days on antioxidant enzyme activities in coelomocytes,intestine and respiratory tree of A. japonicus
2.5 间隔投喂壳寡糖对仿刺参肠道消化酶活性的影响
间隔投喂壳寡糖对仿刺参肠道消化酶活性的影响见表6。与对照组相比,该方式饲喂壳寡糖极显著提高了仿刺参肠道蛋白酶活性(P<0.01),显著提高了仿刺参肠道脂肪酶活性(P<0.05),分别提高了27.92%和11.41%,对仿刺参肠道淀粉酶活性有提高,但无显著差异(P>0.05)。
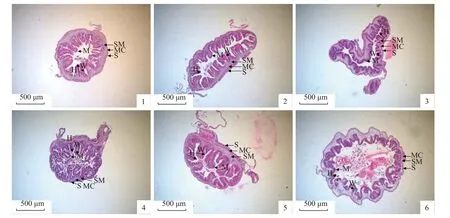
图版 Ⅰ 间隔投喂壳寡糖对仿刺参肠道组织学的影响1~3 分别为对照组前、中、后肠,4~6 分别为实验组前、中、后肠,H.皱襞高度,W.皱襞宽度,M.黏膜层,SM.黏膜下层,MC.肌肉层,S.浆膜层,下同。Plate Ⅰ Effects of COS feeding frequency once every 3 days on the intestinal histology of A. japonicus 1-3. foregut, midgut and hindgut of the control group, respectively; 4-6. foregut, midgut and hindgut of treatment group. H. fold height, W. fold width,M. mucosa, SM. submucosa, MC. muscularis, S. serosa, the same below.
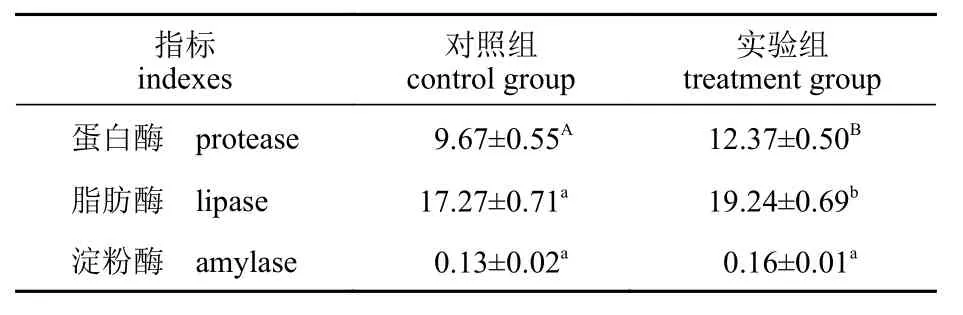
表6 间隔投喂壳寡糖频率对仿刺参肠道消化酶活性的影响Tab. 6 Effects of COS feeding frequency once every 3 days on the intestinal digestive enzyme activities of A. japonicus U
2.6 壳寡糖对仿刺参组织学的影响
组织切片显示,仿刺参肠道由内向外依次为黏膜层、黏膜下层、肌层、浆膜层(图版Ⅰ)。与对照组相比,实验组仿刺参肠道结构更规则,肠绒毛和肌肉层更完整(图版Ⅰ)。肠道切片定量数据如图1 所示,与对照组相比,3 天1 次的壳寡糖饲喂频率极显著地提高了仿刺参前肠肌层和浆膜层厚度(P<0.01),中肠皱襞高度和宽度(P<0.01),后肠皱襞高度和宽度(P<0.01) (图1)。
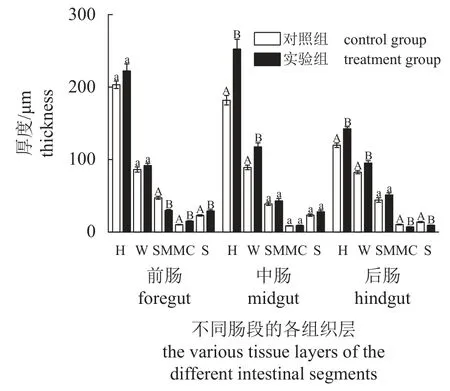
图1 间隔投喂壳寡糖对仿刺参肠道形态参数的影响图中不同小写字母表示组间差异显著(P<0.05),不同大写字母表示组间差异极显著(P<0.01),下同。Fig. 1 Effects of COS feeding frequency once every 3 days on intestinal morphological parameters of A. japonicus Different lowercases stand for significant differences within groups(P<0.05), and different capital letters stand for mean significant differences within groups (P<0.01), the same below.
仿刺参呼吸树呈树状分布于体腔中,其管壁由外向内依次是体腔上皮层、肌层、血腔、内皮层和中央腔[25]。实验组和对照组相比,形态上无明显变化(图版Ⅱ)。在3 天1 次的壳寡糖饲喂频率下,仿刺参呼吸树体腔上皮层的细胞排列紧密,肌肉层界限清晰完整,轻微加厚,血腔中含有大量细胞,内皮层细胞呈脊状向中央腔凸起,中央腔较大且明显(图版Ⅱ)。
2.7 间隔投喂壳寡糖对仿刺参肠道免疫相关基因的影响
间隔投喂壳寡糖对仿刺参肠道5 个免疫相关基因相对表达量的影响如图2 所示。3 天1 次的壳寡糖饲喂频率极显著提高了仿刺参肠道中Ajtlr3、Aj-c3、Aj-lyz、Aj-sod、Aj-relmRNA 的相对表达量(P<0.01),分别提高了41.87%、42.95%、22.04%、14.40%和86.51%。
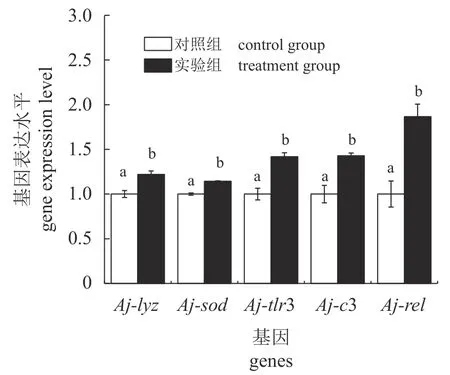
图2 间隔投喂壳寡糖对仿刺参肠道5 个基因相对表达量的影响Aj-lyz.溶菌酶,Aj-sod. Cu-Zn 超氧化物歧化酶,Aj-tlr3. Toll 样受体3,Aj-c3.补体3,Aj-rel. rel 基因。Fig. 2 Effects of COS feeding frequency once every 3 days on relative expression of five genes in intestine of A. japonicus Aj-lyz. lysozyme, Aj-sod. Cu-Zn superoxide dismutase, Aj-tlr3. Toll-like receptor 3, Aj-c3. Complement 3, Aj-rel. rel gene.
2.8 间隔投喂壳寡糖对仿刺参抗病力的影响
灿烂弧菌攻毒后,仿刺参的存活率见图3。与对照组相比,3 天1 次的壳寡糖饲喂频率可以提高仿刺参的存活率,其存活率由53.33%提高至66.67%。
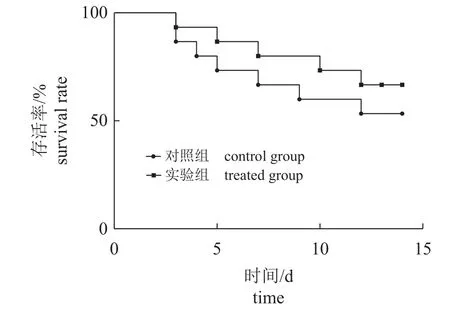
图3 间隔投喂壳寡糖对注射灿烂弧菌的仿刺参存活率的影响Fig. 3 Effects of COS feeding frequency once every 3 days on the survival rate of A. japonicus after challenge test

图版 Ⅱ 间隔投喂对仿刺参呼吸树组织学的影响1. 对照组呼吸树,2. 实验组呼吸树,A. 体腔上层,B. 内皮细胞,C. 血腔,D. 肌层,E. 细胞分泌物,F. 中央腔。Plate Ⅱ Effects of COS feeding frequency once every 3 days on the histology of the respiratory tree of A. japonicus 1. respiratory tree of the control group, 2. respiratory tree of the treatment group. A. coelothelial cell; B. endothelial cell; C. haemocoel; D. muscular layer; E. secretion of endothelial cell; F. center antrum.
3 讨论
3.1 间隔投喂壳寡糖对仿刺参生长的影响
本研究发现,在3 天1 次的饲喂频率下,0.5%壳寡糖能极显著提高仿刺参的脏壁比和肠壁比(P<0.01),但对仿刺参的增重率和特定生长率没有显著影响,与Wang 等[23]研究有一定差异。本研究与徐贵珠[26]的研究相似,其在饲料中添加COS 饲喂60 d 后,中华绒螯蟹(Eriocheir sinensis)的肝胰脏重量、肠道重量显著升高。推测壳寡糖促进生长的机理可能是通过诱导肠道消化酶的表达,促进营养物质的分解;诱导消化器官的生长发育,促进小分子物质的吸收,进而提高生长性能。壳寡糖对不同水产动物生长性能会产生不同的影响[3],针对不同养殖动物的具体作用机制有待进一步研究。
3.2 间隔投喂壳寡糖对仿刺参体腔细胞吞噬活性和呼吸爆发的影响
体腔细胞的吞噬作用是仿刺参吞噬和清除外来物质的重要手段,属于体内防御机制的第一道防线[27-28]。仿刺参体腔液中变形细胞和球形细胞具有吞噬功能,同时,免疫细胞在激活吞噬状态时会产生呼吸爆发作用,释放大量的超氧阴离子和强氧化物(·O2-、·OH、O2和H2O2),具有广泛杀菌和清除异物的功能[29]。有报道称,0.5%壳寡糖饲喂1 周可激活仿刺参体腔细胞吞噬活性,在饲喂4 周内呼吸爆发活性保持在较高水平[13]。1%壳寡糖饲喂仿刺参10 d 后,显著提高了体腔细胞的吞噬活性和吞噬过程中呼吸爆发活性[30]。本研究结果与其相似,3 天1 次的壳寡糖饲喂频率可显著提高仿刺参体腔细胞的吞噬活性和呼吸爆发能力(P<0.05)。推测水溶性的壳寡糖分子本身也具有一定的免疫原性,能够与仿刺参体腔细胞表面受体蛋白相结合,进而激发信号传导,诱导一系列免疫反应,提高仿刺参体腔细胞吞噬活性,产生较多的超氧阴离子,从而提高仿刺参的免疫能力。
3.3 间隔投喂壳寡糖对仿刺参非特异性免疫指标的影响
棘皮动物缺乏脊椎动物中的特异性免疫,因此非特异性免疫能力在仿刺参的免疫防御中发挥着极其重要的作用。本研究中,壳寡糖可通过提高仿刺参体腔细胞、肠道、呼吸树非特异性免疫酶和抗氧化酶活性,加强肠道相关免疫基因的表达,最终提高仿刺参的非特异性免疫能力。ACP和AKP 都是溶酶体酶的标志酶,ACP 可通过水解作用将表面带有磷酸酯的异物破坏,从而加快吞噬细胞对异物的吞噬和降解速率,AKP 能通过改变病原菌的表面结构,发挥调理素的作用[31]。本研究中,壳寡糖间隔投喂可极显著提高肠道的ACP 活性和体腔细胞、肠道的AKP 活性(P<0.01),这与刘均玲等[32]和苏鹏等[33]的研究结果相近。溶菌酶是一种碱性蛋白,不仅能够通过破坏细菌细胞壁的肽聚糖部分防御病害,而且还有消化和滤食海洋细菌的作用[34]。在本研究中,3 天1 次的壳寡糖饲喂频率显著提高了体腔细胞LZM 活性(P<0.05),极显著提高了肠道和呼吸树的LZM 活性(P<0.01),这与李明波等[35]的研究结果相近。同时,实验组肠道Aj-lyz基因表达量极显著高于对照组(P<0.01),与酶活性测定趋势一致,说明3 天1 次的壳寡糖饲喂频率可通过促进溶菌酶活性提高仿刺参的免疫能力。生物体内催化NO 生成的NOS 包括神经型NOS、诱导型NOS 和内皮型NOS,共3 个亚型,其中免疫刺激物能诱导iNOS 产生大量NO,之后产生多种类型的活性氮中间体作为杀菌分子,杀灭细菌、真菌等病原微生物,进而增强机体非特异性免疫功能[36]。本研究中,3 天1 次的壳寡糖饲喂频率极显著提高肠道T-NOS 活性(P<0.01),显著提高体腔细胞和呼吸树的T-NOS 活性(P<0.05),这与刘美思等[11]的研究结果相近。综上所述,该饲喂频率的壳寡糖能刺激仿刺参的免疫系统发挥功能。SOD 和CAT 是抗氧化防御体系中重要的功能酶,可相互关联清除活性氧自由基[37]。本研究中,3 天1 次的壳寡糖饲喂方式极显著提高了仿刺参体腔细胞CAT 活性(P<0.01),并且极显著提高仿刺参肠道Aj-sod基因的表达量(P<0.01)。因此,3 天1 次的壳寡糖饲喂频率对仿刺参的抗氧化能力有一定的促进作用。海参免疫因子是宿主抵御病原菌入侵的主要受体。这些免疫因子包括溶菌酶、模式识别蛋白、Toll 样受体、补体C3 等可能参与海参先天免疫系统的体液因子[38]。Toll 样受体是I 型整体膜糖蛋白家族,主要作用于信号传导,在先天免疫中起着关键作用。在仿刺参中,TLR3 在各组织中广泛表达,并参与对革兰氏阴性菌和dsRNA 病毒的免疫应答[39]。补体是免疫系统的重要组成部分,在维持内部环境的平衡和细菌感染的免疫应答中发挥着关键作用[40]。肠道是机体重要的消化和免疫组织,本研究中,间隔饲喂壳寡糖可极显著提高仿刺参肠道Aj-tlr3、Aj-c3 和Aj-rel基因的相对表达水平(P<0.01),这一结果与肠道非特异性免疫酶活性的响应趋势基本一致。
3.4 间隔投喂壳寡糖对仿刺参消化酶的影响
水产动物消化酶活性的高低能反映其从饲料中消化利用营养物质的能力和效率,进而影响水产动物的生长和发育情况。壳寡糖对不同水产动物肠道和肝胰腺的消化酶活性有着不同的作用效果。本研究中,3 天1 次的壳寡糖饲喂频率下,仿刺参肠道蛋白酶活性极显著高于对照组(P<0.01),肠道脂肪酶活性显著高于对照组(P<0.05),说明此时脂肪和蛋白质为仿刺参提供更多能量,脂肪酶和蛋白酶活性升高。淀粉酶活性与对照组无显著差异,说明碳水化合物作为能量物质的转换相对较少,因此淀粉酶活性变化不大。饲料中添加壳寡糖可提高红鳍东方鲀(Takifugu rubripes)[33]、 珍 珠 龙 胆 石 斑 鱼 [Epinephelus fuscoguttatus(♀)×E.lanceolatus(♂)][41]、 花 鲈(Lateolabrax japonicus)[42]和克氏原螯虾(Procambarus clarkii)[43]的消化酶活性,在本研究中,3 天1 次的壳寡糖饲喂频率也显著提高了仿刺参肠道脂肪酶和蛋白酶活性,因此3 天1 次的壳寡糖饲喂频率较为可行。
3.5 间隔投喂壳寡糖对仿刺参组织学的影响
本实验中,3 天1 次的壳寡糖饲喂频率提高了仿刺参肠道结构的完整性,并且对仿刺参肠道的绒毛高度和肌层厚度有很好的改善作用。肠道是仿刺参对营养物质消化吸收的主要场所,饮食中的物质可以被胃肠道细胞利用,并刺激局部结构的变化[44]。同时,肠道形态变化能反映和评估肠道的功能和肠道的健康状态。肠道绒毛高度及宽度、微绒毛数量及密度、肌层厚度等是影响动物对营养物质进行吸收的重要因素[45]。本研究中,3 天1 次的壳寡糖饲喂频率极显著提高了前肠肌层和浆膜层厚度(P<0.01),以及中肠肠道绒毛高度和宽度(P<0.01),肠绒毛排列规则,发育形态较好。说明该饲喂频率下的壳寡糖有利于仿刺参肠道消化面积的增加,提高营养物质的吸收效率,其机制可能是通过促进肠道黏液的分泌,从而保护肠道绒毛的完整性不被破坏。有研究表明,海参可通过呼吸树吸收溶解在水中的营养物质[46]。本研究中,与对照组相比,实验组仿刺参呼吸树形态无显著变化,因此,3 天1 次的壳寡糖饲喂频率不会破坏仿刺参呼吸树的结构和完整性。
3.6 间隔投喂壳寡糖对仿刺参抗病力的影响
灿烂弧菌是严重威胁仿刺参养殖业持续健康发展的重要病原菌之一,间隔饲喂壳寡糖可提高仿刺参对灿烂弧菌的抗病力。攻毒后的存活率能直观地评价动物机体的免疫抗病能力[47-48]。本实验中,3 天1 次的壳寡糖饲喂频率提高了攻毒后仿刺参的存活率,这同非特异性免疫酶指标结果相似。在攻毒后,实验组和对照组均在同一天开始出现死亡,3 天1 次的壳寡糖饲喂并未延后死亡开始出现的时间,可能是样本量较少,未体现出延缓死亡的效果。但在存活率上,实验组表现更好。有研究证明,壳寡糖能提高吉富罗非鱼(GIFTOreochromis niloticus)对 嗜 水 气 单 胞 菌(Aeromonas hydrophila)的抗病力[49],增强珍珠龙胆石斑鱼抗哈维氏弧菌(Vibrio harveyi)的能力[50],增强仿刺参抗灿烂弧菌的能力[18],本研究中实验组能提高攻毒后刺参的存活率,说明3 天1 次的壳寡糖饲喂频率对仿刺参具有一定的保护作用。结合已有研究,推测这种免疫作用极有可能和肠道、体腔细胞的先天免疫活动有关[51],同时通过直接作用于致病菌细胞膜或通过产生活性氧以抑制其生长[4]。
4 结论
综上所述,以3 天1 次的频率饲喂添加量为0.5%的壳寡糖,能够提高仿刺参生长、免疫、抗氧化能力,改善其肠道功能及形态学特征。因此,养殖中适宜以该方式饲喂仿刺参,以提高其免疫能力。
(作者声明本文无实际或潜在的利益冲突)
