膳食纤维过量摄入对鱼类的致病作用和机制
2024-05-20蔡春芳任胜杰万金娟姚仕彬曹霞敏叶元土
蔡春芳, 任胜杰, 万金娟, 姚仕彬,吴 萍, 曹霞敏, 叶元土
(1. 苏州大学基础医学与生物科学学院,江苏省水产动物营养重点实验室,江苏 苏州 215123;2. 江苏省淡水水产研究所,江苏省现代农业(大宗鱼类)产业技术体系,江苏 南京 210017)
在水产养殖成本中,饲料占一半以上[1]。受动物性饲料原料资源和价格的制约,水产配合饲料中植物性原料的用量越来越高。植物性原料富含膳食纤维(dietary fibers, DFs),这就使养殖鱼类长期处于DFs 高负载状态,但由此带来的生理冲击尚未引起足够的重视。作者及团队多年来的研究表明,DFs 过量摄入可致多种非感染性炎症性疾病,包括出血病、肠炎、腐皮病、烂鳃病、脂肪肝、绿肝症、胆囊肿大、肝胆综合征、白便症等以及暴发性死亡。本文将介绍DFs 的定义、分类、理化特性、可发酵性及常见植物性饲料原料中DFs 的含量,重点介绍作者及团队在鱼类DFs营养生理方面的研究发现,以期为水产病害防控提供新思路,也为水产动物DFs 营养生理研究抛砖引玉。
1 DFs 的定义与分类
1.1 DFs 的定义
相对于六大类营养素,DFs 这一类营养成分定义较晚。文献中可见Hipsley[2]于1953 年首次将其定义为人类消化酶不能消化的植物成分。近20年来DFs 的定义仍在不断更新和完善之中[3-4]。2021 年中国营养学会参考国内外DFs 研究的新进展,对定义进行了更新,明确DFs 是指 “植物中天然存在的、从植物中提取或直接合成的聚合度≥3、可食用的、不能被人体小肠消化吸收的、对人体有健康意义的碳水化合物的聚合物”[4]。大量证据表明DFs 具有强大的生理功能,因此被一些学者称为 “第七营养素”[5]。
DFs 是根据其生理功能定义的一类物质,而人们熟悉的粗纤维是以分离方法定义的一类物质。裸大麦中粗纤维含量约2%,DFs 含量则为30%[6],大豆中粗纤维含量为4.3%,DFs 含量也达30%[7],常被用作饲料的豆渣中DF 更是高达64.8%[8]。
1.2 DFs 的分类
根据DFs 结构的差异,可将其划分为非淀粉多糖(聚合度≥10)、抗性淀粉(聚合度≥10)和抗性低聚糖(聚合度 3~9)[9]。根据DFs 在水中溶解度的不同,可以将其分为可溶性DFs (SDFs)和不溶性DFs (IDFs)[10-11]。SDFs 主 要 有 菊 粉、低 聚 糖、树胶、瓜尔胶、果胶等,IDFs 主要有纤维素、半纤维素和木质素等[11-12]。不同DF 在肠道内的发酵速度、位点及产物也存在较大差异,依据DFs 在肠道中被微生物发酵的程度,还可将其划分为完全发酵类DFs 和部分发酵类 DFs[13]。
2 DFs 的理化特性及可发酵性
DFs 本身不可被单胃动物消化,因此不能直接提供营养,但对营养和代谢具有强大的调节作用,这与DFs 的理化特性及可发酵性有关。
2.1 持水性和膨胀性
DFs 最重要的特性之一是具有较强的持水性和膨胀力[11]。DFs 含有许多亲水性基团,可以吸水和膨胀,1 g 大豆DFs 的持水量可达25 g[14]。大多SDFs 的持水性较强,但DFs 的持水性与其水溶性不完全相关,还与其分子结构有关[15],例如,荔枝渣中IDFs 的持水力比SDFs 还大[16]。通过粉碎、挤压等工艺处理后,DFs 的持水性和膨胀力会有所改变[14,17-18]。
2.2 持油性和吸附性
DFs 具有一定的持油性,能吸附肠道内的油脂,对胆固醇、胆汁酸(BAs)的吸附力也较强[11,19-20],从而降低这些物质的吸收率。研究表明DFs 对脂类的吸附能力取决于其孔隙度而不是分子的亲和力[21-22]。DFs 还会结合、包裹消化酶,从而抑制消化酶的活性[23-24]。
2.3 离子结合与交换能力
DFs 可以结合钙、磷、铁、铜、锰、锌等阳离子,从而影响阳离子的吸收率,抑制重金属的吸收[25]。这是因为DFs 分子结构中含有许多羟基、羧基,可与阳离子结合和交换,包括有机阳离子[17]。鱼类对植物性原料中磷的吸收率较低[26-27],至少部分原因是由于其所含DFs[28-29]。
2.4 发酵性
DFs 是肠道微生物发酵的底物,因此会刺激肠道中微生物的繁殖与发酵[10-11,30],这可能是DFs发挥生理影响的重要途径。DFs 被肠道微生物发酵后会产生乳酸、乙酸、丙酸、丁酸等有机酸[31-32],这些有机酸的过度产生会降低肠道pH,继而又会影响肠道微生物的结构和功能[12,31-32]。不同DFs 的可发酵性不同,纤维素、半纤维素等几乎不发酵,而果胶则可以完全发酵[33],因此,其生理效应也会不同。
3 植物性饲料原料中DFs 含量
植物性饲料原料的干物质中,除了蛋白质、脂类、矿物质、可消化糖之外,其余的大多属于DFs。水产配合饲料常用的植物蛋白源豆粕、菜粕、棉粕、花生粕中DFs 含量均在35%以上。玉米、小麦的加工副产品玉米皮和麸皮中DFs 含量分别为65.4%和35%~50%,用作潜在黏合剂的海藻中DFs 含量也较高(表1)。因此,当配合饲料中植物性原料用量较高时,其DFs 含量就会处于较高水平,普通鱼饲料中DFs 含量常达30%以上。
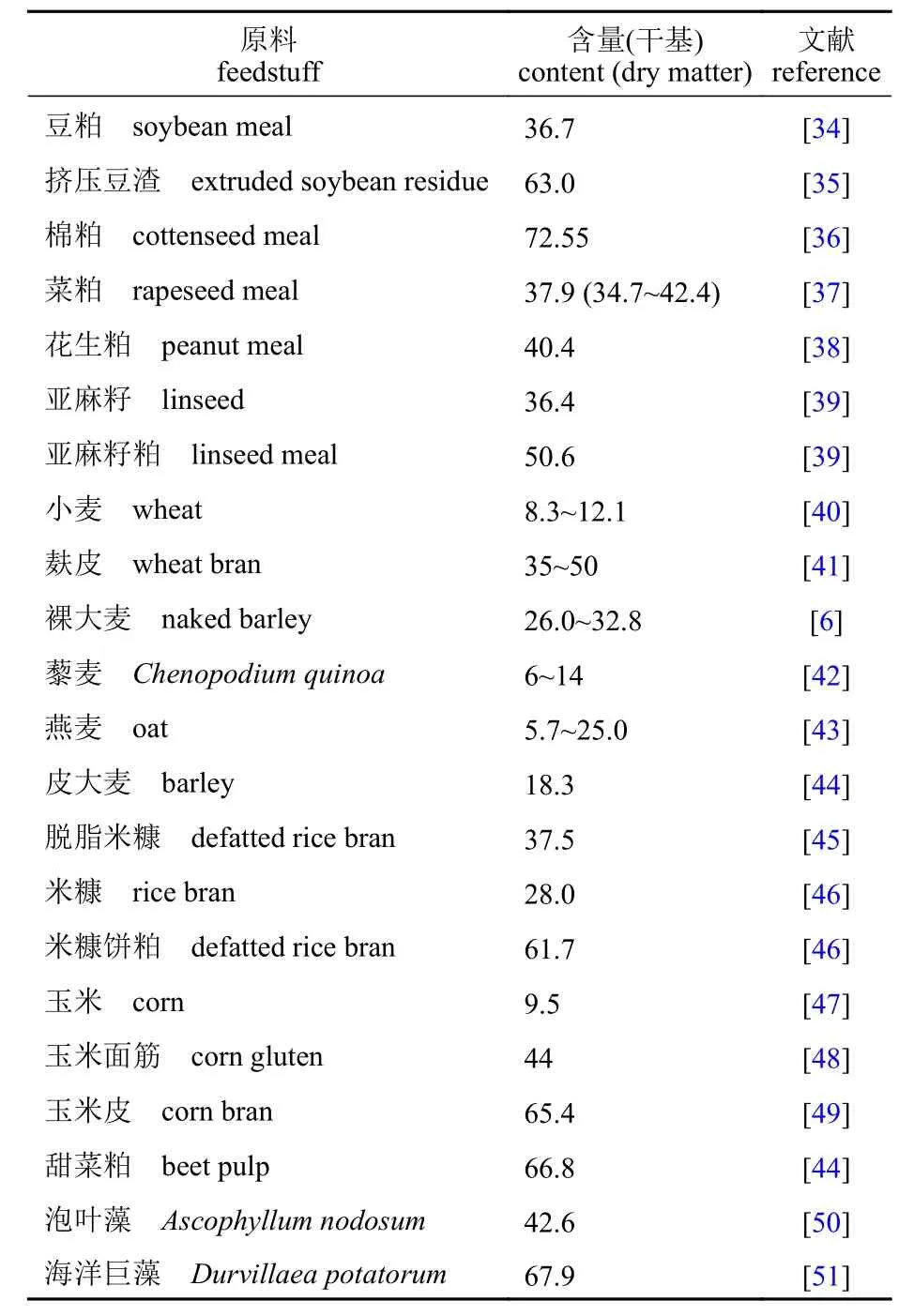
表1 饲料原料及海藻中总膳食纤维 (DFs)含量Tab. 1 Dietary fibers (DFs) content in plant feed ingredients and seaweeds %
4 DFs 的生理效应
4.1 DFs 对健康的改善作用
大量研究表明DFs 对人类健康具有改善作用,因此许多国家都在居民膳食指南中给出了DFs 的推荐摄入量。DFs 可以借助其自身的分子结构特点对肠道内营养物质的消化吸收产生影响,也可以通过结合屏蔽信号分子而发挥生理调控作用。例如,DFs 具有结合BAs、阻碍BAs 重吸收的特性[30],为了维持机体BAs 稳态,肝脏就会代偿性地合成一部分BAs,而合成BAs 的原料是胆固醇,因此,DFs 具有降低胆固醇的作用[30]。此外,DFs 还可以通过影响肠道微生物结构进而影响肠道屏障功能、胃肠道免疫和内分泌反应、氮循环和微生物代谢,这些肠道相关的变化会进一步改变肝脏、肾脏等器官的生理学和生物化学反应[52]。因此,许多慢性疾病,例如糖尿病[53]、肥胖和脂肪肝[32]、高血压[54]、心血管疾病[55]、癌症[56]等都可以通过摄入适量DFs 而得到抑制或缓解。在水产动物上,也有不少研究表明DFs 具有促进生长、提高抗应激能力和免疫力、降低肝脂蓄积等作用(表2)。

表2 膳食纤维(DFs)对水产动物生长和生理的积极影响Tab. 2 Positive effects of dietary fibers (DFs) on the growth and physiology of aquatic animals
4.2 DFs 的抗营养作用
降低消化率和生长性能 如前所述,DFs具有黏性及对营养物质的吸附性,这会导致营养物质消化吸收率下降。在草鱼[66]、尼罗罗非鱼(Oreochromisniloticus)[67]、鲻(Mugilliza)[68]、银 鲫(Carassiusgibelio)[69]、大口黑鲈[70-71]等饲料中添加DFs 均观察到消化率和生长性能下降。本课题组在黄颡鱼(Pelteobagrusfulvidraco)[72]等鱼类中也观察到这种情形。
引起肠道菌群结构改变 肠道微生物参与调节生长发育[73]、代谢[74]、免疫反应[75-76]、营养感知[77]等生理过程,其代谢产物如氨基酸的衍生物、短链脂肪酸、次级BAs 等可穿过肠道上皮进入循环系统,从而发挥更广泛的生理功能[76,78]。肠道微生物结构紊乱必然也会带来许多不利影响。医学研究已表明DFs 过量摄入时可引起肠道微生物结构紊乱[10,79]。在饲喂含30%果胶的黄颡鱼上观察到,其肠道微生物结构从第7 天起出现明显改变,28 d 时与对照组完全不同[80](图1)。大量研究表明,用植物性原料替代鱼粉,肠道微生物结构会发生明显改变[81-83],这可能与植物性原料中含量丰富的DFs 有关。

图1 黄颡鱼摄食对照日粮(CON)和30%果胶日粮(PEC)后肠道微生物结构的分化[80](a) 2 d,(b) 7 d,(c) 14 d,(d) 28 d,(e) 56 d。Fig. 1 Gradual differentiation of gut microbiota structure between P. fulvidraco fed on control diet (CON) and 30% pectin diet (PEC)(a) 2 d, (b) 7 d, (c) 14 d, (d) 28 d, (e) 56 d.
引起组织损伤和死亡 本课题组以大口黑鲈、黄颡鱼、草鱼为对象进行了DFs 营养生理研究,3 种鱼类饲料中DFs 含量分别为15%、20%和50%以上时会出现出血、胆囊肿大、胆汁颜色变化(变深、变淡或变成无色)、溶血、肝脏大小变化(肿大或变小)、肝脏颜色变化(绿肝、白肝、花肝)、肝脂肪变性和纤维化、肠黏膜脱落、肛门红肿、粪便颜色变化(白便或绿便)等症状(图版Ⅰ,图版Ⅱ),并可引起大量死亡,以个体较大的鱼为主。死亡的鱼除了有上述症状外,还表现出体表脱黏毛糙、胸或腹部有胆汁淤积、烂鳍、烂身、烂鳃、肠组织充血、腹水等症状。DFs 营养胁迫会和抓捕、气温突变等胁迫效应叠加,促进疾病的发生和进展。
5 DFs 过量摄入致病的潜在机制
众所周知,DFs 具有结合屏蔽BAs 的能力[11,84],这是DFs 能够发挥降低胆固醇作用的机制所在。但BAs 不仅仅具有乳化脂肪的功能,还是法尼醇X 受体(FXR)的配体。当DFs 过量摄入时,肠道内的一部分BAs 就会被DFs 结合屏蔽,从而抑制了FXR 的活性,而FXR 对BAs 的合成具有负反馈调节功能[85],并参与BAs 循环和炎症反应的调节[86]。FXR 的抑制会导致BAs 过量合成和胆汁淤积,使血清中BAs 剧烈升高(可高至70 倍以上)[72,79,87]。BAs 具 有 细 胞 毒 性 和 溶 血 活 性,高 浓度的BAs 能使生物膜的磷脂和蛋白质脱落,迅速诱导细胞膜损伤和膜洞的形成[88]。当血液中BAs剧烈升高时,损伤和破碎的红细胞增多,其血红素被释放出来,引起溶血现象。血红素在血红素加氧酶的作用下降解为胆绿素(绿色),再由胆绿素还原酶进一步还原为胆红素(黄色)[89]。由于大量血红素在短时间内降解为胆绿素,就使胆汁的绿色加深,肝脏、肠道、皮下等部位也会因胆绿素淤积而呈现绿色,与鱼类养殖中常见的 “胆汁外渗” 现象一致。正常情况下大口黑鲈胆汁中胆绿素较少,呈淡黄色,当DFs 过量摄入时胆汁呈绿色(图版Ⅰ)。当大量胆绿素转变成胆红素时,导致血清和皮肤呈黄色[90],这可能也是黄膘肉的原因。在流行病学研究中发现,饲料是引起大口黑鲈体色发黄的重要原因,更换饲料后体色逐渐正常。
观察到实验鱼长期处于DFs 过量摄入状态时红细胞的渗透脆性下降,这可能是由于红细胞对高BAs 的适应。循环系统中的BAs 水平具有一定的节律性,可以想象,当老弱红细胞由于高BAs被提前破坏和清除后,一段时间内破碎的红细胞数量就会减少,血红素的产生量就低于正常水平,因而胆绿素的产生量也会减少。因此,部分鱼的胆汁颜色就会变浅,甚至无色[87]。胆色素的产生量减少也导致大便内粪胆原减少,粪便变成白色(图版Ⅰ)。

图版 Ⅰ 鱼类膳食纤维(DFs)过量摄入后出现的的肉眼可见病症1. 黄颡鱼体表出血;2. 黄颡鱼绿肝和胆(箭头)肿大; 3. 黄颡鱼白肝,胆汁色深(箭头);4. 大口黑鲈体表出血;5. 大口黑鲈烂身;6. 大口黑鲈出血、胆汁颜色变深(箭头)、腹部肿胀(胀气);7. 黄颡鱼肛门外翻;8. 黄颡鱼饲养7 d 时明显溶血;9. 草鱼白便。Plate Ⅰ Visible symptoms caused by high dietary fiber load in fish 1. hemorrhagia in P. fulvidraco; 2. green liver (arrow) and enlarged gallbladder in P. fulvidraco; 3. white liver and dark green bile (arrow) in P.fulvidraco; 4. hemorrhagia in M. salmoides; 5. rotten body in largemouth bass M. salmoides; 6. bleeding, darkened bile color, abdominal swelling (flatulence) in M. salmoides, white arrow indicating the gallbladder; 7. ectopia cloacae in the P. fulvidraco; 8. obviously hemolyzed after 7 days of feeding in P. fulvidraco; 9. white feces in C. idella.
肝脏中合成的BAs 大多会与牛磺酸或甘氨酸结合,形成胆盐,以降低其疏水性和细胞毒性[91]。鱼类BAs 主要以牛磺酸结合态形式存在[90,92],肝脏中牛磺胆酸占总BAs 的90%以上[90]。当BAs 大量合成时,肝脏中牛磺酸和甘氨酸相对不足,引起游离态BAs 占比大幅度提高[93],从而导致BAs的疏水性提高。研究表明,疏水性BAs 会抑制胆囊肌肉的收缩[94-95],这会使胆汁潴留于胆囊,从而导致胆囊肿大,胆指数升高[72,87,90]。当然,胆囊中BAs 疏水性增强后也会吸收更多的水分以维持其溶解状态,这可能也是胆囊肿大的原因。
BAs 含量越高,疏水性越强,其毒性和溶血活性也越强[96],引起毛细血管损伤,通透性提高[97],从而呈现为出血症状。鳃部毛细血管丰富,因此,烂鳃、出血等症状也会比较明显。
DFs 过量摄入后肝组织中BAs 水平大幅升高(3 倍以上)[87]。研究表明即使远低于产生细胞毒性的浓度,BAs 也可以引起蛋白激酶C (PKC)的活化,PKC 激活p38 促分裂原活化蛋白激酶(p38MAPK)通路,由此进一步激活p53 和核因子kB (NF-kB),激活后的NF-kB 促进编码促炎细胞因子TNF、IL-1β 和IL-6 的基因转录,这些细胞因子又可以正向激活NF-kB,NF-kB 上调和激活后结合FXR 启动子,进一步抑制其转录,从而导致BA 合成亢进和持续性炎症[98],继而引起肝脂肪变性和纤维化[99]、细胞坏死和凋亡[100]。这可能是养殖鱼类肝脏脂肪变性和纤维化的机制所在。
由于DFs 与BAs 的结合是瞬时发生的[101],因而DFs 过量摄入诱导的BAs 合成亢进和炎性反应会在餐后数小时内观察到[80],并于2 d 内就可引起出血、肠炎、烂鳍等症状。如果鱼体代谢能够顺利重塑,肉眼可见的症状会慢慢好转,但低强度的炎性反应持续存在。此时如果采食量(DFs 摄入量)大幅提高,仍可能导致炎症加重甚至诱发炎症因子风暴。
鱼类会通过采食量的自我调节来避免DFs 过量摄入的不利影响。在黄颡鱼上观察到,在第5~8 周采食量明显低于前4 周。其机制尚待研究,可能与DFs 在肠道内的发酵产物丁酸有关,丁酸会产生饱感[102],从而使鱼采食量下降。
不同BAs 具有不同的生理功能。鹅去氧胆酸(CDCA)、脱氧胆酸(DCA)和胆酸(CA)是FXR 的激动剂,T-α-鼠胆酸(T-α-MCA)、T-β-鼠胆酸(T-β-MCA)和熊去氧胆酸(UDCA)是FXR 的抑制剂[103],而肠道微生物决定了BAs 池的大小和种类,DFs又会影响肠道微生物的结构,因此,DFs 过量摄入的致病机制除了经由BAs 直接影响FXR 以外,很可能还因为干扰了肠道微生物的稳态。大量研究提示肠道微生物发酵产生的短链脂肪酸在DFs对宿主健康的影响中起到了桥梁作用[5,31-32,79]。
不同食性的鱼类其肠道微生物结构和BAs 种类不同,肠道微生物发酵DFs 的能力也不同,且DFs 与不同BAs 的结合力差异较大,这可能是不同鱼类对DFs 的耐受性存在种间差异的原因之一。也正因此,DFs 过量摄入对不同鱼类的致病机制也会有所不同。
出血、肠炎、烂鳃、烂身、肝胆综合征等疾病长期困扰着水产养殖业,危害巨大。以出血病为例,发病率可达 50%~100%,暴发后死亡率可高达 20%~80%[104]。对于这些病症,人们已从病原生物的角度开展了大量研究,并注意到该病与饲料有一定的相关性[105-107]。本课题组在调研中也注意到鱼病的发生与饲料品质及摄入量密切相关,例如2022 年苏州地区某大口黑鲈养殖场,选购了两种不同价格的饲料进行了对比实验,结果投喂低价饲料的鱼其脂肪肝、肠炎、烂身、死亡等现象严重,而投喂高价饲料的鱼一切正常,很可能是因为低价饲料中植物性蛋白源用量较高(DFs 含量也高)导致的。2023 年某大口黑鲈养殖场的鱼出现出血、烂身、胀气、胆汁变绿、死鱼等现象,查看投喂记录发现之前投喂量增长幅度较大。由于DFs 过量摄入诱导的炎性反应是全身性的,因而表现出来的症状也是全身性的(图2)。查阅关于鱼类出血病的报道,发现病鱼除了有出血症状,还可见肝脏、胆囊、肠道等器官组织的病变(表3),暗示DFs 过量摄入可能是这些病症的主要诱因,病原生物则可能导致继发感染。
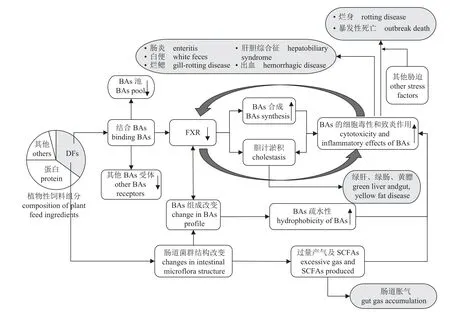
图2 膳食纤维(DFs)诱导鱼类非感染性炎症性疾病的潜在机制BAs. 胆汁酸,FXR. 法尼醇X 受体,SCFA. 短链脂肪酸。Fig. 2 Potential mechanism of dietary fibers (DFs) inducing non-infectious inflammatory diseases in fish BAs. bile acid, FXR. farnesol X receptor, SCFAs. short chain fatty acids.

表3 鱼类患出血病时并发的肝、胆、肠等器官的病变Tab. 3 Pathological changes in organs such as the liver, gallbladder, and intestine associated with hemorrhagic disease in fish
6 过量摄入DFs 致病的对策
6.1 控制投饲量增长幅度
春季气温回升,鱼的采食量增长幅度较大,因而DFs 对BAs 和肠道微生物稳态的干扰作用大。如果DFs 摄入量及其增长幅度超过鱼类代谢重塑能力,就会表现出上述病症,而白便和绿便往往是发病的前期信号。因此,当出现白便、绿便现象时,降低投喂量或改用DFs 含量较低的饲料,鱼病就可以得到扼制。
降低投喂量的作用效果因鱼而异。在大口黑鲈上的效果没有黄颡鱼上好,这可能是因为大口黑鲈抢食凶猛,尽管投喂量下降,但仍有部分鱼能饱食,这些鱼的DFs 摄入量并未下降,因此仍会有陆续死亡现象,且死亡的往往是规格较大的鱼。控制投喂量在鲫、黄颡鱼病情控制上的效果较好。
6.2 调整饲料配方
目前水产饲料标准中使用粗纤维这一指标,DFs 尚未被引入饲料标准,饲料中DFs 限量范围的研究也鲜有报道,但这是从根本上防控DFs 所致疾病的重要途径。控制配合饲料中植物性原料总量,或提高动物性原料用量,有助于病害防控。
决定DFs 致病性的不仅仅是其在饲料中的含量,还与其种类有关。因此,有必要基于DFs 的致病性对植物性饲料原料进行评估和遴选,控制饲料中高致病性DFs 含量。
有证据提示,DFs 可能通过其在肠道中的发酵产物加剧炎症反应[79],因此,对植物性原料先行发酵处理也是降低其致病性的重要抓手。已有大量文献资料和养殖实例表明,发酵过的原料比未发酵的更有利于养殖鱼类生长和健康[117-118]。
养殖鱼类脂肪肝并不完全是由于饲料中脂肪水平过高引起的,也是炎性反应的结果[83]。适当提高饲料脂肪水平(可消化能),降低鱼类采食量,间接降低DFs 摄入量,也有利于鱼类健康。
DFs 致病的机制之一是结合屏蔽BAs,阻碍BAs 的信号传导功能,从而抑制FXR 对BAs 合成的负反馈调节功能和对炎性反应的抑制作用。因此,向饲料中适量添加BAs 可以抑制DFs 的致病性。添加BAs 对改善高DFs 饲料(植物性原料)利用性方面的作用已被反复证明[119-120],今后还需进一步研究适宜的BAs 种类,而这可能还需针对饲料中DFs 的构成进行筛选。
鱼体内结合态BAs 以牛磺酸结合型为主。DFs 过量摄入时游离BAs 增多、BA 毒性增强。因此,可向饲料中适当牛磺酸,使鱼体内结合态BAs 水平提高,从而降低其毒性。已有大量文献报道,在植物蛋白型饲料中添加牛磺酸对鱼类生长和健康有积极作用[121-122]。
6.3 防止多种致炎因子叠加
DFs 的致病特点主要是诱导持续性非感染性炎性反应,一旦与其他致炎因子叠加,很容易引起炎症因子风暴。这些致炎因子包括捕捞和搬运、异常水温及水温突变、水质异常等。养殖鱼类越冬前投喂的饲料质量往往价格低廉,DFs 含量普遍较高,易引起炎性反应及肝肠组织损伤。带病越冬后鱼体虚弱,这时候如果再行分塘、转塘等作业,极易引起炎症因子风暴,导致大量死亡。本课题组在流行病学研究中发现,越冬前进行分塘、转塘操作,或没经搬运的鱼,其越冬后患病率比越冬后进行分、转塘的鱼低得多。越冬之前和之后投喂优质饲料的,患病率也较低。
7 结论
随着生活水平的提高,人类对DFs 的摄入量相对不足,因此,文献中报道的大多是DFs 对健康的积极作用,DFs 也已被纳入食品营养标签。但对水产动物而言,由于受资源和成本的制约,配合饲料中使用了大量的植物蛋白源,养殖鱼类处于DFs 过量摄入状态,并由此造成了BAs 稳态失调和炎性反应,诱导了各种症状的非感染性炎症性疾病。因此,有必要研究DFs 在饲料中的限量范围并将其纳入饲料营养标签。由于DFs 种类多样,其作用靶点是肠道微生物及其代谢物,后者又复杂多样,这就决定了DFs 生理效应的复杂性和多变性。不同鱼种(至少不同食性鱼种)间DFs 耐受性的差异较大,因此,还需针对不同鱼种分别开展研究。当前,为了防控炎症性疾病,在饲料配制时应适当提高动物性原料用量,或/并使用发酵过的植物性原料,也可向饲料中补充胆汁酸、牛磺酸等。在投喂策略上,应控制采食量及其增幅。在管理上,要防止DFs 与其他胁迫因子叠加。
(作者声明本文无实际或潜在的利益冲突)
