饲料中添加胆汁酸对黄鳝生长性能、血清生化和肝肠健康的影响
2024-05-20李加敏徐嘉玲罗天伦徐路遥
雷 薇, 李加敏, 方 鹏, 徐嘉玲, 罗天伦, 徐路遥, 彭 墨
(江西农业大学动物科学技术学院,江西 南昌 330045)
水产集约化养殖规模的不断扩大和渔业资源的匮乏导致鱼粉供不应求,为降低饲料成本和缓解水产饲料生产的压力,人们将目光聚焦于来源广泛且蛋白质含量高的植物原料。植物原料中的抗营养因子和胆固醇缺失往往降低其在水产养殖中的有效利用。因此,寻找合适的饲料添加剂以促进水产养殖动物的生长、代谢和抗氧化能力,成为水产动物集约化养殖的必然选择[1-2]。
胆汁酸(bile acids,BAs)是由肝脏胆固醇分解代谢产生的最终产物,可以将脂质乳化成小的乳糜颗粒,扩大脂质与消化酶的接触面积,进而起到加速脂肪分解,缓解肝脏脂肪异常沉积的作用[3]。研究表明,胆汁酸可以提高仔猪[4]和仔鸡[5]的生长性能和免疫力,调节小鼠[6]的肝脏脂肪代谢,显著提升鳜(Siniperca chuatsi)[7]、虹鳟(Oncorhynchus mykiss)[8]和乌鳢(Channa argus)[9]的生长性能。添加适量胆汁酸可以降低大口黑鲈(Micropterus salmoides)[10]、红鳍东方鲀(Takifugu rubripes)[11]、草鱼(Ctenopharyngodon idella)[12]和珍珠龙胆石斑鱼[Epinephelus fuscoguttatus(♀) ×E.lanceolatus(♂)][13]由高脂饲料诱导的肝脂异常沉积。同时,胆汁酸适量添加可显著提高鳜[7]和宽体舌鳎(Cynoglossus robutus)[14]鱼体的抗氧化能力,增加大口黑鲈[10]的肠黏膜厚度,改变草鱼和珍珠龙胆石斑鱼的胆汁酸图谱[12-13]。因此,饲料中添加胆汁酸对养殖鱼类的生长、代谢和抗氧化等具有积极的调控作用。
黄鳝(Monopterus albus)是一种典型的肉食性淡水养殖鱼类之一,其肉质细腻,且具有丰富的营养价值。黄鳝贪食,生长中极易出现花白肝等脂肪异常沉积、肝肠功能障碍等现象[15],是黄鳝养殖产业亟待解决的重要问题。
鱼粉作为黄鳝饲料的主要蛋白原料,是导致其养殖成本高的主要原因。用植物性蛋白源替代鱼粉,会造成饲料中胆固醇(胆汁酸合成的前体物质)的含量减少。因此,本实验旨在通过向黄鳝饲料中添加胆汁酸,探究其对黄鳝生长性能、体组成、血清生化和肝肠健康的影响,同时确定黄鳝饲料中胆汁酸的适宜添加量,为黄鳝的健康养殖积累基础数据和提供参考。
1 材料与方法
1.1 实验设计
采用单因素试验设计,以鱼粉为主要蛋白质源,α 淀粉作为主要糖源,鱼油、豆油按1∶1 (重量比)混合作为饲料的主要脂肪源,设计粗蛋白水平约为42%、粗脂肪水平约为7.9%的5组不同胆汁酸添加量的等氮等脂饲料。5 组饲料的胆汁酸添 加 量 分 别0、125、250、375 和500 mg/kg,并分别命名为CON、BA125、BA250、BA375 和BA500 组。基础饲料配方组成及营养成分见表1。实验中所用的其他原料均购自深圳市澳华集团股份有限公司。所有饲料原料均粉碎并通过60 目筛,然后均匀加入混合后的鱼油和大豆油(1∶1,重量比)并充分混合,最终成品于自封袋中密封,保存于-20 °C 冰箱备用。
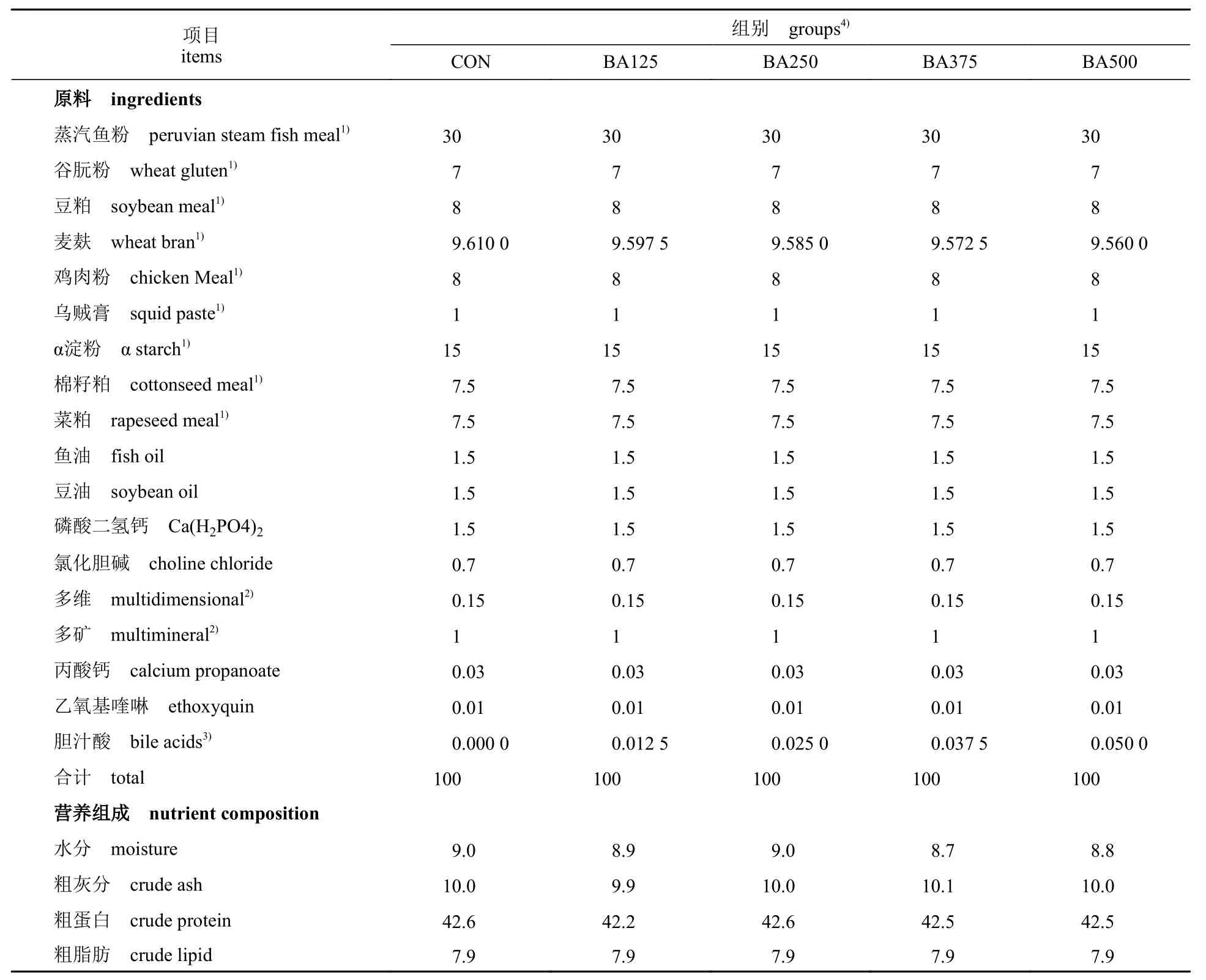
表1 实验饲料的组成及营养成分Tab. 1 Ingredients and proximate chemical composition of the experimental diets %
1.2 养殖管理
本实验所选的黄鳝购自江西余干黄鳝养殖场。筛选1 200 尾初始平均体重为(23.00±0.03) g 的健康黄鳝,首先采用网箱进行养殖,禁食24 h 后将其分为5 组,每组4 个网箱(规格为2.0 m×1.0 m×2.0 m),每个网箱60 尾。养殖期间,每天17:00—18.00 饱食投喂,养殖周期为56 d。整个实验期间观察并记录黄鳝的摄食量和水质情况。养殖水温20.9~29.5 °C, 溶 解 氧 含 量≥5 mg/L, pH 为6.5~7.4,氨氮含量≤2.0 mg/L,亚硝酸盐浓度≤0.10 mg/L。
1.3 样本采集
实验结束后,禁食24 h。称重和计数后记录每个网箱中的黄鳝数量和总重,采用MS-222 麻醉后,每个网箱取3 尾鱼,分别称量体重、体长,进行静脉采血,之后解剖获取肝脏和内脏团进行称重,取其肝脏、肠道存于2 mL 冻存管中,液氮速冻后转移至-80 °C 超低温冰箱中保存。取肝脏和肠道组织存于4%多聚甲醛溶液。本研究获得了江西农业大学实验动物管理和使用伦理委员会批准,实验过程中操作人员严格遵守江西农业大学伦理规范,并按照江西农业大学伦理委员会制定的规章制度执行。
1.4 测定指标及方法
生长性能 生长性能相关计算公式:
式中,Wt和W0分别为终末均重(g, final body weight, FBW)和初始均重(g, initial body weight, IBW),Nt和N0分别为养殖后的终末尾数和初始尾数,L为鱼体长(cm, body length),Wl为肝脏重(g, liver weight),Wv为内脏重(g, visceral weight),FC 为饲料消耗总量(g, total amount of the feed consumed)。
饲料和全鱼营养成分测定 按照AOAC的标准方法测定实验饲料和全鱼的营养成分[16]:将样品在105 °C 烘箱中烘干至恒重得到水分含量;用凯式定氮法测定样品的粗蛋白含量;用索式抽提法测定样品中粗脂肪的含量;将样品在550 °C的马弗炉中灼烧6 h 至恒重得到灰分含量。
血清生理生化指标测定 总胆汁酸(total bile acids,TBA)、血 尿 氮(blood urea nitrogen,BUN)、总胆固醇(Total cholesterol,CHOL)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、谷丙转氨酶(glutamicpyruvic transaminase,ALT)和谷草转氨酶(glutamic oxaloacetic transaminase,AST)的测定使用贝克曼AU480 生化分析仪以及配套的试剂盒。D 乳酸(lactate dehydrogenase, D-LA)的测定使用上海优选品牌酶联免疫分析(ELISA)试剂盒。二胺氧化酶(diamine oxidase, DAO)的测定使用上海抚生实业有限公司酶联免疫分析(ELISA)试剂盒。
肠道消化酶和组织生化指标测定 肠道消化相关的胰蛋白酶、脂肪酶和淀粉酶活性,与肠道抗氧化能力相关的谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)和过氧化氢酶(catalase,CAT),均通过南京建成生物工程研究所试剂盒进行测定,方法参考说明书。
基因表达量测定(RT-PCR 法) 肠道总RNA 使用Trizol 试剂(TaKaRa,日本)提取,使用NanoDrop2000 超微量分光光度计(Thermo Fisher,美国)测定总RNA 浓度。随后使用Prime-ScriptTM反转录试剂盒(TaKaRa,日本)合成cDNA,并用DEPC (diethyl pyrocarbonate)水进行稀释后置于-20 °C 保存备用。定量反转录-聚合酶链式反应使用实时定量PCR 仪(Bio-rad - CFX96)进行实验,反应体积为10 μL,其中引物0.4 μL,cDNA 0.5 μL、SYBR Green qPCR Mix (High ROX) (艾德莱生物科技有限公司,北京) 5.0 μL、无菌非酶水4.1 μL。定量聚合酶链式反应程序设置为95 °C 预变性2 min,95 °C 变性15 s,55~60 °C 退火72 min,72 °C延伸10 s,40 个循环之后形成熔解曲线。采用2-ΔΔCt方法计算基因表达[16]。分析扩增效率后选择18S rRNA 作为本研究内参基因。引物序列如表2所示。

表2 黄鳝实时定量PCR 引物Tab. 2 Quantitative primer of M. albus
1.5 数据分析
数据用 “平均值±标准差(mean±SD,n=4)” 表示,采用SPSS 12.0 统计软件进行单因素方差分析,若组间差异显著(P<0.05) ,则作Duncan 氏多重比较分析。所有原始数据用Microsoft Excel 2017 软件处理,然后分别用Microsoft Word 2017 和Graph-Pad Prism 5 软件绘制成图表。
2 结果
2.1 饲料中添加胆汁酸对黄鳝生长性能的影响
由表3 可知,随着饲料胆汁酸添加量的增加,黄鳝FBW、WGR 和SGR 呈先升后降趋势,BA250和BA375 组FBW、WGR 和SGR 显著高于CON和BA500 组(P<0.05)。FCR 随胆汁酸添加量的增加呈先降后升趋势,BA250 组的FCR 显著低于CON 组 和BA500 组(P<0.05), 但 与BA125 和BA375 组之间无显著差异(P>0.05)。胆汁酸的添加对黄鳝的HSI 和VSI 无显著影响(P>0.05),但BA250 组CF 显著高于CON、BA375 和BA500 组(P<0.05)。

表3 饲料中胆汁酸添加量对黄鳝生长性能的影响Tab. 3 Effects of dietary bile acids on the growth performance of M. albus
2.2 黄鳝饲料适宜胆汁酸添加量
以特定生长率为评价指标,经一元二次回归分析:y=-3.0×10-6x2+1.7×10-3x+1 362.3×10-3(R2=0.930 7),得知胆汁酸最适添加量为283.3 mg/kg;以饲料转化率为评价指标,经一元二次回归分析:y=7.0×10-6x2-3.5×10-3x+1 962.3×10-3(R² = 0.984 7),得出胆汁酸最适添加量为250.0 mg/kg。据此,初始体重为(23.00±0.03) g 的黄鳝饲料中胆汁酸适宜添加量为250.0~283.3 mg/kg。
2.3 饲料中胆汁酸添加量对黄鳝体成分的影响
由表4 可知,随饲料中胆汁酸添加量的增加,全鱼粗蛋白呈先升后降趋势(P<0.05),在BA250组达到最高值。肝脏的粗脂肪随饲料胆汁酸添加量的增加呈先降后升趋势(P<0.05)。全鱼水分、粗脂肪、灰分和肌肉粗脂肪在各组间均无显著差异(P>0.05)。

表4 饲料中胆汁酸添加量对黄鳝全鱼体成分、肝脏和肌肉粗脂肪含量(湿重)的影响Tab. 4 Effects of dietary bile acids on the body composition and total lipid content (wet weight) in liver and muscle of M. albus %
2.4 饲料中胆汁酸添加量对黄鳝血清生理生化指标和肠道通透性指标的影响
由表5 可知,LDL-C 浓度在BA500 组显著高于其余各组(P<0.05)。ALT 含量在添加胆汁酸的各个处理组中均显著低于CON 组,而AST 含量随胆汁酸添加量的增加呈先降后升的趋势(P<0.05)。肠道通透性指标的结果显示,随胆汁酸添加量的增加,D-LA 含量呈降低趋势(P<0.05)。而DAO 呈先降后升趋势(P<0.05),在BA250 组中含量最低。TBA、BUN 和T-CHO 各组间均无显著差异(P>0.05)。
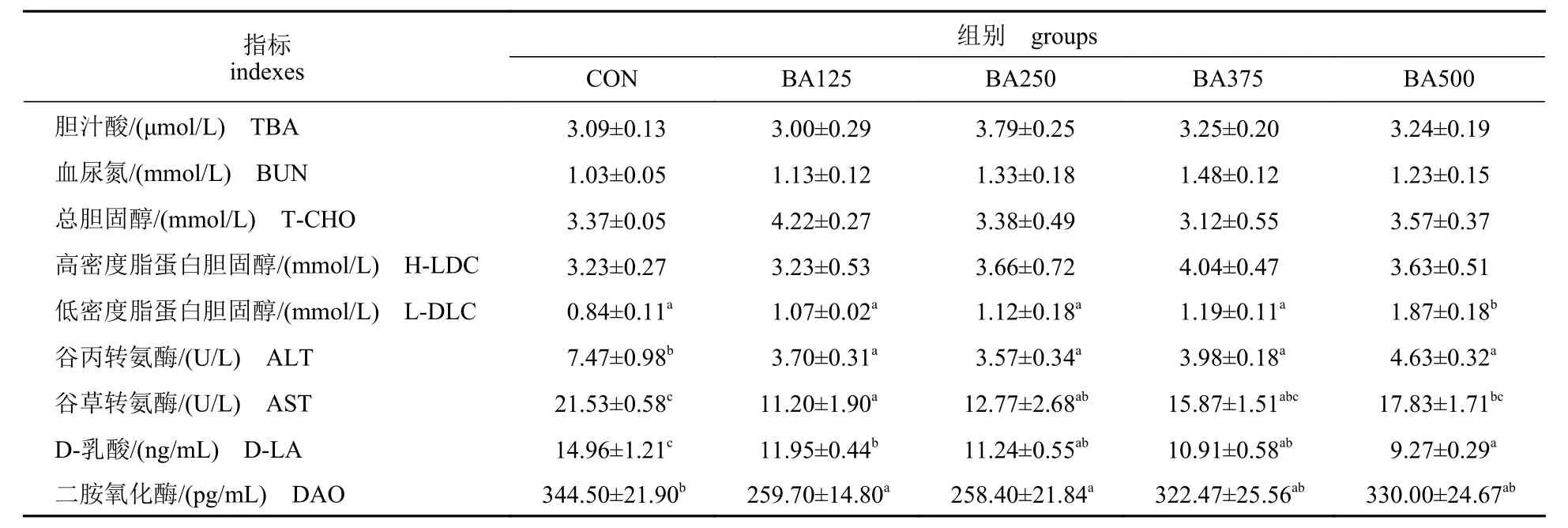
表5 饲料中胆汁酸添加量对黄鳝血清生理生化指标和肠道通透性指标的影响Tab. 5 Effects of dietary bile acids on the serum physiological and biochemical indexes and intestinal permeability indexes of M. albus
2.5 饲料中胆汁酸添加量对黄鳝肠道消化能力的影响
由表6 可知,饲料中添加胆汁酸对黄鳝肠道的淀粉酶和胰蛋白酶活性无显著影响(P>0.05)。在BA250 组中,肠道脂肪酶活性显著低于其他组(P<0.05),且其他组之间均无显著差异(P>0.05)。
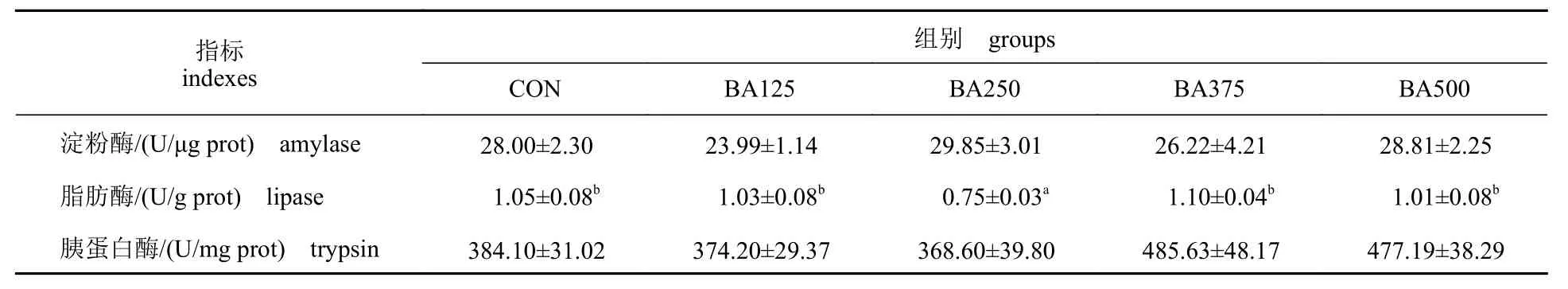
表6 饲料中胆汁酸添加量对黄鳝肠道消化酶活性的影响Tab. 6 Effects of dietary bile acids on the intestinal digestive enzymes activity of M. albus
2.6 饲料中胆汁酸添加量对黄鳝肠道抗氧化能力的影响
由表7 可知,随着胆汁酸添加量的增加,黄鳝肠道的T-SOD 和GSH-Px 活性均呈先升后降的趋势,在BA250 组中黄鳝肠道T-SOD 的活性显著高于BA375 和BA500 组(P<0.05)。MDA 的含量随着胆汁酸添加量的增加呈现先降后升的趋势(P<0.05),BA250 组 显 著 低 于CON 和BA375 组(P<0.05)。

表7 饲料中胆汁酸添加量对黄鳝肠道抗氧化酶活性的影响Tab. 7 Effects of dietary bile acids on the intestinal antioxidant enzyme activity of M. albus
2.7 饲料中胆汁酸添加量对黄鳝肝脏抗氧化酶活性的影响
由表8 可知,随着胆汁酸添加量的增加,肝脏T-SOD 活 性 呈 上 升 趋 势(P<0.05),BA375 和BA500 组 显 著 高 于CON 和BA125 组(P<0.05)。BA250 和BA500 组GSH-Px 活性显著高于CON组(P<0.05)。BA250 组CAT 活性最高,BA500 组最低(P<0.05)。
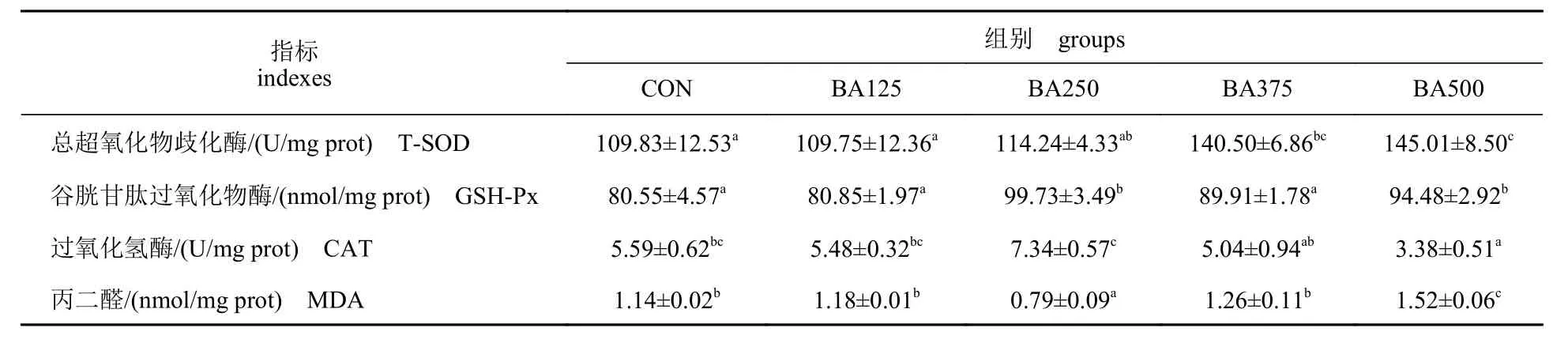
表8 饲料中胆汁酸添加量对黄鳝肝脏抗氧化酶活性的影响Tab. 8 Effects of dietary bile acids on the liver antioxidant enzyme activity of M. albus
2.8 饲料中胆汁酸添加量对黄鳝肝脏组织学结构的影响
肝脏H.E 染色结果显示,CON 组肝细胞肿大,部分肝细胞壁模糊(图版Ⅰ)。BA125 和BA250 组肝脏组织学结构较为完整,细胞核数量增多。BA375 组肝细胞出现空泡化和破裂。BA500 组肝细胞空泡化严重,无核和破裂细胞增多。肝脏油红O 染色结果显示,随饲料胆汁酸添加量增加,肝脏脂滴数量呈先降后升趋势,且在BA250 组最少(图版Ⅱ)。
2.9 饲料中胆汁酸添加量对黄鳝肝脏脂肪代谢的影响
随饲料胆汁酸添加量的增加,肝脏acc和dgat2 的mRNA 表达 水 平 呈 降 低 趋 势(P<0.05),cpt1 的mRNA 表达水平呈先升后降的趋势(P<0.05),pparα的mRNA 表达水平在BA375 时最高(P<0.05) (图1)。

图1 饲料中胆汁酸添加量对黄鳝肝脏脂肪代谢相关基因的影响柱上不同字母代表组间存在显著差异,P<0.05,下同。Fig. 1 Effects of dietary bile acids on lipid metabolismrelated genes in liver of M. albus The different letters on the column represent significant differences between groups, P<0.05, the same below.
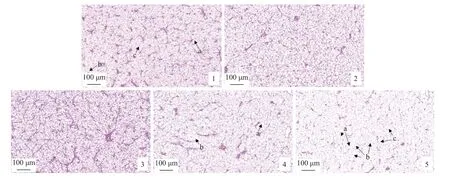
图版 Ⅰ 饲料中胆汁酸添加量对黄鳝肝脏组织形态的影响(H.E 染色) (×40)1~5 分别表示0、125、250、375 和500 mg/kg 胆汁酸组,下同。a.细胞核消失或缩小,b.细胞膜破裂,c.细胞空泡。Plate Ⅰ Effects of dietary bile acids on liver morphology of M. albus (×40)1-5 are CON, BA125, BA250, BA375 and BA500 groups, respectively, the same below. a. the disappearance or shrinkage of the nucleus, b. cell membrane rupture, c. cellular vacuole .
2.10 饲料中胆汁酸添加量对黄鳝肠道组织学结构的影响
肠道形态学指标如图版Ⅲ和图2 所示,各组肠道结构完整,肠绒毛整齐,肠黏膜光滑。但随饲料胆汁酸添加量的增加,肠道绒毛宽度和固有层宽度呈先升后降趋势(P<0.05),肠绒毛宽度在BA375 组达到最高,固有层宽度在BA250 组达到最高。BA500 组绒毛宽度显著低于CON 组(P<0.05);BA500 组肠道绒毛高度显著低于其余各组,而其他各组之间均无显著差异(P>0.05)。

图2 饲料中胆汁酸添加量对黄鳝肠道结构的影响Fig. 2 Effects of dietary bile acids on intestinal structure of M. albus
2.11 饲料中胆汁酸添加量对黄鳝肠道屏障相关基因表达的影响
如图3 所示,随饲料胆汁酸添加量的增加,zo1、zo2 和occludin的mRNA 表达水平均呈先升后降趋势(P<0.05),zo1、zo2 和occludin的mRNA表达水平分别在BA375 组、BA250 组和BA125组达到最高。
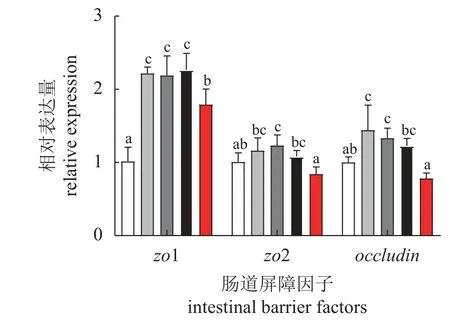
图3 饲料中胆汁酸添加量对黄鳝肠道屏障相关基因表达的影响Fig. 3 Effects of dietary bile acids on the expression of genes related to intestinal barrier of M. albus
3 讨论
3.1 胆汁酸对黄鳝生长性能的影响
胆汁酸是在肝脏中由胆固醇产生,可提高脂肪消化效率,促进胆固醇和有毒代谢物的排泄[12]。本研究发现,添加适量的胆汁酸可显著改善黄鳝的生长性能。在鳜[7]、虹鳟[8]、乌鳢[9]和草鱼[12]的研究中均有相似的结果。可能的原因是胆汁酸促进鱼体对脂肪的代谢吸收。同时本研究发现,饲料中胆汁酸含量过量时,黄鳝的增重率和终末均重有下降的趋势,且饲料转化率显著升高。这与在尼罗罗非鱼(Oreochromis niloticus)[17]中的研究结果一致。可能是过量的胆汁酸造成了胆固醇积累、肝细胞毒性等负面影响,进而导致生长性能降低。适量的胆汁酸可起到促进鱼类生长的作用,而过量的胆汁酸可能会造成毒性并抑制鱼类的生长。在本研究中,饲料中添加胆汁酸并未显著影响胰蛋白酶和淀粉酶的活性,甚至降低了脂肪酶的活性。添加胆汁酸并未影响大黄鱼(Larimichthys crocea)[18]肠道主要消化酶活性;提高了乌鳢[9]和豹纹鳃棘鲈(Plectropomus leopardus)[19]肠道脂肪酶和胰蛋白酶的活性;提高了宽体舌鳎[14]肠道脂肪酶和淀粉酶活性,但不影响其蛋白水解酶活性。因此,胆汁酸添加对鱼类消化酶造成的影响并不一致,这可能与鱼类的种类、大小、养殖条件和饲料组成有关。

图版 Ⅲ 饲料中胆汁酸添加量对黄鳝肠道组织形态的影响(H.E 染色) (×5)LW.固有层宽度,VH.绒毛高度,VW.绒毛宽度,GC.杯状细胞。Plate Ⅲ Effects of dietary bile acids on intestinal morphology of M. albus (×5)LW. lamina propria width, VH. villus height, VW. villus width, GC. goblet cell.
本研究以特定生长率和饲料转化率为评价指标,采用一元二次回归分析,得出黄鳝饲料胆汁酸的适宜添加量为250.0~283.3 mg/kg。目前,在不同鱼类的研究中,饲料中添加的胆汁酸是否能有效地促进鱼类的生长结论并不一致。饲料中添加适量的胆汁酸对大多数鱼类生长性能有积极的促进作用,如大口黑鲈在胆汁酸(鹅去氧胆酸)添加量为900 mg/kg 时生长性能最佳[10];鳜[7]在胆汁酸(猪去氧胆酸占70.9%,猪胆酸占8.0%,鹅去氧胆酸占20.2%)添加量为900 mg/kg 时生长性能显著提升;而大黄鱼在胆汁酸(混合胆汁酸)添加量为300 mg/kg 时生长性能最佳[20]。但对一些鱼类的研究表明,饲料中添加胆汁酸并不能显著改善生长性能,如红鳍东方鲀[11]。因此,胆汁酸的添加效果需根据鱼的种类而异。
3.2 胆汁酸对黄鳝体成分和脂肪代谢的影响
本研究发现,适量的胆汁酸添加可显著降低黄鳝肝脏中粗脂肪含量。饲料添加胆汁酸降低了鳜[7]和红鳍东方鲀[11]的全鱼和肝脏中的粗脂肪含量。饲料胆汁酸添加量从150 mg/kg 提高至450 mg/kg 时显著降低了大黄鱼肝脏的脂肪含量,主要是通过降低脂肪合成基因的表达,以及提高脂质氧化基因的表达来实现[20]。此结果与本实验研究结果相似,acc和dgat2 是鱼类中重要的脂肪酸合成基因,cpt1 和pparα在脂肪酸的氧化分解中起重要调节作用,胆汁酸的添加可提高cpt1 和pparα基因的表达水平,同时降低acc和dgat2 的表达水平,加速脂肪的氧化分解,进而缓解黄鳝肝脏脂肪沉积。然而,过量的胆汁酸可能会破坏胆汁酸的动态平衡,并对脂类代谢产生相反的影响。珍珠龙胆石斑鱼高脂饲料中补充300~900 mg/kg 胆汁酸可降低其肝脏甘油三酯和脂肪含量,而添加1 200~1 500 mg/kg 胆汁酸则作用相反[13]。本实验发现,饲料中胆汁酸添加量为250 mg/kg时,全鱼粗蛋白的含量显著高于其余各组。在凡纳滨对虾(Litopenaeus vannamei)[21]中也有类似的结果。推测其可能的原因,是鱼类增加了对脂肪的吸收利用,从而促进鱼体自身的蛋白质沉积。
3.3 胆汁酸对黄鳝肝脏健康的影响
血清中谷丙转氨酶和谷草转氨酶的含量是评估肝脏损伤的重要指标。本研究中发现,添加胆汁酸的处理组的血清谷丙转氨酶含量显著低于对照组,且谷草转氨酶的含量随胆汁酸添加量的增加呈先降后升趋势,推测饲料中添加适量胆汁酸可缓解黄鳝肝脏损伤,而饲料中过量胆汁酸的添加可能导致肝脏健康受损。在尼罗罗非鱼[17]和凡纳滨对虾[19]中也有相似的结果。
动物细胞的健康与氧化和抗氧化平衡相关,引起机体氧化应激的主要原因之一是机体内活性氧(ROS)的异常增加,生成了脂质过氧化物[22]。丙二醛的含量反映了机体脂质过氧化物的程度,也能间接反映细胞的受损程度[23]。SOD 是生物体内至关重要的抗氧化酶之一,可清除机体内自由基,从而维护机体免受氧化损伤[24]。草鱼饲料中,添加胆汁酸的处理组与未添加的处理组相比,SOD 活性显著上升[25]。随着饲料中胆汁酸添加量的增加,黄鳝肝脏中T-SOD 呈逐渐上升的趋势。适量胆汁酸的添加可提高GSH-Px 和CAT 的活性,在胆汁酸添加量为250 mg/kg 时,二者的活性最高。肝脏中MDA 的含量呈先降低后升高的趋势,且在BA250 组时的含量最低。在对黄鳝的研究中发现,胆汁酸在基因水平上正向调控氧化应激Nrf2-Keap1 通路,可以降低黄鳝肠道氧化应激反应[16]。该结果与对哺乳动物[26]中的结果一致,推测胆汁酸的抗氧化作用可能依赖于通过调节Nrf2-Keap1 信号通路,进而发挥清除丙二醛和增强鱼体抗氧化能力的作用。
肝脏是脂肪代谢的重要器官。研究表明,饲料中低浓度的胆汁酸添加对尼罗罗非鱼的肝脏形态无显著影响,而添加1.35 g/kg 的胆汁酸会导致其肝细胞出现严重的核迁移和空泡化现象[17]。饲料中添加300 mg/kg 的胆汁酸可改善大口黑鲈的肝细胞肿大和空泡化,同时降低肝脏的脂滴数量,改善肝脏脂肪蓄积情况[25]。凡纳滨对虾饲料中添加适量胆汁酸可使肝胰腺小体恢复正常,排列整齐,改善肝胰腺的健康[21]。本研究发现,饲料中添加适量的胆汁酸可降低黄鳝肝细胞的空泡化,恢复肝脏的完整性,同时减少脂肪在肝脏中的蓄积。但过量的胆汁酸(500 mg/kg)会导致肝脏空泡数目增多,肝细胞破裂,从而导致肝脏损伤。
3.4 胆汁酸对黄鳝肠道健康的影响
本研究结果发现,黄鳝肠道中T-SOD 和GSH-Px 的活性随胆汁酸添加量的增加呈先升后降的趋势。推测饲料中适量胆汁酸的添加可提高黄鳝肝脏和肠道的抗氧化能力,过量的胆汁酸可能不一定会达到综合抗氧化的效果,且鱼体中不同的器官对胆汁酸的耐受性可能不同,因此几种酶活性呈现不同的变化趋势。
肠道是鱼类消化吸收的主要场所,其肠绒毛决定消化吸收效率。研究表明,饲料中添加适量胆汁酸对鱼体会产生积极的影响,添加适量胆汁酸可增加大口黑鲈肠道绒毛长度和杯状细胞数量[27]。在本研究中,随着饲料胆汁酸添加量的增加,肠道的绒毛宽度和固有层宽度呈先升后降的趋势,在BA250 组时固有层宽度达到最高,而在BA500 组中绒毛宽度显著低于对照组。同时BA500 组的绒毛高度显著低于对照组,表明饲料中添加适量胆汁酸(125~375 mg/kg)可能通过改善肠道结构促进鱼体对营养物质的消化吸收,进而促进生长;但高浓度(500 mg/kg)的胆汁酸添加会对黄鳝肠道结构造成损伤,进一步影响肠道健康。
肠道健康与黏膜屏障的完整性密切相关。DAO是主要存在于肠黏膜上皮细胞内的代谢酶,D-LA是肠道内细菌的代谢产物,正常情况下二者在血清中含量极低。当肠上皮细胞损伤时,肠道黏膜被破坏,通透性增加,往往会导致DAO 和D-LA进入机体血液中,因此二者在血清中的含量通常作为评判肠道屏障功能的重要指标[28]。本实验结果显示,随着饲料中胆汁酸添加量的增加,黄鳝血清中D-LA 的含量呈显著降低的趋势。DAO 呈先降后升的趋势。同时,对肠道屏障具有保护和调节功能的紧密连接蛋白基因(zo1、zo2、occludin)的表达水平也呈先升后降的趋势。综上,推测胆汁酸适量添加可提高黄鳝肠道屏障的功能,降低肠道的通透性,而过量的胆汁酸可能造成肠道屏障的损伤。该结果与张帆等[29]对小鼠(Mus musculus)的研究结果相似,对于胆汁酸减轻机体的肠道损伤的作用可能与胆汁酸受体有关。胆汁酸受体G 蛋白偶联受体5 (TGR5)被胆汁酸激活,TGR5激活后可减轻炎症反应,抑制NF-κB 信号传导,通过抑制肠道炎症反应进而减轻肠道的损伤。
4 结论
饲料中适量添加胆汁酸可增强黄鳝肝脏和肠道抗氧化能力,降低肝脏损伤和肝脂沉积,改善肠道功能,进而提高黄鳝生长性能。以特定生长率和饲料转化率作为评价指标,采用一元二次回归方程得,初始均重为(23.00±0.03) g 的黄鳝饲料中胆汁酸的适宜添加量为250.0~283.3 mg/kg。
(作者声明本文无实际或潜在的利益冲突)
