神经酸对H2O2诱导PC12细胞氧化损伤的保护作用
2024-05-20玛依乐艾海提刘垚杰李建科
玛依乐·艾海提,刘垚杰,李建科
(陕西师范大学食品工程与营养科学学院,陕西 西安 710119)
氧化损伤通常是由活性氧(reactive oxygen species,ROS)的产生和积累引起,ROS由内源性代谢途径的激活和外源性刺激产生。ROS是神经元变性和损伤的重要因素,通过脂质过氧化、蛋白质氧化和凋亡基因表达等细胞氧化损伤诱导细胞凋亡和坏死[1]。因此,维持ROS产生和消除的稳态可能对防止氧化损伤的发生具有重要作用[2]。研究表明,通过清除自由基缓解氧化应激对神经元的损伤,在神经退行性疾病的治疗中有前景[3]。临床前动物研究数据表明,单不饱和脂肪酸可能在多种情况下对减缓氧化应激相关疾病有效[4]。
神经酸(nervonic acid,NA)(顺-15-二十四碳烯酸,C24:1)是中枢神经系统中主要的长链单不饱和脂肪酸,它是脑神经组织和神经细胞的核心天然成分[5-6]。NA是一种具有促进受损神经组织修复和再生作用的物质。然而,人体很难合成NA,因此需要从饮食中获取NA[7]。元宝枫是中国特有的一种枫树,其结实率和含油量都很高。元宝枫籽油主要由C16~C24脂肪酸组成,其中不饱和脂肪酸的含量高于90%,并且含有5%~7%的NA[8]。元宝枫籽油是NA的高质量来源,NA是21世纪最受欢迎的脑健康活性物质[9]。NA水平的降低与个体患精神病的高风险密切相关[10],补充NA是一种公认的有效治疗多种神经系统疾病的方法,如脱髓鞘疾病[11-13]。先前的研究表明,在x-肾上腺脑白质营养不良和多发性硬化症等脱髓鞘疾病患者死后的脑髓鞘鞘脂中发现NA的含量减少,而饱和脂肪酸(例如C24:0和C26:0)的含量增加[14]。研究还表明,NA对于改善脱髓鞘疾病儿童和成人的健康至关重要,喂养富含NA的配方奶可促进婴儿和早产儿的神经发育[15-16]。因此,NA与髓鞘和中枢神经系统的正常功能密切相关。先前的研究结果表明,神经酸可减轻紫杉醇诱导的PC12细胞和小肠隐窝上皮细胞IEC-6的凋亡损伤,并上调B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)/Bcl-2相关X蛋白质(Bcl-2 associated X protein,Bax)表达,下调细胞色素c表达[17-18]。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是一种氧化还原敏感的核因子,在抗氧化防御系统中起着至关重要的作用,并控制下游抗氧化基因的表达,如血红素加氧酶-1(heme oxygenase 1,HO-1)。kelch样ECH关联蛋白1(kelch-like ECHassociated protein 1,Keap1)是Nrf2的重要负调控因子,通过抗氧化反应元件相互作用,调节抗氧化蛋白的表达水平[19]。
因此,本实验采用常用于研究神经退行性疾病的细胞模型PC12细胞,探讨NA对H2O2诱导的PC12细胞氧化损伤和细胞凋亡的保护作用。
1 材料与方法
1.1 材料与试剂
PC12细胞、大鼠肾上腺嗜铬细胞瘤细胞(高分化)来源于中国科学院细胞库。
NA(纯度>99%,CAS:506-37-6)美国Sigma-Aldrich公司;5%灭活胎牛血清、5%灭活马血清、DMEM高糖培养基 美国Gibco公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、1%青链霉素混合液美国HyClone公司;H2O2(质量分数30%)上海阿拉丁生化科技股份有限公司;BCA蛋白浓度检测试剂盒、ROS检测试剂盒、吐温20、苯基甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)上海碧云天生物技术有限公司;Hoechst 33342染料、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒南京建成生物工程研究所;MTT、RIPA裂解液、DEPC水、总RNA提取试剂盒(TRIzol法)、cDNA反转录(Hiscript II Q RT Super Mix)试剂盒、定量聚合酶链式反应(polymerase chain reaction,PCR)(Cham QTM SYBR qPCR Master Mix)试剂盒 南京维兹生物科技有限公司;抗Nrf2、Keap1、Caspase-3、HO-1、Bax、Bcl-2抗体、抗β-肌动蛋白抗体 美国Cell Signaling Technology公司;Omini-ECLTM基础性化学发光检测试剂盒上海雅酶生物医药科技有限公司。
1.2 仪器与设备
CCL-170B-8型CO2恒温培养箱 新加坡ESCO公司;DMI300B型荧光倒置显微镜 德国徕卡公司;Multiskan GO-1510型全波长酶标仪、Nanodrop 2000型微量核酸测定仪 美国Thermo Fisher Scientific公司;CFX96型实时荧光定量PCR仪 美国Bio-Rad公司;Bio-Best200E凝胶成像仪 美国SIM公司;TGL-16gR高速冷冻离心机上海安亭科学仪器厂。
1.3 方法
1.3.1 细胞培养与分组
细胞培养:PC12细胞在25 cm2的细胞培养瓶中培养,加入5%胎牛血清、5%马血清、100 μg/mL链霉素、100 μg/mL青霉素,在37 ℃、5% CO2湿化培养箱中培养24 h。每2~3 d更换一次培养液,每周2 次以1∶3的比例进行传代培养[20]。
正常对照组(NC组):100 μL细胞悬液+(弃掉原培养液)100 μL DMEM培养基+100 μL DMEM培养基。200 µmol/L H2O2处理组(MOD组):100 µL细胞悬液+100 μL DMEM培养基+100 µL H2O2(用DMEM培养基稀释的200 µmol/L H2O2)。0.1 µmol/L NA+200 µmol/L H2O2处理组(LN组):100 μL细胞悬液+100 µL 0.1 µmol/L NA+100 µL 200 µmol/L H2O2。1 µmol/L NA+200 µmol/L H2O2处理组(HN组):100 μL细胞悬液+100 µL 1 µmol/L NA+100 µL 200 µmol/L H2O2。
1.3.2 MTT实验
将MTT溶解在磷酸盐缓冲溶液(phosphate buffered saline,PBS)中,制成5 mg/mL储备溶液,并在-20 ℃保存,用于检测细胞活力。PC12细胞(1×105个/孔)接种在96 孔板中并培养1 d,使用体积分数为0.1% DMSO和不同浓度的NA(0.001、0.01、0.1、1、10、50 µmol/L)处理细胞24 h。丢弃培养基后,将5 mg/mL MTT溶液添加到每个孔(10 µL),并在37 ℃孵育3 h[21],从每个孔中吸出培养基并加入150 μL DMSO溶液,于570 nm波长处测定OD值。实验组为不同浓度NA处理的细胞液,空白组为没有细胞的培养液,对照组为无NA处理的细胞液。细胞存活率按下式计算:
1.3.3 PC12细胞氧化损伤模型的建立
将密度为5×104个/孔的PC12细胞接种于96 孔板中,每孔接种100 µL细胞悬液。设置NC组(100 µL细胞悬液)和实验组(100 µL细胞悬液)。在37 ℃和5%CO2湿化培养箱中培养24 h。然后把培养液弃掉,NC组中加入100 µL DMEM培养基,实验组分别加入100 µL用DMEM培养基稀释终浓度为50、100、200、500、800 µmol/L的H2O2,分别培养6、12、24、48 h后,采用MTT法测定细胞存活率。
1.3.4 NA干预H2O2诱导的PC12细胞活力测定
PC12细胞的活力由MTT法测定,将PC12细胞(5×104个/孔)接种于96 孔板中,设置NC组、MOD组、LN组和HN组,每孔接种100 µL细胞悬液。在37 ℃、5% CO2培养箱中培养24 h后,NC和MOD组中各加入100 µL培养基,LN和HN组中分别加入终浓度为0.1、1 µmol/L的NA(根据NA的细胞毒性结果)预处理24 h后,NC组中加入DMEM培养基,MOD、LN和HN组中各加入DMEM稀释的200 µmol/L H2O2继续培养24 h后,采用MTT法测定细胞存活率[2]。
1.3.5 Hoechst 33342染色检测
将PC12细胞(5×103个/孔)接种在6 孔板中,培养24 h。细胞处理采用1.3.4节中的方法。PC12细胞培养物在PBS(含质量分数为4%的甲醛)中4 ℃固定15 min,然后用5 µg/mL Hoechst 33342在黑暗中孵育细胞20 min,对细胞核进行染色。用PBS洗涤细胞至少2 次,在荧光显微镜下观察凋亡细胞[2]。染色质浓缩或细胞核碎裂的细胞被标记为凋亡细胞。
1.3.6 细胞内ROS的测定
通过氧化剂敏感探针2’,7’-二氯二氢荧光素二乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)检测细胞内ROS的荧光强度[21]。将PC12细胞(3×105个/孔)接种于6 孔板中,培养24 h。细胞的处理采用1.3.4节中的方法。处理结束后,弃培养液,用P B S 洗3 遍。然后加入无血清培养基稀释的DCFH-DA(稀释比例1∶1 000),37 ℃恒温培养箱孵育20 min,用PBS洗3 遍,充分洗净DCFH-DA,每孔加入1 mL PBS,在荧光显微镜下观察拍照。用酶标仪测定荧光强度,激发波长为488 nm,发射波长为525 nm。
1.3.7 丙二醛(malondialdehyde,MDA)含量、LDH水平、SOD和GSH-Px活性测定
将PC12细胞(2×105个/孔)接种于6 孔板中,培养24 h,按照1.3.4节中的方法分组处理细胞,然后加入1 mL细胞裂解液,10 000×g离心10 min,收集上清液,按照MDA、LDH、SOD和GSH-Px检测试剂盒说明书进行操作。
1.3.8 蛋白免疫印迹(Western blot,WB)检测PC12细胞的蛋白表达情况
将PC12细胞(3×104个/孔)接种于6 孔板中,培养24 h,按照1.3.4节中的方法分组处理细胞,加入1 mL含有蛋白酶抑制剂(PMSF)的细胞裂解液,4 ℃、13 000 r/min离心10 min,收集上清液,获得总蛋白。采用BCA蛋白浓度检测试剂盒测定蛋白浓度。将20 µg样品在体积分数10%十二烷基硫酸钠-聚丙烯酰胺凝胶上进行电泳分离蛋白,转移到PVDF膜上。用5%的脱脂牛奶在Tris含吐温-20缓冲盐溶液(Tris buffered saline with Tween-20,TBST)中将膜在室温条件下封闭2 h,用抗Nrf2、抗Keap1、抗HO-1、抗Bcl-2、抗Bax、抗Caspase-3和抗β-肌动蛋白抗体(稀释比1∶1 000)在TBST中4 ℃孵育过夜。膜清洗后,在室温条件下孵育二抗2 h。采用Omni-ECLTM基础性化学发光检测试剂盒检测,并使用Bio-1D软件分析蛋白表达情况。
1.3.9 基因表达情况检测
将PC12细胞以4×105个/孔接种在6 孔板中,培养24 h,按照1.3.4节中的方法分组处理并收集细胞,用TRIzol试剂提取总RNA。取1 µL提取得到的RNA,使用微量核酸测定仪测定RNA纯度和浓度,根据RNA浓度计算出cDNA反转录所对应的体积,在200 µL PCR管中依次加入相应试剂,总体积为20 µL,按照反转录试剂盒的说明书进行逆转录,得到的cDNA进行后续PCR扩增,保存于-20 ℃冰箱。然后进行实时PCR。β-肌动蛋白作为参照,使用2-ΔΔCt方法评估基因表达。PCR引物由西安擎科泽西生物科技有限责任公司合成,引物序列如表1所示。

表1 引物的相关信息Table 1 Information of primers used in this study
1.4 数据处理与统计分析
2 结果与分析
2.1 NA对H2O2诱导PC12细胞损伤的保护作用
从图1A可以看出,NA在0.001~10 μmol/L范围内对PC12细胞存活率与NC组无显著差异(P>0.05),这说明10 μmol/L及以下的NA对PC12细胞无毒副作用。然而,当浓度为50 μmol/L时,PC12细胞的活力受到显著影响(P<0.05)。因此,选择0.1 μmol/L和1 μmol/L NA作为合适的干预浓度。图1B显示,随着H2O2浓度的增加,对细胞增值的抑制程度也增加。与NC组相比,200 μmol/L H2O2处理24 h后,PC12细胞存活率为60.12%(图1C)。为此,后续实验设置H2O2浓度为200 μmol/L。如图1D所示,在不同浓度的NA(0.1、1 μmol/L)预处理24 h后,用等量的NA和200 μmol/L H2O2联合处理细胞24 h,其存活率显著高于仅用H2O2处理组(P<0.05)。从图1D、E可以看出,NA处理组与MOD组相比,NA能显著提高H2O2处理PC12细胞的存活率(P<0.05)。如图1F所示,在NC组中几乎没有检测到凝聚核,而在H2O2损伤组中明显出现明亮的凝聚核(箭头所示),LN和HN组中这些现象明显改善。综上说明NA预处理对H2O2诱导的PC12细胞损伤有明显的保护作用。
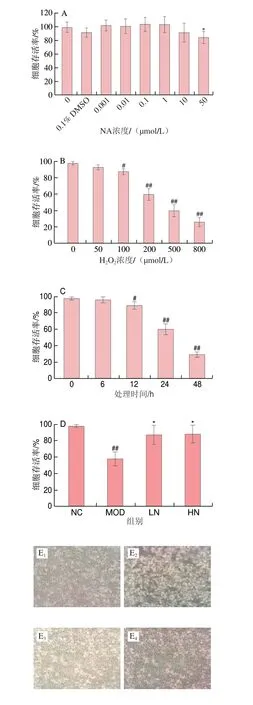
图1 NA对H2O2诱导PC12细胞的保护作用Fig.1 Protective effect of NA on H2O2-induced PC12 cells
2.2 NA对PC12细胞内ROS和氧化损伤的影响
如图2A、B所示,H2O2处理细胞24 h后,细胞中ROS积累迅速增加;然而,用NA处理的PC12细胞中,由H2O2诱导ROS水平的增加被减弱。结果表明NA可以抑制PC12细胞中ROS的产生。如图2C~F所示,与NC组相比,MOD组的SOD和GSH-Px活性极显著降低(P<0.01),而LDH和MDA含量极显著升高(P<0.01)。与MOD组相比,NA处理可以显著提高SOD和GSH-Px的活性(P<0.0 5),显著降低LDH 和MDA 含量(P<0.05)。然而,SOD、GSH-Px、MDA和LDH水平的变化在LN和HN组之间无显著差异(P>0.05)。这些结果表明,NA可能对H2O2诱导损伤的PC12细胞具有保护作用。
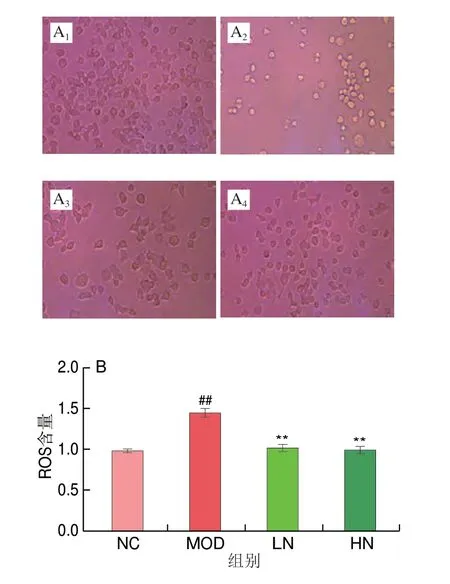

图2 NA对H2O2诱导PC12细胞中抗氧化活性的影响Fig.2 Effect of NA on antioxidant activity in H2O2-induced PC12 cells
2.3 NA对H2O2诱导的相关凋亡蛋白表达水平影响
基于上述结果,本实验证实NA可以保护PC12细胞遭受氧化损伤,因此进一步研究其潜在机制。如图3所示,与NC组相比,MOD组Bcl-2/Bax的表达比例极显著降低(P<0.01)。然而,与MOD组相比,LN和HN组中Bcl-2/Bax的比值显著上调(P<0.05),与NC组相比,MOD组Caspase-3蛋白相对表达水平明显升高(P<0.01)。而与MOD组相比,LN和HN组的Caspase-3蛋白相对表达水平显著下降(P<0.05),然而,LN和HN组之间没有显著差异(P>0.05)。上述结果说明,NA可能抑制H2O2引起细胞凋亡的发生。
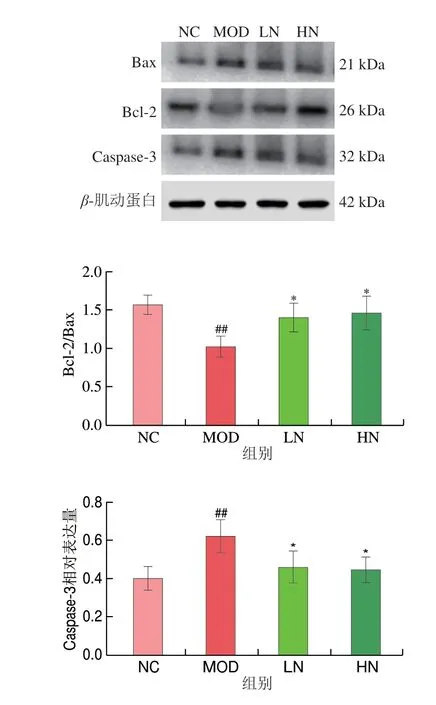
图3 NA对H2O2诱导的相关凋亡蛋白表达水平的影响Fig.3 Effect of NA on the expression levels of apoptotic proteins in H2O2-induced cells
2.4 NA对H2O2诱导的Nrf2/Keap1/HO-1通路相关蛋白影响
如图4所示,与NC组相比,MOD组中Nrf2和HO-1的相对表达量明显减少(P<0.05),而Keap1的相对表达量显著增加(P<0.05),然而HN组的处理明显改善了这种趋势(P<0.05)。结果表明,NA可能通过Nrf2/HO-1信号途径保护PC12细胞免受氧化损伤。

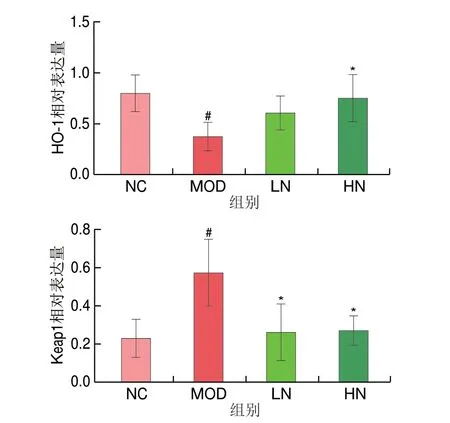
图4 NA对H2O2诱导Nrf2/HO-1通路相关蛋白表达水平的影响Fig.4 Effect of NA on the expression levels of Nrf2/HO-1 signaling pathway related proteins in PC12 cells induced by H2O2
2.5 NA对H2O2诱导PC12细胞相关基因表达的影响
如图5所示,与NC组相比,MOD组Nrf2、HO-1和Bcl-2基因的表达量极显著降低(P<0.01),而Keap1、Bax和Caspase-3基因的表达量明显增加(P<0.01)。与MOD组相比,NA预处理显著上调Nrf2、HO-1和Bcl-2的表达水平(P<0.05),并显著下调Keap1、Bax和Caspase-3的表达水平。这些结果进一步验证了上述实验结果。
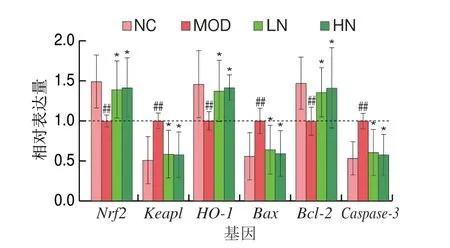
图5 NA对H2O2诱导PC12细胞相关基因表达的影响(n=3)Fig.5 Effect of NA on gene expression in H2O2-induced PC12 cells (n=3)
3 讨论
大脑中氧化应激反应的增加被认为是引起神经系统疾病的主要因素之一[18]。许多研究通过使用抗氧化剂和饮食诱导等方法减少ROS造成的氧化损伤。研究发现,NA在人体细胞中具有潜在的抗氧化和神经保护作用[17-18,22]。本实验利用PC12细胞作为模型探索NA对氧化应激的保护作用。结果显示,在适当浓度下,NA可以保护PC12神经元细胞免受H2O2诱导的氧化损伤、抑制细胞内ROS的积累,并上调一系列与抗氧化和细胞凋亡相关蛋白及其基因的表达水平。这些结果表明,NA可能通过激活Nrf2通路保护PC12细胞免受氧化损伤。
H2O2作为一种具有相对稳定性质的重要ROS,经常被用作建立体外氧化损伤模型[23]。PC12细胞是常用的神经细胞株,具有一定的神经元特性,是研究神经元细胞生理病理过程的常用模型[24]。有研究表明,H2O2诱导的氧化损伤PC12细胞是研究某些药物对神经元细胞是否具有保护作用分子机制最常用的细胞模型[25]。因此,本实验选择H2O2建立PC12细胞的氧化损伤模型,其特点是氧化和抗氧化反应处于不平衡状态[26]。大脑特别容易受到自由基的攻击和氧化损伤,因此维持大脑中氧化还原平衡对于防止氧化应激诱导的细胞损伤至关重要[27-28]。尽管神经退行性疾病的病因尚未得到充分探讨,但氧化损伤已被确定在神经退行性疾病的潜在发病机制中发挥关键作用。NA是髓鞘鞘磷脂中的主要脂肪酸,在大脑和外周神经组织生长和神经系统的信号传递中起着重要的作用。然而,它在神经系统疾病中保护机制需要进一步研究。
NA被证明会影响各种细胞的活力和凋亡[15,17-18]。此外,NA可以完全穿过血脑屏障,直接作用于神经纤维进行修复和疏通,并诱导神经纤维自我生长和分裂[22]。Hu Dandong等[11]报道,NA可以剂量依赖性地减轻1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导PD模型小鼠的运动障碍症状,有显著的改善作用。还有研究表明,NA可能通过Nrf2/ARE信号通路抑制氧化应激,从而降低实验性自身免疫性脑脊髓炎小鼠大脑中ROS的浓度,并增加SOD和过氧化氢酶的水平[22]。本研究发现H2O2对PC12细胞具有细胞毒性,并呈浓度依赖性。此外,Hoechst 33342染色和ROS检测数据显示,H2O2诱导PC12细胞凋亡。当用NA预处理时,H2O2诱导的PC12细胞活力显著增加,细胞凋亡明显被减弱,这进一步表明NA对H2O2损伤的PC12细胞具有保护作用。
ROS是各种疾病形成和发展的重要因素之一。细胞氧化损伤可产生过量的ROS,会损伤细胞DNA、蛋白质、脂质和细胞结构,并促进细胞死亡和凋亡[29-30]。前人的研究表明,H2O2通过提高ROS的水平增强氧化应激损伤[31-32]。因此,本实验使用荧光探针和MDA试剂盒测定PC12细胞中ROS和MDA的产生量。结果表明,H2O2导致PC12细胞中ROS和MDA含量增加,然而,与H2O2处理组相比,NA预处理显著抑制了这些异常变化,这可能与NA的抗细胞凋亡活性有关。
Bax、Bcl-2和Caspase-3等一系列凋亡相关蛋白是细胞死亡和细胞存活的主要调节因子[33-34]。本实验研究了NA是否可以抑制H2O2诱导导致的细胞凋亡。结果表明,与NC组相比,H2O2显著降低了Bcl-2/Bax的比值。然而,H2O2导致的凋亡被NA预处理显著抑制。ROS通过激活Bax增强胞质Caspase-3活性。此外,Bcl-2家族蛋白,包括抗凋亡(Bcl-2)和促凋亡(Bax)成员,在凋亡通路的早期阶段发挥关键作用[35]。据报道,Nrf2是抗氧化基因的重要转录激活因子[36]。本实验结果表明,NA显著抑制H2O2诱导的PC12细胞中HO-1水平升高和Keap1水平的降低,NA可能通过激活Nrf2/HO-1信号通路减轻PC12细胞氧化损伤。
4 结论
本实验结果表明,NA对H2O2诱导的PC12神经元细胞氧化损伤表现出良好的保护作用。这种保护作用主要表现为维持细胞形态的完整性和细胞生存活力,抑制H2O2引起的细胞凋亡,提高细胞抗氧化酶系统的表达和细胞抗氧化水平,其主要机制可能是激活Nrf2/HO-1信号通路。由此可见,NA是一种具有良好应用前景的食品功能因子。
