转录组学分析空气对泡菜“生花”酵母菌的影响机制
2024-05-18罗思洋练银银杨宇航谭兆涛潘玉龙索化夷宋佳佳张玉
罗思洋,练银银,杨宇航,谭兆涛,潘玉龙,索化夷,宋佳佳,张玉,4*
1(西南大学 食品科学学院,重庆,400700)2(西南大学 食品科学与工程国家实验教学示范中心,重庆,400700) 3(重庆市潼南区农业农村委员会,重庆,402660)4(国家柑橘工程中心,西南大学,重庆,400712)
泡菜是以新鲜蔬菜为原料,经中低浓度食盐水泡渍发酵、调味、包装、灭菌等过程生产加工而成的发酵食品[1]。截至2021年年底,四川省共有泡菜生产企业450余家,市场份额占中国总市场份额的70%,年产值446亿元[2]。但由于泡菜原料未经过灭菌处理和泡菜发酵过程难以控制,在发酵过程中一旦发酵条件不利,腐败微生物就会大量滋生,造成泡菜品质劣变,大量产品废弃,给泡菜生产企业带来严重经济损失[3]。因此,泡菜品质的保持对于泡菜生产企业而言就显得尤为重要。
在泡菜品质劣变的众多现象中,“生花”是泡菜最常见的品质裂变现象。泡菜“生花”是微生物在不良环境影响下,与渗出的胞外聚合物一起凝聚成的膜,可附着在固体表面或漂浮于液体表面[4]。泡菜“生花”不仅影响风味,还会加快泡菜的腐败,导致整坛泡菜都不能食用[5-6]。现有研究表明引起泡菜“生花”的微生物主要是酵母菌:毕赤酵母、假丝酵母、汉斯德巴氏酵母、酿酒酵母等[6-8]。作者在前期研究中证实了“生花”酵母菌(CandidaparapsilosisB7)易成膜且成膜稳定,并且“生花”受温度和O2的影响[9]。虽然现在众多研究证明了导致泡菜“生花”的主要菌属是酵母菌,也分离到了具体的“生花”菌株,但是关于“生花”菌株的“生花”机制研究并不多见,使得泡菜“生花”问题未能有效解决。
泡菜“生花”受环境因素影响,泡菜坛/池的密封性是影响泡菜“生花”的关键因素[9]。本文选取在“生花”泡菜中分离鉴定的主要“生花”菌株C.parapsilosisB7为研究对象,模拟密封/非密封2种环境条件,利用转录组学和生物信息学结合分析的方法,研究C.parapsilosisB7在有/无空气下转录组表达的差异情况,同时进行实时荧光定量PCR(real-time quantitative PCR, qRT-PCR)验证关键差异基因的变化,探究C.parapsilosisB7的“生花”分子机制,为研究泡菜“生花”精准防控提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
“生花”酵母菌(C.parapsilosisB7)由本实验室菌种资源库保藏(“生花”泡菜样液中分离得到)。
1.1.2 试剂
YPD培养基、酵母基因组DNA提取试剂盒,北京索莱宝科技有限公司;Trizol Reagent、RevertAid第一链cDNA合成试剂盒,美国Thermo Fisher科技有限公司;异丙醇、无水乙醇,重庆川东化工有限公司;三氯甲烷,重庆科试化学有限公司;无核糖核酸酶水,上海碧云天公司。
1.2 仪器与设备
H-2050R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;CFX Connect型PCR仪,美国BioRad公司;LRHS-150-Ⅱ恒温恒湿培养箱,上海跃进医疗器械有限公司;SW-CJ 2FD双人单面超净工作台,苏州安泰空气技术有限公司;HiSeq X Reagent Kits/NovaSeq Reagent Kits测序平台,美国Illumina公司。
1.3 实验方法
1.3.1 菌株的活化
取甘油保藏的C.parapsilosisB7 200 μL接种到10 mL液体YPD培养基中,37 ℃培养48 h。在液体YPD培养基菌悬液中取一环接种到固体YPD培养基中,37 ℃培养48 h;在固体YPD培养基菌落中取一环接种到10 mL液体YPD培养基中,37 ℃培养48 h;最后在该液体YPD培养基菌悬液中取一环接种到固体YPD培养基中,37 ℃培养48 h后于4 ℃储存,备用。
1.3.2 转录组测序
1)菌体收集
将活化的C.parapsilosisB7接种到YPD液体培养基中,实验组(有空气)使用透气试管塞,对照组(无空气)使用玻璃塞,37 ℃培养48 h。于10 000×g4 ℃离心10 min,去除上清液,使用无菌PBS洗涤菌体3次,收集菌体,经液氮速冻保存。每个组3个重复。
在进行企业的网络营销效果分析系统设计中,要尽可能将在系统设计中将关系消费效果的网络营销影响因素和消费者行为涵盖在内,确保网路哦营销效果分析更加精准到位,对于消费行为和影响因素做到更有效的把握,这样才能确保网络营销的有效性,为企业制定和调整网络营销方案提供有效的支持。例如,据不完全统计,使用网络搜寻资料的网民,90%是先通过搜索关键词,查看排名靠前的相关网页,关键词的设置,可以让目标群体最快速搜索的查看到项目情况,获最先的机会与客户视觉接触。
2)RNA提取、文库构建及测序
采用TRIzol(Invitrogen)法提取样本中的总RNA,并使用DNase I(TaKaRa)去除基因组DNA。分别采用2100 Bioanalyser(Agilent)、ND-2000(NanoDrop Technologies)方法检测RNA样品的质量。采用TruSeqTMRNA sample preparation Kit(Illumina,San Diego,CA)试剂盒进行RNA文库的构建。使用Ilumina HiSeq xten/NovaSeq 6000测序平台进行高通量测序。
1.3.2.1 差异基因(differential expression analyses,DEGs)表达
使用软件RSEM(http://deweylab.github.io/RSEM/)分别定量分析基因和转录本的表达水平。使用DESeq2软件进行差异基因筛选并对原始计数(raw counts)进行统计分析以获得组间差异表达基因或转录本的比较结果,筛选条件为P<0.05且|log2FC|≥1。
1.3.2.2 GO和KEGG富集
以进行差异显著分析并注释到GO和KEGG数据库的基因集为背景基因集,差异显著分析所得到的DEGs注释到GO和KEGG数据库的基因集为差异基因集,利用DESeq2软件对DEGs进行GO功能富集和KEGG通路分析。
1.3.3 qRT-PCR检测差异基因表达
根据RNA-seq数据随机选择DEGs,采用Primer 3程序设计引物。PCR条件为95 ℃预变性3 min;95 ℃变性5 s,56 ℃退火30 s,共40个循环。以Actin为内参,采用2-△△CT法计算相对表达。引物及序列见表1。

表1 引物序列Table 1 Primer sequence
1.4 数据分析处理
2 结果与分析
2.1 转录组数据统计分析及基因组比对结果
总体而言,在去除接头污染、长度不足或质量差的序列后,获得了两组有效的数据,超过93.79%的reads的平均质量值≥30,6个样品的GC含量为(40.42±0.02)%(表2)。以上结果说明,本次测序所得cDNA文库质量高,可以进行后续生物信息学的进一步研究。对比其他文献对于其研究内容的转录组数据统计分析,本研究与其相似之处在于同样进行了Clean reads和Clean bases的统计比较,不同之处在于其根据研究内容特性对每个样品总比对数/率、特异比对数/率及外显子比对数/率进行了统计[10]。而本研究则是对样品的碱基质量百分数和GC含量进行统计分析,能更好突出本次测序文库质量。
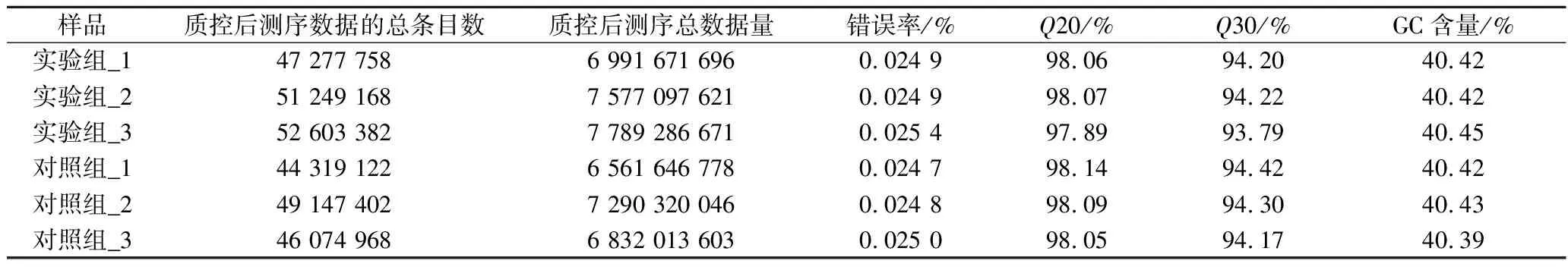
表2 C.parapsilosis B7测序数据统计评估Table 2 Evaluation and statistics of sequencing data of C.parapsilosis B7

表3 显著差异通路及基因分析Table 3 Significant difference pathways and gene analysis
2.2 基因表达差异分析
使用DESeq2软件筛选出具有显著差异表达的基因(P<0.05,上/下调差异倍数为>2.0倍)。采用散点图和火山图表现差异基因在两个样本间的表达差异程度。其他文献采用韦恩图和火山图进行实验组和对照组的基因表达差异分析,通过韦恩图展现实验组和对照组基因的相似性[11-13]。如图1所示,横坐标表示基因的表达倍数变化,纵坐标表示基因的差异显著性;红点表示上调基因,蓝点表示下调基因,灰点表示差异不显著基因。转录组数据分析表明,与对照组相比,实验组中筛选到183个DEGs,其中42个DEGs表达显著上调,占总DEGs的22.95%,141个DEGs表达显著下调(图1)(P<0.05)。结果表明C.parapsilosisB7在空气刺激下,基因表达发生一定的差异性。从上述结果中筛选有空气条件下C.parapsilosisB7形成生物膜相关表达差异基因进行后续分析。

a-表达量差异散点图;b-表达量差异火山图
2.3 DEGs GO富集分析
通过Goatools软件将DEGs注释到Gene Ontology(GO)数据库,得到DEGs可能具有的功能信息,其中GO包括分子功能(molecular function, MF)、细胞组分(cellular component, CC)和生物过程(biological process, BP)3个维度。如图2所示,显著上调的DEGs在3个维度中富集的显著性水平较高,在BP类主要富集到蛋白质相关过程(有机氮化合物生物合成过程、肽生物合成过程、肽代谢过程、细胞蛋白质代谢过程、细胞氮化合物生物合成过程)以及酰胺合成、代谢,在CC和MF类主要富集到核糖体相关部位(胞质小核糖体亚单位、核糖体小亚基、核糖核蛋白复合物、大核糖体亚基、核糖体亚基、胞质大核糖体亚基、核糖体的结构成分)。如图2所示,显著下调的DEGs在BP类主要富集到某些糖类酶的活性(葡聚糖外切-1,3-β-葡萄糖苷酶活性、葡聚糖内切-1,6-β-葡萄糖苷酶活性、D-阿拉伯糖-1-脱氢酶活性),在CC类主要富集到某些糖类代谢(葡聚糖分解代谢过程、多糖分解代谢过程、细胞碳水化合物代谢过程)及脂肪酸的合成、代谢。脂肪酸的生物合成原料主要是葡萄糖分解代谢产生的乙酰CoA,且天冬酰胺等参与脂肪酸的生物合成,则酰胺生物合成、细胞酰胺代谢可能与脂肪酸生物合成相关。同时核糖体是合成蛋白质的场所,它将遗传密码转换成氨基酸序列并从氨基酸单体构建蛋白质聚合物[14-15]。以上结果表明,空气刺激会影响核糖体功能和脂肪酸合成及代谢进而影响C.parapsilosisB7的生长及代谢,这为差异基因的KEGG富集分析提供思路。
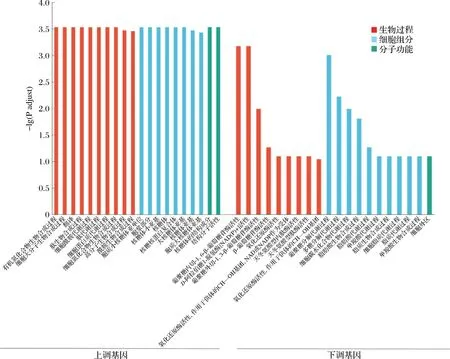
图2 DEGs GO富集分析Fig.2 GO analysis classification of DEGs
2.4 DEGs KEGG富集分析
为了进一步系统地分析差异基因富集到的代谢通路,采用KOBAS(一个用于注释和识别丰富的路径和疾病的web服务器)分析受空气影响的C.parapsilosisB7对KEGG途径的富集,采用BH(FDR)方法进行多路复用,并根据生物信息学数据库将DEGs分配到不同的途径。如图3所示,DEGs显著富集到核糖体途径,脂肪酸生物合成途径中(P<0.05),则KEGG富集到的通路与GO富集分析到的功能一致。
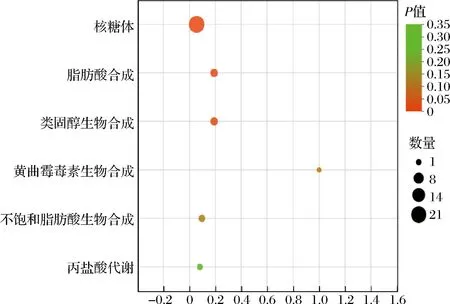
图3 差异表达基因KEGG富集分析Fig.3 KEGG pathway analysis of differentially expressed genes
DEGs在核糖体的通路显著富集,且富集数最多,超过差异基因总数的25%。核糖体是合成蛋白质的分子机器,通过对mRNA的解读,与携带氨基酸的tRNA协同作用翻译出一条多肽链,多肽链再经过后期的加工、折叠及转运等过程,最后形成有功能的蛋白[14-15]。在菌株进行生命活动的每个过程中都有核糖体的参与,本研究中核糖体中的亚基蛋白的调控基因RPL3/4/5/10/12/15、RPSA/3A/15A、RPS9和RPL7A/10A是显著上调的(图4)。

图4 核糖体通路Fig.4 The pathway of ribosome
RPL3/4/5/10/12/15、RPSA/3A/15A、RPS9和RPL7A/10A基因注释到翻译过程,上述基因的上调提高了翻译准确度,促进了翻译的正向调节,说明翻译质量和速度将可能会加快。核糖体蛋白SA(ribosomal protein SA, RPSA)是40S核糖体亚基的一个组成部分,在HeLa细胞中被鉴定为H2O2靶点[16]。核糖体蛋白L4和L22形成大核糖体亚基中肽出口通道的一部分。RPL4蛋白是一种高度保守的核糖体亚基,其对于维持核糖体翻译效率和保真度至关重要[17]。RPL10位于氨基酸tRNAs在调节过程中移动的通道附近,并参与tRNA通过该结构的运动;RPL10还很好地定位为肽酰转移酶中心附近的活性传感器,并将该信息传递到其他功能中心以协调核糖体功能。RPL10环是核糖体结构和功能的主控制器,影响核糖体组装和生物发生的关键步骤以及延伸的蛋白质合成阶段[18]。生物膜的主要成分是脂质和蛋白质,蛋白质在生物膜的形成中起促进作用[9,19]。有空气条件下,核糖体通路中RPL10、RPSA等基因上调有利于蛋白质的合成,从而有利于生物膜的形成。
另外,DEGs在脂肪酸生物合成途径中显著富集。脂肪酸分为饱和脂肪酸和不饱和脂肪酸,其中在不饱和脂肪酸合成途径中FAD2显著上调(P<0.05)。FAD2基因编码对多不饱和脂质合成至关重要的酶,在不饱和脂肪酸的生物合成途径中起着极其重要的作用[20]。磷脂的组成成分磷脂酰丝氨酸和磷脂酰乙醇胺含不饱和脂肪酸较多,而磷脂又是生物膜的重要组成部分[21-22]。细胞膜上的磷脂主要由磷脂酰乙醇胺(phosphatidylethanolamine, PE)、磷脂酰肌醇(phosphatidylinositol, PI)和磷脂酰胆碱(phosphatidylcholine, PC)组成,其中PS、PE和PI位于细胞膜脂质双层内侧,PC位于膜外侧,PS和PE中[22]。因此脂肪酸代谢通路中FAD2是不饱和脂肪酸合成的关键基因,从而有利于形成磷脂,进而有利于生物膜的形成。
2.5 DEGs qRT-PCR验证
在KEGG富集分析中,实验组相对于对照组而言,FAD2上调(表2),由于FAD2基因编码对多不饱和脂质合成至关重要的酶[20],则多不饱和脂质合成增加。同时核糖体蛋白调控基因如RPL4、RPL10,RACK1,RPS2等上调(表2),说明核糖体的作用加剧,促进蛋白质的产生[14-15],从而有利于生物膜的形成[19]。为了验证转录组学预测的准确性,定量分析了核糖体通路和脂肪酸生物合成通路中的FAD2、RPL4、RPL10的表达量。其中并没有选择甾醇通路中基因进行qRT-PCR验证,这是因为在这个通路中基因虽然发生显著变化,但其表达量非常低。如图5所示,验证结果表明,实验组相对于对照组,这3个基因的表达量显著上调(P<0.05)。转录组测序结果与qRT-PCR结果一致,表明DEGs的结论是可靠的。

a-FAD2;b-RPL4;c-RPL10
3 结论
本文通过对泡菜中“生花”酵母菌C.parapsilosisB7进行转录组测序,分析了有空气和无空气条件下C.parapsilosisB7差异表达基因。研究发现,空气刺激下C.parapsilosisB7中具有合成蛋白质和磷脂功能的基因发生了变化,对核糖体通路和脂肪酸合成通路具有显著影响,改变了这两个通路中的25个基因的上调/下调。在核糖体通路中,核糖体蛋白调控基因RPL4、RPL10、RPSA较为关键,且脂肪酸合成通路中FAD2为关键基因。经过qRT-PCR验证,证实空气刺激导致RPL4、RPL10、FAD2基因显著上调。综上所述,空气刺激可通过上调RPL4、RPL10、FAD2等关键基因的表达,而使核糖体和脂肪酸合成通路上调,进而有利于产生蛋白质和磷脂,从而导致C.parapsilosisB7“生花”。本研究结果为C.parapsilosisB7“生花”机理的深入探索提供依据,同时为泡菜“生花”现象的抑制提供靶向研究方向。
