不同提取方式对山楂果渣可溶性膳食纤维结构及功能特性的影响
2024-05-18祖齐欣王勇刘素稳徐永平李淑英王淑玉常学东
祖齐欣,王勇,刘素稳,,3,4*,徐永平,李淑英,王淑玉,常学东,3
1(河北科技师范学院 食品科技学院,河北省燕山特色农业产业技术研究院,河北 秦皇岛,066000)2(大连赛姆生物工程技术有限公司博士后工作站,辽宁 大连,116033)3(河北省燕山特色果品加工技术创新中心,河北 承德,067000)4(河北省果品加工技术创新中心,河北 秦皇岛,066000)
山楂(CrataeguspinnatifidaBge.)隶属于蔷薇科山楂属,药食两用,具有很高的营养价值。其膳食纤维含量在水果中名列前茅,并且可溶性膳食纤维(water-soluble dietary fiber,SDF)含量较高,属于高质量膳食纤维。山楂富含多酚,具有降血脂、抗衰老、抗癌、抗疲劳等多种药理作用[1-2]。目前,工业上提取多酚产生大量果渣废弃物,通常作为废料处理[3]。山楂果渣中膳食纤维未充分开发利用,造成大量资源浪费、企业效益低和农民收入低等问题。
膳食纤维作为第七大营养素[4],它在预防和缓解便秘、高血糖、直肠癌和高血压等方面发挥着重要作用[5-6]。特别是SDF能显著影响碳水化合物和脂质的代谢,还能吸附重金属离子和胆固醇,引起了医学界、食品工业甚至广大公众的关注[7-8]。目前国内外制备SDF的主要方法有热水提法、化学法、酶法、发酵法和联合法。其中最常用的化学法易操作、适合大规模生产,但需要经过酸碱和高热的处理,得到的SDF存在品质、色泽较差,持水力和膨胀力下降等问题[9-10]。酶法具有条件温和、样品纯度高等特点。发酵法成本低、提取率高,但需要的环境条件复杂,难以控制[11]。因此,寻找和开发具有SDF提取率高,功能特性好的技术成为亟待解决的关键问题。
微波技术作为一种现代高新技术在食品中的应用越来越广泛。它作为一种波能,可以使加工后的溶剂经历偶极子旋转,迅速均匀地提高溶剂温度,增加化合物的溶解度。微波辅助处理还可以增加细胞内压力,使细胞壁破裂,露出内容物,有利于增加提取率和提高SDF功能特性[12-14]。例如,微波处理方竹笋膳食纤维,既增强了水合性,又提高了抗氧化性能[15]。因此,微波技术在SDF提取上有应用潜力。多技术联合法能够有效弥补单一提取方法的缺点,是较为完善的提取方法。目前还没有关于微波联合酶法提取山楂膳食纤维的研究。碱法提取具有操作简单、易于控制,是提取SDF最广泛使用的方法之一。酶法提取是通过酶促反应去除原料中非膳食纤维成分,提取物SDF具有较高纯度。因此本实验研究采用微波酶法、酶法和碱法3种方法制备山楂SDF,并比较SDF的理化特性、抗氧化及体外调节糖脂的功能特性,以筛选出制备高质量山楂果渣SDF的最优方法,延长山楂深加工产业链,促进山楂产业的高质量发展。
1 材料与方法
1.1 仪器与设备
1.1.1 仪器与设备
ICS5000离子色谱仪、Nicolet5700傅里叶红外光谱仪,美国Thermo Fisher Nicolet公司;UGC-24M氮吹仪,上海力辰仪器科技有限公司;SU-8010扫描电子显微镜、UV-2910紫外分光光度计、Dmax.2500v pc型X-射线衍射仪,日本Hitachi公司;ARC254差示扫描量热仪,德国耐驰仪器制造有限公司;TDZ5-WS型台式离心机,长沙湘仪离心机仪器有限公司;WD900B型微波炉,顺德市格兰仕电器实业有限公司;LGJ.30D真空冷冻干燥机,北京四环科学仪器厂有限公司。
1.1.2 试剂与材料
无水乙醇,天津永晟精细化工有限公司;α-淀粉酶(10万 U/g)、糖化酶(10万 U/g)、中性蛋白酶(15万U/g)、纤维素酶(10万 U/g)、牛磺胆酸钠、甘氨胆酸钠,上海源叶生物科技有限公司;DPPH、抗坏血酸等试剂,美国Sigma公司;浓硫酸、浓盐酸,福晨(天津)化学试剂有限公司;冰醋酸,天津市凯通化学试剂有限公司;NaOH,天津欧博凯化工有限公司。
山楂:摘自中国承德兴隆县,2020年10月采摘,全熟。
1.2 实验方法
1.2.1 山楂果渣膳食纤维提取
1.2.1.1 山楂果渣制备
山楂果渣取自提取多酚后的果渣,具体操作为:山楂果去核,山楂∶水=1∶2(g∶mL)打浆。山楂果浆与75%酸化乙醇按体积比1∶3在45 ℃恒温水浴提取2 h,静置抽滤,滤渣在45 ℃烘箱烘干8 h,粉碎后过筛得到干燥的山楂果渣。
1.2.1.2 山楂膳食纤维提取
微波辅助酶法制备SDF(microwave-enzymatic extraction of soluble dietary fiber,MSDF):经响应面优化后的最佳提取方法为1.0 g山楂果渣加入10 mL蒸馏水,微波功率480 W处理3 min。静置降温至45 ℃,加入α-淀粉酶0.1%、纤维素酶0.5%、中性蛋白酶0.6%(均为质量分数),在pH 4.5的条件下恒温酶解120 min。95 ℃高温蒸煮灭酶10 min,抽滤取上清液。向滤液中加入4倍体积无水乙醇,静置醇沉12 h。在4 000 r/min离心15 min取沉淀,冷冻干燥后为MSDF。
酶法制备SDF(enzymatic extraction of soluble dietary fiber,ESDF):同上述微波酶辅助法,但不进行微波处理。
碱法制备SDF(alkaline extraction of soluble dietary fiber,NSDF):参考许祯毅等[16]的方法。1.0 g SDF样品,加入30 mL 50 g/L NaOH溶液,水浴60 min后趁热抽滤取上清液,待滤液冷却至25 ℃后用3 mol/L的HCl溶液调节滤液的pH值至4.5,过滤。按照微波辅助酶法离心,干燥得到NSDF。
1.2.2 SDF结构测定
1.2.2.1 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)
将SDF样品与KBr混合,在玛瑙研钵中研磨。真空压片,置于光路中扫描,扫描范围为4 000~400 cm-1,得到红外光谱。
1.2.2.2 外貌形态观察
使用扫描电镜观察改性前后膳食纤维微观结构的变化。用离子喷金80 s,在100~10 000倍的扫描电镜下拍摄。
1.2.2.3 X-射线衍射(X-ray diffraction,XRD)
工作电压30 kV,工作电流20 mA,衍射角度2°~80°,分辨率0.02°,扫描速率10 ℃/min,扫描范围3°~90°,波数为500~4 000 cm-1,获得XRD谱图[17]。
1.2.2.4 热重分析(thermogravimetry analysis,TGA)
参照KHATKAR等[18]的方法,取5 mg SDF样品置于热重分析仪中,在N2环境,升温速度5 ℃/min条件下,得到SDF样品在50~600 ℃的TGA曲线。
1.2.3 SDF成分组成分析
1.2.3.1 SDF单糖组成分析
采用高效阴离子交换色谱测定SDF单糖组成。
(1)标准溶液的配制和计算方法
取9种单糖标准品(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸、葡萄糖醛酸)配成标准母液溶液。取各单糖标准溶液精密配制浓度标准品作为混标。根据绝对定量方法,测定不同单糖质量,根据单糖摩尔质量计算出摩尔比。
(2)SDF样品准备
精密称量5 mg SDF样品置于安瓿瓶中,加入3 mol/L三氟乙酸2 mL,120 ℃水解3 h。准确吸取酸水解溶液转移至管中N2吹干,加入5 mL水涡旋混匀,吸取50 μL加入950 μL去离子水,12 000 r/min离心5 min。取上清液进行成分分析。
(3)色谱柱为DionexCarbopacTMPA20(3 mm×150 mm);流动相A:H2O;B:15 mmol/L过氧乙酸钠;15 mmol/L NaOH+100 mmol/L过氧乙酸钠;流速0.3 mL/min;进样量5 μL;柱温30 ℃;检测器为电化学检测器。
1.2.3.2 总酚、花色苷测定
福林-酚法测定SDF样品总酚含量;pH示差法测定SDF样品花色苷含量。
1.2.3.3 基本成分检测
SDF纯度、蛋白质、脂肪、水分和灰分含量分别参照以下标准测定:GB/T 5009.88—2016《食品中膳食纤维的测定》、GB 5009.5—2016《食品中蛋白质的测定》、GB 5009.6—2016《食品中脂肪的测定》、GB 5009.3—2016《食品中水分的测定》和GB 5009.4—2016《食品中灰分的测定》。
1.2.4 SDF 理化性质测定
1.2.4.1 持水力
向刻度试管中准确称取质量为1.0 g的干SDF样品,加入10 mL的蒸馏水后将刻度试管放置于4 ℃冰箱1 h。4 000 r/min离心15 min,将其沉淀转移到的表面皿中,称取其质量[19]。根据公式(1)计算持水力。

(1)
式中:m1,干SDF样品质量,g;m2,表面皿质量,g;m3,表面皿与SDF样品质量,g。
1.2.4.2 持油力
向刻度试管中准确称取质量为1.0 g的干SDF样品,添加10 mL玉米油并充分混合将混合物置于(22±1) ℃恒温箱1 h。4 000 r/min离心15 min后,称量弃上层油后的SDF样品量[19]。根据公式(2)计算持油力。

(2)
式中:m1,干SDF样品质量,g;m2,弃去油层SDF样品质量,g。
1.2.4.3 吸水膨胀力
称取SDF样品1.0 g于10 mL刻度试管中,测定干样体积。加入10 mL蒸馏水,搅拌均匀,室温下静置24 h。测定膨胀后体积。根据公式(3)计算吸水膨胀力。

(3)
式中:V0,干SDF样品体积,mL;V1,膨胀后体积,mL;m,干SDF样品质量,g。
1.2.4.4 溶解性
将1.0 g SDF样品溶解30 mL蒸馏水中,并在25 ℃下摇床振荡6 h。4 000 r/min离心悬浮液,舍去上清液,在105 ℃烘干至恒重。根据公式(4)计算溶解性[20]。
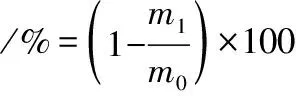
(4)
式中:m1,SDF样品残渣烘至恒质量,g;m0,SDF样品干质量,g。
1.2.4.5 阳离子交换能力
称取1.0 g SDF样品浸没于装有0.10 mol/L HCl溶液的锥形瓶中,37 ℃振荡24 h后过滤,收集滤渣。用蒸馏水不断冲洗滤渣直至用100 g/L AgNO3检测不到Cl-为止,最后干燥至恒重。0.1 g恒重SDF样品置于装有100 mL 50 g/L NaCl溶液的锥形瓶中,充分振荡混合均匀,用NaOH溶液(0.01 mol/L)缓慢滴定,5 min后酚酞指示剂不变色即为滴定终点,同时用纯水替代HCl溶液做空白试验[21]。根据公式(5)计算阳离子交换能力。

(5)
式中,m,SDF样品质量,g;V1,试样消耗NaOH的体积,mL;V2,空白消耗NaOH的体积,mL;c,NaOH浓度,mol/L。
1.2.5 抗氧化能力测定
1.2.5.1 自由基清除能力
在试管中加入3 mL不同浓度SDF样品和3 mL DPPH乙醇溶液(200 μmol/L),避光30 min,测定517 nm处的吸光度值。3 mL无水乙醇代替DPPH乙醇溶液作为空白组,测定吸光度值。对照组用3 mL蒸馏水代替SDF样品,测定吸光值。根据公式(6)计算清除率,维生素C作为阳性对照。

(6)
式中:A1,SDF样品上清液的吸光度;A2,空白上清液的吸光度;A3,对照组上清液的吸光度。
1.2.5.2 羟自由基(·OH)清除能力
在SDF样品组试管中加入0.4 mL 2 mmol/L水杨酸、1 mL 0.15 mmol/L FeSO4、0.2 mL SDF样品溶液、1 mL 6 mmol/L H2O2和0.4 mL蒸馏水。对照组用蒸馏水代替水杨酸,空白组用蒸馏水代替SDF样品溶液。以上3组试管37 ℃恒温水浴1 h,取出冷却,用蒸馏水调零,在510 nm处测吸光值。照公式(7)计算清除率,维生素C作为阳性对照。

(7)
式中:A1,SDF样品上清液的吸光度;A2,对照组上清液的吸光度;A3,空白组上清液的吸光度。
1.2.6 体外降血糖活性
1.2.6.1 葡萄糖吸附力测定
参考WANG等[22]的方法,将1.0 g SDF样品加入100 mL 100 mmol/L葡萄糖溶液中,37 ℃水浴振荡6 h。5 000 r/min离心15 min,取上清液,测定540 nm上清液中葡萄糖含量。葡萄糖吸附力按公式(8)计算。

(8)
式中:m,干SDF样品质量,g;n,原始葡萄糖含量,mmol;n2,吸附后葡萄糖含量,mmol。
1.2.6.2 α-淀粉酶抑制能力测定
将1.0 g SDF样品和4.0 mg α-淀粉酶加入到40 mL玉米淀粉溶液中,将溶液在37 ℃水浴振荡酶解1 h,然后加入0.1 mol/L NaOH溶液80 mL终止酶解反应。5 000 r/min离心20 min,取上清液,用DNA法测定葡萄糖含量。以相同条件下未添加SDF样品的玉米淀粉溶液为对照[23]。根据公式(9)计算。

(9)
式中:ρ1,添加膳食纤维样本酶解液中的葡萄糖含量,mg/mL;ρ2,未添加膳食纤维样本酶解液中的葡萄糖含量,mg/mL。
1.2.7 体外降血脂活性
1.2.7.1 胆固醇吸附能力
取鲜鸡蛋蛋黄,用9倍蒸馏水稀释搅拌至完全乳化,分别调节pH值至2和7,采用邻苯二甲酸法测定记录胆固醇含量。取1.0 g SDF样品与分别与不同pH值的25 mL稀释蛋黄液混合,37 ℃连续水浴振荡2 h。取4 mL样液,加入16 mL无水乙醇,5 000 r/min离心20 min,取上清液,测定波长550 nm处上清液中胆固醇含量[24]。根据公式(10)计算。

(10)
式中:m,干SDF样品质量,g;W1,原始胆固醇含量,mg;W2,上清液胆固醇含量,mg。
1.2.7.2 胆酸盐吸收能力
(1)胆酸盐标准曲线的绘制
参考于美汇等[25]的方法有改动。配制浓度为0.03、0.06、0.12、0.18、0.24、0.30 mmol/L的甘氨胆酸钠,0.05、0.10、0.15、0.20、0.25、0.30 mmol/L的牛磺胆酸钠标准溶液。得到标准曲线方程为甘氨胆酸钠:Y=0.380 7X+0.022 8,R2=0.996 1和牛磺胆酸钠:Y=0.234 2X+0.009,R2=0.999 2。
(2)胆酸盐结合
参考于美汇等[25]的方法,分别移取3 mL 10 mg/mL SDF样品溶液于100 mL具塞锥形瓶中,加入3 mL 10 mg/mL胃蛋白酶和1 mL 0.01 mol/L 的HCl溶液,37 ℃恒温振荡消化1 h;加入0.1 mol/L的NaOH溶液调节pH值至6.3,随后加入4 mL 10 mg/mL胰蛋白酶,37 ℃恒温振荡消化1 h,每个SDF样品中加入4 mL 0.4 mmol/L甘氨胆酸钠和0.5 mmol/L牛磺胆酸钠,37 ℃恒温振荡1 h后,4 000 r/min离心20 min,取上清液,387 nm波长处测定吸光度。甘氨胆酸钠和牛磺胆酸钠结合率按公式(11)、公式(12)计算。
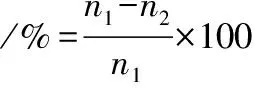
(11)
式中:n1,甘氨胆酸钠加入量,μmol;n2,甘氨胆酸钠剩余量,μmol。

(12)
式中:n3,牛磺胆酸钠加入量,μmol;n4,牛磺胆酸钠剩余量,μmol。
1.2.8 数据统计与分析
所有实验重复3次,实验结果表示为平均值±标准偏差。采用SPSS 26.0软件进行数据处理,平均数之间的差异通过单因素方差分析(ANOVA),P<0.05为显著性差异,采用Origin 9.0作图。
2 结果与分析
2.1 提取方式对SDF外观的影响
由图1可知3种提取方式的膳食纤维在感官上有很大差别。MSDF和ESDF颜色较浅,而NSDF颜色极深,这可能是因为碱法提取过程中,强碱使山楂果渣中膳食纤维可溶性色素或者蛋白质发生褐变,产生深色物质。从状态上看MSDF外观更加蓬松,表明微波酶解提取SDF具有良好的外观。

图1 三种提取方式的SDF外观对比Fig.1 Comparison of SDF appearance among three extraction methods
2.2 提取方式对SDF结构的影响
为进一步确定3种提取方式对SDF结构和热特性的影响,采用FTIR、XRD、扫描电镜、TGA等方法进行分析。
2.2.1 山楂SDF的FT-IR分析

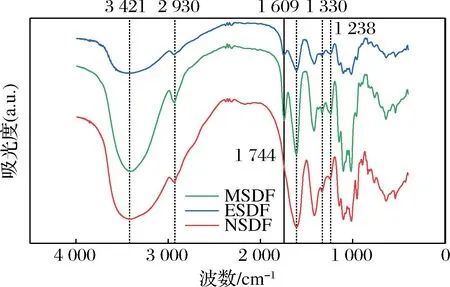
图2 不同提取方式下SDF的FT-IR图Fig.2 FT-IR diagram of SDF under different extraction methods
2.2.2 山楂SDF微观结构分析
在图2基础上进一步分析SDF的微观结构。如图3所示,ESDF表面光滑,结构紧凑。经NaOH溶液提取的NSDF颗粒表面不均匀,形成断层结构。SDF经微波酶解,也形成断层结构,表面有大量小颗粒,形成雪花状,与前人研究结果一致[27]。造成这种现象的原因是微波引起SDF内部局部过热,细胞内的蒸气压迅速上升,局部水蒸气使细胞壁破裂,导致比表面积增加,形状松散多孔。MSDF这些松散的结构有利于扩大SDF颗粒的表面积,对提高SDF的持水能力和溶胀比具有积极作用。

a-MSDF;b-ESDF;c-NSDF
2.2.3 山楂SDF晶体结构分析
SDF晶体结构可影响其持水性和持油性,因此测定其结晶性可以推测其功能特性。3种提取方式对SDF晶体结构的影响见图4。

图4 不同提取方式SDF的XRD图Fig.4 XRD patterns of SDF with different extraction methods
MSDF和ESDF在2θ=17.45°、21.1°、32.2°和40.1°处出现明显的衍射峰,NSDF与前两种提取方法的SDF不同是13.12°处有一个大的衍射峰。3种方法在21.1°处为主衍射峰,与天然纤维素I一致结晶结构是结晶区与无定形区共存的状态。微波后SDF的衍射峰形状没有发生显著变化,微波没有改变SDF的晶型。NSDF结晶区的峰高以及峰面积均有所下降,说明相对结晶度均有不同程度的降低。这可能是因为NaOH溶液处理在一定程度上破坏了SDF的结晶区域,结晶区转变为非晶区,进而导致结晶度略有下降,NSDF的分子间作用力减弱,可以呈现更松散的形态,有利于SDF的水合性能[28]。这一结果与王司琪等[29]研究的玉耳膳食纤维结果一致。
2.2.4 山楂SDF热特性分析
TGA是研究材料热降解的有效方式,分析热重可以了解SDF在食品加工中的稳定性。在加热条件下,SDF失重可分为3个阶段:干燥阶段、碳化阶段和燃烧阶段(图5)。在第一阶段,在30~200 ℃有一个小的损失,主要反应可能是SDF样品脱水。第二阶段,在200~300 ℃发生严重失重,过程包括聚糖环脱水和细胞壁细胞骨架分解。第三阶段为500~600 ℃,在此温度下,SDF几乎分解。NSDF最终的残余重量高于其他两种方法的原因可能是,NSDF中含有不被碳化的化学物质。微波前后SDF在热学性质曲线中未观察到明显差异,这说明微波处理未对山楂果渣SDF的热稳定性产生显著影响。

图5 不同提取方式SDF热重图Fig.5 SDF thermogravimetric graph with different extraction methods
2.3 提取方式对山楂果渣SDF成分组成的影响
2.3.1 SDF单糖成分组成分析
单糖组成如表1和图6所示,3种SDF含有9种单糖,包括岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸、葡萄糖醛酸。其中半乳糖醛酸是MSDF和ESDF中的主要单糖,含量分别高达306.07和298.38 μg/mg,MSDF略高于ESDF。可能是微波处理导致多糖链部分断裂,小幅度增加了半乳糖醛酸含量。半乳糖醛酸是由α-1,4糖苷键线性连接在一起的多聚物,也是果胶中的主要单糖,半乳糖醛酸的大量存在表明果胶可能是SDF的重要成分。MSDF和ESDF中葡萄糖、阿拉伯糖、半乳糖和木糖浓度较高,4种糖总含量分别为202.7和196.93 μg/mg,说明半纤维素聚合物也是山楂果渣SDF的主要成分之一。NSDF中葡萄糖含量最高,其次是半乳糖醛酸和阿拉伯糖,这表明半纤维素和纤维素等非果胶多糖与NSDF一起提取。KEREH等[30]证明含糖醛酸的物质可以提高鸡蛋的抗氧化性,表明糖醛酸的含量越高,其清除自由基的能力越强。本研究3种方法得到的SDF均存在具有抗氧化能力的半乳糖醛酸,其中MSDF含量最高。MA等[31]的研究表明,低聚半乳糖醛酸在小鼠抗UVB辐射中有较好的抗氧化作用,这可能是SDF具有抗氧化作用的原因之一。

表1 不同提取方式的山楂果渣SDF单糖成分 单位:μg/mg
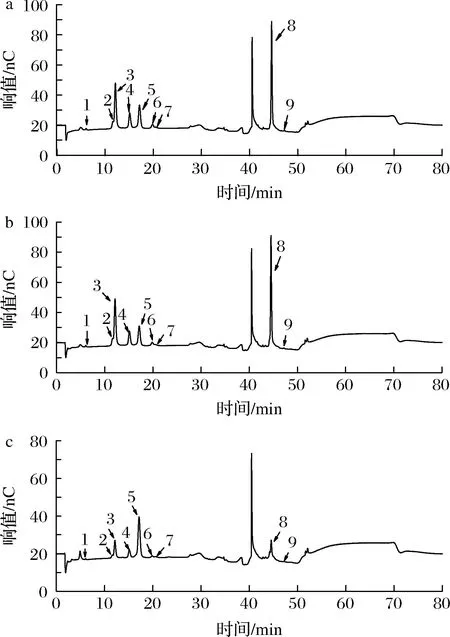
1-岩藻糖;2-鼠李糖;3-阿拉伯糖;4-半乳糖;5-葡萄糖;6-木糖;7-甘露糖;8-半乳糖醛酸;9-葡萄糖醛酸a-MSDF色谱图;b-ESDF色谱图;c-NSDF色谱图
2.3.2 SDF总酚和花色苷含量分析
如图7所示,3种方法的SDF中均含有微量的总酚、花色苷。总酚含量ESDF中含量高于MSDF和NSDF(P<0.05)(图7-a),推测原因可能是微波加热和强碱使得酚类物质分解。如图7-b所示,NSDF中花色苷含量显著高于其他两种提取方式的SDF(P<0.05),其他两种提取方法的SDF中花色苷含量差别不大(P>0.05)。

a-总酚含量;b-花色苷含量
2.3.3 基本成分分析
由表2可知,3种提取方式提取均获得高纯度SDF样品,酶法和微波酶法纯度高于碱法。表明采用酶法或微波酶法提取SDF具有纯度好的优点。

表2 三种方法SDF主要成分含量Table 2 Content of main components of SDF in three methods
2.4 提取方式对山楂SDF理化性质的影响
由表3可知,MSDF持水力为2.69 g/g,分别高于ESDF 64.02%、NSDF 20.09%,持油力为0.51 g/g分别高于ESDF 4.08%、NSDF 24.39%,吸水膨胀力6.67 mL/g高于ESDF 15.80%、NSDF 10.07%(P<0.05)。溶解性大小在一定程度上反映SDF分子质量大小,溶解度越高,分子质量越小,由溶解度结果可知,3种方法山楂果渣SDF在25 ℃时的溶解性均大于50%,且MSDF溶解性最高。由此推测3种方法提取的SDF都是低分子质量物质。膳食纤维阳离子交换能力具有降血压、排毒的功效,表3看出MSDF阳离子交换能力高于ESDF 122.22%,高于NSDF 90.17%,显著高于其他两种方法的SDF(P<0.05),原因可能是微波使得SDF的羧基、羟基、氨基等侧链基团暴露出来从而提高阳离子交换能力。
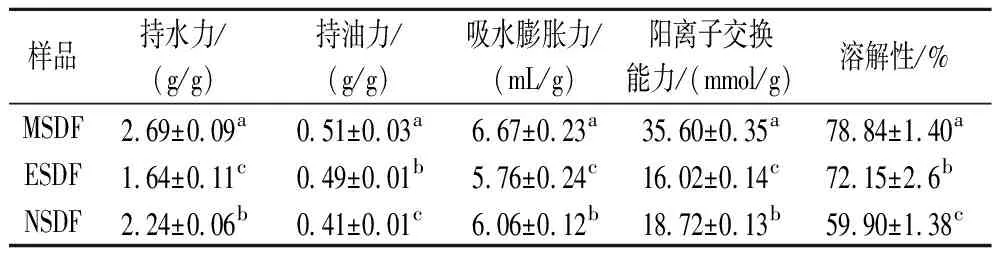
表3 不同提取方式的山楂果渣 SDF 功能特性Table 3 Functional properties of hawthorn pomace SDF with different extraction methods
2.5 提取方式对山楂SDF抗氧化能力的影响
维生素C具有良好的DPPH自由基清除活性,以维生素C为对照验证SDF的DPPH自由基清除能力。由图8-a可知,3种提取方式SDF都具有较好的DPPH自由基清除能力,清除率随着SDF浓度增加而增强。MSDF的清除能力最强,半抑制浓度(half inhibitory concentration,IC50)为0.07 mg/mL,ESDF的清除能力IC50为0.08 mg/mL,NSDF清除率IC50为0.31 mg/mL,NSDF的DPPH自由基清除能力最弱,可能原因是NSDF的半乳糖醛酸含量较低。由图8-b可知,3种SDF对·OH清除效果明显,其清除能力随SDF浓度的增大而增强。其中ESDF的清除效果最强,IC50为1.23 mg/mL,MSDF清除率IC50略高于ESDF。
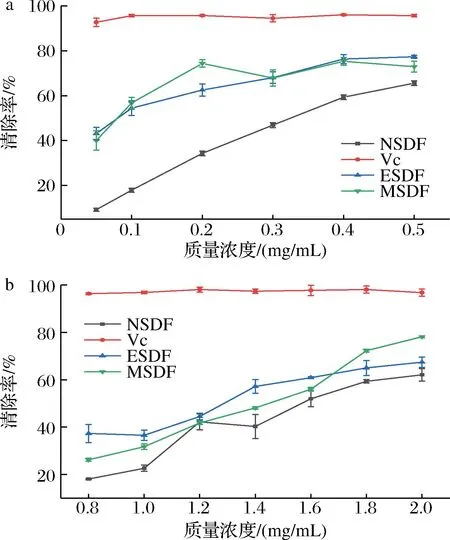
a-DPPH自由基清除能力;b-·OH清除能力
2.6 提取方式对山楂SDF体外降血糖、降血脂活性的影响
如图9所示,3种方法的SDF都具有较好的α-淀粉酶的抑制能力,而MSDF葡萄糖吸收能力高于ESDF 30.31%,高于NSDF 16.50%(P<0.05)。研究证明,增加SDF的颗粒粒径、孔隙和水合性能可以有效增加其葡萄糖吸收能力[32]。MSDF的葡萄糖吸收能力显著高于ESDF,与前文所述的结果一致。如图10所示,3种方法均具有良好的甘氨酸钠结合能力,且NSDF稍高于其他两种方法。MSDF牛磺胆酸钠结合率分别高于ESDF 63.77%,NSDF 23.40%(P<0.05)。不同提取方式SDF对胆固醇的吸附能力存在显著差异(P<0.05),当pH=7时,其大小顺序为MSDF>NSDF>ESDF,MSDF比ESDF高28.45%,当pH=2时,其大小顺序为NSDF>MSDF>ESDF。两种pH值下的ESDF吸收能力显著低于其他两种方法(P<0.05)。酸度和碱度对SDF吸附胆固醇的能力有很大影响,模拟小肠的pH=7环境中对胆固醇的吸附能力高于模拟胃pH=2酸性条件,表明山楂果渣SDF主要作用于肠道。比表面积的增加和电荷密度的变化是增加SDF胆固醇吸收能力、胆酸钠结合能力一大重要因素。微波法制备的MSDF结构蓬松,增加了比表面积,这可能是胆固醇吸收能力与胆酸钠结合能力显著高于ESDF的原因。

a-α-淀粉酶抑制能力;b-葡萄糖吸收能力
3 结论与讨论
本研究以山楂果渣为原料提SDF,验证了3种提取方式对SDF的理化、结构和功能特性的影响。与其他两种方式相比较,微波酶解法提取的SDF具有纯度高、条件温和、SDF功能特性较好等特点,开发价值较高。MSDF与ESDF以半乳糖醛酸和阿拉伯糖为主,NSDF葡萄糖含量最高。MSDF的持水力、持油力等理化性质良好,优于ESDF和NSDF;并且MSDF结构呈现雪花状疏松、多孔。3种方法山楂果渣SDF均具有抑制α-淀粉酶,葡萄糖吸收的能力,对胆固醇和胆酸钠表现出了较高的吸附性能,且MSDF在3种方法中表现最佳,具备开发功能性食品的潜力,但其体内功能作用和机制还需进一步研究。
微波酶解法提取山楂果渣SDF具有开发意义,且山楂果渣SDF具有作为预防肥胖、高血糖、高血脂等慢性疾病的功能食品原料来源的潜力。既可以提高山楂农副产品的利用率,又能减轻副产物的环境污染,延长山楂深加工的产业链。
