原子吸收光谱法测定注射用哌拉西林钠中钠含量
2024-05-18李佳蕊韩彬王强王巧高燕霞
李佳蕊 韩彬 王强 王巧 高燕霞


摘要:目的 建立原子吸收分光光度法测定注射用哌拉西林钠中钠含量,同时对国产制剂成盐情况进行评价。方法 原子吸收分光光度法(atomic absorption spectrophotometry,AAS)。采用钠元素空心阴极灯光源;空气-乙炔火焰原子化器;检测波长589.0 nm;4%氯化铯溶液作为电离抑制剂,临用稀释50倍。结果 原研企业4批次样品中钠含量平均值4.46%,16家国内生产企业204批次样品中钠元素含量平均值4.41%,均高于理论值4.26%,不同生产企业的产品钠含量差异大,多批次超出理论值±5%范围。结论 该方法操作简单、专属性强、结果准确,可通过钠含量的测定,对哌拉西林钠原料成盐工艺水平进行评估。
关键词:哌拉西林钠;钠含量;质量分析;工艺控制
中图分类号:R917 文献标志码:A
Determination of sodium content in piperacillin sodium for injection by atomic absorption spectrometry
Li Jiarui1,2, Han Bin1, Wang Qiang1, Wang Qiao2, and Gao Yanxia1,2
(1 Hebei Institute for Drug and Medical Device Control, Shijiazhuang 050021; 2 Hebei Medical University, Shijiazhuang 050017)
Abstract Objective This study established an atomic absorption spectrophotometry (AAS) method for the determination of sodium content in piperacillin sodium for injection and evaluated the salt formation of domestic piperacillin sodium. Methods AAS with a sodium-element hollow cathode light source and an air-acetylene flame atomizer was utillized; the detection wavelength was 589.0 nm, and 4% cesium chloride solution was used as the ionization inhibitor, which was diluted 50 times for detection. Results The average sodium content in 4 batches of brand-name products was 4.46%, and the average sodium content in 204 batches of generic drugs from 16 domestic manufacturers was 4.41%, both higher than the theoretical value of 4.26%. The sodium content was significantly different among the domestic manufacturers, and many batches exceeded the theoretical value of ±5%. Conclusion The method was simple, specific and accurate. It could be used to evaluate the technological level of piperacillin sodium raw materials by determining the sodium content.
Key words Piperacillin sodium; Sodium content; Quality analysis; Process control
哌拉西林鈉是半合成β-内酰胺类抗生素,具有广谱抗菌活性。原研企业为日本富山化学株式会社,国内首家通过一致性评价企业为瑞阳制药股份有限公司。临床制剂注射用哌拉西林钠是我国基本药物,可作为儿童用药。主要不良反应为过敏,多表现皮疹。国家局药品评价中心共收到该品种的不良反应上报信息15030份,其中严重不良反应2594份,比例在国产抗生素中排名在前,需对该品种质量保持高度关注。
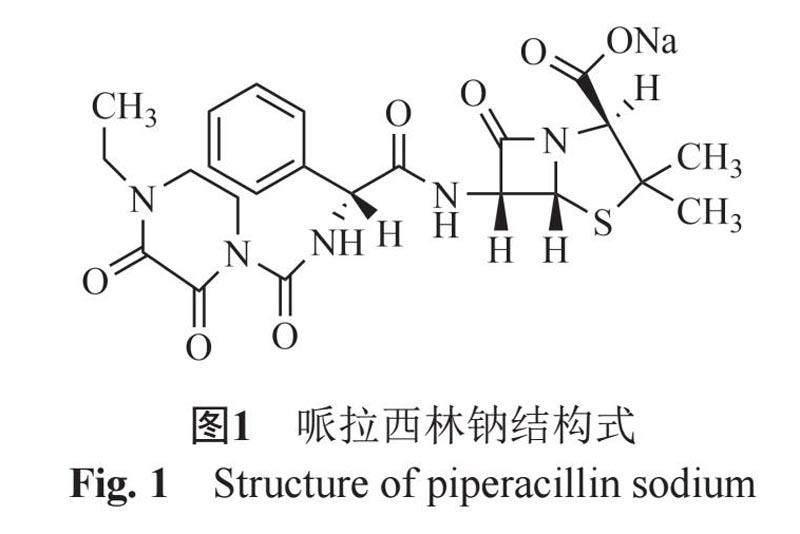
注射用哌拉西林钠仅含有哌拉西林钠无菌原料,无辅料添加,制剂的质量与原料工艺的整体控制水平直接相关。哌拉西林钠是由哌拉西林(API)与钠按1:1成盐而成(图1)[1],成盐后可显著改善活性成分在水中的溶解性,便于临床用药。如果成盐不完全,临床应用时部分活性成分可形成难溶微粒进入血液循环,有堵塞微循环风险。过量钠盐,增加生产成本,有诱发钠钾失衡损害心血管健康的潜在风险。因此对哌拉西林钠原料中钠含量的控制可有效保障制剂的安全性和有效性。
本文依据《中国药典》2020年版四部通则0406“原子吸收分光光度法”第一法(标准曲线法)[2-3],建立原子吸收-火焰法测定哌拉西林钠中的钠含量,并按照通则9101“分析方法验证指导原则”[4]进行验证,同时通过对204批次国产制剂和4批次原研制剂样品中钠的含量的考察,对哌拉西林钠原料的成盐工艺水平进行评估。
1 仪器和试剂试药
1.1 仪器
卡尔费休氏水分测定仪,Thermo V30S;电子天平,Mettler TOLDEO XS205;原子吸收分光光度计,Thermo ICE3000。
1.2 试剂试药
无水甲醇(批号:20120522),含量:99.5%(国药集团化学试剂有限公司);无吡啶卡尔费休试剂(批号:220503)(天津市四友精细化学品有限公司);氯化铯(批号:201417),含量:99.99%(上海阿拉丁生化科技股份有限公司);钠元素标准溶液(批号:22042),含量:1000 μg/mL(国家计量科学研究院);实验用水为实验室自制的超纯水(Ω=18.2)。
204批次国产注射用哌拉西林钠均为2023年国家药品抽检样品,涉及16家生产企业(企业1、2、3、4、5、6、7、8、9、10、11、12、13、14、15和16),3种规格;参比制剂为日本富山化学株式会社产品(企业A)。
2 实验条件选择
2.1 测定波长的选择
钠元素特征谱线的最灵敏线为589.0 nm,次灵敏线为589.6 nm和330.2 nm,其中589.6 nm与589.0 nm的灵敏度强度相差2倍,330.2 nm与589.0 nm相差100倍,因此当采用火焰法测定钠含量时,选择589.0 nm为测定波长,溶液中钠元素的适宜浓度范围为0.05~2.0 μg/mL;选择330.2 nm时,溶液中钠元素的适宜浓度范围为10~200 μg/mL。本文优选最灵敏线589.0 nm作为哌拉西林钠的测定波长。
2.2 供试品取样量的确定
哌拉西林钠(C23H26N5NaO7S)分子量为539.54,钠元素分子量为22.99,哌拉西林钠中钠元素理论含量为4.26%(按无水物计)。称量天平按十万分之一精度值计,钠元素最小取样量为10 mg,则供试品哌拉西林钠的最低取样量为0.23 g。另标准溶液稀释以整数计,按线性中点为限度值计算,中点浓度为0.5 μg/mL时,对应供试品的取样量为0.25 g。
2.3 是否使用电离抑制剂
原子吸收分光光度法是对蒸气中呈原子状态的金属元素的特征电磁辐射吸收强度进行定量分析的一种仪器分析方法。原子吸收分光光度法遵循朗伯-比尔定律,通过比较对照品溶液和供试品溶液的吸光度,计算供试品中待测元素的含量。因此,溶液中待测元素是否完全保持原子状态,对测定结果有直接影响。哌拉西林钠溶于水后,存在钠元素电离转化成钠离子的可能,添加氯化铯可有效抑制钠元素在水溶液中的形态转化,使待测溶液处于稳定状态。通常氯化铯的加入量应为待测元素的10倍以上。
制备供试品溶液2份,其中一份用超纯水直接稀释至100 mL。另一份精密加4%氯化铯溶液2 mL后再用超纯水稀释至刻度。将两份溶液导入火焰,按表1测定条件分别测定吸光度值。结果显示,添加氯化铯溶液的样品溶液测得的吸光度值明显高于不含氯化铯的样品溶液.說明添加氯化铯溶液可以有效防止钠原子的离子化。
3 溶液的制备
3.1 4%氯化铯溶液的制备
称取氯化铯4.01 g,置100 mL量瓶中,超纯水溶解并稀释至刻度,摇匀;
3.2 空白溶液的制备
精密量取4%氯化铯溶液1 mL,置50 mL量瓶中,超纯水稀释至刻度,摇匀。
3.3 供试品溶液的制备
取供试品0.25g,精密称定,置200 mL容量瓶中,加超纯水溶解并稀释至刻度,摇匀;精密量取0.5 mL,置50 mL量瓶中,加4%氯化铯溶液1 mL,用超纯水稀释至刻度,摇匀。
3.4 钠元素标准贮备液(10 μg/mL)的制备
精密量取钠元素标准溶液1 mL,置100 mL容量瓶中,加超纯水稀释至刻度,摇匀。
3.5 对照品溶液的制备
精密量取钠元素标准储备液①0.5 mL、②1.0 mL、③2.0 mL、④2.5 mL、⑤3.0 mL、⑥5.0 mL、⑦6.0 mL分别置50 mL量瓶中,精密加入4%氯化铯溶液1 mL,超纯水稀释至刻度,摇匀,即得浓度分别为①0.1 μg/mL、②0.2 μg/mL、③0.4 μg/mL、④0.5 μg/mL、⑤0.6 μg/mL、⑥1.0 μg/mL、⑦1.2 μg/mL的系列标准溶液。
4 方法学验证
4.1 专属性试验
本品无辅料添加,按表1仪器条件,分别测定超纯水、稀释50倍的4%氯化铯溶液、及哌拉西林溶液的吸光度值,结果均在0.007以下,不干扰哌拉西林钠中钠元素的测定,说明方法专属性良好。
4.2 检测限及定量限
按 “基于响应值标准偏差和标准曲线斜率法”测定,即通过测定空白值的标准偏差(δ),按照公式LOD=3.3δ/S,计算检测限,其中S为标准曲线的斜率(S=0.23383)。
取空白溶液导入火焰,连续测定11次,测定结果见表2,吸光度值标准偏差δ=0.000237。则LOD为0.0033 μg/mL;定量限(10 δ/S)为0.0101 μg/mL。方法灵敏度良好。
4.3 线性和范围
取钠元素系列标准溶液,分别将溶液导入火焰测定,记录吸光度值。以钠元素浓度(X,μg/mL)为横坐标,以测定吸光度(Y,Abs)为纵坐标,绘制标准曲线(图2)。结果表明:钠元素在0.1~1.2 μg/mL浓度范围内与吸光度线性关系良好,回归方程为:y= 0.23511x + 0.0040, r=0.9998。
4.4 准确度
取样品(批号:40721203)9份,每份0.25 g,精密称定,置200 mL量瓶中,超纯水溶解并稀释至刻度,精密量取0.25 mL置50 mL量瓶中;精密量取对照品贮备溶液0.75、1.25和1.75 mL各3份,置上述量瓶中,加4%氯化铯溶液1 mL,超纯水稀释至刻度,制成高(0.6 μg/mL)、中(0.5 μg/mL)、低(0.4 μg/mL)浓度溶液各3份,测定回收率。
结果,高浓度回收率分别为100.17%、101.47%和100.62%;中浓度回收率分别为100.27%、100.91%和100.32%,低浓度回收率分别为99.71%、100.42%和100.17%,钠含量平均回收率为100.45%,RSD=0.50%(n=9),回收率良好,证明本法测定钠含量准确性良好,符合验证要求。
4.5 精密度
(1)进样精密度 取同一供试品溶液,重复测定6次,记录吸光度值,评估仪器的精密度。供试液吸光度的均值为0.5487,RSD=0.92%,提示仪器精密度良好。
(2)重复性 同一实验人员平行制备6份供试品溶液,依次测定,记录吸光度值,考查本法的重复性。6次测定的钠含量均值为4.36%,RSD=0.28%,提示方法的重复性良好。
(3)中间精密度 3名实验人员取同一批样品(批号:40721203),按“3.溶液的制备”项下,分别制备钠元素系列标准溶液和6份供试品溶液。将溶液导入火焰,记录吸光度,计算样品钠含量,考查本法的中间精密度。
比较3名实验人员的测定结果:人员1测得钠含量平均值4.31%,人员2测得钠含量平均值4.30%,人员3测得钠含量平均值4.31%;钠含量测定值RSD=0.13% (n=18),提示方法精密度良好。
4.6 稳定性
将系列标准溶液和供试品溶液于室温放置,分别在0、2、4、6、8和10 h测定,记录标准曲线斜率和供试品溶液的吸光度。不同时间的标准曲线斜率均值为0.24080,RSD=0.47%;供试品溶液的吸光度均值为0.5168,RSD=0.44%。提示系列标准溶液和供试品溶液于室温放置10 h稳定。
注意:建议采用聚乙烯材质的容量瓶。若用玻璃容量瓶,由于玻璃中含有硅酸钠成分,放置过程中钠离子将迁移至溶液,从而影响线性灵敏度和供试品测定的准确度。若稀释操作选择使用玻璃容量瓶,对照品溶液和供试品溶液均需临用新制。
5 样品测定
对国内16家生产企业的204批次样品和4批次原研样品分别进行测定:原研企业的4批次样品钠含量均值为4.46%,16家生产企业204批次样品钠含量均值为4.41%,不同企业样品钠含量的分布情况见图3,全部样品的钠含量频数分布见图4。
6 讨论
对哌拉西林钠的成盐情况进行评估。理论上哌拉西林与钠的成盐比例应为1:1,若成盐率控制在理论值的90.0%~110.0%范围,则钠含量应为3.83%~4.69%(按无水物计)。若成盐率控制在理论值的95.0%~105.0%范围,则钠含量应为4.04%~4.47%(按无水物计)。原研制剂(企业A产品)的钠含量范围4.42%~4.50%,平均值4.46%,国产制剂钠含量范围4.20%~4.59%,平均值4.41%;按平均值计,无显著差异。原研制剂批次间的RSD为0.8%,但其中两批超出理论值(100%成盐)的95.0%~105.0%范围。国产制剂的测定结果分布在理论值的90.0%~110.0%范围,符合成盐1:1要求;但不同生产企业、同一生产企业不同批次样品间的差异较大,企业7全部使用自产原料,产品的成盐结果相对集中(RSD=0.81%),其他企业原料来源多家生产企业,表现为批间产品的成盐情况不稳定。但总体而言,国产制剂的整体成盐情况较好。
本方法除具有专属性强、灵敏度高、操作简单、无需使用有机溶剂[5]、节约检测成本外,还具备两方面特有的优势:①可以用于多批次样本的快速筛查。系列标准溶液中点值为理论值,样品溶液测定吸光度值与中点值对比,可快速判定样品中钠含量大概情况;②测定结果的计算过程简单,供试品校正后浓度除以供试品取样量乘以2即得湿品钠含量,便于方法的掌握和推广。
参 考 文 献
国家药典委员会. 中华人民共和国药典(2020年版二部)[S]. 北京: 中国医药科技出版社, 2020: 906-907.
国家药典委员会. 中华人民共和国药典(2020年版四部)[S]. 北京: 中国医药科技出版社, 2020: 41-42.
李何杏, 彭洁, 洪建文. 原子吸收分光光度法测定注射用盐酸头孢替安中碳酸钠含量[J]. 中国抗生素杂志, 2022, 47(2): 179-182.
国家药典委员会. 中华人民共和国药典(2020年版四部)[S]. 北京: 中國医药科技出版社, 2020: 906-907.
谭胜连, 闵翠娥, 李毅, 等. HPLC-CDD法测定以碳酸钠为助溶剂的头孢类产品中碳酸钠的含量[J]. 中国抗生素杂志, 2012, 37(12): 920-923.
作者简介:李佳蕊,女,生于1999年,在读硕士研究生,主要从事抗生素药品检验及质量标准研究,E-mail: 2565984520@qq.com
*通信作者,E-mail: 657968434@qq.com
第一作者:李佳蕊,女,生于1999年,河北医科大学药学专业研究生在读。从事抗生素药品检验及质量标准研究。
通信作者:高燕霞,主任药师,药物分析专业硕士。现任河北省药品医疗器械检验研究院副院长。在国家级核心期刊共发表学术论文117余篇。 完成多项药典会、 省科技厅及省局课题, 主研课题获全国商业科技进步奖特等奖1项,河北省科技进步一等奖1项、二等奖1项,三等奖2项。
