盐酸洛美沙星滴耳液的质量分析与评价
2024-05-18曾红霞杨盈周玉平王建周霞朱坤丹张凤妹郑金琪
曾红霞 杨盈 周玉平 王建 周霞 朱坤丹 张凤妹 郑金琪


摘要:目的 评价国内不同企业生产的盐酸洛美沙星滴耳液的质量现状。方法 采用法定标准结合探索性研究对111批抽验样品进行综合评价,包括杂质分析、抑菌剂、辅料相容性、包装材料、抑菌效力和处方合规性方面,综合评价国内产品质量及现行质量标准对产品质量的可控性。结果 法定检验结果显示,111批盐酸洛美沙星滴耳液合格率为100%。但现行法定标准中的有关物质方法重现性、杂质分离和检出能力差,且抑菌剂测定方法未涵盖本品使用的全部抑菌剂种类。探索性研究结果显示,本品的杂质水平主要与处方工艺有关,不同企业的杂质检出情况差异明显。国内厂家的处方和辅料与原研差异较大,光降解杂质含量与处方中有机物含量呈显著负相关。不同企业包装材料的遮光作用存在明显差异。一家厂家的抑菌效力测定结果达《中国药典》2020年版抑菌效力判断B标准,未达A标准。111批次抽样抑菌剂、EDTA和乙醇含量均与处方量一致。结论 目前国产盐酸洛美沙星滴耳液总体质量较好;现行标准需要进一步提高;本品处方工艺差别对质量影响很大,且与原研差异大,建议尽快开展质量与疗效一致性评价。
关键词:盐酸洛美沙星滴耳液;质量评价;评价性抽验;一致性评价;杂质分析
中圖分类号:R978.1文献标志码:A
Quality analysis and evaluation of lomefloxacin hydrochloride ear drops
Zeng Hongxia1, 2, Yang Ying2, Zhou Yuping3, Wang Jian1, Zhou Xia1, Zhu Kundan1, Zhang Fengmei1, and Zheng Jinqi1
(1 Zhejiang Institute of Food and Drug Control, Key Laboratory of Key Technologies for Generic Drug Evaluation, Zhejiang Key Laboratory of Quality Control of Drug Contact Materials, Zhejiang Provincial Key Laboratory of Drug Contact Materials, Hangzhou 310052; 2 China Jiliang University, Hangzhou 310018; 3 Zhejiang University of Technology, Hangzhou 310014)
Abstract Objective This study evaluated the quality status of lomefloxacin hydrochloride ear drops produced by different domestic manufacturers. Methods A comprehensive evaluation of 111 batches of samples was carried out using legal specifications combined with exploratory research, including impurity analysis, bacteriostatic agents, excipient compatibility, packaging materials, bacteriostatic efficacy and formulation compliance. The quality of domestic products and the controllability of current specifications were comprehensively evaluated. Results The statutory determination results showed that the qualification rate of 111 batches of lomefloxacin hydrochloride ear drops was 100%. However, the reproducibility, impurity separation, and detection ability of the related substance methods in the current specifications were poor, and the bacteriostatic agent determination method did not cover the types used in the products. The exploratory research results showed that the impurity level of the products was mainly related to the formulation process, and the impurity detection situations varied significantly among different manufacturers. There were significant differences between the formulation and excipients of domestic manufacturers and the original drugs, and there was a significant negative correlation between the content of photodegradation impurities and the organic content in their formulation. There were significant differences in the shading effect of packaging materials from different manufacturers. The results of the bacteriostatic efficacy determination of one manufacturer reached the B standard for the judgment in the 2020 edition of the Chinese Pharmacopoeia but did not meet the A standard. The levels of bacteriostatic agents, EDTA and ethanol in 111 batches were consistent with the prescribed amount. Conclusion The overall quality of domestically produced lomefloxacin hydrochloride ear drops was good at present. The current specification should be further improved. The difference in formulation process of the products had a significant impact on their quality, and they differed greatly from the original drugs, so it was recommended to conduct quality and efficacy consistency evaluations as soon as possible.
Key words Lomefloxacin hydrochloride ear drops; Quality evaluation; Evaluative testing; Consistency evaluation; Impurities analysis
洛美沙星(lomefloxacin)是日本北陆公司研制的含双氟原子的新型第三代氟喹诺酮类广谱抗菌药, 通过抑制细菌的DNA螺旋酶起到杀菌作用[1-3]。日本千寿制药株式会社首先对盐酸洛美沙星滴耳液进行了研究,于1994年12月上市,国内北京银建药业有限公司于2005年7月8日最早获得批准文号。适用于敏感菌所致的中耳炎、外耳道炎和鼓膜炎[4-5],不良反应为中耳痛及瘙痒感[6-8]。《中国药典》(ChP)收载了盐酸洛美沙星、盐酸洛美沙星片和盐酸洛美沙星胶囊,未收载盐酸洛美沙星滴耳液,美国药典(USP)、英國药典(BP)、欧洲药典(EP)和日本药局方(JP)均未收载该品种。
盐酸洛美沙星滴耳液是2022年国家药品抽检品种,抽检共涉及6家企业111批次,样品涵盖全国25个省级行政区,其中95批来自经营单位,8批来自使用单位,8批来自生产企业。本文基于现行法定标准WS1-(X-034)-2002Z-2016对111批次抽检样品进行全项检验,针对发现的有关物质、辅料相容性等问题,开展探索性研究工作,对本品的质量状况进行客观评价分析。
1 仪器及试药
1.1 仪器
LC-20AD 高效液相色谱仪(日本Shimadzu公司)、1260 高效液相色谱仪(美国Agilent公司)、LC/MS-IT-TOF高分辨液质联用仪(日本Shimadzu公司)、SHH-101GD稳定性试验光照箱(重庆市永生实验仪器厂)、7890A气相色谱仪(美国Agilent公司)、XPE205电子分析天平(瑞士Mettler公司)、Milli-Q?超纯水系统(美国密理博公司)、MLS-3781高压蒸汽灭菌器(日本Panasonic公司)、HFsafe-1200生物安全柜(上海力申科学仪器有限公司)、SF450灭菌箱(德国Memmert公司)、IF450恒温培养箱(德国Memmert公司)、ICP55低温培养箱(德国Memmert公司)、HTY-601集菌仪(浙江泰林生物技术股份有限公司)、FC502薄膜过滤器(浙江泰林生物技术股份有限公司)
1.2 色谱柱
Kromasil 100-5 C18柱(4.6 mm×250 mm, 5 μm);GL science inertsil ODS-3V柱(4.6 mm×250 mm, 5 μm);Diamonsil-C18柱 (250 mm×4.6 mm, 5 μm);Inertsustain C18柱(250 mm×4.6 mm, 5 μm);YMC-Pack ODS-AQ柱(4.6 mm×150 mm, 5 mm);DB-624毛细管柱(0.53 mm×30 m, 3 μm)。
1.3 试药
洛美沙星(含量:90.4%,批号:201603)、硫柳汞钠(含量:94.6%,批号:135050-201401)、羟苯甲酯(含量:99.9%,批号:100278-201906)、羟苯乙酯(含量:100.0%,批号:100847-202105)、羟苯丙酯(含:99.9%,批号:100444-202005)、羟苯丁酯(含量:100%,批号:110792-200503)、苯扎溴铵(含量:每1 mL含苯扎溴铵10.2 mg,批号:135051-202002)、苯扎氯铵(含量:每1 mL含苯扎氯铵12.50 mg,批号:100549-202106)、苯甲酸钠(含量:99.8%,批号:100433-202103)、三氯叔丁醇(含量:94.7%,批号:100492-202104)均购自中国食品药品检定研究院;EDTA-2Na(含量:90.2%,批号:R13090)购自USP;ICH/USP 1类和2类元素标准溶液(Agilent,含V:10 mg/mL;Co:5 mg/mL;Ni:20 mg/mL;Cd:2 mg/mL,批号:0010325187);ICH/USP元素混合标准溶液(Agilent,含Cu:300 mg/mL;Cr:1100 mg/mL; Ba:700 mg/mL,批号:0103425613);内标标准溶液(Agilent,含Sc:10 mg/mL、Ge:5 mg/mL、In:5 mg/mL、Bi:5 mg/mL,批号:0122073316);铝单元素标准溶液(编号:BW 30019-1000-NC-50,含量:1000 μg/mL,批号:B1912146)、镁单元素标准溶液(编号:GBW(E) 080126,含量:1000 μg/mL,批号:21012)、铁单元素标准溶液(编号:GBW(E) 083185,含量:1000 μg/mL,批号:B1912125)、锌单元素标准溶液(编号:GSB 04-1761-2004,含量:1000 μg/mL,批号:20A0003-6)、锰单元素标准溶液(编号:GSB 04-1736-2004,含量:1000 μg/mL,批号:201025-2)均购自中国计量科学研究院。
超纯水由Millipore纯水仪制备;色谱级乙腈、甲醇、乙醇和正丙醇均购自德国Merck公司;色谱级甲酸铵购自美国Sigma公司;优级甲酸购自德国Merck公司;色谱级磷酸购自上海阿拉丁生化科技股份有限公司;分析级戊烷磺酸钠、磷酸二氢铵、四丁基氯化铵、醋酸钠和硫酸铁、硝酸均购自国药集团化学试剂有限公司;分析级盐酸购自北京化学试剂研究所。
盐酸洛美沙星滴耳液均为2022年国家药品抽检样品,共计111批次,涉及6家生产厂家(A、B、C、D、E和F厂家),规格为5 mL:15 mg;8 mL:24 mg; 10 mL:30 mg;原研样品为日本千寿制药株式会社(批号:A051)生产,规格为5 mL:15 mg。
1.4 菌株和培养基
金黄色葡萄球菌[CMCC(B)26003]、铜绿假单胞菌[CMCC(B)10104]、白念珠菌[CMCC(F)98001]和黑曲霉[CMCC(F) 98003]均购自中国食品药品检定研究院;胰酪大豆胨琼脂培养基(批号:1105565)、沙氏葡萄糖琼脂培养基(批号:1107925)、胰酪大豆胨液体培养基(批号:1090975)和沙氏葡萄糖液体培养基(批号:1102045)均购自广东环凯微生物科技有限公司;pH7.0无菌氯化钠-蛋白胨缓冲液(批号:220704)购自南通凯恒生物科技发展有限公司。
2 方法
2.1 法定检验
按照国家药品标准WS1-(X-034)-2002Z-2016对111批盐酸洛美沙星滴耳液进行检验。主要项目包括性状、鉴别、pH值、颜色、有关物质、装量差异和含量测定等。
2.2 探索性研究
2.2.1 有关物质分析
采用国家药品标准WS1-(X-034)-2002Z-2016有关物质方法对所有企业样品的有关物质进行考察。
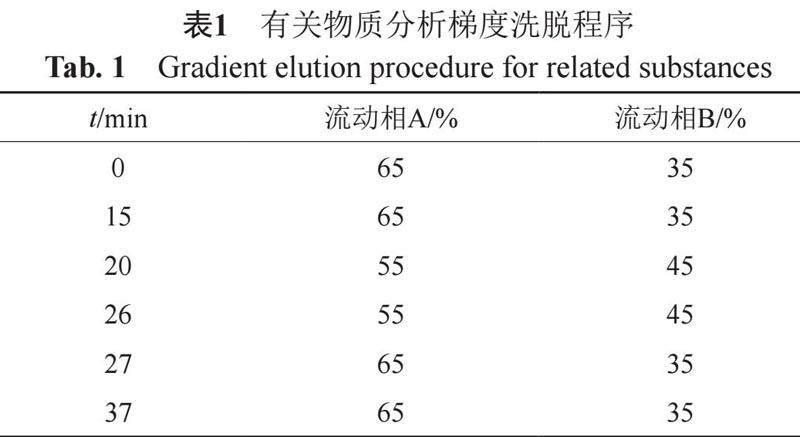
色谱条件:Kromasil 100-5 C18柱(4.6 mm×250 mm, 5 μm);流动相A为戊烷磺酸钠溶液(取戊烷磺酸钠 1.5 g,磷酸二氢铵3.5 g,加水950 mL使溶解,用磷酸调节pH值至3.0,用水稀释至1000 mL),流动相B为甲醇,按表1进行线性梯度洗脱;检测波长为287 nm;流速为1.2 mL/min,进样体积20 μL。
2.2.2 元素杂质分析
按照通则0412电感耦合等离子体质谱法(中国药典2020年版)使用电感耦合等离子体质谱仪(ICP-MS)对盐酸洛美沙星滴耳液中金属元素的含量进行测定。试验前用调谐液调整仪器各项指标,使仪器各项指标达到测定要求后编辑测定方法,用直接进样法在有机加氧模式下测定空白溶液、标准品溶液、供试品溶液,分别测定同位素24Mg、27Al、45Sc、51V、52Cr、55Mn、56Fe、59Co、60Ni、63Cu、66Zn、73Ge、111Cd、115In、137Ba和209Bi的浓度(ng/mL):其中以45Sc为内标,测定4Mg、27Al、51V、52Cr、55Mn、56Fe;以73Ge为内标,测定59Co、60Ni、63Cu、66Zn;以137Ba为内标,测定73Ge、111Cd、115In和209Bi。洛美沙星滴耳液中元素杂质含量(ng/mL)=测得浓度(ng/mL)×10(稀释倍数)。
2.2.3 抑菌剂测定
采用HPLC法同时测定硫柳汞、羟苯甲酯、羟苯乙酯、羟苯丙酯、羟苯丁酯、苯扎溴铵、苯甲酸钠、苯扎氯铵和三氯叔丁醇等9种抑菌剂的含量。
供试品溶液制备:精密量取供试品2 mL,置10 mL量瓶中,用甲醇稀释至刻度,摇匀,即得。
系统适用性溶液制备:精密称取硫柳汞钠、苯甲酸钠对照品,分别用水稀释制成每1 mL中约含0.2和0.4 mg的溶液作為各贮备液;精密称取羟苯甲酯、羟苯乙酯、羟苯丙酯、羟苯丁酯对照品,分别用甲醇稀释制成每1 mL中均约含0.4 mg的溶液作为各贮备液;精密量取苯扎氯铵、苯扎溴铵对照品各约1 mL,分别置10 mL量瓶中,用水稀释至刻度,摇匀,作为各贮备液;精密称取三氯叔丁醇对照品,用甲醇稀释制成每1 mL中约含6 mg的溶液,作为三氯叔丁醇贮备液;精密量取上述各贮备液适量,用甲醇稀释制成每1 mL中约含硫柳汞和苯甲酸钠均约为40 μg,羟苯甲酯、羟苯乙酯、羟苯丙酯、羟苯丁酯均约为20 μg,苯扎溴铵和苯扎氯铵均约为50 μg,三氯叔丁醇约为0.6 mg的混合对照品溶液。
色谱条件:ZORBAX RX C18柱(4.6 mm×250 mm, 5 μm);流动相A为1%三乙胺溶液(用磷酸调节pH值至3.0),流动相B为甲醇,梯度洗脱(表2);柱温为35 ℃,检测波长为214 nm,进样量为20 μL。
2.2.4 包装材料合理性评价
分别取6家企业盐酸洛美沙星滴耳液,除去纸盒外包装,带内包装在4500 Lx光照度下分别放置5、10和30 d;另一份将内容物转移至透明的容量瓶中,不带内包装经紫外光照射10 d。采用现行法定检验标准HPLC法,测定不同包装材料的盐酸洛美沙星滴耳液中光降解杂质的含量,探索包装材料对光降解杂质的影响。
2.2.5 辅料相容性研究
取盐酸洛美沙星原料药0.15 g,精密称定,置50 mL量瓶,加入不同体积的甘油、丙二醇及乙醇混匀后用水稀释至刻度,摇匀,在紫外光下照射10 d,采用现行法定检验标准HPLC法测定光降解杂质的含量,探索辅料对盐酸洛美沙星滴耳液光降解杂质的影响。
2.2.6 抑菌效力评价
按《中国药典》2020年版通则1121“抑菌效力检查法”测定。取各批次盐酸洛美沙星滴耳液样品至灭菌管中,分别接种菌液并避光贮存,同时设置不含样品仅加菌液的稀释剂对照组,在规定时间分别取相应管中的供试品,采用经验证的计数方法(取供试品原液1 mL,加至100 mL pH7.0无菌氯化钠-蛋白胨缓冲液中,摇匀,薄膜过滤,每膜用上述缓冲液500 mL分次冲洗,滤过,抽干,取出滤膜贴至相应琼脂平板培养)进行活菌计数,评价其抑菌效力。
2.2.7 处方合规性评价
EDTA-2Na的筛查:采用HPLC法测定盐酸洛美沙星滴耳液中EDTA-2Na的含量。
色谱条件:YMC-Pack ODS-AQ 柱(4.6 mm×150 mm, 5 mm);流动相A为四丁基氯化铵的醋酸盐缓冲液(取四丁基氯化铵4.8 g和醋酸钠8 g,加水1980 mL溶解,用冰醋酸调节pH至4.0,用水稀释至2000 mL,摇匀),流动相B为乙腈-流动相A(6:4),梯度洗脱(表3);柱温为35 ℃;检测波长为350 nm;进样量为20 mL。
乙醇量的测定:按《中国药典》2020年版四部通则0711-乙醇量测定法,采用第一法-气相色谱法(毛细管柱法)对盐酸洛美沙星滴耳液中乙醇量进行测定。
气相条件:采用6%氰丙基苯基-94%二甲基聚硅氧烷为固定液的毛细管柱;初始温度40 ℃,维持2 min,以3 ℃/min的速率升温至65 ℃,再以25 ℃/min的速率升温至200 ℃,维持10 min;进样口温度为200 ℃;检测器(FID)温度为220 ℃;载气为氮气,流速为1.5 mL/min;采用顶空分流进样,分流比为1:1,进样量为1.0 mL;顶空瓶平衡温度为85 ℃,平衡时间为20 min。
3 结果与讨论
3.1 法定标准检验
按照现行法定标准检验,抽样111批盐酸洛美沙星滴耳液合格率为100%,但同一家企业不同批次间有关物质数据离散度大,其中E厂家有2批最大单杂接近限度,异常高于其他批次,提示质量不稳定,可能其处方工艺存在缺陷。此外,发现有两家企业的部分产品未执行现行法定质量标准,提示监管方面存在漏洞。
现行法定质量标准有关物质方法的重现性、杂质分离和检出能力差,抑菌剂测定方法未涵盖本品使用的全部抑菌剂种类,提示现行标准需要修订。
3.2 探索性研究结果
3.2.1 有关物质
对不同企业产品的有关物质检验数据进行统计分析:最大单个杂质和杂质总量的数据离散度大,不服从正态分布(Kolmogorov-Smirnov结果Sig.值均为0<0.05)。最大单个杂质图和杂质总量频数分布图及各生产企业箱式图见图1。比较不同企业产品批间均一性:A厂家>D厂家>F厂家>C厂家>B厂家>
E厂家,其中E厂家两次被抽检于不同地区(吉林省、内蒙古)的210702批次杂质总量达0.6%,最大单个杂质0.4%,异常高出其他批次(杂质总量最高0.2%,最大单个杂质最高0.1%),提示E厂家生产工艺稳定性差,产品质量差异大。同时发现,采用已作废标准(WS1-(X-034)-2002Z)控制产品质量的产品,杂质的含量明显高于按现行标准(WS1-(X-034)-2002Z-2016)进行质量控制的产品。
3.2.2 元素杂质分析
采用ICP-MS法测定6个厂家各3批样品中的12种元素杂质的含量。方法验证表明,各金属元素在相应的浓度范围内均具有良好的线性关系(r≥0.9993),加标回收率均在88.82%~111.48%之间,RSD均小于0.55%(n=6)。国际人用药品技术要求协调理事会(ICH)Q3D根据元素杂质的毒性和来源将其分为4个级别(1、2A、2B和3),并根据不同的给药途径(口服、注射和吸入)给出不同的限量[9-10]。检查发现盐酸洛美沙星滴耳液中的诸金属元素均符合规定,提示其由包装材料及生产中引入有害元素杂质的风险较小。
3.2.3 抑菌剂分析
基于文献和现有的标准方法,优化建立了新的抑菌剂分析测定方法,使其涵盖中国药典及WS1-(X-034)-2002Z-2016标准中涉及的全部9种抑菌剂。典型的系统适用性图谱见图2。
按建立的方法,对全国抽检的6家企业111批盐酸洛美沙星滴耳液和1批原研进行了筛查,结果表明,原研含有苯扎氯铵为20.6 μg/mL,国内6家企业仅F厂家含有三氯叔丁醇,结果见表4。
3.2.4 包装材料合理性评价
比较带有内包装和不带内包装的药品经光照射后的光降解杂质含量:不带内包装的E厂家和D厂家产品经光照射后光降解杂质含量接近;有内包装保护的D厂家产品光照30 d后光降解产物(1.09%)>E厂家(0.60%)产品,D厂家包装材料的透光率(34.20%)远高于E厂家(1.79%),提示包装材料是影响不同生产企业产品光稳定性的重要因素之一。
对比B厂家和A厂家的产品:B厂家不带内包装的内容物光降解杂质含量(14.06%)大于A厂家(5.48%),提示其对光的稳定性较差;而有内包装保护光照30 d的产品的B厂家的光降解产物(0.71%)与 A厂家的光降解产物(0.74%)相近;其中B厂家包装材料的透光率(0.07%)远小于A厂家(18.68%)。该结果不仅一步说明包装材料对产品光稳定性的重要性,还提示药物处方是影响光稳定性的另一重要因素。
3.2.5 辅料相容性研究
参照盐酸洛美沙星滴耳液处方,设计盐酸洛美沙星原料药与不同辅料(甘油、乙醇、丙二醇)与不同量混合的系列组合,最终用水稀释至50 mL,比较其在紫外光下光照10 d后光降解杂质的变化(表5)。结果表明,随着甘油和乙醇浓度的增加,氯代杂质和光降解总杂质含量显著减少。
采用SPSS统计软件对实验结果进行相关性分析,结果显示氯代杂质及光降解总杂质含量与甘油和乙醇的量均呈显著负相关(相关系数为-1.000),甘油、丙二醇和乙醇可以明显提高其光稳定性,降低盐酸洛美沙星滴耳液的光降解反应。
3.2.6 抑菌效力評价
按《中国药典》2020年版<1121>抑菌效力检查法,评估7个厂家的盐酸洛美沙星滴耳液的抑菌效力,其中5个厂家的产品达到A标准;原研(CEOLIA)和B厂家的产品对金黄色葡萄球菌和铜绿假单胞菌的抑制作用可以达到A标准,但对黑曲霉的抑制作用仅能达到B标准。
3.2.7 处方合规性评价
新建立了分析盐酸洛美沙星滴耳液中EDTA-2Na的HPLC方法。方法验证表明方法的专属性、线性及范围、检测限及定量限、准确度、精密度(重复性)均满足盐酸洛美沙星滴耳液中EDTA-2Na含量的测定要求。对111批盐酸洛美沙星滴耳液中EDTA-2Na含量进行了测定,其含量与处方加入量基本一致。
采用气相色谱法对盐酸洛美沙星滴耳液中的乙醇量进行了测定。111批次盐酸洛美沙星滴耳液中乙醇量与处方加入量基本一致。6家厂家产品中的乙醇量依次为:0(F厂家和原研)、12.7%(B厂家)、20.3%(D厂家)、25.0%(A厂家)、29.4%(E厂家)和31.2%(C厂家)。
4 结论
本次国家评价性抽验采用前期调研、文献检索、法定标准检验结合探索性研究的方式,对盐酸洛美沙星滴耳液的质量现状进行了分析与评价。111批次样品按法定标准检验合格率100%,本品质量状况总体情况较好。
本品现行标准中的有关物质方法存在一定的缺陷:可检出杂质少,杂质分离较差,未对结构明确、毒性较大杂质进行控制。此外,现行标准的抑菌剂测定方法未能涵盖本品使用的全部抑菌剂种类。
探索性研究发现,国内盐酸洛美沙星滴耳液在有关物质、抑菌效力检查、包装材料等方面存在差异,本品的处方工艺与原研产品存在较大差异,尽快开展质量与疗效一致性评价是提高本品质量的关键。
参 考 文 献
赵莹, 李国军, 李成建. 洛美沙星所致光敏反应文献概述[J]. 中国药物滥用防治杂志, 2015, 21(4): 240-245.
陈杨, 刘理慧, 吴翠蓉, 等. 喹诺酮类耐药基因qnr的研究进展[J]. 国外医药(抗生素分册), 2021, 42(4): 193-203.
Thu D M P, Zyta M Z, Mark A T B. Quinolone antibiotics[J]. Med Chem Comm, 2019, 10(6): 1719-1739.
赵忠锋, 荣玉真, 赵秋丽. 盐酸洛美沙星滴耳液治疗急性化脓性中耳炎效果评价[J]. 社区医学杂志, 2013, 11(19): 42-43.
代红梅, 张林果. 盐酸洛美沙星滴耳液结合海呋龙散治疗外耳道炎临床观察[J]. 淮海医药, 2017, 35(4): 488-489.
Wang X, Winterstein A G, Alrwisan A, et al. Risk for tympanic membrane perforation after quinolone ear drops for acute otitis externa[J]. Clin Infect Dis, 2020, 70(6): 1103-1109.
Eljaaly K, Alkhalaf A, Alhifany A A, et al. Photosensitivity induced by lomefloxacin versus other fluoroquinolones: A meta-analysis[J]. J Infect Chemother, 2020, 26 (6): 535-539.
Beberok A, Wrzesniok D, Szlachta M, Lomefloxacin induces oxidative stress and apoptosis in COLO829 melanoma cells[J]. Int J Mol Sci, 2017, 18 (10): 2194-2211.
ICH Q3(D). Guideline For Elemental Impurities[S]. 2019: 25.
USP-NF <232>. Elemental Impurities – Limits[S]. Published On: 04-Jan-2021.
作者简介:曾红霞,女,生于1988年,博士,主管药师,主要从事药品质量研究工作,E-mail: 827522948@qq.com
*通信作者,E-mail: zjq@zjyj.org.cn
第一作者:曾红霞,2019年毕业于浙江工业大学药物化学专业,获理学博士学位,主管药师,2014年7月至今就职于浙江省食品药品检验研究院化学药品检验所,中国计量大学硕士生导师,主持或参与国家药品抽验工作共5项,主持或参与省药监局课题共3项,主持或參与药典会课题共4项,多次参加国家标准物质协作标定工作,发表论文10余篇。
通信作者:郑金琪,2004年毕业于沈阳药科大学药学院药物制剂专业,获理学硕士学位,主任药师,浙江省食品药品检验研究院化学药品检验研究所所长,国家药品监督管理局仿制药评价关键技术重点实验室副主任,浙江工业大学硕士生导师,国家食品药品审核查验中心GCP检查员,浙江省药学会药物分析专业委员会委员主持完成20多个中国药典标准提高工作、20多个国家标准物质协作标定工作,主持省部级科研项目5项,参编著作11本,发表论文60多篇,获国家发明专利2项。
