注射用盐酸多西环素质量评价
2024-05-18傅小雅刘月
傅小雅?刘月

摘要:目的 對国产注射用盐酸多西环素的质量现状进行评价。方法 采用法定标准对86批抽检样品进行检验;结合注射剂一致性评价要求,利用参比制剂,通过对原料药精制工艺、维生素C质量控制、制剂处方工艺、包材、有关物质及血管刺激性试验和溶血试验等关键项目的比较研究,分析不同企业制剂的质量差异及现行标准的合理性。 结果 86批样品法定检验合格率为100%。探索性研究优化了有关物质测定方法,并对杂质来源进行了归属;建立了主要辅料维生素C的杂质和含量检测方法;发现使用未精制原料的企业,杂质含量明显高于使用精制原料的企业;国内仿制制剂与参比制剂在性状、灌装量、包材、有关物质及稳定性等方面存在差异;发现制剂使用与临床不良反应间的相关性。 结论 国内三家生产企业质量状况分别为“好、一般、差”,与参比制剂在一些质量属性方面存在差异,建议国内企业优化生产工艺尤其是冷冻干燥工艺及使用更好质量的包材以提升产品质量;现行标准可进一步提高。
关键词:注射用盐酸多西环素;评价性抽验;质量评价;一致性评价;有关物质;维生素C
中图分类号:R978.1,R917文献标志码:A
Quality evaluation of doxycycline hyclate for injection
Fu Xiaoya and Liu Yue
(Hainan Provincial Institute of Inspection and Testing Drug Control,Haikou 570216)
Abstract Objective The quality of domestic doxycycline hydrochloride for injection was evaluated. MethodsA total of 86 batches of samples underwent testing in accordance with the prescribed regulatory criteria. According to the requirements of consistency evaluation of injections, the quality difference of preparations from different enterprises and the rationality of current standards were analyzed by comparing the refining process of apis, quality control of vitamin C, formulation process, packaging materials, related substances, vascular irritation test and hemolysis test with reference preparations. Results The qualified rate of 86 batches of samples was 100%. The method of determination of related substances was optimized and the source of impurities was attributed. The method of impurity and content determination of vitamin C was established. It was found that the impurity content of the enterprises using unrefined raw materials was obviously higher than that of the enterprises using refined raw materials. There were differences in properties, filling amount, packing materials, related substances and stability between the domestic generic preparation and the reference preparation. Associations were found between clinical use and adverse reactions. Conclusion The quality status of the three domestic production enterprises was “good, average and poor” respectively, and there were differences in some quality attributes with the reference preparations. It was recommended that domestic enterprises optimize the production process, especially the freeze-drying process and the use of better quality packaging materials toimprove product quality. Current standards could be further improved.
Key words Doxycycline hydrochloride for injection; Evaluative testing; Quality evaluation; Consistency evaluation; Impurity; Vitamin C
多西环素是四环素类抗生素,能特异性地与细菌核糖体30S亚基的A位置结合,抑制肽链的增长和影响细菌蛋白质的合成[1],是目前临床上常用的抗菌活性最强的四环素类抗生素[2]。盐酸多西环素最早是由美国Pfizer公司研发,1967年12月6日其胶囊剂获FDA批准,1972年9月5日注射用盐酸多西环素(商品名:VIBRAMYCIN)被FDA批准上市。多西环素注射剂克服了口服刺激胃肠道的缺点,临床主要用于立克次体属等微生物以及革兰阴性菌引起的感染。不良反应有胃肠道反应、肝肾毒性、免疫及血液系统损害等[3]。
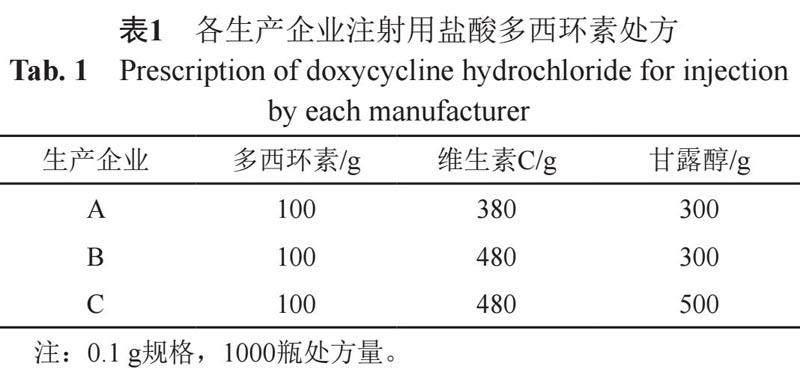
注射用盐酸多西环素国内现行质量标准有YBH09982008、YBH02832019、WS1-(X-012)-2014Z,美国药典2023在线版[4]亦有收载。国内现有4家生产单位和6个批准文号,规格有0.1 g和0.2 g。注射用盐酸多西环素为2023年国家评价性抽验品种,抽验涉及国内24个省、自治区和直辖市的药品生产、经营和使用单位,共获得86批次样品,涉及3家生产企业(A、B、C企业),各生产企业处方中均采用维生素C作为抗氧剂(表1)。本文采用现行法定标准对全部抽检样品进行检验,依据发现的问题开展探索性研究;对当前注射用盐酸多西环素的质量状况进行客观评价和分析。
1 仪器及试药
1.1 仪器
LC-20AD高效液相色谱仪(Shimadzu);Agilent 1260 高效液相色谱仪(Agilent);XS205电子天平(Mettler Toledo);D8 ADVANCE多晶X射线衍射仪(Bruker);NKT 2010-L激光粒度仪(山东耐克特分析仪器有限公司);LHH-250GSP综合药品稳定性试验箱(上海一恒科学仪器有限公司);Leica DM2500型偏光显微镜(Leica)等。
1.2 试药
86批次注射用盐酸多西环素均为2023年度国家药品评价性抽验样品,涉及3家生产企业(A、B、C企业),一种规格0.1g;参比制剂为Fresenius Kabi USA LLC生产的商品名为DOXY100的产品(批号:6023593)。
多西环素对照品(批号:130485-202104) 、β-多西环素(即杂质A,批号:130405-200907)、美他环素(即杂质B,批号:130499-200802)、土霉素(即杂质E,批号:130487-201321)、维生素C(批号:100425-201504)均来自中国食品药品检定研究院;杂质C(批号:CPD-2106051B)、杂质D(批号:CPD-2004121B)、杂质F(批号:CPD-2007061A)均来源于奥逊(上海)生物科技有限公司;糠醛(批号:B2315432)来源于上海阿拉丁生化科技股份有限公司。
乙腈为色谱纯(西陇化工), N,N-二甲基甲酰胺、磷酸、三乙胺、冰醋酸等试剂均为分析纯(广州化学试剂厂),实验用水均为超纯水。
2 试验方法
2.1 法定检验
按照药品标准YBH09982008和WS1-(X-012)-2014Z,对86批注射用盐酸多西环素进行检验。主要检验项目包括性状、鉴别、酸度、溶液的澄清度与颜色、有关物质、杂质吸光度、干燥失重、细菌内毒素、无菌及含量测定等。
2.2 探索性研究
2.2.1 原料药精制工艺
制剂三家生产企业(A、B和C企业)中C企业未对原料药进行精制。通過目视法检视原料药的性状、流动性,采用新优化的有关物质检验方法对杂质进行比对,采用偏光显微镜及粉末X射线衍射分析测试晶型,并进行粒度和粒度分布测试,比较精制前后原料质量的差异,确定精制工艺的必要性和不同精制工艺的差异性,评估原料药精制工艺对终产品制剂质量的影响。
2.2.2 维生素C质量控制
维生素C的主要降解产物是草酸和糠醛,建立 HPLC法测定其杂质及含量。糠醛在有关物质检测中同时进行。
草酸HPLC检测方法[5]:采用资生堂Agilent ZORBAX Extend C18色谱柱(4.6 mm×250 mm,
5 μm);以磷酸盐缓冲液(取磷酸二氢钾1.36 g,加水500 mL溶解后,加10%四丁基氢氧化铵溶液32 mL,加水至1000 mL,用磷酸调节pH值至6.5)-乙腈(80:20)为流动相;流速为1.0 mL/min;柱温为30 ℃;检测波长205 nm;进样体积20 μL,样品室温度5 ℃。
维生素C HPLC含量检测方法:采用Agilent ZORBAX SB-C18 色谱柱(4.6 mm×150 mm,5μm),以磷酸盐缓冲液(0.01 mol/L磷酸二氢钾,用磷酸调pH至2.55,用0.22 μm滤膜过滤)为流动相。流速为
0.6 mL/min;柱温为25 ℃;检测波长245 nm;进样体积2 μL;样品室温度4 ℃;运行时间10 min。
2.2.3 制剂处方工艺、包材、配伍合理性分析
①测定制剂晶体形态,结合各企业冻干工艺参数,分析不同制剂产品质量差异的原因。
②模拟实际生产工艺,选择不同温度(20 ℃和
30 ℃)、5个配比(原料与不同辅料搭配)、时间(0、6和12 h)等条件进行配液温度、药液存放时间及原辅料兼容性试验考察。
③参比制剂存在过量灌装,因而开展灌装量分析,即按参比制剂说明书临床用法对样品复溶后开展抽提试验,测定西林瓶中的残留量和注射器中的死体积,计算临床使用中损失量。
④药物和包材相容性试验选择在40 ℃下,同一批次A企业制剂分别置低硼硅与中硼硅玻璃管制注射剂瓶,分别在0、5、10、20和30 d取样检测,同步进行参比制剂的比较。
2.2.4 HPLC法测定有关物质
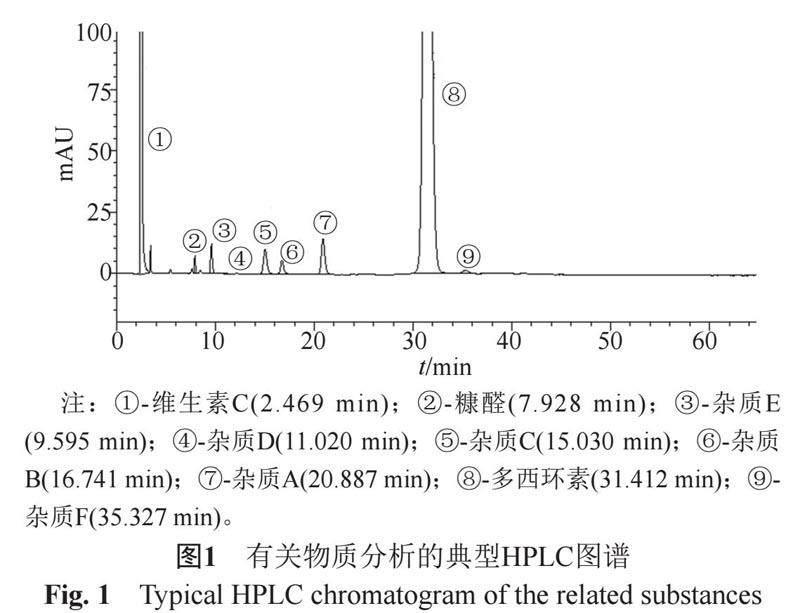
在现行标准的有关物质检测方法基础上,以有效分离注射用盐酸多西环素的主要已知杂质为目标,对HPLC方法进行了优化。
色谱条件:采用资生堂Agilent ZORBAX Extend C18色谱柱(4.6 mm×250 mm,5 μm);以醋酸盐缓冲液[0.25 mol/L醋酸铵溶液-0.1 mol/L乙二胺四醋酸二钠溶液-三乙胺(100:10:1),用冰醋酸或氨水调节pH值至8.8]-乙腈(87:13)为流动相;流速为1.0 mL/min;柱温为35 ℃;检测波长280 nm;进样体积20 μL。
2.2.5 血管刺激性试验和溶血试验[6-7]
血管刺激性试验:成年家兔15只分为3组,采用同体左右侧自身比对法,各家兔右侧耳缘静脉给予各组供试品溶液,左侧耳缘静脉均给予等体积的0.9%氯化钠注射液作为阴性对照。每天给药总量为临床拟用最高剂量5 mg/kg BW,1次/d,连续给药3 d。观察注射部位、给药血管局部及周围组织的变化,并进行组织病理学检查:剖检及光镜下观察。
体外试管法溶血试验:采用1 mg/mL的供试品溶液;取试管22支,依次加入2%兔红细胞混悬液、0.9%氯化钠注射液、超纯水、3家生产单位的注射用盐酸多西环素,置37 ℃±0.5 ℃的恒温水浴锅中孵育3 h。分别在15 min、30 min、45 min、1 h、2 h、3 h 各时间点取出试管,观察有无溶血或红细胞凝聚现象,有疑似凝聚结果出现时进行显微镜检查。
3 结果与讨论
3.1 法定检验结果
按现行法定标准检验,86批注射用盐酸多西环素全部符合规定,合格率为100%。
3.2 法定检验中发现的问题
法定检验中发现以下问题:①C企业使用的原料为非注射级,且未对使用的原料进行精制,使得其制剂的溶液颜色及产品中原料工艺杂质的检出量大于A、B企业及参比制剂,尤其是多批次制剂的杂质A接近不合格限度;②现行质量标准有关物质检测方法不完善,缺少对主要辅料维生素C的杂质和含量测定;③参比制剂存在过量灌装,国内3家生产企业未考虑注射剂在临床实际使用中存在的约3%的抽提损失量;④国内生产企业均采用低硼硅玻璃管制注射剂瓶,参比制剂采用中硼硅,本品为偏酸产品,低硼硅包装不能确保产品质量。
3.3 探索性研究
3.3.1 原料药精制工艺的探讨
目前国内尚无注射用盐酸多西环素原料药上市。参比制剂及国内3家生产企业(A、B、C企业)中仅C企业未对原料药精制后使用。原料精制后粉末颜色变浅,流动性改善,杂质含量降低,工艺杂质A、杂质F及总杂质均有所下降。如A企业的原料,精制后杂质A由1.27%降低至0.14%、杂质F由0.60%降低至0.21%、总杂质由2.09%降低至0.73%。各企业的精制工艺基本是原料合成工艺中的最后一步酸乙醇成盐工序的重复。A企业精制品的杂质下降幅度大于B企业;相较于A企业,B企业精制工艺缺少酸化步骤;酸化通过维持pH环境,避免杂质降解,且可增加原料的溶解度;说明A企业的精制工艺优于B企业。精制前后原料药的晶型没有变化,但粒度有变化。考虑本品制剂工艺的原料需溶解,因而认为原料的晶型及粒度对制剂质量的影响较小。
3.3.2 维生素C质量控制
主要辅料维生素C作为抗氧剂保护盐酸多西环素免于氧化降解。维生素C在处方中的占比接近50%,且本身不稳定,但A、B、C企业均未对维生素C的含量及氧化降解杂质草酸进行控制。对86批次样品中的维生素C含量进行测定,其范围为96.75%~103.06%,参比制剂为107.95%;所有样品包括参比制剂中均未检出草酸。
3.3.3 有关物质分析
根据盐酸多西环素合成路线及降解途径分析注射用盐酸多西环素中杂质的可能来源。盐酸多西环素以土霉素(杂质E)为起始原料,在中间产物美他环素(杂质B)转变成多西环素的过程中,β-多西环素(杂质A)为副产物。发生差向异构化形成4-表多西环素(杂质C),4,6-表多西环素(杂质D)是β-多西环素的4-表异构体,是一种次要的衍生物。土霉素(杂质E)发酵过程中产生的2-乙酰-2-脱氨甲酰土霉素在盐酸多西环素生产中会转换成2-乙酰-2脱氨甲酰多西环素(杂质F)。辅料维生素C在有氧条件的降解产物是草酸,无氧条件下则为糠醛。优化后的有关物质分析方法的典型色谱图见图1。
86批次抽检样品及1批次参比制剂中的杂质均主要为A、B、C。已过效期的参比制剂中杂质的检出情况明显好于A、C企业。对国产不同企业的产品进行比较,彼此间差异十分明显(图2):①杂质A:参比制剂检出结果为0.59%;未对原料进行精制的C企业产品的均值为1.74%,远大于A企业均值0.60%和B企业均值0.96%;②杂质B:参比制剂未检出;A企业产品含量集中在0.25%左右,高于B、C企业;③杂质C:A、B企业的产品中含量较为接近,C企业产品的含量范围为0.17%~0.74%,数据批间分离较大,其可能原因是其配液的温度最高,杂质C的含量与制剂配液温度的高低相对应。杂质含量与制剂工艺明显相关。
3.3.4 制剂处方工艺、包材、配伍合理性分析
(1)国内仿制制剂与参比制剂的外观存在明显差异。参比制剂外观良好,无分层、破碎、颜色不均匀的情况;A、C企业存在冻干饼块颜色不均匀,A企业还存在破碎的情况。
(2)国内B企业的产品处方与参比的处方一致,粉末X射线衍射分析其衍射图谱基本一致,仅强度略有不同(图3),不仅可判断二者的晶型基本一致,且说明B企业的预冻、升华温度等冻干参数接近参比制剂[8-9]。
(3)制剂过程中盐酸多西环素的降解反应,特别是异构化反应与配液温度、配液时间、配液完成到除菌过滤的时限有直接的关系。盐酸多西環素水溶液的稳定性极差,会发生氧化、水解、异构化等多种降解反应,其中差向异构化形成的杂质C是其主要降解反应。在溶液状态下,辅料维生素C会加剧差向异构化降解形成杂质C,通常前6 h的降解反应比较激烈,6 h之后放缓。
(4)国内生产企业均采用低硼硅玻璃瓶,参比制剂采用中硼硅玻璃瓶。置低硼硅玻璃瓶中的样品溶液,放置30 d后色调发生改变,颜色由黄绿色4号变成黄色6号;置中硼硅的样品溶液与参比制剂溶液颜色变化情况基本一致,色调未改变,颜色变成黄绿色5号;杂质变化趋势:低硼硅>中硼硅>参比制剂,尤其是杂质C的增加趋势最明显。此外,偏酸性的注射用盐酸多西环素对温度敏感,其在中硼硅玻璃瓶中与在低硼硅玻璃瓶中相比具有更好的热稳定性和化学稳定性(耐酸、碱)。
3.3.5 血管刺激性试验和溶血试验
血管刺激性试验显示,在临床使用浓度下
(1 mg/mL),3家企业的制剂对家兔耳缘静脉有明显刺激性反应,与注射部位及血管损害、静脉炎、血管炎及血管刺激等不良反应存在相关性。体外试管法溶血试验表明,在临床使用浓度下样品对家兔红细胞混悬液具有溶血作用,3家企业的样品结果基本一致,与说明书中对血液系统的不良反应报道,如溶血性贫血、血小板减少症、中性白细胞减少症和嗜酸性粒细胞增多可能存在相关性。即注射用盐酸多西环素自身存在较明显的不良反应。
4 结论
本次国家评价性抽验采用前期调研、文献检索、法定标准检验结合探索性研究的方式对3家企业86批次注射用盐酸多西环素的质量进行了评价。探索性研究以有關物质、草酸、维生素C含量、盐酸多西环素含量等为指标,对不同的制剂过程、包材、配伍合理性等进行了比较,并对国内现行标准(YBH02832019、WS1-(X-012)-2014Z、YBH09982008)的质控能力进行了评价。与参比制剂相比较,国产制剂的有关物质控制差距较大。对现行标准进行评价,标准YBH02832019“好”,标准 “一般”,标准YBH09982008“差”;对不同企业产品进行评价,B企业产品质量“好”,A企业产品质量“一般”,C企业产品质量“差”。
建议C企业在制剂过程增加对原料的精制,提高质控标准,使用更好的包材。在临床使用中需关注产品自身的不良反应,特别是患者注射部位及血管的刺激情况;临床如长期使用应关注患者的血项指标。
参 考 文 献
李伟, 杨阳. 多西环素的药理学进展及临床应用概述[J]. 广东畜牧兽医科技, 2009, 34(6): 3-5.
王玉, 程晓兵. 盐酸多西环素结晶工艺的优化[J]. 国外医药(抗生素分册), 2021, 42(2): 125-129.
陆莹梅, 李建林, 吕华林. 多西环素药理学及新型制剂的研究进展[J]. 湖南畜牧兽医, 2015, 190(6): 8-10.
USP-NFOnline[EB/OL]. [2023-02-08]. https://doi.org/10.31003/USPNF_M28358_04_01.
国家药典委员会. 奥沙利铂. 中华人民共和国药典四部[S]. (2020年版). 北京: 中国医药科技出版社, 2020: 1671-1673.
国家食品药品监督管理总局.药物刺激性、过敏性和溶血性研究技术指导原则[S]. 2014.
国家药典委员会. 溶血与凝聚检查法. 中华人民共和国药典四部[S]. (2020年版). 北京: 中国医药科技出版社, 2020: 1148.
蔡继兰, 叶东, 汪宗华. 药品冻干过程中各关键环节的控制及常见问题分析[J]. 药学研究, 2013, 32(3): 179-182
徐慧娟, 杜加秋, 钟梁, 等. 注射用盐酸万古霉素冻干工艺对冻干物外观形态及晶型的影响[J]. 中国医药工业杂志, 2022, 53(8): 1196-1200.
作者简介:傅小雅,女,生于1973年,副主任药师,主要从事药品检验及药品质量研究工作,E-mail: 911794134@qq.com
第一作者:傅小雅,女,生于1973年,毕业于中国药科大学药学专业,副主任药师,1995年起至今就职于海南省药品检验所,主要从事药品检验及药品质量研究工作,承担并完成多个品种国家评价性抽验工作、质量标准的起草与复核、国家药品标准提高、进口药品标准复核等工作。
