瑞马唑仑调节HIF-1α/BNIP3信号通路对OGD/R诱导神经细胞自噬和凋亡的影响
2024-05-16王效德后晓超李青青司玉婷周小平徐桂萍
王效德 后晓超 李青青 司玉婷 周小平 徐桂萍
1 材料与方法
1.1 材料 小鼠海马神经元细胞HT22(普诺赛公司);瑞马唑仑(恒瑞医药);2-ME2(HIF-1α抑制剂)(MCE公司);AnnexinV-FITC/PI凋亡检测试剂盒(索莱宝公司);HIF-1α、BNIP3、LC3-Ⅱ、LC3-Ⅰ抗体、羊抗兔二抗(CST公司)。
1.2 细胞培养 HT22细胞置于含有10%胎牛血清DMEM培养基中,在37℃,含有5% CO2的环境下进行培养。
1.3 OGD/R诱导[7]HT22细胞弃去培养液,用高压PBS清洗2遍后加入不含血清的DMEM培养基,后将细胞在含有1% O2、5% CO2、94% N2的培养箱中培养6 h,导致HT22细胞缺氧。6 h后进行复氧,弃掉不含血清培养基,重新加入含10%胎牛血清的DMEM培养基,在37℃,含5% CO2的培养箱中进行培养。
1.4 筛选瑞马唑仑作用浓度 将OGD/R诱导的HT22细胞根据参考文献[8]用不同浓度的瑞马唑仑进行处理,24 h后加入MTT试剂,放回温箱继续孵育4 h,4 h后吸除上清,加入DMSO溶液,孵育10 min后,酶标仪在570 nm的波长下测量光密度(OD),细胞存活率=(OD处理组/OD对照组)×100%。
1.5 细胞分组 将HT22细胞分为对照组、OGD/R组、瑞马唑仑组、2-ME2(HIF-1α抑制剂)组、瑞马唑仑+2-ME2组。对照组不做处理,正常培养;OGD/R组进行OGD/R诱导;瑞马唑仑组进行OGD/R诱导并加入50 μg/mL瑞马唑仑;2-ME2组进行OGD/R诱导并加入0.5 μmol/L 2-ME2[9];瑞马唑仑+2-ME2组进行OGD/R诱导并加入50 μg/mL瑞马唑仑和0.5 μmol/L 2-ME2。药物均在再灌复氧注期间给予。
1.6 CCK-8实验检测5组HT22细胞活力 24 h后将5组HT22细胞每孔加入CCK-8溶液(10 μL),放回温箱孵育2 h,酶标仪在450 nm的波长下测量OD值。
1.7 流式细胞术检测5组HT22细胞凋亡率 24 h后收集5组HT22细胞,用PBS进行漂洗后根据AnnexinV-FITC/PI凋亡检测试剂盒说明进行操作,流式细胞仪检测5组HT22细胞凋亡率。
1.8 透射电子显微镜观察5组HT22细胞自噬小体的形成 24 h后将5组HT22细胞弃去上清,预冷PBS轻轻洗涤3遍,胰酶消化细胞,离心后弃去上清,加入戊二醛固定液过夜固定细胞,采用超薄切片机切片,然后将切片用醋酸铀-枸橼酸铅进行双染,透射电子显微镜观察HT22细胞超微结构。
1.9 Western blot检测5组HT22细胞HIF-1α、BNIP3、LC3-Ⅱ/LC3-Ⅰ的表达 24 h后将5组HT22细胞弃去上清,预冷PBS轻轻洗涤2遍,加入RIPA裂解液裂解细胞,提取细胞蛋白,将获得蛋白用BCA法进行定量,取蛋白样品进行SDS-PAGE凝胶电泳,将条带通过湿转转印至PVDF膜,转膜结束后将膜用脱脂乳进行封闭,然后再依次过夜4℃孵育一抗(HIF-1α、BNIP3、LC3-Ⅱ、LC3-Ⅰ),室温孵育二抗,将膜ECL避光显色,扫描条带保存图像,并用Image J软件分析蛋白灰度值。
2 结果
2.1 不同浓度瑞马唑仑对OGD/R诱导的HT22细胞存活率影响 不同浓度瑞马唑仑均升高HT22细胞存活率(P<0.05),当50 μg/mL瑞马唑仑时细胞存活率显著升高,且浓度再次增加时细胞存活率变化不明显,因此本研究后续选择50 μg/mL瑞马唑仑处理细胞。见表1。

表1 不同浓度瑞马唑仑对OGD/R诱导的HT22细胞存活率影响 %,
2.2 5组HT22细胞活力比较 与对照组比较,OGD/R组HT22细胞OD450值显著下调(P<0.05);与OGD/R组比较,瑞马唑仑组显著上调,2-ME2组显著下调(P<0.05);与瑞马唑仑组比较,瑞马唑仑+2-ME2组HT22细胞OD450值显著下调(P<0.05);与2-ME2组比较,瑞马唑仑+2-ME2组显著上调(P<0.05)。见表2。

表2 5组HT22细胞OD450值比较 n=6,
2.3 5组HT22细胞凋亡率比较 与对照组比较,OGD/R组HT22细胞凋亡率显著上调(P<0.05);与OGD/R组比较,瑞马唑仑组显著下调,2-ME2组显著上调(P<0.05);与瑞马唑仑组比较,瑞马唑仑+2-ME2组HT22细胞凋亡率显著性上调(P<0.05);与2-ME2组比较,瑞马唑仑+2-ME2组显著下调(P<0.05)。见表3,图1。

图1 5组HT22细胞凋亡率比较

表3 5组HT22细胞凋亡率比较 n=6,%,
2.4 5组HT22细胞超微结构比较 对照组HT22细胞形态正常,线粒体结构完整;与对照组比较,OGD/R组HT22细胞线粒体出现裂变,并有少量自噬小体存在;与OGD/R组比较,瑞马唑仑组HT22细胞胞质中自噬小体数量增加,线粒体裂变明显增加;2-ME2组HT22细胞胞质中自噬小体数量减少;与瑞马唑仑组比较,瑞马唑仑+2-ME2组HT22细胞自噬小体数量减少。见图2。

图2 5组HT22细胞自噬小体形成(醋酸轴-枸椽酸铅染色×10 000)
2.5 5组HT22细胞HIF-1α、BNIP3、LC3-Ⅱ/LC3-Ⅰ表达比较 与对照组比较,OGD/R组HT22细胞HIF-1α、BNIP3、LC3-Ⅱ/LC3-Ⅰ表达均显著下调(P<0.05);与OGD/R组比较,瑞马唑仑组均显著上调,2-ME2组均显著下调(P<0.05);与瑞马唑仑组比较,瑞马唑仑+2-ME2组均显著下调(P<0.05);与2-ME2组比较,瑞马唑仑+2-ME2组均显著上调(P<0.05)。见表4,图3。
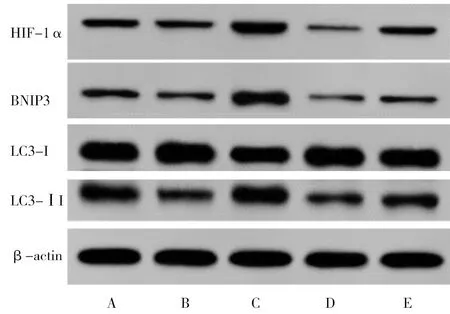
图3 Western blot检测5组HT22细胞HIF-1α、BNIP3、LC3-Ⅱ、LC3-Ⅰ蛋白表达;A 对照组;B OGD/R组;C 瑞马唑仑组;D 2-ME2组;E 瑞马唑仑+2-ME2组

表4 5组HT22细胞HIF-1α、BNIP3、LC3-Ⅱ/LC3-Ⅰ表达比较 n=6,
3 讨论
海马是对大脑缺血缺氧非常敏感的部位。海马神经元受损可引起认知障碍,其中神经元凋亡是其重要表现形式[10],因此降低海马神经元凋亡可缓解大脑缺血再灌注时脑损伤。自噬是一种溶酶体依赖性降解途径,可以清除受损的细胞器维持细胞内稳态[11],因此寻找可抑制OGD/R诱导的神经细胞凋亡,并引起适度自噬的药物具有重要意义。
缺血再灌注导致海马神经元损伤,常作为体外研究脑缺血再灌注损伤理想模型[12-13],本文结果显示,OGD/R诱导后HT22细胞活力显著性降低,凋亡率显著升高,表明OGD/R诱导导致HT22细胞损伤。
瑞马唑仑目前正在开发中,具有快速镇静及更快的恢复等特点[14]。Xu等[1]研究表明在脑缺血再灌注大鼠模型中瑞马唑仑可减少梗死体积,减轻皮质神经元损伤,表明瑞马唑仑对神经细胞具有保护作用。本研究首先筛选瑞马唑仑作用浓度,然后检测瑞马唑仑干预后HT22细胞活力以及凋亡情况,结果显示瑞马唑仑干预后HT22细胞活力增加,凋亡率显著降低,表明瑞马唑仑对OGD/R诱导的HT22细胞具有保护作用。
自噬和凋亡常相互串扰,适度自噬可及时清除受损细胞器,从而防止进一步损伤[15],自噬水平在生理条件下较低,但在缺氧条件下可以增加[16],这种增加会加重伤害,但也可以起到保护作用[17]。自噬的有效控制对于开发缺氧诱导的脑损伤的新治疗策略非常重要。有研究表明脑缺血再灌注后增强自噬,减轻脑缺血区神经损伤,保护脑组织[18],另有研究表明OGD/R诱导大鼠脑皮质神经元损伤,抑制自噬后加重神经元凋亡和损伤[19],上述研究表明适度促进自噬将保护神经元。本文结果显示瑞马唑仑干预细胞后自噬小体数量增加表明瑞马唑仑促进OGD/R诱导的HT22细胞自噬。
线粒体是细胞能量代谢中心,在缺氧时对细胞死亡信号非常敏感,也是活性氧攻击的“目标”[20],HIF-1α/BNIP3是研究较多的线粒体自噬通路,研究表明HIF-1α/BNIP3介导自噬可保护OGD/R诱导的神经细胞[7]。基于以前的研究,我们假设瑞马唑仑通过激活HIF-1α/BNIP3通路发生自噬,从而发挥保护作用。本研究结果显示,瑞马唑仑干预后HIF-1α、BNIP3蛋白水平显著性升高,表明瑞马唑仑激活HIF-1α/BNIP3信号通路。为进一步验证此结果,本文用HIF-1α抑制剂2-ME2干预细胞,抑制HIF-1α/BNIP3信号通路从而抑制线粒体自噬,结果显示与OGD/R组比较,HT22细胞损伤加重,活力下降,凋亡率升高,表明抑制HIF-1α/BNIP3信号通路加重HT22细胞损伤。与2ME2组比较,瑞马唑仑+2-ME2组HT22细胞损伤减轻,表明瑞马唑仑可通过增强自噬从而减轻OGD/R诱导的HT22细胞损伤。
综上所述,瑞马唑仑可通过激活HIF-1α/BNIP3信号通路促进OGD/R诱导的神经细胞自噬,抑制细胞凋亡,从而减轻OGD/R诱导的神经细胞损伤。但本研究尚存在不足之处,是否存在其他通路调近代此过程仍需进一步研究。
