生物信息学预测铜离子载体诱导细胞死亡关键因子铁氧化还原蛋白1的特性
2024-05-16关蕴良
关蕴良
2022年3月有研究团队发现了“铜死亡”,这种新的细胞程序性死亡(programmed cell death,PCD)形式有别于以前熟知的细胞凋亡、细胞焦亡和程序性坏死,它是一种新的倚赖金属离子诱发蛋白毒性应激导致的细胞死亡[1]。上一次发现金属离子可引发PCD是十年前的铁死亡;但前者造成细胞死亡的机制是与其截然不同的细胞膜脂质过氧化损伤[2]。研究者们用上百例肿瘤细胞系筛选药物为切入点,结合多种细胞死亡诱导剂和抑制剂探索发现,铜死亡依赖于线粒体呼吸,铜离子载体利用氧化应激引起了肿瘤细胞的易感性;而这一过程中Fdx1和蛋白质脂酰化是铜离子载体诱导细胞死亡的关键因子,且前者还是后者的上游调节因子[3]。目前,PCD与免疫性疾病[4]、发育障碍[5]和癌症[6]等多种疾病的相关性已有很多报道。对这些疾病致病机制的探讨以及药物治疗靶点的寻找,以PCD调控基因为切入点是生命科学领域常见且有效的科研角度。故本文从Fdx1入手,选择网络数据挖掘的形式,分析其蛋白的氨基酸结构,预测生物学功能,为后续铜死亡相关研究的科研设计提供理论支持。
1 资料与方法
1.1 一般资料 人Fdx1蛋白氨基酸序列由UniProt获得,登录号为P10109。
1.2 方法 分析人Fdx1蛋白结构和预测其功能所用的生物信息学数据库、服务器及软件包等资源信息。见表1。

表1 分析人Fdx1蛋白所用的生物信息学资源详细信息
2 结果
2.1 基本分析
2.1.1 理化性质:ProtParam分析人Fdx1蛋白氨基酸序列:长度为184 aa,分子质量约为19 kDa,理论等电点是5.51,分子式为C819H1341N251O275S9,含2 695个原子。消光系数为8730M-1cm-1(假设所有成对的半胱氨酸残基都形成胱氨酸),半衰期为30 h(哺乳动物网织红细胞,体外),脂肪系数为85.43,总平均亲水性为-0.207,不稳定系数为45.75(<40稳定)。在组成的20种氨基酸中丙氨酸(A)和甘氨酸(G)所占的比例最高(均10.9%);色氨酸(W)最低(0.5%)。带负电荷的氨基酸残基(谷氨酸 + 天冬氨酸)有25个,带正电荷的氨基酸残基(赖氨酸+精氨酸)有20个。是PredictProtein对于人Fdx1蛋白氨基酸组成和比例的可视化呈现。见图1。

图1 人Fdx1蛋白中各氨基酸构成及含量比例图;G:甘氨酸;A:丙氨酸;V:缬氨酸;L:亮氨酸;I:异亮氨酸;P:脯氨酸;F:苯丙氨酸;Y:酪氨酸;W:色氨酸;S:丝氨酸;T:苏氨酸;C:半胱氨酸;M:蛋氨酸;N:天冬酰胺;Q:谷氨酰胺;D:天冬氨酸;E:谷氨酸;K:赖氨酸;R:精氨酸;H:组氨酸
2.1.2 亲疏水性分析:将ProtScale每次运行计算和显示的残基数缺省值设为9,得到人Fdx1蛋白整个氨基酸序列的波峰值在第13位丙氨酸(A)处,评分为1.744分,是疏水性最强的点;波谷值在第62位丝氨酸处(S),评分-2.278,是亲水性最强的点。以0分为中线整体比较(>0:疏水性;<0:亲水性),人Fdx1蛋白亲水区域多于疏水区域,属亲水性蛋白(与理化性质分析结果一致)。见图2。

图2 人Fdx1蛋白亲疏水性分析结果
2.1.3 跨膜区分析:TMHMM 2.0预测人Fdx1蛋白质不具有跨膜结构。全部氨基酸序列均在膜外。见图3。

图3 人Fdx1蛋白跨膜区预测结果
2.1.4 信号肽预测:SignalP 5.0分析认为,人Fdx1蛋白含有信号肽序列的可能性为0.0003。即不含信号肽的可能性大。见图4。

图4 人Fdx1蛋白信号肽分析结果
2.1.5 亚细胞定位:Hum-mPLoc 3.0推测,在预测因子涵盖的12个亚细胞位置中,人Fdx1蛋白唯一在线粒体基质定位的得分为正(2.343577分),其他部位均为负分,即其在线粒体基质的可能性最大。来自SwissBioPics数据库的可视化图中着淡黄色的线粒体,形象地印证了这一相同的预测结果。见图5。

图5 人Fdx1蛋白亚细胞定位示意图
2.2 特征结构分析
2.2.1 结构域分析:在PFAM domains的Normal模式下运行SMART,可得出人Fdx1蛋白第72~157位存在1个高度保守的结构功能域——Fer2(E=5.8e-10)。见图6。

图6 人Fdx1蛋白结构功能域预测结果
2.2.2 模体结构:将MEME筛选数量设定为11。形象化的展示了人Fdx1蛋白具体的模体信息(不同颜色方块代表不同模体,方块大小代表模体长度,框图内有每个模体具体的氨基酸序列构成)(P值均<0.05)。见图7。

图7 人Fdx1蛋白模体分析结果
2.3 空间结构预测
2.3.1 二级结构:SMOPA预测人Fdx1蛋白二级结构结果:主要类型为α-螺旋,有68个(占整个氨基酸序列的36.96%);其次为无规则卷曲,61个(33.15%);第三是延伸链,36个(19.57%);还有10.33%的β-折叠(19个)。见图8。

图8 人Fdx1蛋白二级结构预测结果;蓝色:α-螺旋;绿色:β-折叠;黄色:无规则卷曲;红色:延伸链
2.3.2 三级结构:先将人Fdx1蛋白序列与SWISS-MODEL数据库中已有蛋白进行序列比对寻找到50条模板,再兼顾两者序列的一致性、全球性模型质量估测值(global model quality estimate,GMQE)和全局得分等综合排序,最终选择到相似度最高的同源蛋白为模板建模,得到的人Fdx1蛋白三级结构(GMQE:0.59;全局得分:0.83 ± 0.05;模板:3p1m.2.A;序列同一性:100.00%)。见图9。

图9 预测人Fdx1蛋白的三级结构图
2.3.3 四级结构:GeneCards推测Fdx1的四级结构与CYP11A1存在相互作用。并且Fdx1与蛋白结合且在蛋白功能发挥中必要的非蛋白质化合物——辅因子是[2Fe-2S]簇。
2.4 翻译后修饰
2.4.1 磷酸化:NetPhos 3.1显示人Fdx1蛋白整条氨基酸序列共含有22个磷酸化位点:其中丝氨酸磷酸化位点13个;苏氨酸磷酸化位点8个;酪氨酸磷酸化位点1个。主要涉及包括蛋白激酶A/C、酪蛋白激酶Ⅰ和细胞分裂周期基因2等在内的多个特异性磷酸激酶。见图10。

图10 人Fdx1蛋白磷酸化位点预测结果图
2.4.2 糖基化
2.4.2.1 N-糖基化:NetNGlyc 1.0分析人Fdx1蛋白氨基酸序列一共出现了6条N-糖基化位点。排除第40位和第96位阴性位点(均<0.5的阈值),剩余有第73、97、135和162位4条。见图11,表2。

图11 人Fdx1蛋白N-糖基化位点预测结果图

表2 人Fdx1蛋白N-糖基化位点详细信息
2.4.2.2 O-糖基化:NetOglyc4.0对人Fdx1蛋白中O-GalNAc(黏蛋白型)糖基化位点预测显示,其氨基酸全序列有7个O-糖基化位点超过阈值0.5,分别在第30、34、46、50、52、56和61位。
2.4.3 甲基化:根据被甲基取代氨基上的氢原子数量,赖氨酸甲基化可分为单-(K.momo)、双-(K.di)和三甲基化(K.tri);而精氨酸甲基化可分为单-(R.mono)、对称双- (R.s.di)、不对称双甲基化(R.a.di)。GPS-MSP 1.0预测人Fdx1蛋白甲基化位点的组成:精氨酸甲基化比例明显多于赖氨酸甲基化。其氨基酸序列上的具体位置:两大类氨基酸甲基化位点混合分布于氨基酸序列两端且接近中段。见图12。

图12 人Fdx1蛋白甲基化位点预测情况
2.4.4 泛素化:在平衡准确度和特异性后(阈值皆为0.3),BDM-PUB 1.0对人Fdx1蛋白泛素化位点预测信息的总结表格。由此可见,人Fdx1蛋白分别在第82、84和182位点处出现泛素化修饰的可能性高。见表3。

表3 人Fdx1蛋白泛素化位点预测结果
2.4.5 苏木化:GPS-SUMO 2.0预测人Fdx1蛋白小泛素相关修饰物(small ubiquitin related modifier,SUMO)(“苏木”)位点完整信息。见表4。
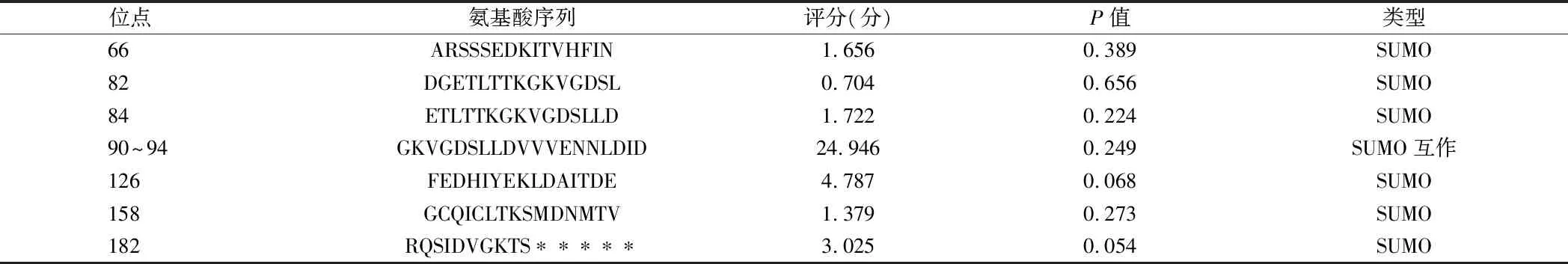
表4 人Fdx1蛋白苏木化位点预测结果
2.4.6 乙酰化
2.4.6.1 Nα-末端乙酰化:NetAcet 1.0预测人Fdx1蛋白有2处氨基酸残基疑似存在乙酰化位点的可能性较高,但评分都<0.500分,还需要通过实验验证一下预测。
2.4.6.2 Nε-赖氨酸乙酰化:将性能GPS-PAIL 1.0选择设为最高严格性(均≥0.5),可得到结果:人Fdx1蛋白在4个氨基酸残基处存在Nε-赖氨酸乙酰化的可能性很高。见表5。

表5 人Fdx1蛋白Nε-赖氨酸乙酰化位点预测结果
2.4.7 脂质修饰:将GSP-Lipid 1.0程序阈值设为中等,系统发现人Fdx1蛋白有3处氨基酸残基出现脂质修饰化的可能性较高。见表6。
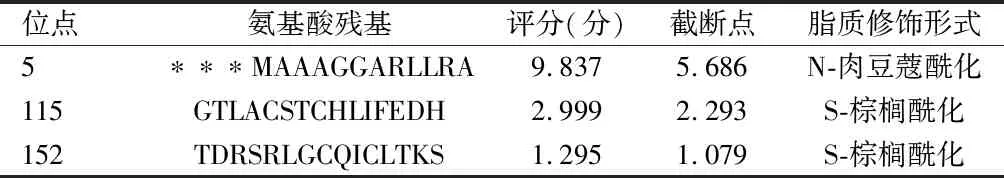
表6 人Fdx1蛋白脂质修饰化位点预测结果
2.5 生物学功能
2.5.1 蛋白质相互作用:为尽可能排除其它因素的干扰,将STRING系统默认值调至最高可信度(0.9),设定一级关联下互作蛋白数不超过10个。找到11个节点、22条边、平均局部聚类系数为0.903,蛋白互作富集P值为0.000785。见图13。

图13 人Fdx1关联蛋白的相互作用可视化图;CYP11A1:胆固醇侧链裂解酶;FdxR:还原型辅酶II;ISCU:铁硫簇组装酶;NFS1:半胱氨酸脱硫酶;CYCS:细胞色素c;AKR1B1:醛糖还原酶;FXN:共济蛋白;LYRM4:含LYR基序的蛋白质4;HSCB:铁硫簇共伴侣蛋白;STAR:立体定向急性调节蛋白;图中各颜色线条关联方式及关联依据:已知关联:—(专业数据库);—(实验确定);预测关联:—(基因相邻);—(基因融合);—(基因共存);其他:—(文本挖掘);—(共表达);—(蛋白同源)
2.5.2 信号通路分析:根据运算,Reactome推测人Fdx1蛋白涉及二十几种通路,与疾病和代谢的关系最为密切。每个有向无环的烟花分支都又能具体化成一个目标通路。 见图14。

图14 人Fdx1蛋白Reactome通路总览图
2.6 表达分析
2.6.1 正常组织:ProteomicsDB分析人Fdx1蛋白在血液&免疫、神经和肌肉骨骼等6大类组织的蛋白表达情况。其中,表达前三位的分别是内脏系统的鼻腔呼吸上皮(log10 650 ppm)>内分泌系统的肾上腺(log10 206 ppm)>生殖系统的胎儿的睾丸(log10 174 ppm)。见图15。

图15 人Fdx1蛋白在正常组织中的表达情况
2.6.2 细胞株:MOPED分析人Fdx1在肿瘤细胞株中蛋白表达结果。表达最高的前3位依次是:脑癌里的U251细胞(log10 557 ppm)、肾癌里的RXF393细胞(log10 287 ppm)、黑色素瘤里的M14细胞(log10 255 ppm)。见图16。

图16 人Fdx1蛋白在细胞株中的表达情况
3 讨论
Fdx是含有由非血红素铁和无机硫组成的活性位点的电子载体蛋白。1962年在巴氏梭菌中一种不含血红素的褐色蛋白中被分离,后又在菠菜叶绿体中发现[7]。现已知广泛存在于包括植物、原核生物和真核生物等各类生命体中。植物中Fdx参与光合作用、氢代谢和生物固氮等生物学过程[8-10]。原核生物和真核生物中Fdx的功能讨论涉及电子传递、辅酶Q生物合成以及类固醇激素等方面[11-13]。人类有两种同源物:Fdx1和Fdx2。前者主要在肾上腺皮质和髓质里高度表达;后者在中枢神经系统中含量丰富[14]。二者皆有祖先高度保守的Fe-S簇功能:不仅参与Fe-S簇自身活动,还组装Fe-S簇形成本身[15]。单独对Fdx1的研究也有不少,如:(1)基因多态性与IgA肾病风险存在关联[16]。(2)参与卵巢颗粒细胞的转录调控[17]。(3)影响肺腺癌的预后并介导其代谢[18]。最新的泛癌分析证实,Fdx1是可作为免疫治疗的预测因子和预后的生物标志物[19]。已知游离铜离子是有毒的,大多数生物都进化出了包含伴侣蛋白在内的、高度专业化的铜转运系统。目前对于铜离子如何在这些蛋白间移动的机械构造方面研究已有长足进展;但将铜转运与细胞调节过程联系起来的、高度复杂的网络机制还有待挖掘。据此可知,Fdx1的分析对了解铜死亡的调控非常重要。
本研究利用ProtParam、SMART和SMOPA等数据挖掘软件对人Fdx1蛋白的氨基酸序列进行了6类生物信息预测和分析。结果发现:(1)基本分析:人Fdx1蛋白属于较不稳定的亲水性蛋白;在中性溶液里带负电,偏酸性;未预测到跨膜区和信号肽,说明不是分泌蛋白的可能性高,且发挥膜间信号转导的作用低。氨基酸序列结构组成中含量最多的丙氨酸和甘氨酸皆为脂肪族氨基酸。故推测,人Fdx1蛋白参与脂质转运或脂质代谢过程的可能性较大,已有论文证实这一生信推测[20]。建模分析人Fdx1蛋白亚细胞定位最大几率是线粒体基质,这一结果不难理解铜死亡与线粒体呼吸的紧密关联。(2)特征结构分析:人Fdx1蛋白发现了Fer2结构域,这说明其具有Fer2家族成员共有的分子活性,比如铁离子存储、铁稳态调控和电子传递等等[21]。(3)空间结构:①二级结构超一半为α-螺旋,说明人Fdx1蛋白多肽链机械强度较高,并且伸缩性较好。②通过同源建模法预测的三级结构,相较于X射线晶体衍射和NMR核磁共振等物理方法测定蛋白质三级结构更迅速、成本更低。③四级结构发现,人Fdx1与CYP11A1互作强。已知后者编码的胆固醇侧链裂解酶是催化类固醇激素合成的首要限速步骤[22]。据此推测,Fdx1也可能参与机体的内分泌调节。(4)蛋白的翻译后修饰。①人Fdx1蛋白丝氨酸、苏氨酸和酪氨酸磷酸化修饰位点均有,预测对蛋白活性的调控与已有文献报道[23]一致。②糖基化蛋白质组学认为,N-糖基化修饰在蛋白正确折叠、功能定位和胞内运输中起到重要作用;O-GalNAc糖基化对黏蛋白凝胶化功能和屏障保护作用必不可少,在一些疾病的发生发展过程中也起着至关重要的作用[24]。人Fdx1蛋白二者均预测出不少的修饰位点,未来可以探索糖基化修饰与Fdx1相关肿瘤等其他疾病的关系。③精氨酸甲基化参与RNA剪接、翻译与信号转导等许多重要的生命过程[25]。从铜死亡机制研究知道人Fdx1与癌症有关;但与其甲基化相关的辅助因子、是否串扰组蛋白甲基化等许多甲基化过程还亟待挖掘,为了更加精准的调节其转录活性,Fdx1蛋白甲基化是一个可开发的热点。④乙酰化、泛素化、苏木化在内的4种翻译后修饰位点又陆续在人Fdx1上预测出来。这说明其对生命活动的机理、筛选疾病临床标志物和鉴定药物靶点等许多方面探索都具有重要价值。(5)预测出的互作蛋白分为几类,对于基于基因相邻/融合/共存预测的关联蛋白等是未来可以开发的领域。(6)尽管Fdx1在人体正常组织和肿瘤细胞内都是低表达状态,但是已发现的集中表达部位和细胞都值得重点关注。
本文选择生物信息学方法,分析了人Fdx1蛋白的氨基酸序列,预测出其可能具有的生物学功能。希望本文的结果能对以后铜死亡、PCD或者相关基础课题的科研设计和疾病治疗靶点寻找的方向提供理论参考。
