ANGPTL2在2型糖尿病肾病的炎症性损伤和纤维化中的机制研究
2024-05-14董杨陆晨张雪琴朱国强黄明芳陆瑾瑜
董杨,陆晨,张雪琴,朱国强,黄明芳,陆瑾瑜
新疆医科大学第一附属医院肾脏病中心,乌鲁木齐 830054
2 型糖尿病(type 2 diabetes mellitus,T2DM)是比例最高的糖尿病分型。T2DM 患者通常存在胰岛素抵抗或胰岛素分泌不足,慢性并发症是其主要死因[1]。其中糖尿病肾病(diabetic nephropathy,DN)是微血管损害后最常见的并发症,DN 增加了疾病治疗难度及死亡风险,进一步降低了患者的生活质量。DN 形成及发展中炎症风暴、组织纤维化在其中起关键作用[2],但过程尚未十分清晰。血管生成素样蛋白(angiopoietin-like protein,ANGPTL)为一类具有与血管生成素类似结构的蛋白,其中ANGPTL2 属于新发现的血管生成相关蛋白。目前ANGPTL2 与2 型糖尿病肾病(type 2 diabetic nephropathy,T2DN)发生机制中的炎症状态、纤维化是否相关的报道相对较少。故本研究经构建T2DN 动物模型,分析ANGPTL2 与T2DN 炎性损伤及纤维化的关系及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar 大鼠45 只,均为雄性且均属于无特定病原体(specific pathogen free,SPF)级别,6~8 周龄,体质量在181~200 g,均购买自新疆医科大学动物实验中心(许可证号:SCXK(新)2003-0001)。大鼠生存环境:温度20~23℃、相对湿度65%~75%,光照周期2 h/12 h,在适应性养殖后1 周开始试验。
1.1.2 主要仪器 罗氏血糖仪:罗氏诊断产品(上海)有限公司;荧光倒置显微镜:日本尼康;组织包埋机(E0987 型);组织匀浆仪:武汉微塞尔生物科技有限公司;DNM-9602A 型酶标仪:北京普朗医疗公司;ChemiDoc SRS+成像系统(Bio-Rad)。
1.1.3 实验药物与主要试剂 链脲佐菌素(streptozotocin,STZ)由Sigma-Aldrich 生产,批号V 900890;二甲双胍购自宝鸡市国康生物科技有限公司,纯度≥98%,批号为1115-70-4;原位末端转移酶标记(TdT-mediated dUTP-biotin nick end labeling,TUNEL)染色试剂盒(碧云天生物技术,批号C1098);白细胞介素-6(interleukin 6,IL-6)、C 反应蛋白(C-reactive protein,CRP)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、转化生长因子β1(transforming growth factor β1,TGF-β1)酶联免疫吸附试验试剂盒购自深圳子科生物科技有限公司;ANGPTL2 抗体购自武汉尤尔公司,肾病蛋白(Nephrin)、足突蛋白(Podocin)抗体购自美国Santa Cruz 公司。
1.2 方法
1.2.1 建模及分组 大鼠经过适应性喂养后,随机选取其中15 只作为正常对照组(NC 组),予以常规饲料喂养,余下30 只(随机数字表法分为T2DN 组、二甲双胍组各15 只,T2DN 组及二甲双胍组)均经高脂高糖饮食喂养8 周,之后空腹状态下一次性腹腔注射小剂量STZ 建立T2DN 模型。建模成功标准:48 h 后测得随机血糖≥16.7 mmol/L,血糖未达标大鼠继续注射同等剂量STZ,48 h 后再次测定血糖,直至随机血糖达标;7 d 后予以尿蛋白定性检测,尿蛋白阳性为T2DN 建模成功[3]。在T2DN 建模成功第2日二甲双胍组予以二甲双胍250 mg/(kg·d)灌胃,对照组、T2DN 组则予以等体积生理盐水灌胃,各组连续给药12 周。
1.2.2 血糖及生化指标检测 模型成功建立后进行各项试验室检验。①血糖:自大鼠尾静脉处采血,参照血糖仪应用方法检测血糖值;②胰岛素:5425R 型高速冷冻离心机(南京北等电子商务有限公司生产)先开机降温,取大鼠心脏血3 ml,低温下离心,转动速率为3000 r/min、离心时间为10 min,取血浆按上海酶联科技生物有限公司生产的胰岛素测定试剂盒操作方法完成胰岛素含量检测;③生化检测:将小鼠置于代谢笼内,收集24 h 内尿液,以考马斯亮蓝法测定在全自动生化分析仪(AU5800 型,美国Beckman-Coulter 公司生产)下测定24 h 尿蛋白定量;同样取心脏血5 ml,生化分析下测定血肌酐(serum creatinine,Scr)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)。
1.2.3 肾脏组织病理取材 大鼠腹腔内注射戊巴比妥钠麻醉,仰卧位固定后打开胸腔,完成胰岛素检测所用的心脏血后剪开左心耳,将4%多聚甲醛持续灌流,直至大鼠心脏、肺均出现乳白色。剥离肾周围的结缔组织摘取大鼠左肾,用生理盐水清洗血渍后一部分放置于液氮罐内留存备用。
1.2.4 大鼠肾组织形态学观察 另一部分大鼠肾组织固定、包埋、切片,脱蜡、脱水后行苏木素伊红(Hematoxylin-Eosin,HE)染色、马松(Masson)三色染色及高碘酸-希夫染色(Periodic acid-Schiffs,PAS)染色,形成的图像均在显微镜(200 倍)下拍摄。
1.2.5 观察肾组织细胞凋亡情况 依据试剂盒操作规范,对肾组织石蜡切片进行TUNEL 组织荧光染色,显微镜下观察大鼠肾组织细胞情况,荧光绿色为凋亡细胞,评定细胞凋亡指数,判断标准为400 倍显微镜下随机选取6 个视野,注意均应包含肾小球结构,观察凋亡细胞数目及存活细胞数,计算公式为荧光绿色细胞数目/蓝色细胞核细胞数目×100%。
1.2.6 炎性损伤及纤维化指标测定 取肾组织匀浆,采用酶联免疫吸附试验测定IL-6、CRP、VEGF、TGF-β1。
1.2.7 ANGPTL2、Nephrin、Podocin mRNA 表达水平测定 经聚合酶链反应检测,以上述蛋白及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)条带光密度值表示相对表达量,基因表达产物相对定量方式为Ct 值。引物序列参照文献[9]设计如下表1。

表1 聚合酶链反应引物序列
1.3 观察指标 比较各组血糖、生化指标,分析T2DN 小鼠肾组织病理特征,比较各组小鼠肾组织切片TUNEL 染色结果、肾组织炎症性损伤指标(IL-6、CRP)及纤维化指标(VEGF、TGF-β1),统计并比较各组小鼠ANGPTL2、Nephrin 及Podocin mRNA表达水平,分析T2DN 组大鼠ANGPTL2 mRNA 与IL-6、CRP 及VEGF、TGF-β1 之间的相关性。
1.4 统计学方法 采用SPSS 20.0 统计软件进行数据分析;计量资料 符合正态分布采用表示,多组间比较采用单因素方差分析、LSD-t检验。ANGPTL2与炎性及肾纤维化指标的相关性采用Pearson 法。P<0.05 代表差异存在统计学意义。
2 结果
2.1 各组血糖及生化指标比较 T2DN 组血糖、24 h 尿蛋白定量、Scr、TG、TC 均高于对照组、二甲双胍组,T2DN 组胰岛素低于其他两组,对照组与二甲双胍组上述各指标差异亦存在统计学意义(P<0.05)。见表2。

表2 各组血糖及生化指标比较
2.2 肾组织病理改变 成功构建T2DN 大鼠模型,T2DN 组的大鼠一般体征异常,肾组织可见明显病理改变,肾组织结构发生变化,炎症细胞浸润明显,肾小球肥大、系膜基质扩张、基底膜增厚、胶原蛋白过度沉积、肾纤维化较严重,中晚期时肾小球出现固缩与硬化,KW 结节形成,可合并肾小管损伤,发生空泡及颗粒变性,间质呈现明显纤维化;二甲双胍组大鼠一般体征逐渐恢复正常,病理损伤逐渐好转,肾小球系膜基质范围减小、基底膜变薄,胶原蛋白沉积减少,肾纤维化逐渐改善。见图1。

图1 肾组织病理改变(×200倍)
2.3 TUNEL 染色结果 TUNEL 染色显示,T2DN 组细胞凋亡指数(45.67%±4.89%)较对照组(5.74%±0.62%)、二甲双胍组(15.63%±1.97%)增加(t=31.374,P<0.001;t=22.069,P<0.001),二甲双胍组细胞凋亡指数也大于对照组(t=18.547,P<0.001)。见图2、图3。

图2 TUNEL染色结果(×200倍)
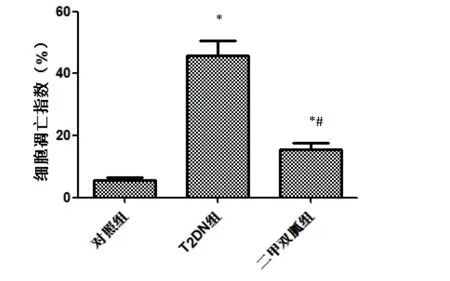
图3 各组细胞凋亡指数比较
2.4 各组炎症性损伤及纤维化指标比较 T2DN 组IL-6、CRP、VEGF、TGF-β1 表达量高于对照组、二甲双胍组,二甲双胍组上述因子表达量高于对照组(P<0.05)。见表3。
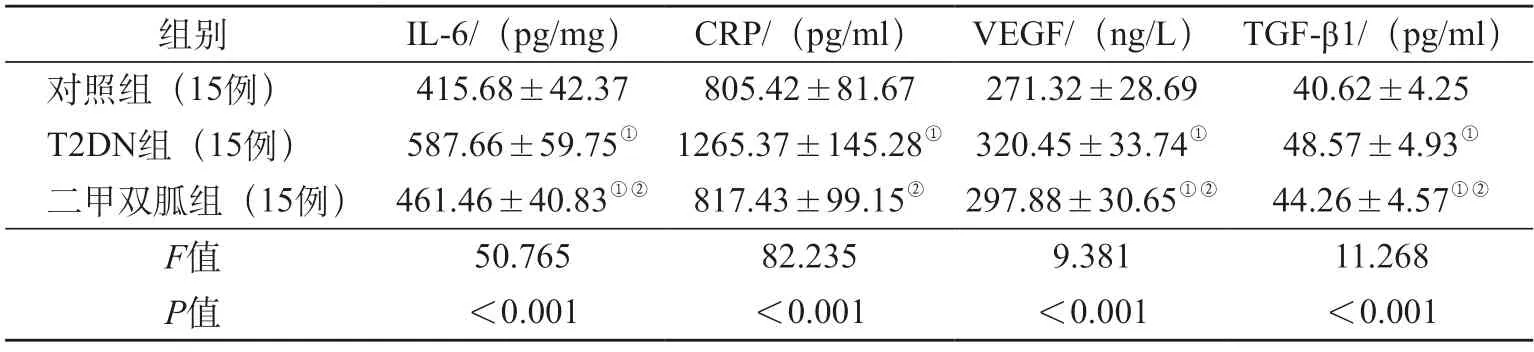
表3 各组炎症性损伤及纤维化指标比较
2.5 各组ANGPTL2、Nephrin、Podocin mRNA 表达水平比较 T2DN 组ANGPTL2 mRNA 高于对照组、二甲双胍组(P<0.05),T2DN 组的Nephrin、Podocin mRNA 低于对照组、二甲双胍组,对照组、二甲双胍组上述指标差异也有统计学意义(P<0.05)。见表4、图4。
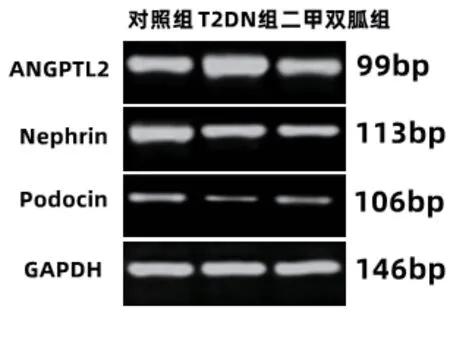
图4 各组ANGPTL2、Nephrin、Podocin mRNA表达水平

表4 各组ANGPTL2、Nephrin、Podocin mRNA表达水平比较
2.6 相关分析结果 T2DN 大鼠ANGPTL2 mRNA 与IL-6、CRP、VEGF、TGF-β1 呈正相关(r=0.536、0.718、0.439、0.511,均P<0.05)。
3 讨论
肾细胞凋亡及肾间质纤维化已成为T2DN 的主要病理特征,此外肾纤维化作为DKD 的重要环节,是肾脏慢性病变进展至终末期的共同过程[4]。本次发现,T2DN 出现明显的血糖、生化指标改变,原因在于T2DN 大鼠已经存在明显的糖脂代谢异常,而血糖、血脂增高后可导致全身器官损害,包括肾脏微血管,致使基底膜增厚、系膜细胞基质积聚等,最终引起肾功能下降、尿蛋白等[5],故T2DN 组大鼠尿蛋白定量及血肌酐均最高。上述肾脏病理改变过程中,大血管、微血管的内皮细胞损害可导致炎症因子聚集,同时高血糖导致糖皮质醇增多后可抑制机体免疫能力,最终促使炎症因子高表达,因此表3 中T2DN 组IL-6、CRP 数值最大。一方面,高水平炎症因子可直接加重肾小管间质的炎症程度[6],且肾小球损伤过程中可产生TGF-β1,该物质活化后可引起巨噬细胞浸润、迁移并促进VEGF 分泌,进一步加重肾脏微炎症状态,这是本次T2DN 组肾组织匀浆中VEGF 等表达量高于另外两组及二甲双胍组高于对照组的原因;另一方面炎症因子对机体胰岛素信号形成干扰[7],加重胰岛素抵抗。高血糖经诱导氧化应激及AGEs 合成而激活TGF-β,TGF-β1 在糖尿病性肾小球硬化症与间质纤维化中起中介效应[8],诱发糖尿病肾病形成及肾组织纤维化进展。
本次实验成功构建T2DN 大鼠模型,T2DN 组的大鼠一般体征异常,肾组织可见明显病理改变,肾组织结构发生变化,二甲双胍组病理损伤逐渐好转,TUNEL 染色显示,T2DN 组细胞凋亡指数较对照组、二甲双胍组增加,说明T2DN 所处的高血糖环境可直接或间接引起肾小球病例变化,但是经二甲双胍治疗后可稍微缓解病理性损伤。本次发现,ANGPTL2与T2DN 进展有密切关联,ANGPTL2 于1999 年首次发现并通过聚合酶链反应从人、小鼠的成熟心肌互补DNA 文库中克隆出编码ANGPTL2 的互补DNA,ANGPTL2 位于人类基因位于9q34,其编码的蛋白质由439 个氨基酸组成,在人体脂肪组织及心脏、脾脏、肺脏、胃、肠道、子宫中均有较高的mRNA 表达,尤其是在内脏脂肪组织中表达较高,为循环生成素样蛋白2 的主要来源。ANGPTL2 与Angs 具有相似结构及一定同源性,但不能与酪氨酸受体Tie1 或Tie2 结合,在功能上也表现出多样性[9],正常表达利于血管再生、组织修复过程,然而过量ANGPTL2 表达可导致机体慢性炎症反应及不可逆性组织重建,继而促使相关疾病发生,包括T2DM、肿瘤、代谢性疾病、脑梗死等[10],尽管其具体机制仍未完全明确,但是根据本研究结果,T2DN 动物模型已经发生明显的ANGPTL2 增高,本研究结果亦表明ANGPTL2 与T2DN 进展中炎症损伤及肾纤维化指标均有较强的正相关性。其机制与下调Nephrin、Podocin 有关,以往研究认为,ANGPTL2 主要通过炎症途径参与足细胞损伤[11],但其具体分子机制还有待进一步研究;血管损伤伴随炎症为T2DN 的重要特征[12-13],ANGPTL2在活体内会诱导血管炎症,其本质特征为大量白细胞黏附至血管壁及血管通透性增高,经整合素α5β1/Racl/NF-κβ 途径刺激NF-κβ 的核转位及Iκβ 的降解,增加各种炎症细胞因子表达,同时诱导单核/巨噬细胞趋化作用,ANGPTL2 经整合素信号通路及诱导单核/巨噬细胞的趋化性在内皮细胞上激活炎症级联反应;此外ANGPTL2 的C 末端存在纤维蛋白样结构域,可发挥Toll 样受体4 配体的功能,这也成为其参与慢性炎症的可能机制[14]。另也有研究显示,ANGPTL2通过MEK/ERK/Nrf-1 通路调控自噬,影响DKD 肾纤维化的进展。这些研究证实了ANGPTL2 上调会增加T2DN 的炎性损伤及肾纤维化损伤[15]。
综上所述,ANGPTL2 上调会增加T2DN 的炎性损伤及肾纤维化,三者有密切关联,ANGPTL2 的这种作用可能和其下调Nephrin、Podocin 有关。
