术前AAPR联合CONUT评分对食管癌根治术后辅助化疗患者预后的影响
2024-05-14高新英燕蕾
高新英,燕蕾
1青岛大学附属泰安市中心医院消化内科,泰安 271000;2青岛大学附属泰安市中心医院药学部,泰安 271000
食管癌是一种常见的恶性肿瘤,其在国内的发病率和死亡率均保持在较高水平[1]。目前临床中对于其的治疗方案主要包括食管癌根治术等手术治疗和术前或术后的辅助化疗等。由于中晚期食管癌患者已经出现转移,单纯的食管癌根治术无法彻底切除病灶,治愈率较低,多采用根治术切除联合术后辅助化疗的方式进行治疗。尽管有研究报道食管癌根治术后辅助化疗可发挥较好的疗效[2]。然而报道较少,其对于预后的影响仍需进一步探究。白蛋白/碱性磷酸酶比值(albumin/alkaline phosphatase ratio,AAPR)是指血清白蛋白水平与碱性磷酸酶水平之间的比值,其可以反映机体的营养状况和肝功能状况,既往研究证实其与肝癌、肾癌、膀胱癌等恶性肿瘤的预后结局密切相关[3-5]。控制营养状态(controlling nutritional status,CONUT)评分通过淋巴细胞计数、血清白蛋白及总胆固醇水平评估患者的营养状况,既往被用于胃癌、卵巢癌等肿瘤的预后结局评估,具备良好的效能[6-7]。然而较少见到AAPR、CONUT 评分与食管癌的相关报道。基于此,本研究旨在探讨AAPR 联合CONUT评分对食管癌根治术后辅助化疗患者预后的影响。
1 对象与方法
1.1 研究对象 选取2021 年1 月至2022 年8 月于青岛大学附属泰安市中心医院行食管癌根治术患者100 例。纳入标准:符合食管癌的诊断标准[8];行食管癌根治术及新辅助化疗;既往未接受过食管癌相关治疗。排除标准:合并严重心脏病、肝功能不全、肾功能不全等;合并其他恶性肿瘤;合并感染性疾病或出血性疾病。本研究的所有流程均符合《赫尔辛基宣言》。
1.2 方法
(1)术前AAPR 检测:于次日清晨,采集空腹静脉血5 ml,以3000 r/min 的速度离心3 min,离心分离血清后通过酶联免疫吸附法检测血清白蛋白、碱性磷酸酶水平,血清白蛋白、碱性磷酸酶试剂盒均购自北京万泰生物药业股份有限公司,仪器使用美国Multiskan 产全自动酶标仪,计算AAPR。
(2)CONUT 评 分[9]:包括血清白蛋白、淋巴细胞计数和总胆固醇3 个指标。其中血清白蛋 白≥3.5 g/dl 计0 分,3.0~<3.5 g/dl 计2 分,2.5~<3.0 g/dl 计4 分,<2.5 g/dl 计6 分;淋巴细胞计数≥1600、1200~<1600、800~<1200、<800 分 别0、1、2、3 分;总胆固醇≥180 mg/dl、140~<180 mg/dl、100~<140 mg/dl、<100 mg/dl分别计0、1、2、3 分;总分为12 分,分数越高则表示营养状况越差。
(3)治疗方法:所有患者均接受食管癌根治术及淋巴清扫,术后行常规化疗,方案包括:第1 日,75 mg/m2多西他赛(深圳万乐药业有限公司,国药准字H20052067,规格:0.5 ml ∶20 mg)静脉滴注;第2~5 日,75 mg/m2顺铂(齐鲁制药有限公司,国药准字H37021357,规格:20 mg)静脉滴注,3 周为一个疗程,共4 个疗程。
1.3 随访和比较 所有患者从接受一线化疗开始持续随访1 年,记录3 个月时不良反应发生情况,6 个月时的复发、转移或死亡情况,以及1 年生存情况。
(1)比较6 个月良好预后和不良预后患者的AAPR、CONUT 评分差异,分析AAPR、CONUT 评分对患者预后不良的预测效能。根据患者术后6 个月的预后结局,将复发、转移或死亡患者纳入预后不良组,术后未出现复发、转移或死亡,恢复良好的患者纳入预后良好组。
(2)比较不同水平AAPR、CONUT 评分患者的3 个月不良反应发生率和1 年生存情况。不良反应包括恶心呕吐和白细胞减少。
1.4 统计学方法 应用SPSS 23.0 统计学软件分析数据。经正态性检验,符合正态分布的计量资料以表示,组间比较使用t检验;计数资料以百分比(%)表示,组间比较使用χ2检验;AAPR、CONUT评分对不良预后的预测效能采用受试者工作特征(ROC)曲线分析,采用MedCalc 软件绘制曲线;采用GraphPad Prism 8 绘制生存曲线,差异性对比使用log-rank 检验;P<0.05 表示差异有统计学意义。
2 结果
2.1 AAPR、CONUT 评分与不良预后的关系分析 不良预后与良好预后两组的年龄、性别、BMI、临床分期、病理分型比较,差异均无统计学意义。预后不良组的AAPR 小于预后良好组,CONUT 评分大于预后良好组(P<0.05)。见表1。

表1 不良预后和良好预后的基线资料比较
ROC 曲线分析显示,AAPR、CONUT 评分及两者联合预测不良预后的AUC 分别为0.781、0.807、0.892;AAPR、CONUT 评分的最佳截断值分别为0.59、3.05。见图1、表2。

图1 AAPR、CONUT评分预测6个月不良预后的ROC曲线

表2 AAPR、CONUT评分预测6个月不良预后的价值分析
2.2 不同水平AAPR、CONUT 评分患者的3 个月不良反应发生率和1 年生存分析 以ROC 曲线AAPR、CONUT 评分的最佳截断值进行分组:高AAPR(>0.59)组54 例,低AAPR(≤0.59)组46 例;高CONUT 评分(>3.05)组39 例,低CONUT 评分(≤3.05)组61 例。
(1)不同水平AAPR、CONUT 评分患者的3 个月不良反应发生率:低AAPR 组和高CONUT 组患者的恶心呕吐、白细胞减少等3 个月不良反应发生率均更高(P<0.05)。见表3。
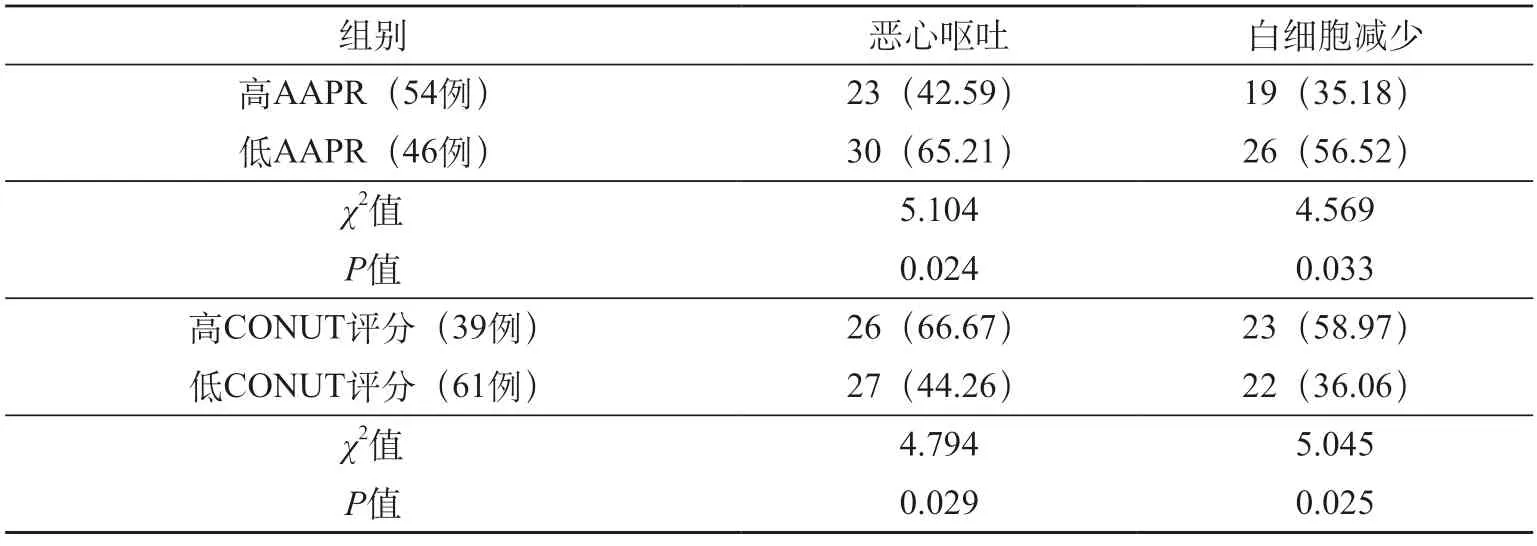
表3 不同水平AAPR、CONUT评分患者的不良反应发生率比较 [例(%)]
(2)不同水平AAPR、CONUT 评分患者的1 年生存分析:治疗后1 年,100 例食管癌患者中,生存72 例,死 亡18 例,1 年生存率为72.00%。其中高AAPR 组生存44 例,死亡10 例,1 年生存率为81.48%,平均生存时间为(11.24±2.21)个月;低AAPR 组生存28 例,死亡18 例,1 年生存率为60.86%,平均生存时间为(9.58±3.82)个月;高AAPR 组的1 年生存率高于低AAPR 组(HR0.400,95%CI0.189~0.848,P=0.014)。
高CONUT 评分组生存23 例,死亡16 例,1 年生存率为58.97%,平均生存时间为(9.61±3.46)个月;低CONUT 评分组生存49 例,死亡12 例,1 年生存率为80.33%,平均生存时间为(11.06±2.29)个月;高CONUT 评分组的1 年生存率低于低CONUT 评分组(HR2.656,95%CI1.211~5.824,P=0.015)。见图2、图3。

图2 不同AAPR水平的生存曲线

图3 不同CONUT评分的生存曲线
3 讨论
随着治疗技术的进步,手术以及术后的辅助化疗等方案治疗中晚期食管癌的疗效也在不断改善,然而其近期和远期预后的不良结局发生情况仍有待改善。异质性治疗等因素均可能导致食管癌患者获得较差的预后结局[10]。因此,预测食管癌患者预后并及时干预对于改善其预后结局具有重要意义。
AAPR 是一种新型血清标志物,其水平与肝癌、前列腺癌等恶性肿瘤的预后密切相关,可在一定程度上反映炎症反应、免疫力及营养状况[11-12]。CONUT评分则通过分析血清白蛋白水平、总淋巴细胞计数和血清胆固醇水平三项指标,综合评估患者营养状态,常被用于评估患者的营养状况和预后,特别是在癌症等疾病的辅助治疗中[13]。本研究结果显示,预后不良组的AAPR 小于预后良好组,CONUT 评分大于预后良好组(P<0.05);AAPR、CONUT 评分及两者联合预测食管癌根治术后辅助化疗患者预后结局的AUC 分别为0.781、0.807、0.892;高AAPR 组的不良反应发生率均低于低AAPR 组,1 年生存率高于低AAPR 组(P<0.05);高CONUT 评分组的不良反应发生率均高于低CONUT 评分组,1 年生存率低于低CONUT 评分组(P<0.05)。这说明AAPR、CONUT 评分能够良好预测食管癌根治术后辅助化疗患者的预后结局,并且AAPR 越高、CONUT 评分低的患者,其生存时间更长、不良反应风险更低。究其原因认为,AAPR 和CONUT 评分都是反映患者营养状况的指标。良好的营养状况有助于维持免疫系统的正常功能。较高的AAPR 可能反映了较高的白蛋白水平和较低的炎症反应,这可能有助于保持免疫系统的稳定和正常功能。较低的CONUT 评分可能代表较好的营养状态和较少的炎症反应,从而有利于预后[14]。此外,也有研究认为,良好的营养状况对肿瘤生长和治疗反应也有重要影响[15]。较好的营养状况可能提供足够的能量和营养物质,有助于维持正常细胞功能和组织修复,从而增强对肿瘤的抵抗力和对治疗的反应性。相反,较差的营养状况可能导致机体的代谢紊乱和免疫力下降,使得患者更容易出现治疗不良反应,获得较差的预后结局。
综上所述,术前AAPR、CONUT 评分对食管癌根治术后辅助化疗患者的预后结局存在显著影响,AAPR 越高、CONUT 评分低的患者,其生存时间更长、不良反应风险更低。且术前AAPR 联合CONUT 评分可良好预测食管癌患者治疗后的预后结局。可为临床中食管癌患者预后的评估提供参考。
