子宫内膜癌患者组织内PGK1、VEGF-C表达与病理特征和预后的关系
2024-05-14王昆,陈强
王 昆,陈 强
陕西省榆林市第一医院:1.病理科;2.手足显微外科,陕西榆林 719000
子宫内膜癌是一种常见的发生于子宫内膜上皮的女性生殖器官恶性肿瘤,近年来随着肥胖、多囊卵巢综合征的增多,子宫内膜癌的发病率和病死率也不断升高[1-2]。苏立贞等[3]研究发现,免疫细胞、炎症因子、血管新生、原癌基因激活等与肿瘤的发生和发展密切相关。有研究表明,子宫内膜癌发病机制复杂,环境、遗传等因素均与其发病相关[4-5],磷酸甘油酸酯激酶1(PGK1)在糖酵解过程中具有重要作用,可调控磷酸激酶的激活程度,影响癌细胞进展,在乳腺癌、肝癌、胃癌等中其表达会增加[6];血管内皮生长因子-C(VEGF-C)参与肿瘤组织的血管和淋巴管新生过程,也与肿瘤的淋巴结转移有一定关系[7]。有研究发现,PGK1、VEGF-C参与子宫内膜癌的病理过程[8-9]。通过监测相关因子的表达情况可能发现该病发生的分子机制,对于患者针对性治疗方案的制订及预后的改善具有重要意义。本研究通过观察子宫内膜癌患者癌组织及癌旁组织中PGK1、VEGF-C的表达及其与患者病理特征的关系,探讨PGK1、VEGF-C在子宫内膜癌中的发病机制,以期为子宫内膜癌的早期诊治提供新思路。现报道如下。
1 资料与方法
1.1一般资料 回顾性选取2017年5月至2020年5月榆林市第一医院收治的106例子宫内膜癌患者作为研究对象,所有患者均经组织病理检查确诊,每例标本中均含有癌组织和癌旁组织。本研究通过榆林市第一医院医学伦理委员会批准(2020-17号),所有研究对象均签署知情同意书。纳入标准:(1)子宫内膜癌符合第4版《子宫内膜癌诊断与治疗指南》[10]中相关诊断标准;(2)经术后病理学检查确诊为子宫内膜癌;(3)年龄≥18岁;(4)首次确诊;(5)临床资料完整。排除标准:(1)妊娠期或哺乳期女性;(2)生殖系统先天畸形;(3)术前有放化疗史;(4)伴其他恶性肿瘤;(5)生殖道盆腔感染;(6)脏器功能严重障碍;(7)合并内分泌疾病;(8)存活时间≤3个月。
1.2方法 (1)比较子宫内膜癌患者癌组织与癌旁组织PGK1、VEGF-C表达。采用免疫组织化学染色法检测子宫内膜癌患者癌组织与癌旁组织内PGK1、VEGF-C表达,癌旁组织取距离癌组织5 cm以上的正常子宫内膜组织。PGK1、VEGF-C主要分布于细胞质中,依据染色强度与阳性细胞占比评分之积对PGK1、VEGF-C进行判定。染色强度评分0分(无色)、1分(浅黄色)、2分(黄色)、3分(棕色);阳性细胞占比评分:0分(<5%)、1分(5%~<25%)、2分(25%~<50%)、3分(50%~<75%)、4分(≥75%);PGK1乘积:>5分为高表达,≤5分为低表达;VEGF-C乘积:>2分为阳性,≤2分为阴性。(2)分析子宫内膜癌患者癌组织PGK1、VEGF-C表达与病理特征间的关系。收集患者的年龄、肿瘤最大径、病理类型、分化程度、国际妇产科联盟(FIGO)分期、肌层浸润深度、淋巴转移状态等临床资料,比较不同病理特征子宫内膜癌患者癌组织内PGK1、VEGF-C表达。(3)比较子宫内膜癌组织内不同PGK1、VEGF-C表达患者的预后情况。院外随访3年,采用电话或门诊的形式观察PGK1高表达、PGK1低表达、VEGF-C阳性、VEGF-C阴性患者的3年生存情况。
1.3统计学处理 采用SPSS22.0统计软件处理数据。计数资料以例数或百分率表示,组间比较采用χ2检验。采用GraphPadPrism8.0软件进行Kaplan-Meier生存曲线分析和Log-Rank检验,分析不同PGK1、VEGF-C表达患者的预后情况。以P<0.05为差异有统计学意义。
2 结 果
2.1子宫内膜癌患者癌组织与癌旁组织PGK1、VEGF-C表达比较 子宫内膜癌患者癌组织中PGK1高表达、VEGF-C阳性患者比例显著高于癌旁组织,差异均有统计学意义(P<0.05)。见表1。

表1 子宫内膜癌患者癌组织与癌旁组织PGK1、VEGF-C表达比较[n(%)]
2.2子宫内膜癌患者癌组织内PGK1、VEGF-C表达与临床特征的关系 PGK1高表达患者低分化、FIGO分期为Ⅲ~Ⅳ期及有淋巴结转移比例显著高于PGK1低表达患者,差异均有统计学意义(P<0.05),VEGF-C阳性患者FIGO分期Ⅲ~Ⅳ期和有淋巴结转移比例显著高于VEGF-C阴性患者(P<0.05)。见表2。

表2 子宫内膜癌患者癌组织内PGK1、VEGF-C表达与临床特征间的关系[n(%)]
2.3子宫内膜癌组织内不同PGK1、VEGF-C表达与患者预后的关系 对106例子宫内膜癌患者进行3年随访,3年生存率为79.25 %(84/106);子宫内膜癌组织PGK1高表达患者3年生存率为67.44 %(29/43),子宫内膜癌组织PGK1低表达患者3年生存率为87.30%(55/63),Kaplan-Meier生存曲线分析结果显示,PGK1高表达患者3年生存率显著低于PGK1低表达患者(Log-Rankχ2=7.513,P<0.01);子宫内膜癌组织VEGF-C阳性患者3年生存率为75.00%(60/80),子宫内膜癌组织VEGF-C阴性患者3年生存率为92.31%(24/26),Kaplan-Meier生存曲线分析结果显示,VEGF-C阳性患者3年生存率显著低于VEGF-C阴性患者(Log-Rankχ2=6.527,P<0.01)。见图1。
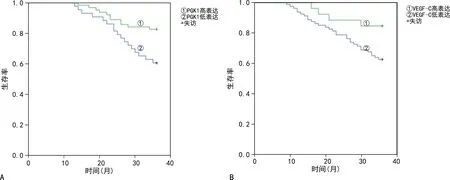
注:A 为不同PGK1表达患者的3年生存曲线;B为不同VEGF-C表达患者的3年生存曲线。
3 讨 论
本研究结果显示,子宫内膜癌患者癌组织中PGK1高表达、VEGF-C阳性患者比例显著高于癌旁组织(P<0.05),提示PGK1高表达及VEGF-C阳性表达对子宫内膜癌的发生具有重要作用。PGK1是糖酵解过程中重要的三磷酸腺苷合成酶,有催化1,3-二磷酸甘油酸向3-磷酸甘油酸转变的作用[11]。肿瘤组织血管大量扩张的同时伴随有组织缺氧现象,会抑制线粒体丙酮酸氧化磷酸化过程,乳酸增加,可通过PGK1反映丙酮酸生成的乳酸水平,PGK1高表达也意味着肿瘤组织的生成与增殖。VEGF-C属于VEGF家族成员,也是淋巴管生成因子,VEGF-C与血管内皮细胞生长因子受体2(VEGFR-2)结合可使酪氨酸激酶信号途径得到激活,并促进淋巴上皮细胞增殖和淋巴管生成[12];VEGF-C可通过影响肿瘤细胞生存与分化使化疗灵敏度下降,降低抗肿瘤治疗效果;也有相关研究指出,VEGF-C在食管癌、甲状腺癌等中均呈阳性表达,且能够促进肿瘤浸润、扩散和转移[13-14]。
有研究显示,分化程度、FIGO分期、淋巴转移状态与肿瘤患者病情进展及预后密切相关,低分化、FIGO分期Ⅲ~Ⅳ期及淋巴结转移患者的病情会更严重,预后也会更差[15]。本研究在观察PGK1、VEGF-C与子宫内膜癌患者病理特征的关系时发现,PGK1高表达患者低分化、FIGO分期Ⅲ~Ⅳ期、有淋巴结转移的患者比例显著高于PGK1低表达患者(P<0.05),而VEGF-C阳性患者FIGO分期Ⅲ~Ⅳ期、有淋巴结转移的患者比例显著高于VEGF-C阴性患者(P<0.05),提示PGK1、VEGF-C不仅与子宫内膜癌发病过程相关,且影响患者的疾病进展。分析原因主要为,PGK1对子宫内膜腺体细胞内磷酸化程度具有重要影响,有加剧癌细胞生物学特征恶化的作用,细胞质乳酸堆积是肿瘤发展的重要过程,肿瘤细胞的侵袭、转移与乳酸代谢水平息息相关,子宫内膜癌患者病情进展的过程中会不断产生大量的乳酸,PGK1表达会显著上升[16]。VEGF-C一方面可诱导肿瘤周边淋巴管的新生,另一方面可使原有淋巴管增生、扩张,并促使两者融合,扩大肿瘤细胞的接触面积,为其提供更多氧气和营养物质;VEGF-C还能提高血管及淋巴管通透性,调节淋巴内皮细胞黏附因子表达,增加肿瘤细胞侵袭和转移风险[17];VEGF-C与VEGFR-2、VEGFR-3具有相互作用,能够促进肿瘤细胞生长、增殖,抑制肿瘤细胞凋亡,提高肿瘤细胞的增殖活性及浸润性,使肿瘤进一步发展、恶化[18]。
另外,本研究Kaplan-Meier生存曲线分析结果显示,PGK1高表达患者3年生存率显著低于PGK1低表达患者(Log-Rankχ2=7.513,P<0.01);VEGF-C阳性患者3年生存率显著低于VEGF-C阴性患者(Log-Rankχ2=6.527,P<0.01),提示PGK1、VEGF-C表达与子宫内膜癌患者预后有关,PGK1高表达及VEGF-C阳性大概率预示患者预后不良,这可能是因为随着PGK1和VEGF-C的表达的增加,子宫内膜癌患者肿瘤恶性程度较高、病情加重、淋巴结转移风险升高,容易导致患者出现不良预后。由于样本量的限制,本研究也存在一定不足,后续研究还需扩大样本量、延长随访时间,进一步验证研究结果。
综上所述,子宫内膜癌患者组织内PGK1呈高表达,VEGF-C呈阳性表达,且PGK1、VEGF-C与病理特征、疾病进展及预后密切相关。