微小RNA-1246在结直肠癌患者血清中的表达水平及其临床意义
2024-05-14刘丽萍崔发财
刘丽萍,崔发财
1.河南省新密市中医院检验科,河南新密 452300;2.河南省人民医院检验科,河南郑州 453000
结直肠癌(CRC)是一种常见的消化道恶性肿瘤,国际癌症研究机构的数据显示2020年全球新发CRC病例数约为185万[1],新增病死病例数约为90万,其发病率和病死率已分别位列全球恶性肿瘤的第三位和第二位[2],严重影响患者的生命健康。局限性发病的CRC患者5年生存率可达90%以上[3],而TNM Ⅳ期CRC患者5年生存率仅为10%左右[4],转移和复发是导致CRC患者死亡的主要原因[5],因此筛选潜在的CRC生物标志物用于肿瘤的早期诊断和转移预警,对于改善患者预后和提高术后生存率至关重要。微小RNA(miRNA)是一类长度为20~22 nt的内源性非编码RNA,在生理条件下参与细胞分化、细胞间信号传导等多个细胞生物学过程[6]。有研究报道miRNA异常表达参与肿瘤的发生、发展过程[7],其中一些miRNA可稳定表达于肿瘤患者体液中被称为循环miRNA,它们具有肿瘤异质性、组织特异性、含量丰富和易于检测等优点[8],为临床CRC筛查提供了新的手段。miR-1246是一种新发现的miRNA,有研究发现其在乳腺癌[9]、多发性骨髓瘤[10]及宫颈癌[11]患者血清中表达水平升高,在肿瘤早期诊断和预后评估方面均发挥重要作用,miR-1246在CRC组织中高表达并与TNM分期和淋巴结转移相关[12],但其在CRC患者血清中的表达情况鲜见报道。本研究将分析miR-1246在CRC患者血清中的表达情况,分析其与患者临床病例特征的关系,并进一步评价其在CRC诊断方面的价值。现报道如下。
1 资料与方法
1.1一般资料 选取2017年1月至2020年12月在新密市中医院接受手术治疗的60例CRC患者作为CRC组,另选取同时期在本院住院治疗的60例结直肠腺瘤(CRA)患者作为CRA组和60例健康体检者作为健康对照组。纳入标准:(1)CRC经术后病理检查确诊,并符合《中国结直肠癌诊疗规范(2017版)主要更新概要》[13]中的相关诊断标准;(2)患者术前未接受放化疗及免疫治疗;(3)临床资料完整。排除标准:(1)合并炎症性肠病或克罗恩病或腺瘤性息肉病;(2)合并重要脏器器质性病变及功能不全;(3)患有其他类型恶性肿瘤疾病或癌前病变。CRC组男39例,女21例;平均年龄(51.3±8.8)岁;低分化腺癌19例,中、高分化腺癌41例;参考美国癌症联合委员会(AJCC)直肠癌TNM分期标准[14]: Ⅰ期6例,Ⅱ期22例,Ⅲ期16例,Ⅳ期16例;淋巴结转移33例,无淋巴结转移27例。CRA组男35例,女25例;平均年龄(48.7±6.5)岁。健康对照组男36例,女24例;平均年龄(47.2±9.3)岁。三组性别、年龄比较,差异均无统计学意义(P>0.05),具有可比性。所有研究对象均知晓本研究,并签署知情同意书;本研究经新密市中医院医学伦理委员会批准(编号:XMSZYY-20220201001)。
1.2仪器与试剂 用于检测miR-1246表达的RNA提取试剂盒、反转录试剂盒和高特异性染料法定量聚合酶链反应(qPCR)检测试剂盒均购自诺唯赞生物科技有限公司,miR-1246引物由上海生工生物工程公司合成,UV-3600紫外分光光度计购自日本岛津公司,ABI 7500实时荧光定量PCR仪购自美国ABI公司;用于检测癌胚抗原(CEA)、糖类抗原(CA)199水平的试剂盒及配套质控品,Abbott i2000电化学发光免疫分析仪均购自美国雅培公司。
1.3方法
1.3.1标本采集与处理 分别抽取3组研究对象清晨空腹静脉血于真空采血管(5 mL促凝管,13 mm×75 mm,三力医疗),室温静置30 min,离心(离心速度3 000 r/min、离心半径8 cm)5 min后,收集1.0~1.2 mL血清于1.5 mL无RNA酶EP管中,冻存于-80 ℃超低温冰箱中待测,标本避免反复冻融。
1.3.2血清miR-1246表达水平检测 采用TRIzol法提取血清总RNA,采用紫外分光光度法测定RNA的水平和纯度。将总RNA加入含反转录酶的反应体系中合成cDNA。制备qPCR扩增体系:正、反向引物各0.4 μL,cDNA 2 μL,2 ×SYBR Green qPCR预混合试剂10 μL,加双重去离子水补足至20 μL。反应条件:95 ℃预变性10 min,95 ℃变性15 s,61 ℃退火30 s,70 ℃ 延伸20 s,40个循环。采用2-ΔΔCt法计算血清中miR-1246相对表达水平。miR-1246正向序列:5′-ACACTCCAGCTGGGAATGGATTTTTGG-3′,反向序列:5′-CTCAACTGGTGTCGTGGA-3′; U6正向序列:5′-CTCGCTTCGGCAGCACA-3′,反向序列:5′-AACGCTTCACGAATTTGCGT-3′。
1.3.3血清CEA和CA199水平检测 采用电化学发光免疫分析法检测血清CEA和CA199水平,电化学发光免疫分析仪开机后首先进行室内质控测量,当CEA和CA199的质控数据在控后,按照试剂盒说明书检测血清CEA和CA199水平。
1.4统计学处理 采用SPSS21.0和Graphpad Prism7.0软件进行统计学分析和绘图。计量资料首先进行Kolmogorov-Smirnov(K-S)正态性检验,呈偏态分布的计量资料以M(P25,P75)表示,多组间比较采用采用Kruskal-WallisH检验,两组间比较采用Mann-WhitneyU检验。采用Spearman相关分析CRC患者血清miR-1246表达水平与血清CEA、CA199水平的相关性。绘制受试者工作特征(ROC)曲线评估血清miR-1246联合CEA、CA199诊断CRC的价值。以P<0.05为差异有统计学意义。
2 结 果
2.1三组研究对象血清miR-1246、CEA和CA199水平的比较 CRC组血清miR-1246表达水平显著高于CRA组和健康对照组(P<0.05),而CRA组和健康对照组血清miR-1246表达水平比较,差异无统计学意义(P>0.05);CRC组血清CEA、CA199水平显著高于CRA组和健康对照组(P<0.05),而CRA组和健康对照组血清CEA、CA199水平比较,差异均无统计学意义(P>0.05)。见表1。

表1 三组研究对象血清miR-1246、CEA和CA199水平的比较[M(P25,P75)]
2.2不同临床特征CRC患者中血清miR-1246、CEA和CA199水平比较 TNM分期Ⅲ~Ⅳ期、有淋巴结转移和有远处转移CRC患者的血清miR-1246表达水平显著高于TNM分期Ⅰ~Ⅱ期、无淋巴结转移和无远处转移CRC患者(P<0.05);TNM分期Ⅲ~Ⅳ期、低分化和有远处转移CRC患者的血清CEA浓度显著高于TNM分期Ⅰ~Ⅱ期、高中分化和无远处转移CRC患者(P<0.05);TNM分期Ⅲ~Ⅳ期、低分化、有淋巴结转移和有远处转移CRC患者的血清CA199浓度显著高于TNM分期Ⅰ~Ⅱ期、高中分化、无淋巴结转移和无远处转移CRC患者(P<0.05)。见表2。
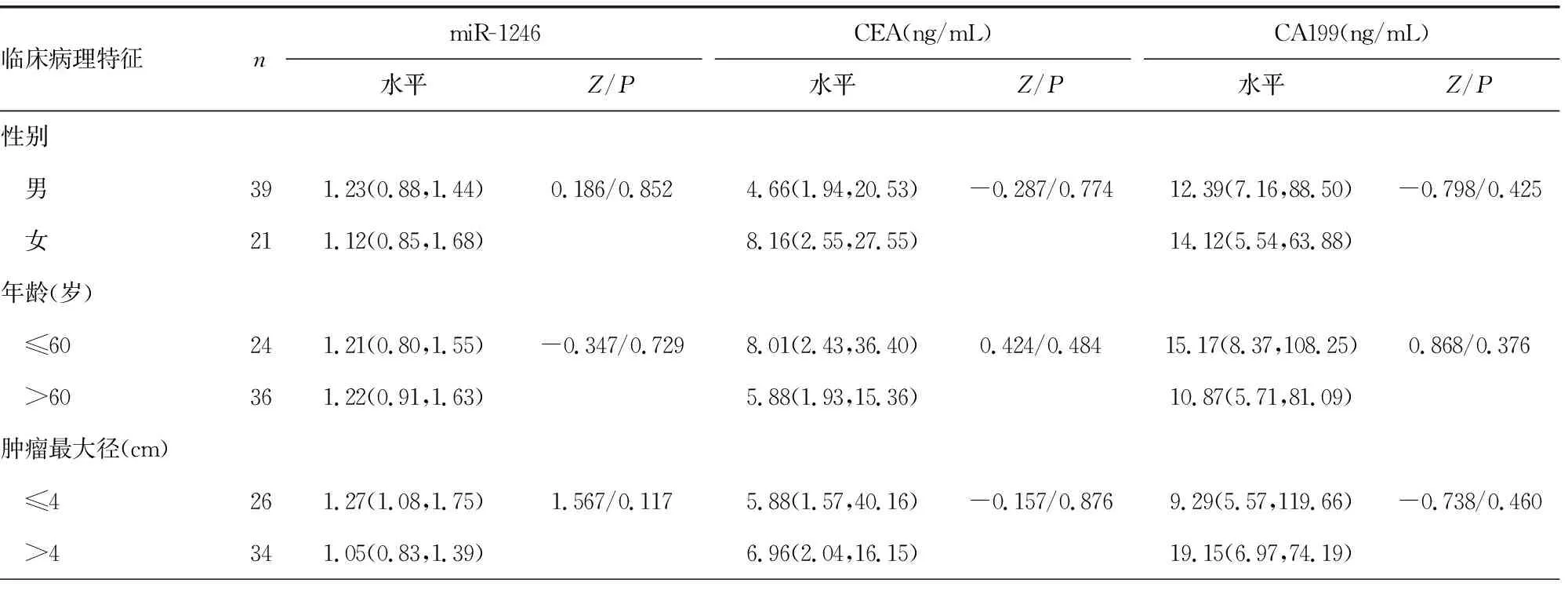
表2 不同临床病理特征CRC患者血清miR-1246、CEA、CA199水平比较[M(P25,P75)]
2.3血清miR-1246表达水平与血清CEA、CA199水平的相关性 Spearman相关性分析结果显示,CRC患者血清miR-1246表达水平与CEA、CA199水平均呈正相关(r=0.397,P=0.002;r=0.443,P<0.05)。见表3。
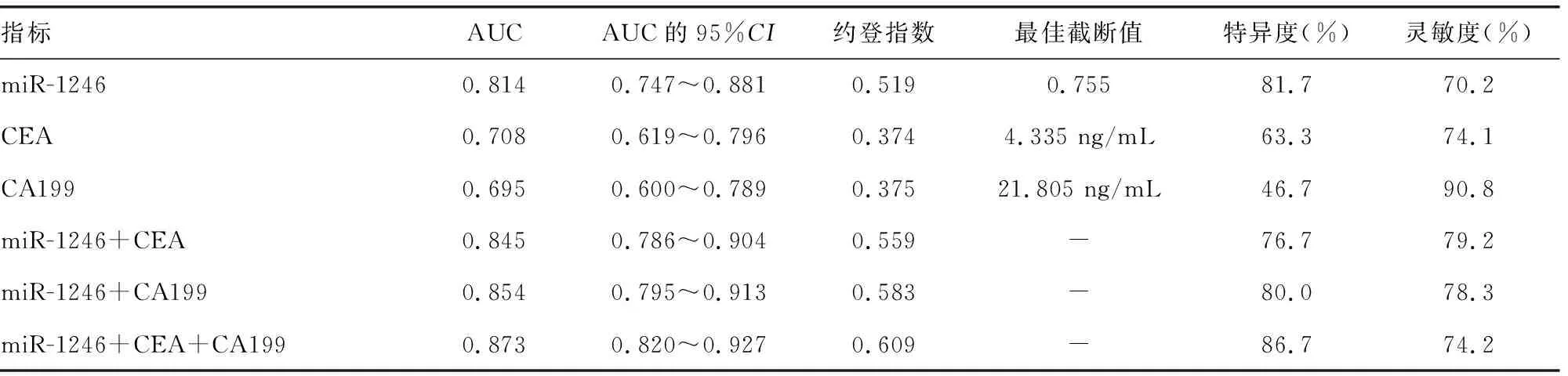
表3 血清miR-1246、CEA、CA199单项及联合检测对CRC的诊断价值分析
2.4血清miR-1246、CEA、CA199单项及联合检测对CRC的诊断价值 以CRA患者和健康对照组为阴性样本,CRC患者为阳性样本,绘制ROC曲线。结果显示,miR-1246单独诊断CRC的曲线下面积(AUC)为0.814(95%CI:0.747~0.881),显著高于CEA[0.708(95%CI:0.619~0.796)]和CA199[0.695(95%CI:0.600~0.789)]单独诊断的AUC(Z=2.004,P=0.045;Z=2.077,P=0.038);miR-1246联合CEA或CA199诊断CRC的AUC分别为0.845(95%CI:0.786~0.904)和0.854(95%CI:0.795~0.913),与miR-1246单独诊断CRC的AUC比较,差异均无统计学意义(Z=1.459,P=0.145;Z=1.725,P=0.095);miR-1246、CEA和CA199联合诊断CRC的AUC为0.873(95%CI:0.820~0.927),显著高于miR-1246单独诊断的AUC(Z=2.169,P=0.030)。见图1、表3。
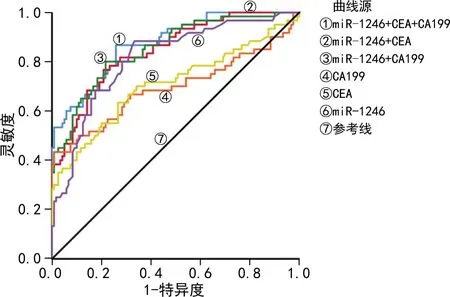
图1 血清miR-1290、CEA、CA199单项及联合检测诊断CRC的ROC曲线
3 讨 论
CRC早期发病隐匿,多数患者出现明显临床症状才选择就诊,此时癌细胞已发生周围组织浸润和远距离器官转移,临床治疗难度大,CRC患者预后生存率差。血清CEA和CA199是临床常用肿瘤标志物,在CRC的诊断和疗效检测方面发挥一定作用[15],但由于它们缺乏较高的灵敏度和特异度[16],常常造成部分患者漏诊或误诊,临床应用价值受到限制。
循环miRNA是肿瘤诊断标志物的热门研究领域,它们具有肿瘤异质性、可复制和易于检测的优点,目前已发现多个miRNA在CRC患者血清中表达水平升高,与肿瘤的临床病理特征及预后密切相关,可能是潜在的CRC生物标志物。BADER等[17]发现,miR-223在CRC患者组织和血清中的表达具有相关性,均异常高表达,血清miR-223可作为评估CRC患者预后的特异性指标。ABO-ELELA等[18]的研究表明,CRC患者血清中miR-574-3p和miR-27a表达升高,它们在不同分期、不同分级及不同肿瘤大小患者中的表达存在显著差异,且miR-574-3p和miR-27a联合检测诊断CRC的灵敏度均优于CEA和CA199单独检测。
CHUMA等[19]研究发现,miR-1246是一种新报道的miRNA,其在肝癌患者血清中高表达,并与淋巴结转移、肿瘤分化和门静脉侵袭呈正相关,血清miR-1246表达是预测肝癌患者预后的独立影响因素; miR-1246在乳腺癌患者血清中高表达并与分期相关,其鉴别乳腺癌患者和健康志愿者的灵敏度和特异度均达到90%。本研究结果发现,血清miR-1246在CRC组患者血清中的表达水平显著高于CRA组和健康对照组,提示miR-1246检测可用于肠道恶性疾病的诊断,ROC曲线分析进一步显示,血清miR-1246单独诊断CRC的AUC为0.814(95%CI:0.747~0.881),显著高于传统肿瘤标志物CEA[0.708(95%CI:0.619~0.796)]和CA199[0.695(95%CI:0.600~0.789)],其性能评价处于良好区间,诊断灵敏度和特异度分别为70.2%和81.7%,对于CRC诊断具有一定价值。近年来,基于CEA和CA199的多指标联合检测越来越受到研究者关注,它可以弥补单指标检测特异度或灵敏度低的缺点,可有效提高CRC患者检出率[21]。本研究结果表明,miR-1246与CEA或CA199组成的双指标联合检测未能显著提高miR-1246对CRC的诊断效能,而miR-1246、CEA、CA199 3项联合检测诊断CRC的AUC为0.873(95%CI:0.820~0.927),诊断的灵敏度和特异度也均高于miR-1246单独检测,提示miR-1246联合多种传统肿瘤标志物检测诊断CRC有更高的准确性。本研究通过分析不同临床病理特征的CRC患者血清miR-1246表达水平发现,TNM分期Ⅲ~Ⅳ期、有淋巴结转移和有远处转移的患者血清miR-1246表达水平显著高于TNM分期Ⅰ~Ⅱ期、无淋巴结转移和无远处转移的患者(P<0.05),提示血清miR-1246可用于评估CRC恶性程度及预测肿瘤复发与转移。
综上所述,miR-1246在CRC患者血清中的表达水平明显升高,并与患者TNM分期、淋巴结转移、远处转移有关,miR-1246对CRC的诊断效能优于CEA、CA199,而miR-1246、CEA、CA199 3项联合检测可进一步提高对CRC的诊断效能。然而,本次研究纳入的样本量有限,所得结论有待大样本、长期随访及多中心研究证实。