利多卡因通过抑制NETs改善阿霉素引起的心脏毒性
2024-05-14刘文涛何学明
陈 铃,孟 文,朱 霞,刘文涛,何学明
1.蚌埠医科大学附属连云港市东方医院老年医学科,江苏连云港 222042;2.江苏省连云港市东方医院转化医学中心实验室,江苏连云港 222042;3.南京医科大学药理学实验室,江苏南京 211100;4.江苏省连云港市东方医院转化医学中心,江苏连云港 222042
癌症一直是困扰人们的一大难题,其中由化疗药物引起的心脏毒性是癌症患者死亡的重要原因之一,病死率仅次于复发性恶性肿瘤[1]。所有化疗药物包括靶向药物都有潜在的心脏毒性,表现为亚临床左室功能障碍、充血性心力衰竭、心肌缺血甚至心脏猝死等。在众多化疗药物中,蒽环类是目前应用最广泛的一类化疗药物,其代表性药物阿霉素的抗癌作用强,化疗指数高,临床上用于治疗各种实体瘤及血液系统肿瘤,但因其心脏毒性严重限制了临床应用[2]。因此,寻找阿霉素化疗性心脏病新的治疗方案极其迫切。
中性粒细胞胞外诱捕网(NETs)是中性粒细胞的一种不同于凋亡和坏死的新型死亡方式,也是一种新型的防御模式。NETs是从中性粒细胞排出的网状复合物,由游离脱氧核糖核酸 (DNA)、组蛋白和中性粒细胞颗粒蛋白组成。中性粒细胞通过排出嵌入瓜氨酸组蛋白3(CitH3)、髓过氧化物酶DNA(MPO-DNA)和其他细胞内分子的细胞外染色质来产生NETs。NETs成分通常起抗菌作用,但过量的NETs是有害的,并可能导致炎症和组织损伤[3]。NETs大量分泌,引起游离DNA(cf-DNA)和中性粒细胞弹性蛋白酶(NE)同时释放,细胞cf-DNA 和组蛋白促进促炎性细胞因子释放,导致严重的全身炎症反应[4]。利多卡因属于细胞钠通道抑制剂,可用于局部麻醉及抗快速性心律失常。有研究发现利多卡因还具有抗肿瘤的作用[5]。临床研究发现采用利多卡因麻醉的患者血液中NETs水平降低,提示利多卡因可能具有降低NETs生成的功能[6]。因此提出假说“利多卡因可能通过抑制NETs缓解阿霉素引起的心脏毒性”。本研究旨在探究利多卡因对阿霉素诱导的心脏毒性的保护作用机制,为临床有效预防化疗性心脏病提供新的思路。现报道如下。
1 材料与方法
1.1实验动物 30只SPF级 C57BL/6小鼠购于河南斯克贝斯生物有限科技股份有限公司,体质量16~20 g,6周龄,雌性,小鼠可以自由获取食物和水,环境温度21~25 ℃,相对适度50%~60%,每笼5~6只,笼子底部有柔软的垫层。实验中小鼠饲养及取材均符合相关规定。
1.2主要试剂和仪器 盐酸多柔比星(GLPBio,GC16994)、利多卡因粉剂(GLPBio,GC17608);重组Anti-Histone H3抗体 [RM1001](Abcam,ab281584);髓过氧化物酶(MPO)抗体(武汉三鹰,81610-1-RR);Synergy2多功能酶标仪(美国BioTek公司);Centrifuge5810R多功能大容量高速离心机(美国Eppendorf公司);低速自动平衡离心机(美国Eppendorf公司);CitH3酶联免疫吸附试验(ELISA)试剂盒(MM-13757H1)、MPO-DNA 复合物ELISA试剂盒(MM-2467H1)。
1.3方法
1.3.1小鼠心脏毒性模型的建立与分组 30只小鼠随机分为对照组、阿霉素组(DOX组)和利多卡因+阿霉素组(LIDO+DOX组),每组10只。对照组:给予小鼠腹腔注射生理盐水1 mL/100g;DOX组:予以20 mg/kg单次腹腔注射阿霉素制备急性心脏毒性模型,阿霉素给药剂量参考文献[7];LIDO+DOX组:予以小鼠尾静脉注射利多卡因6 mg/kg,间隔30 min后腹腔注射阿霉素20 mg/kg。然后每24 h尾静脉注射一次利多卡因,连续注射10 d。在第10天,用10%水合氯醛麻醉麻醉处死各组小鼠,手术剥离小鼠心脏组织,用福尔马林固定液保存。眼眶取血留存待测。
1.3.2临床标本收集与处理 收集连云港市东方医院10例未接受过阿霉素类化疗药物患者(未接受组)和10例接受过阿霉素类化疗药物患者(接受组)的外周血标本,将外周血标本离心(1 000 r/min,15 min),分离血清,置于-80 ℃条件下保存,用于后续研究。
1.3.3cfDNA、CitH3、MPO-DNA的检测 采集各组小鼠血浆标本,置于有肝素抗凝剂的试管内,3 000 r/min离心5 min,分离血浆,置于-80 ℃条件下保存待测;使用ELISA检测血浆中cf-DNA、CitH3、MPO-DNA水平。所有程序均严格按照ELISA试剂盒说明书进行操作,显色后在酶标仪450 nm 波长下测定吸光度,通过标准曲线计算样品MPO-DNA、CitH3、cf-DNA水平。使用人专用ELISA试剂盒检测患者血清MPO-DNA、CitH3、cf-DNA水平。
1.3.4免疫荧光(IF)检测各组小鼠心脏组织中NETs相关标志物中MPO、CitH3的表达量 脱蜡水化后将小鼠心脏组织切片浸入柠檬酸-磷酸氢二钠缓冲液中行抗原修复。3%H2O2溶液中浸泡15 min后,PBS冲洗3次,每次5 min。加入一抗4 ℃孵育过夜。加入二抗,放入湿盒中,37 ℃放置20 min,PBS冲洗。二氨基联苯胺(DAB)工作液显色,苏木精-伊红复染,然后进行1%盐酸分化、脱水、透明、中性树脂封片。脒基苯基吲哚(DAPI)染色细胞核用奥林巴斯显微镜进行观察。
1.3.5各组小鼠心肌细胞损伤评估 通过全自动分析仪检测各组小鼠血清中磷酸肌酸激酶(CK)、磷酸肌酸激酶同工酶(CK-MB)水平。

2 结 果
2.1未接受组和接受组患者血清cf-DNA、MPO-DNA、CitH3的水平比较 接受组患者血清中cf-DNA、MPO-DNA和CitH3水平均明显高于未接受组,差异均有统计学意义(P<0.05)。见表1。
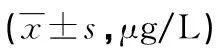
表1 未接受组和接受组患者血清cf-DNA、MPO-DNA、CitH3水平比较
2.2各组小鼠血清CK、CK-MB水平比较 DOX组小鼠血清CK、CK-MB水平明显高于对照组和LIDO+DOX组小鼠(P<0.05)。见表2。
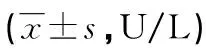
表2 各组小鼠血清CK、CK-MB水平比较
2.3各组小鼠血浆cf-DNA、MPO-DNA、CitH3水平比较 DOX组与LIDO+DOX组小鼠血浆MPO-DNA、CitH3和cf-DNA水平明显高于对照组(P<0.05),但LIDO+DOX组小鼠血浆MPO-DNA、CitH3和cf-DNA水平明显低于DOX组(P<0.05)。见表3。
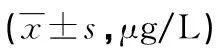
表3 各组小鼠血浆cf-DNA、MPO-DNA、CitH3水平比较
2.4各组小鼠心肌组织中MPO、CitH3表达量比较 DOX组小鼠心肌组织中MPO和CitH3表达量明显高于对照组和LIDO+DOX组小鼠(P<0.05)。见表4。

表4 各组小鼠心肌组织中MPO、CitH3表达量比较
3 讨 论
阿霉素的化疗虽是癌症治疗的基石,但其临床应用和治疗价值却受到严重心脏毒性的阻碍,其结果甚至导致左心室功能障碍和充血性心力衰竭[8]。阿霉素引起的心脏毒性特别是急性心脏毒性引起的各种心律失常,包括室速、室颤、室缓等,均是癌症患者猝死的主要临床表现。但在如今的大部分癌症化疗中,用于治疗乳腺癌、肉瘤、肺癌、膀胱癌等其他各种癌症时,阿霉素都有一定疗效。其主要机制为药物本身抑制DNA合成的毒性作用、氧自由基(ROS)导致心肌细胞膜脂质过氧化和心肌细胞线粒体DNA的损伤作用及心脏转录因子的失调[9],这也是引起细胞衰老的主要机制。有研究表明细胞衰老在介导化疗性心脏病方面起着核心作用[10],明确细胞衰老机制会打开化疗性心脏病新型预防方法的大门。
BINET等[11]发现中性粒细胞会生成一种特殊的形态NETs,NETs不仅可以介导缺氧、无菌性炎症和氧化应激等多种损伤,而且与衰老的病理性血管密切相关。NETs在中性粒细胞受到强烈刺激后,被主动快速释放到细胞外来包裹及杀伤外来入侵的病原体。虽然具有消除病原体作用,但NETs对宿主组织的损伤也是不能忽略的:通过促进自身免疫的发展并导致其他功能失调,包括细胞转移、血栓形成和不适当凝血[12]。尤其是血栓和不适当凝血造成的缺血缺氧,最终引起大量ROS和炎症因子的产生,又会进一步加剧NETs的形成,这一种恶性循环的病理过程在新型冠状病毒感染、肿瘤、糖尿病、关节炎等多种疾病中发挥着至关重要的作用。在新型冠状病毒感染中,血管内NETs的释放可能引发微血栓形成,其中cf-DNA水平的升高与MPO和中性粒细胞弹性蛋白酶的其他特异性标志物有关[13]。在心血管疾病中,已经明确NETs促进动脉粥样硬化、心肌梗死及缺血再灌注损伤的发生、发展[14]。本研究中,通过收集未接受DOX化疗和接受过阿奇霉素化疗患者的血清并检测NETs相关标志物MPO-DNA、CitH3和cf-DNA的水平,发现接受阿奇霉素化疗后的患者血清中MPO-DNA、CitH3和cf-DNA水平明显升高。在此之前,TODOROVA等[15]研究发现,发生阿霉素诱导心脏毒性的乳腺癌患者血中Nets水平升高。而后笔者检测到阿奇霉素建模小鼠血浆NETs水平的升高同样验证了这个观点。
本研究检测了利多卡因预处理后使用DOX干预的小鼠血清中CK及CK-MB的水平,与DOX组比较,利多卡因预处理后的小鼠心肌损伤明显减轻。LI等[16]研究提出白细胞介素-37通过抑制中性粒细胞细胞外陷阱的形成来减轻柯萨奇病毒B3诱导的心肌损伤;REN等[17]在临床试验中发现在围术期用利多卡因和右美托咪定静脉输注可降低肺癌患者NETs和肿瘤转移生物标志物的血清水平。这与本研究在利多卡因预处理后加入DOX相比仅用阿奇霉素处理后的小鼠心脏组织中的MPO-DNA、CitH3和cf-DNA表达量降低相一致。进一步支持了利多卡因抑制NETs生成可缓解心肌损伤的结论。
本课题组前期实验发现利多卡因可通过激活AMPK-SOCS3信号通路,通过抑制组织因子和改善循环而缓解急性肺损伤[18]。有报道提出利多卡因通过AMPK-SOCS3抑制神经炎症从而缓解吗啡耐受[19];利多卡因与腺苷配合能增加失血性休克的存活率,其中p-AMPK的水平增加[20]。利多卡因又可以通过激活AMPK增加SOCS3的表达,最终抑制ASK1、组织因子和基质金属蛋白酶2/9(MMP-2/9)表达,达到缓解脓毒症引起的急性肺损伤的目的[18]。刘海波等[21]还发现利多卡因预处理可以明显改善心肌损伤小鼠死亡率。但是利多卡因如何通过调控AMPK-SOCS3信号通路来影响NETs,其具体机制仍不明确。本研究已初步证实了利多卡因对阿霉素引起的心脏毒性具有缓解作用,为化疗患者的心脏保护用药提供了新思路,具有重要的临床意义。
综上所述,本研究推测NETs的表达影响阿霉素心脏毒性,并且证实利多卡因可以通过抑制NETs的表达显著降低小鼠心脏毒性。利多卡因影响NETs生成的具体机制有待进一步深入研究。