徐州地区0~3岁婴幼儿牛奶蛋白过敏的临床特征及影响因素分析
2024-05-14杨歆蕾沈栋林
杨歆蕾,沈栋林
1.徐州医科大学第一临床学院,江苏徐州 221000;2.徐州医科大学附属医院儿科,江苏徐州 221000
牛奶蛋白过敏(CMPA)是婴幼儿常见异常免疫反应,流行病学统计显示CMPA全球发病率为2.0%~3.0%[1],国内开展的一项多中心调查显示我国足月儿和早产儿CMPA发病率分别为2.67%和3.03%[2]。婴幼儿CMPA不仅会导致呕吐、腹泻和腹痛等消化道症状,还可能累及皮肤、呼吸道或心血管等全身其他器官系统,并对患儿发育造成不利影响[3]。有文献报道CMPA按发病机制可分为免疫球蛋白 E(IgE)介导、非IgE介导和混合介导,3种机制引发的CMPA不仅临床表现存在明显不同,临床干预策略也存在差异[4]。本研究以徐州地区4 983例0~3岁婴幼儿作为研究对象,探讨CMPA的临床特征,为提升CMPA诊断和治疗水平提供参考,现将结果报道如下。
1 资料与方法
1.1一般资料 通过社区卫生服务中心收集2019年10月至2022年10月徐州地区0~3岁婴幼儿的相关资料。纳入标准:(1)年龄为0~3岁,(2)临床资料完整。排除标准:(1)合并免疫功能缺陷;(2)合并严重皮肤病;(3)合并代谢性疾病;(4)合并消化道畸形;(5)合并血液系统疾病;(6)合并其他牛奶蛋白激发试验相关禁忌证。本研究婴幼儿家属均知晓本研究详细内容并自愿签署知情同意书。本研究获得徐州医科大学附属医院医学伦理委员会审批(伦理批号:2019-20-12)。
1.2方法
1.2.1问卷调查 参照《中国婴幼儿牛奶蛋白过敏诊治循证建议》[5]制订CMPA临床调查问卷,并于本研究婴幼儿入组时指导其父母填写。按徐州10个行政区分别发放问卷(云龙区、鼓楼区、贾汪区、泉山区、铜山区、邳州市、新沂市、睢宁县、沛县、丰县)。问卷调查均在各行政区的社区卫生服务中心帮助下完成,查询该社区登记有0~3岁婴幼儿的家庭,通过上门调查的方式发放问卷,其中2019年10月至2020年12月各行政区分别发放200份问卷,2021年1—12月各行政区分别发放150份问卷,2022年1—10月行政区分别发放150份问卷,每个行政区共发放问卷500份,合计发放5 000份。
问卷内容包括年龄、性别、孕周、分娩方式、是否早产、喂养方式、辅食添加情况及父母过敏史等信息,完成后由儿科医师进行评分并进一步询问婴幼儿临床表现。同时开展体格检查。结合病史、临床表现和体格检查结果确定疑似CMPA病例,所有数据均由儿科医师独立录入,并由2位副主任及以上的儿科专家统一进行审核。
1.2.2实验室检查 采集疑似CMPA患儿肘静脉血3 mL,采用BS-2000M/BS-800M全自动生化仪(深圳迈瑞公司)分别检测血红蛋白(Hb)和清蛋白(ALB)水平,试剂盒均购自上海碧云天公司,操作步骤均严格遵照说明书要求完成。采用BH-5100 T型原子吸收光谱仪(北京博晖公司)检测Ca、Fe和Zn等微量元素水平。采用Cobas e601E-E型全自动电化学发光免疫分析仪(瑞士Roche公司)检测血清25-羟基维生素D3[25(OH)D3]水平,试剂盒购自上海泽叶生物技术公司,操作步骤严格遵照说明书要求完成。采用CAP250过敏原检测系统(瑞典Pharmacia公司)检测总IgE、牛奶蛋白特异性IgE(sIgE)水平及嗜酸性粒细胞(EOS)计数。各指标婴幼儿正常值参考范围为:Ca为2.25~2.75 mmol/L;Fe为7.52~11.80 mmol/L;Zn为38.38~80.06 μmol/L;25(OH)D3为20~50 ng/L;总IgE为0~100 kU/L;牛奶蛋白sIgE为0~0.35 kU/L;EOS计数为(0~5)×109/L。
1.2.3牛奶蛋白回避/激发试验 嘱疑似CMPA患儿饮食中回避牛奶蛋白及其制品2~4周,若症状改善或消失,提示可能为CMPA。做好急救准备准备工作后进行开放激发试验,先将1滴牛奶滴于患儿嘴唇,然后每隔20~30 min按0.5、1.0、3.0、10.0、30.0、50.0、100.0、200.0 mL逐次增量,院内观察患儿症状2 h,诱发出过敏反应即可确诊为CMPA,若未见异常症状则嘱家属离院后继续观察患儿2周,并详细记录症状,判断是否为迟发型CMPA。
1.2.4皮肤点刺试验 将新鲜牛奶或牛奶抗原提取物于疑似CMPA患儿左前臂进行点刺,并以生理盐水作为阴性对照,观察15 min后阳性组皮肤丘疹直径≥3 mm,阴性组丘疹直径<3 mm,且两者差值>3 mm,提示CMPA阳性,否则可排除IgE介导CMPA。
1.2.5判断标准 (1)CMPA严重程度。根据《中国婴幼儿牛奶蛋白过敏诊治循证建议》[5]评估CMPA严重程度。满足以下一项及以上症状为轻度:①呕吐或反流、腹泻或便秘;②皮肤出现湿疹、红斑或风团;③咳嗽、流涕。满足以下一项及以上症状者为中度:①便血;②血管性水肿;③喘息;④肠痉挛持续时间≥3周,每周≥3次,每次≥3 h。满足以下一项及以上症状者为重度:①长期胃肠道不适引起的生长障碍、缺铁性贫血或低白蛋白血症,或内镜发现结肠溃疡性病变;②严重渗出性湿疹;③喉头水肿或支气管阻塞导致呼吸困难;④病变累及2个及以上器官系统,或发生过敏性休克。(2)CMPA分型。根据皮肤点刺试验和IgE检测结果进行分型,以皮肤点刺试验阳性或牛奶蛋白sIgE>0.35 kU/L为IgE介导型,反之为非IgE介导型[6]。(3)早产。妊娠28~37周分娩为早产。(4)喂养方式。婴幼儿出生6个月内仅喂养母乳,不添加任何其他食物为纯母乳喂养;完全以牛奶、羊奶或代乳品喂养者为人工喂养;二者均有为混合喂养。(5)营养不良。根据《中国0~18岁儿童、青少年身高、体重的标准化生长曲线》[7]计算Z评分,满足以下任意一项即为营养不良;年龄别身高的Z评分<—2、年龄别体质量的Z评分<—2,或(和)身高别体质量的Z评分<—2为生长迟缓、低体质量和消瘦。

2 结 果
2.1徐州地区0~3岁婴幼儿CMPA患儿临床特征 回收问卷5 000份,排除填写不完整或存在明显错误的问卷后剩余4 983份,问卷有效率为99.66%,共收集4 983例0~3岁婴幼儿资料。4 983例婴幼儿中共检出CMPA患儿124例,发病率为2.49%。不同年龄婴幼儿的CMPA发病率比较,差异有统计学意义(χ2=10.065,P=0.002),且1~2岁和>2岁婴幼儿的CMPA发病率均低于<1岁的婴幼儿(χ2=5.258,P=0.022;χ2=8.055,P=0.005)。早产儿及父母有过敏史的婴幼儿CMPA发病率显著高于非早产儿及父母无过敏史者,差异均有统计学意义(χ2=6.881,P=0.009;χ2=9.753,P=0.002)。见表1。

表1 徐州地区4 983例0~3岁婴幼儿CMPA的临床特征[n(%)]
2.2CMPA患儿分型及严重程度 皮肤点刺试验和IgE检测结果显示,124例CMPA患儿中IgE介导型26例(20.97%),非IgE介导型98例(79.03%);严重程度分别为轻度63例(50.81%),中度39例(31.45%),重度22例(17.74%)。
2.3IgE介导型和非IgE介导型CMPA患儿临床症状比较 IgE介导型呕吐/胃食管反流的比例显著低于非IgE介导型(χ2=11.668,P=0.001),而发生湿疹/风团/红斑、流涕/咳嗽/喘息、口周红肿和累及2个及以上系统的比例均显著高于非IgE介导型(χ2=32.975,P<0.001;χ2=10.000,P=0.002;χ2=17.293,P<0.001;χ2=4.908,P=0.027);但IgE介导型与非IgE介导型CMPA患儿病情严重程度比较,差异无统计学意义(P>0.05)。见表2。
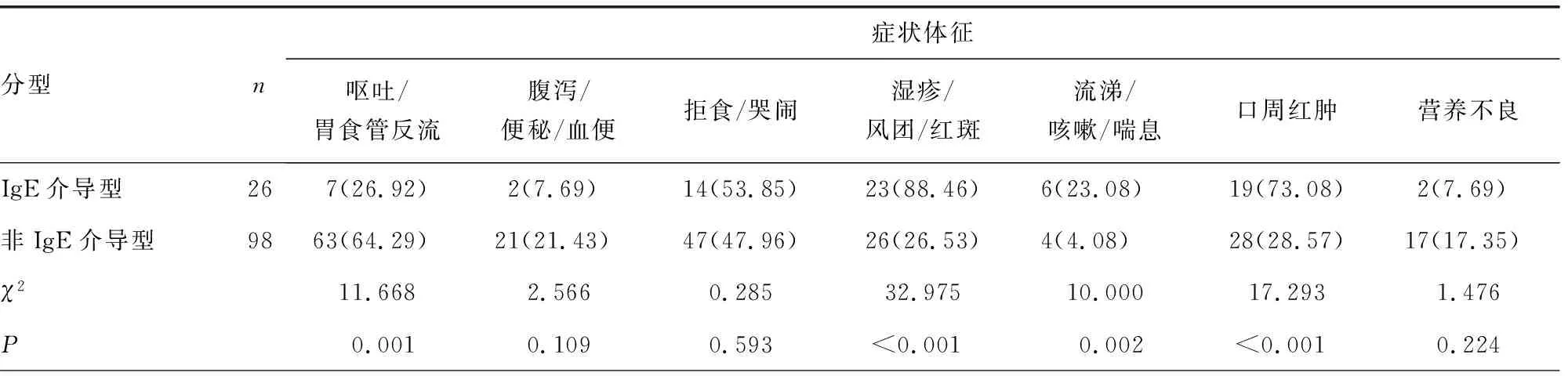
表2 IgE介导型和非IgE介导型CMPA患儿临床症状比较[n(%)]
2.4IgE介导型和非IgE介导型CMPA患儿实验室指标水平比较 IgE介导型和非IgE介导型CMPA患儿Ca、Fe、Zn水平均低于正常参考范围,但差异均无统计学意义(P>0.05)。两种分型发生贫血和低蛋白血症的比例均较低,但差异无统计学意义(P>0.05)。IgE介导型患儿总IgE阳性比例和牛奶蛋白sIgE阳性比例均显著高于非IgE介导型(χ2=19.855,P<0.001;χ2=50.077,P<0.001);但IgE介导型和非IgE介导型患儿Ca、Fe、Zn、25(OH)D3水平和EOS计数升高比例比较,差异均无统计学意义(P>0.05)。见表3。

表3 IgE介导型和非IgE介导型CMPA患儿实验室指标水平比较或n(%)]
2.50~3岁婴幼儿发生CMPA的影响因素分析 以是否发生CMPA作为因变量(否=0,是=1),将婴幼儿CMPA临床特征中有统计学意义的指标作为自变量,并赋值(年龄:>2岁=0,1~2岁=1,<1岁=2;早产:否=0,是=1;父母过敏史:无=0,有=1),进行多因素Logistic回归分析。结果显示,年龄<1岁(OR=4.674,95%CI:2.890~7.560)、早产(OR=3.077,95%CI:1.669~5.674)、父母有过敏史(OR=3.908,95%CI:2.236~6.830)是发生CMPA的危险因素(P<0.05)。见表4。
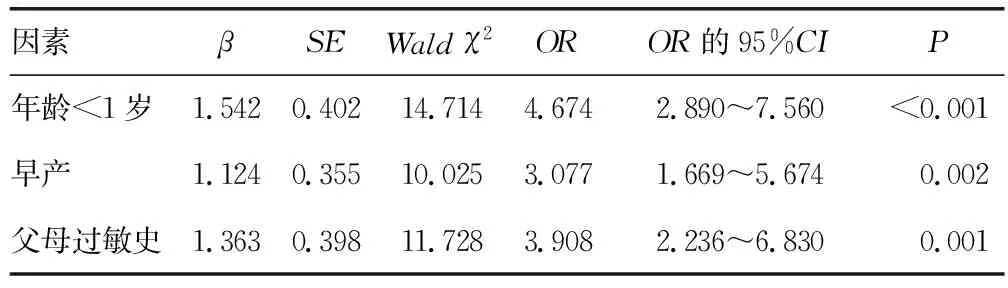
表4 0~3岁婴幼儿发生CMPA的多因素Logistic分析
3 讨 论
CMPA症状缺乏特异性,诊断过程较为复杂,且现阶段仍缺少针对性治疗手段,膳食回避是唯一明确有效的治疗方法。CMPA的发病机制较为复杂,既往研究认为与胃肠道黏膜屏障和免疫功能未发育成熟密切相关,因此好发于0~3岁婴幼儿。本研究对徐州地区的4 983例0~3岁婴幼儿开展调查和分析,结果显示CMPA发病率为2.49%,与YANG等[2]报道结果相近。国内关于CMPA的流行病学报道较为少见,本研究中徐州地区CMPA发病率在2019—2022年各年比较无明显差异,但有增加,仍值得警惕。韦茹等[8]报道显示婴幼儿CMPA发病的常见危险因素包括剖宫产、纯母乳喂养以及维生素D缺乏等,其中纯母乳喂养以及维生素D缺乏还可导致患儿重度病变风险升高。本研究结果显示,不同年龄婴幼儿的CMPA发病率比较,差异有统计学意义(χ2=10.065,P=0.002),与1~2岁、>2岁儿童相比,<1岁的发病率最高,早产儿CMPA发病率显著高于非早产儿(χ2=6.881,P=0.009),且多因素Logistic回归分析显示,年龄<1岁、早产是发生CMPA的危险因素,提示CMPA发病与年龄及胎龄关系密切。低龄或早产儿童胃肠道功能发育较差,进食牛奶蛋白后其中的变应原进入机体引起过敏反应的风险更高。SARDECKA等[9]报道显示伴家族过敏史的婴儿CMPA患病风险可升高3倍,其中有特应性皮炎和哮喘家族史的患病风险更高。本研究显示,父母有过敏史的婴幼儿CMPA发病率显著高于父母无过敏史者(χ2=9.753,P=0.002),且多因素Logistic回归分析显示,父母过敏史是发生CMPA的危险因素,提示CMPA具有一定的遗传倾向,对具有家族过敏史的婴幼儿需要加强监测和预防,在孕期或围生期开展筛查和确认,从而制订合理营养策略,预防严重不良后果产生。
本研究结果显示IgE介导型CMPA占20.97%,介于成智等[10]报道的4.00%与韦茹等[8]报道的55.91%之间,其原因可能与各地区饮食习惯不同有关。既往研究表明不同类型CMPA患儿临床表现存在一定差异,其中IgE介导型主要累及皮肤黏膜,表现为红斑、风团或血管性水肿,同时还可伴有胃肠道和呼吸道症状,而非IgE介导型则以胃肠道症状为主,呼吸道症状较为少见,现阶段关于混合介导型的研究还较少,其发病机制和临床症状均未明确[11-12]。本研究结果显示与IgE介导型发生呕吐/胃食管反流的比例均显著低于非IgE介导型(P<0.05),而发生湿疹/风团/红斑、流涕/咳嗽/喘息、口周红肿和累及2个及以上系统的比例显著高于非IgE介导型(P<0.05),提示可根据症状对CMPA类型进行一定程度区分,其中非IgE介导型起病较慢且仅通常仅表现为消化系统症状[13],而IgE介导型则起病较急,主要表现为皮肤黏膜症状,并累及多个器官系统[14],可为确诊前采取干预措施提供参考信息,但临床确诊和治疗仍依据实验室检查结果和牛奶蛋白回避/激发试验结果。
CMPA患儿由于需要饮食回避,可能引起营养不良和发育异常。本研究中IgE介导型和非IgE介导型CMPA患儿营养不良、贫血和低蛋白血症的比例均较低,两种分型比较,差异均无统计学意义(P>0.05)。有文献报道Ca、Fe、Zn、25(OH)D3水平降低不仅导致CMPA发生风险升高,还与病情严重程度存在密切联系,Ca、Fe、Zn、25(OH)D3水平越低,CMPA病情越严重[15-17]。饮食回避可能进一步加重微量元素缺乏程度,从而形成恶性循环,导致CMPA病情不断恶化[18]。本研究结果显示,IgE介导型和非IgE介导型Ca、Fe、Zn、25(OH)D3水平均低于正常值参考范围,表明患儿微量元素缺乏风险较高,因此需密切关注婴幼儿营养水平并酌情补充微量元素。对于已经确诊为CMPA的患儿,在饮食回避的同时还需加强营养干预,不仅有利于改善病情,还可有效预防营养不良发生[19-20]。此外本研究结果显示IgE介导型CMPA患儿总IgE和牛奶蛋白sIgE阳性率分别为65.38%和46.15%,IgE介导型和非IgE介导型EOS计数升高比例分别为7.69%和9.18%,可见IgE和EOS虽可作为筛查CMPA的参考指标,但均无法排除CMPA,且对CMPA分型的参考价值较低,临床诊断仍需依据皮肤点刺试验和牛奶蛋白回避/激发试验结果。
综上所述,徐州地区0~3岁婴幼儿CMPA发病率随年龄升高而降低,早产儿和父母有过敏史可导致发病率升高,且不同类型CMPA患儿临床症状差异较大,详细区分患儿症状和实验室检查结果对制订合理治疗措施具有重要参考意义。本研究主要局限性为部分CMPA患儿入组时已确诊并接受治疗,家属对患儿病史和症状记忆可能存在偏倚,此外部分患儿为多次发病,部分患儿尚未发病,为临床筛查时确诊,这可能导致患儿症状存在偏倚,因此后续将进一步纳入初诊CMPA患儿为样本对临床症状、实验室指标和治疗效果进行深入分析,详细区分患儿症状和实验室检查结果对制订合理治疗措施的意义。